Нокаутирующая мышь
, Нокаутная мышь или нокаутная мышь , — это генетически модифицированная мышь ( Mus musculus ), у которой исследователи инактивировали или « выбили » существующий ген , заменив его или разрушив его искусственным участком ДНК . Они являются важными моделями животных для изучения роли генов, секвенирование которых было проведено , но функции которых еще не определены. Вызвав неактивность определенного гена у мыши и наблюдая любые отличия от нормального поведения или физиологии, исследователи могут сделать вывод о его вероятной функции.
В настоящее время мыши являются видами лабораторных животных наиболее близкими к человеку , к которым можно легко применить метод нокаута. Они широко используются в экспериментах по нокауту, особенно в тех, которые исследуют генетические вопросы, связанные с физиологией человека . Нокаутировать гены у крыс гораздо сложнее и стало возможным только с 2003 года. [1] [2]
Первая зарегистрированная нокаутирующая мышь была создана Марио Р. Капечки , Мартином Эвансом и Оливером Смитисом в 1989 году, за что они были удостоены Нобелевской премии по физиологии и медицине 2007 года . Аспекты технологии создания нокаутных мышей и сами мыши запатентованы во многих странах частными компаниями.
Используйте [ править ]

Выключение активности гена дает информацию о том, что этот ген обычно делает. Люди имеют много общих генов с мышами. Следовательно, наблюдение за характеристиками нокаутных мышей дает исследователям информацию, которую можно использовать для лучшего понимания того, как аналогичный ген может вызывать или способствовать заболеванию у людей.
Примеры исследований, в которых были полезны нокаутные мыши, включают изучение и моделирование различных видов рака , ожирения , болезней сердца , диабета , артрита , злоупотребления психоактивными веществами , тревоги , старения и болезни Паркинсона . Нокаутные мыши также предлагают биологический и научный контекст, в котором можно разрабатывать и тестировать лекарства и другие методы лечения.
Ежегодно в экспериментах используются миллионы нокаутных мышей. [3]
Штаммы [ править ]

Существует несколько тысяч различных линий нокаутных мышей. [3] Многие мышиные модели названы в честь инактивированного гена. Например, мышь с нокаутом р53 названа в честь гена р53, который кодирует белок, который в норме подавляет рост опухолей, останавливая деление клеток и/или индуцируя апоптоз. Люди, рожденные с мутациями, деактивирующими ген p53, страдают синдромом Ли-Фраумени — состоянием, которое резко увеличивает риск развития рака костей, рака молочной железы и рака крови в раннем возрасте. Другие модели мышей названы в соответствии с их физическими характеристиками или поведением.
Процедура [ править ]
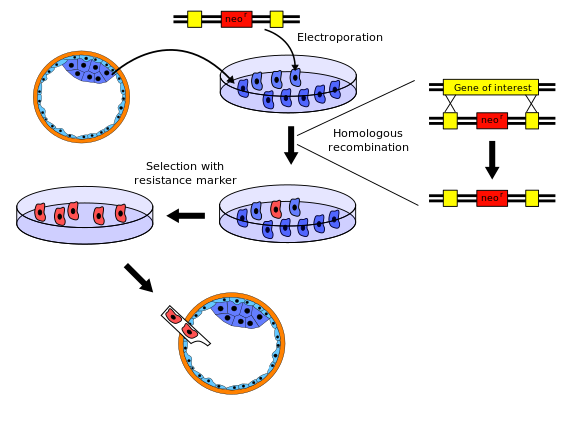

Существует несколько вариантов процедуры получения нокаутных мышей; Ниже приведен типичный пример.
- Ген, который необходимо нокаутировать, выделяют из библиотеки генов мыши . Затем создается новая последовательность ДНК , которая очень похожа на исходный ген и его непосредственную соседнюю последовательность, за исключением того, что она изменена настолько, что делает ген неработоспособным. Обычно новая последовательность также снабжается маркерным геном , геном, которого нет у нормальных мышей и который придает устойчивость к определенному токсичному агенту (например, неомицину) или вызывает заметные изменения (например, цвет или флуоресценцию). Кроме того, для осуществления полного отбора в конструкцию также включен второй ген, например, tk+ герпеса.
- Эмбриональные стволовые клетки выделяют из бластоцисты мыши (очень молодого эмбриона ) и выращивают in vitro . В этом примере мы возьмем стволовые клетки белой мыши.
- Новую последовательность, полученную на этапе 1, вводят в стволовые клетки, полученные на этапе 2, путем электропорации . В результате естественного процесса гомологичной рекомбинации новую последовательность с нокаутированным геном некоторые из электропорированных стволовых клеток включат в свои хромосомы вместо исходного гена. Шансы на успешную рекомбинацию относительно невелики, поэтому большинство измененных клеток будут иметь новую последовательность только в одной из двух соответствующих хромосом – их называют гетерозиготными . Клетки, трансформированные вектором, содержащим ген устойчивости к неомицину и ген tk+ герпеса, выращивают в растворе, содержащем неомицин и ганцикловир, для отбора трансформаций, которые произошли посредством гомологичной рекомбинации. Любая вставка ДНК, произошедшая посредством случайной вставки, погибнет, потому что они дают положительный результат как на ген устойчивости к неомицину, так и на ген tk+ герпеса, генный продукт которого реагирует с ганцикловиром, образуя смертельный токсин. Более того, клетки, которые не интегрируют какой-либо генетический материал, дают отрицательный результат на оба гена и поэтому погибают в результате отравления неомицином.
- Эмбриональные стволовые клетки, содержащие нокаутированный ген, выделяют из неизмененных клеток с использованием маркерного гена, полученного на этапе 1. Например, неизмененные клетки можно уничтожить с помощью токсичного агента, к которому измененные клетки устойчивы.
- Нокаутированные эмбриональные стволовые клетки, полученные на этапе 4, вставляют в бластоцисту мыши . В этом примере мы используем бластоцисты серой мыши. Бластоцисты теперь содержат два типа стволовых клеток: исходные (серой мыши) и нокаутированные клетки (белой мыши). Эти бластоцисты затем имплантируют в матку самок мышей, где они развиваются. Таким образом, новорожденные мыши будут химерами : некоторые части их тел возникают из исходных стволовых клеток, другие части — из нокаутированных стволовых клеток. На их шерсти будут видны пятна белого и серого цвета: белые пятна, полученные из нокаутированных стволовых клеток, и серые пятна, полученные из бластоцисты-реципиента.
- Некоторые из новорожденных мышей-химер будут иметь гонады, полученные из нокаутированных стволовых клеток, и, следовательно, будут производить яйцеклетки или сперму, содержащие нокаутный ген. Когда этих мышей-химер скрещивают с другими мышами дикого типа, у некоторых из их потомков во всех клетках будет одна копия нокаутированного гена. Эти мыши не сохраняют ДНК серой мыши и не являются химерами, однако они все еще гетерозиготны.
- Когда эти гетерозиготные потомки скрещиваются, некоторые из их потомков унаследуют нокаутированный ген от обоих родителей; они не несут функциональной копии исходного неизмененного гена (т.е. они гомозиготны по этому аллелю).
Подробное объяснение того, как создаются нокаутные (КО) мыши, можно найти на сайте Нобелевской премии по физиологии и медицине 2007 года. [4]
Ограничения [ править ]
Национальные институты здравоохранения обсуждают некоторые важные ограничения этого метода. [5]
Хотя технология нокаутных мышей представляет собой ценный исследовательский инструмент, существуют некоторые важные ограничения. Около 15 процентов нокаутов генов являются летальными для развития, а это означает, что генетически измененные эмбрионы не могут вырасти во взрослых мышей. Эту проблему часто решают с помощью условных мутаций . Отсутствие взрослых мышей ограничивает исследования эмбриональным развитием и часто затрудняет определение функции гена в отношении здоровья человека . В некоторых случаях ген может выполнять иную функцию у взрослых, чем у развивающихся эмбрионов.
Нокаут гена также может не привести к заметным изменениям у мышей или даже может привести к появлению характеристик, отличных от тех, которые наблюдаются у людей, у которых тот же ген инактивирован. Например, мутации гена p53 связаны с более чем половиной случаев рака у человека и часто приводят к опухолям в определенном наборе тканей. Однако когда ген p53 выключается у мышей, у животных развиваются опухоли в других тканях.
Вся процедура может варьироваться в зависимости от штамма, из которого были получены стволовые клетки. Обычно используют клетки, полученные из штамма 129. Этот конкретный штамм не подходит для многих экспериментов (например, поведенческих), поэтому очень часто происходит обратное скрещивание потомства с другими штаммами. Доказано, что некоторые геномные локусы очень трудно выбить. Причинами могут быть наличие повторяющихся последовательностей, обширное метилирование ДНК или гетерохроматин . Смущающее присутствие 129 соседних генов в нокаутном сегменте генетического материала получило название «эффект флангового гена». [6] Предложены методы и рекомендации по решению этой проблемы. [7] [8]
Другим ограничением является то, что обычные (т.е. безусловные) нокаутные мыши развиваются в отсутствие исследуемого гена. Иногда потеря активности во время развития может маскировать роль гена во взрослом состоянии, особенно если ген участвует в многочисленных процессах, охватывающих развитие. Затем требуются подходы с условными/индуцируемыми мутациями, которые сначала позволяют мышам нормально развиваться и созревать перед удалением интересующего гена.
Еще одним серьезным ограничением является отсутствие эволюционных адаптаций в модели нокаута, которые могут произойти у животных дикого типа после их естественной мутации. Например, специфичная для эритроцитов коэкспрессия GLUT1 со стоматином представляет собой компенсаторный механизм у млекопитающих, которые не способны синтезировать витамин С. [9]
См. также [ править ]
- Химера (генетика)
- Генетически модифицированный организм
- Генетика
- Хьюмус
- Международный консорциум нокаутных мышей
- Международный консорциум по фенотипированию мышей
- Нокаутирующий мох
- Онкомомышь
Ссылки [ править ]
- ^ Пилчер HR (19 мая 2003 г.). «Это нокаут» . Природа . дои : 10.1038/news030512-17 . Проверено 3 апреля 2014 г.
- ^ Зан Ю, Хааг Дж.Д., Чен К.С., Шепель Л.А., Вигингтон Д., Ван Ю.Р., Ху Р., Лопес-Гуахардо CC, Брозе Х.Л., Портер К.И., Леонард Р.А., Хитт А.А., Шоммер С.Л., Элегбеде А.Ф., Гулд М.Н. (июнь 2003 г.) . «Получение нокаутных крыс с использованием мутагенеза ENU и скринингового анализа на основе дрожжей». Природная биотехнология . 21 (6): 645–51. дои : 10.1038/nbt830 . ПМИД 12754522 . S2CID 32611710 .
- ^ Jump up to: Перейти обратно: а б Спенсер Дж. (декабрь 2002 г.). «История мыши как модельного организма» . Национальный институт исследования генома человека . Проверено 3 апреля 2014 г.
- ^ «Нобелевская премия по физиологии и медицине 2007 года» . Нобелевская премия.org. 19 сентября 1985 г. Проверено 3 апреля 2014 г.
- ^ «Информационный бюллетень о нокаутирующих мышах» . Национальный институт исследования генома человека. Август 2015 года . Проверено 3 апреля 2014 г.
- ^ Герлай Р. (май 1996 г.). «Ген-таргетинговые исследования поведения млекопитающих: это мутация или фоновый генотип?». Тенденции в нейронауках . 19 (5): 177–81. дои : 10.1016/S0166-2236(96)20020-7 . ПМИД 8723200 . S2CID 33396039 .
- ^ Вулфер Д.П., Крузио В.Е. , Липп Х.П. (июль 2002 г.). «Нокаутные мыши: простые решения проблем генетического фона и фланкирующих генов». Тенденции в нейронауках . 25 (7): 336–40. дои : 10.1016/S0166-2236(02)02192-6 . ПМИД 12079755 . S2CID 33777888 .
- ^ Крузио В.Е., Голдовиц Д., Холмс А., Вулфер Д. (февраль 2009 г.). «Стандарты публикации исследований мутантов на мышах» . Гены, мозг и поведение . 8 (1): 1–4. дои : 10.1111/j.1601-183X.2008.00438.x . ПМИД 18778401 . S2CID 205853147 .
- ^ Монтель-Хаген А., Кинет С., Манель Н., Монгеллаз С., Прохаска Р., Баттини Дж. Л., Делоне Дж., Ситбон М., Тейлор Н. (март 2008 г.). «Эритроцитарный Glut1 запускает поглощение дегидроаскорбиновой кислоты у млекопитающих, неспособных синтезировать витамин С» . Клетка . 132 (6): 1039–48. дои : 10.1016/j.cell.2008.01.042 . ПМИД 18358815 .
Внешние ссылки [ править ]
- Техасский институт геномной медицины A&M (TIGM) - веб-сайт для заказа ES клеток и мышей, созданных TIGM.
- Создание нокаутных мышей для нацеливания на вектор от Knockout Mice Research (KMR) - веб-сайт для заказа эмбриональных стволовых клеток, нацеливания на векторы и трансгенных мышей, созданных с помощью KMR.
- Изучение функции генов: создание нокаутных мышей – обзор журнала Science Creative Quarterly
- Веб-сайт координации данных проекта Knock Out Mouse Project (KOMP) — общедоступный интерфейс для получения информации о состоянии генов, включенных в инициативу KOMP.
- Веб-сайт репозитория The Knock Out Mouse Project (KOMP) – веб-сайт для заказа ES клеток, векторов и мышей, созданных в рамках проекта KOMP.
- Веб-сайт Mouse Genome Informatics (MGI) - база данных модельных организмов сообщества для лабораторных мышей
- Метод гомологичной рекомбинации (и нокаутная мышь)
- Информационный бюллетень о нокаутных мышах (Genome.gov)