Миелиновый белок нулевой
| МПЗ | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | MPZ , CHM, CMT1, CMT1B, CMT2I, CMT2J, CMT4E, CMTDI3, CMTDID, DSS, HMSNIB, MPP, P0, нулевой белок миелина, CHN2 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 159440 ; МГИ : 103177 ; Гомологен : 445 ; Генные карты : МПЗ ; ОМА : МПЗ - ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Нулевой миелиновый белок ( P0 , MPZ ) представляет собой одномембранный гликопротеин. [5] который у человека кодируется геном MPZ . P0 является основным структурным компонентом миелиновой оболочки периферической нервной системы (ПНС) . [6] Нулевой миелиновый белок экспрессируется шванновскими клетками и составляет более 50% всех белков периферической нервной системы, что делает его наиболее распространенным белком, экспрессируемым в ПНС. [6] Мутации нулевого белка миелина могут вызывать дефицит миелина и связаны с нейропатиями, такими как болезнь Шарко-Мари-Тута и болезнь Дежерина-Соттаса . [7]
Структура
[ редактировать ]| Myelin-PO_C | |||
|---|---|---|---|
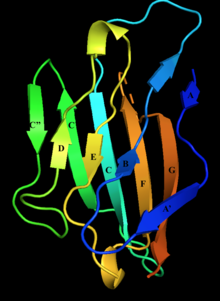 Структура внеклеточного домена нулевого белка миелина с мечеными бета-нитями. Нити D, E, B и A составляют один бета-лист, нити A', G, F, C, C', C'' составляют другой бета-лист. | |||
| Идентификаторы | |||
| Символ | Myelin-PO_C | ||
| Пфам | ПФ10570 | ||
| ИнтерПро | ИПР019566 | ||
| Суперсемейство OPM | 193 | ||
| белок OPM | 3оай | ||
| Мембраном | 213 | ||
| |||
У человека ген, кодирующий нулевой белок миелина, расположен на хромосоме 1 рядом с локусом Даффи или рецептором антигена/хемокина Даффи. Ген имеет длину около 7000 оснований и разделен на 6 экзонов. Всего нулевой белок миелина имеет длину 219 аминокислот. [6] и содержит много основных аминокислотных остатков. [8]
Нулевой миелиновый белок состоит из внеклеточного N-концевого домена (аминокислоты 1–124), одной трансмембранной области (125–150) и меньшей положительно заряженной внутриклеточной области (151–219). [6] [9] [10] Его цитоплазматический домен имеет сильный положительный заряд, но, по-видимому, не сворачивается в глобулярную структуру. [11] Внеклеточный домен структурно аналогичен иммуноглобулина . домену [8] и поэтому белок считается принадлежащим к суперсемейству иммуноглобулинов . [12]
Известно, что нулевой белок миелина не только существует в виде мономера, но и образует димеры и тетрамеры с другими молекулами нулевого белка миелина у позвоночных. [13]
Функция
[ редактировать ]Миелиновая оболочка представляет собой многослойную мембрану, уникальную для нервной системы, которая действует как изолятор, значительно увеличивая скорость проведения аксонального импульса. Нулевой миелиновый белок, отсутствует в центральной нервной системе, [14] является основным компонентом миелиновой оболочки периферических нервов . Мутации, нарушающие функцию нулевого белка миелина, могут привести к снижению экспрессии миелина и дегенерации миелиновой оболочки в периферической нервной системе. [15] В настоящее время предполагается, что нулевая экспрессия белка миелина обусловлена сигналами от аксона. Однако более подробные сведения о регуляции нулевого белка миелина неизвестны. [6]
Постулируется, что нулевой белок миелина является структурным элементом формирования и стабилизации миелина периферических нервов. [9] Также предполагается, что нулевой миелиновый белок служит молекулой клеточной адгезии, удерживающей вместе несколько слоев миелина. [10] Когда миелинизирующая клетка несколько раз оборачивает свою мембрану вокруг аксона, образуя несколько слоев миелина, нулевой белок миелина помогает сохранять компактность этих слоев, служа «клеем», удерживающим слои миелина вместе. [11] Это достигается за счет удержания своей характерной структуры катушки вместе за счет электростатических взаимодействий. [8] его положительно заряженного внутриклеточного домена с кислыми липидами на цитоплазматической поверхности противоположного бислоя. [14] и за счет взаимодействия между гидрофобными глобулярными «головками» соседних внеклеточных доменов . [14]
Функция нулевого белка миелина аналогична функции других белков с доменами иммуноглобина, таких как полииммуноглобин и белок Т4. Эти белки функционируют как молекулы связывания и адгезии и участвуют в гомотипических взаимодействиях или взаимодействиях, в которых участвуют два сходных белка. [9] Нулевой белок миелина скрепляет миелиновую оболочку, участвуя в гомотипических взаимодействиях с другими белками нулевого белка миелина. мембраной миелина Внеклеточный домен нулевого миелинового белка связывается с сфинголипидной и удерживает вместе слои миелина, используя гомотипические взаимодействия с другими внеклеточными доменами нулевого миелинового белка. [7] и с внеклеточными остатками триптофана, взаимодействующими с мембраной. [8]
Также было показано, что нулевой миелиновый белок взаимодействует с другими белками, такими как периферический миелиновый белок 22 . [16] Однако на данный момент цель этих взаимодействий еще не определена. [16]
Ассоциации с невропатией
[ редактировать ]Известно, что мутации в нулевом белке миелина вызывают дегенерацию миелина и нейропатию . [7] Считается, что мутации, которые снижают адгезионную функцию нулевого белка миелина или его способность участвовать в гомеотипических взаимодействиях с другими белками нулевого белка миелина, вызывают нейропатию. [17] Мутации нулевого белка миелина могут привести к проблемам с развитием миелина на ранних этапах жизни или к дегенерации миелина на аксоне в более позднем возрасте. [12] Некоторые мутации могут вызывать нейропатию в младенчестве, например болезнь Держерина-Соттаса , в то время как другие мутации могут вызывать нейропатию в течение первых двух десятилетий жизни, например болезнь Шарко-Мари-Тута . [7] Добавление заряженной аминокислоты или изменение остатка цистеина во внеклеточной мембране может привести к раннему развитию нейропатии. Усечение цитоплазматического домена или изменение третичной структуры нулевого белка миелина также может привести к нейропатии. [7] потому что было показано, что цитоплазматический домен необходим для гомотипических взаимодействий. [12]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с GRCh38: Ensembl, выпуск 89: ENSG00000158887 – Ensembl , май 2017 г.
- ^ Перейти обратно: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000056569 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Магнаги В., Каварретта И., Гальбиати М., Мартини Л., Мельканги Р.К. (ноябрь 2001 г.). «Нейроактивные стероиды и белки периферического миелина». Исследования мозга. Обзоры исследований мозга . 37 (1–3): 360–71. дои : 10.1016/s0165-0173(01)00140-0 . ПМИД 11744100 . S2CID 8004545 .
- ^ Перейти обратно: а б с д и Застенчивый Я (март 2006 г.). «Периферические невропатии, вызванные мутациями нулевого белка миелина». Журнал неврологических наук . 242 (1–2): 55–66. дои : 10.1016/j.jns.2005.11.015 . ПМИД 16414078 . S2CID 32802793 .
- ^ Перейти обратно: а б с д и Шай М.Э., Яни А., Краевски К., Грандис М., Льюис Р.А., Ли Дж. и др. (февраль 2004 г.). «Фенотипическая кластеризация в мутациях MPZ» . Мозг . 127 (Часть 2): 371–84. дои : 10.1093/brain/awh048 . ПМИД 14711881 .
- ^ Перейти обратно: а б с д Шапиро Л., Дойл Дж. П., Хенсли П., Колман Д. Р., Хендриксон В. А. (сентябрь 1996 г.). «Кристаллическая структура внеклеточного домена P0, основного структурного белка миелина периферических нервов» . Нейрон . 17 (3): 435–49. дои : 10.1016/s0896-6273(00)80176-2 . ПМИД 8816707 . S2CID 1719833 .
- ^ Перейти обратно: а б с Лемке Г., Аксель Р. (март 1985 г.). «Выделение и последовательность кДНК, кодирующей основной структурный белок периферического миелина». Клетка . 40 (3): 501–8. дои : 10.1016/0092-8674(85)90198-9 . ПМИД 2578885 . S2CID 1230708 .
- ^ Перейти обратно: а б Лемке Г., Ламар Э., Паттерсон Дж. (март 1988 г.). «Выделение и анализ гена, кодирующего нулевой белок периферического миелина». Нейрон . 1 (1): 73–83. дои : 10.1016/0896-6273(88)90211-5 . ПМИД 2483091 . S2CID 51695021 .
- ^ Перейти обратно: а б Хан Х., Милликоски М., Рускамо С., Ван С., Курсула П. (январь 2013 г.). «Миелинспецифические белки: структурно разнообразная группа молекул, взаимодействующих с мембранами». Биофакторы . 39 (3): 233–41. дои : 10.1002/биоф.1076 . ПМИД 23780694 . S2CID 21111930 .
- ^ Перейти обратно: а б с Камхольц Дж.А., Брукал М., Ли Дж., Шай М. (2007), «Нулевой миелиновый белок и CMT1B: история двух фенотипов», Molecular Neurology , Elsevier, стр. 463–474, doi : 10.1016/b978-012369509-3.50031- 7 , ISBN 9780123695093
- ^ Томпсон А.Дж., Кронин М.С., Киршнер Д.А. (март 2002 г.). «Нулевой миелиновый белок существует в виде димеров и тетрамеров в нативных мембранах периферического нерва Xenopus laevis». Журнал нейробиологических исследований . 67 (6): 766–71. дои : 10.1002/jnr.10167 . ПМИД 11891790 . S2CID 36556147 .
- ^ Перейти обратно: а б с Сакамото Ю, Китамура К, Ёсимура К, Нисиджима Т, Уемура К (март 1987 г.). «Полная аминокислотная последовательность белка РО в миелине периферических нервов крупного рогатого скота» . Журнал биологической химии . 262 (9): 4208–14. дои : 10.1016/S0021-9258(18)61334-1 . ПМИД 2435734 .
- ^ Киршнер Д.А., Иноуе Х., Сааведра Р.А. (ноябрь 1996 г.). «Мембранная адгезия в периферическом миелине: хорошие и плохие обертки с белком P0» . Структура . 4 (11): 1239–44. дои : 10.1016/s0969-2126(96)00132-3 . ПМИД 8939762 .
- ^ Перейти обратно: а б Д'Урсо Д., Эрхардт П., Мюллер Х.В. (май 1999 г.). «Периферический миелиновый белок 22 и нулевой белок: новая ассоциация миелина периферической нервной системы» . Журнал неврологии . 19 (9): 3396–403. doi : 10.1523/JNEUROSCI.19-09-03396.1999 . ПМК 6782240 . ПМИД 10212299 .
- ^ Парейсон Д., Маркези С., Сальсано Э. (2013), «Доминантный синдром Шарко-Мари-Тута и родственные расстройства», Заболевания периферических нервов , Справочник по клинической неврологии, том. 115, Elsevier, стр. 817–845, doi : 10.1016/b978-0-444-52902-2.00047-3 , ISBN. 9780444529022 , PMID 23931817
Дальнейшее чтение
[ редактировать ]- Патель П.И., Лупски-младший (апрель 1994 г.). «Болезнь Шарко-Мари-Тута: новая парадигма механизма наследственных заболеваний». Тенденции в генетике . 10 (4): 128–33. дои : 10.1016/0168-9525(94)90214-3 . ПМИД 7518101 .
- Роа Б.Б., Лупски-младший (1994). «Молекулярная генетика невропатии Шарко-Мари-Тута». Достижения в области генетики человека . Том. 22. С. 117–52. дои : 10.1007/978-1-4757-9062-7_3 . ISBN 978-1-4757-9064-1 . ПМИД 7762451 .
- Нелис Э., Хайтс Н., Ван Броекховен С. (1999). «Мутации в генах периферического миелина и связанных с ними генах при наследственных периферических невропатиях» . Человеческая мутация . 13 (1): 11–28. doi : 10.1002/(SICI)1098-1004(1999)13:1<11::AID-HUMU2>3.0.CO;2-A . ПМИД 9888385 . S2CID 31130790 .
- Ватанабэ М., Ямамото Н., Окоши Н., Нагата Х., Коно Ю., Хаяши А. и др. (сентябрь 2002 г.). «Асимметричная невропатия, чувствительная к кортикостероидам, с мутацией нулевого гена белка миелина». Неврология . 59 (5): 767–9. дои : 10.1212/wnl.59.5.767 . ПМИД 12221176 .
- Хаттори Н., Ямамото М., Ёшихара Т., Койке Х., Накагава М., Ёсикава Х. и др. (январь 2003 г.). «Демиелинизирующие и аксональные особенности болезни Шарко-Мари-Тута с мутациями миелин-родственных белков (PMP22, MPZ и Cx32): клинико-патологическое исследование 205 японских пациентов» . Мозг . 126 (Часть 1): 134–51. дои : 10.1093/brain/awg012 . ПМИД 12477701 .
- Застенчивый Я (март 2006 г.). «Периферические невропатии, вызванные мутациями нулевого белка миелина». Журнал неврологических наук . 242 (1–2): 55–66. дои : 10.1016/j.jns.2005.11.015 . ПМИД 16414078 . S2CID 32802793 .
- Хаясака К., Нанао К., Тахара М., Сато В., Такада Г., Миура М. и др. (октябрь 1991 г.). «Выделение и определение последовательности кДНК, кодирующей основной структурный белок периферического миелина человека». Связь с биохимическими и биофизическими исследованиями . 180 (2): 515–8. дои : 10.1016/S0006-291X(05)81094-0 . ПМИД 1719967 .
- Уврье Р.А., Маклеод Дж.Г., Кончин Т.Е. (февраль 1987 г.). «Гипертрофические формы наследственной моторной и сенсорной нейропатии. Исследование гипертрофической болезни Шарко-Мари-Тута (HMSN типа I) и болезни Дежерина-Соттаса (HMSN типа III) в детском возрасте». Мозг . 110 (Часть 1) (1): 121–48. дои : 10.1093/мозг/110.1.121 . ПМИД 3467805 .
- Тачи Н., Исикава Ю., Минами Р. (1985). «Два случая врожденной гипомиелинической нейропатии». Мозг и развитие . 6 (6): 560–5. дои : 10.1016/s0387-7604(84)80101-1 . ПМИД 6099985 . S2CID 4767216 .
- Хаясака К., Химоро М., Ван Ю., Таката М., Миношима С., Симидзу Н. и др. (сентябрь 1993 г.). «Структура и хромосомная локализация гена, кодирующего нулевой белок миелина человека (MPZ)». Геномика . 17 (3): 755–8. дои : 10.1006/geno.1993.1400 . ПМИД 7503936 .
- Су Ю, Брукс Д.Г., Ли Л., Леперк Дж., Трофаттер Дж.А., Рэвеч Дж.В. и др. (ноябрь 1993 г.). «Ген нулевого миелинового белка мутировал у пациентов с типом 1B Шарко-Мари-Тута» . Труды Национальной академии наук Соединенных Штатов Америки . 90 (22): 10856–60. Бибкод : 1993PNAS...9010856S . дои : 10.1073/pnas.90.22.10856 . ПМК 47877 . ПМИД 7504284 .
- Химоро М., Ёсикава Х., Мацуи Т., Мицуи Ю., Такахаши М., Кайдо М. и др. (сентябрь 1993 г.). «Новая мутация гена миелина P0 в родословной невропатии Шарко-Мари-Тута 1». Международная биохимия и молекулярная биология . 31 (1): 169–73. ПМИД 7505151 .
- Хаясака К., Химоро М., Саваиши Ю., Нанао К., Такахаши Т., Такада Г. и др. (ноябрь 1993 г.). «Мутация de novo гена миелина P0 при болезни Дежерина-Соттаса (наследственная моторная и сенсорная нейропатия III типа)». Природная генетика . 5 (3): 266–8. дои : 10.1038/ng1193-266 . ПМИД 7506095 . S2CID 2512684 .
- Фам-Динь Д., Фурбиль И., Бланке Ф., Маттеи М.Г., Рокель Н., Латур П. и др. (декабрь 1993 г.). «Ген основного нулевого периферического белка миелина: структура и локализация в кластере генов гамма-рецепторов Fc на хромосоме человека 1q21.3-q23». Молекулярная генетика человека . 2 (12): 2051–4. дои : 10.1093/hmg/2.12.2051 . ПМИД 7509228 .
- Томас Ф.П., Лебо Р.В., Розоклия Г., Дин К.С., Лавлейс Р.Э., Латов Н. и др. (1994). «Томакулярная невропатия в хромосоме 1, синдром Шарко-Мари-Тута». Акта Нейропатологика . 87 (1): 91–7. дои : 10.1007/BF00386259 . ПМИД 7511317 . S2CID 19827120 .
- Нелис Э., Тиммерман В., Де Йонге П., Ванденберге А., Фам-Динь Д., Даутиньи А. и др. (декабрь 1994 г.). «Быстрый скрининг генов миелина у пациентов с ШМТ1 с помощью анализа SSCP: выявление новых мутаций и полиморфизмов в гене P0». Генетика человека . 94 (6): 653–7. дои : 10.1007/bf00206959 . ПМИД 7527371 . S2CID 5750189 .
- Хилми С., Фурнье М., Валейн Х., Гандар Дж.К., Бонне Дж. (февраль 1995 г.). «Миелиновый гликопротеин P0: идентификация сайта, фосфорилированного in vitro и in vivo эндогенными протеинкиназами». Журнал нейрохимии . 64 (2): 902–7. дои : 10.1046/j.1471-4159.1995.64020902.x . ПМИД 7530295 . S2CID 32511382 .
- Раутенштраусс Б., Нелис Э., Грел Х., Пфайффер Р.А., Ван Броекховен С. (сентябрь 1994 г.). «Идентификация инсерционной мутации de novo в P0 у пациента с фенотипом синдрома Дежерина-Соттаса (DSS)». Молекулярная генетика человека . 3 (9): 1701–2. дои : 10.1093/hmg/3.9.1701 . ПМИД 7530550 .
- Латур П., Бланке Ф., Нелис Э., Боннебуш С., Шапон Ф., Дирайсон П. и др. (1995). «Мутации в гене нулевого белка миелина, связанные с болезнью Шарко-Мари-Тута типа 1B» . Человеческая мутация . 6 (1): 50–4. дои : 10.1002/humu.1380060110 . ПМИД 7550231 . S2CID 20852048 .
Внешние ссылки
[ редактировать ]- Запись GeneReviews/NCBI/NIH/UW о невропатии Шарко-Мари-Тута типа 1
- Запись GeneReviews/NCBI/NIH/UW о невропатии Шарко-Мари-Тута типа 2
- Миелин + белок + ноль Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)
- Обзор всей структурной информации, доступной в PDB для UniProt : P25189 (миелиновый белок P0) в PDBe-KB .





