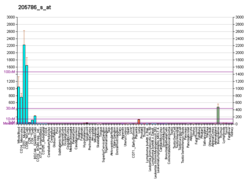
Интегрин альфа М
| ИТГАМ | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | ITGAM , CD11B, CR3A, MAC-1, MAC1A, MO1A, SLEB6, субъединица интегрина альфа М | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 120980 ; МГИ : 96607 ; Гомологен : 526 ; GeneCards : ITGAM ; ОМА : ИТГАМ - ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Интегрин альфа-М (ITGAM) представляет собой одну белковую субъединицу, которая образует гетеродимерную молекулу интегрина альфа-М бета-2 (α M β 2 ), также известную как антиген макрофага-1 (Mac-1) или рецептор комплемента 3 (CR3). [5] ITGAM также известен как CR3A и молекула кластера дифференцировки 11B (CD11B). Вторая цепь α M β 2 представляет собой общую субъединицу интегрина β 2, известную как CD18 , и, таким образом, интегрин α M β 2 принадлежит к подсемейству β 2 (или лейкоцитарным) интегринов. [6]
α M β 2 экспрессируется на поверхности многих лейкоцитов , участвующих во врожденной иммунной системе , включая моноциты , гранулоциты , макрофаги и естественные клетки-киллеры. [5] и подмножества Т- и В-клеток. [7] Он опосредует воспаление, регулируя адгезию и миграцию лейкоцитов, и участвует в нескольких иммунных процессах, таких как фагоцитоз , клеточно-опосредованная цитотоксичность, хемотаксис и клеточная активация. [5] Он участвует в системе комплемента благодаря своей способности связывать инактивированный компонент комплемента 3b (iC3b). [8] Субъединица ITGAM (альфа) интегрина α M β 2 непосредственно участвует в адгезии и распространении клеток, но не может опосредовать клеточную миграцию без присутствия субъединицы β2 (CD18). [5]
В полногеномных исследованиях ассоциаций однонуклеотидные полиморфизмы в ITGAM имели самую сильную связь с системной красной волчанкой с отношением шансов 1,65 для аллели Т rs9888739 и волчанки. [9] [10]
В гистопатологии часто используют иммуногистохимию с антителами против CD11B для идентификации макрофагов и микроглии .
Функция CD11b
[ редактировать ]CD11b, как молекула интегрина на поверхности лейкоцитов , играет важную роль в миграции, адгезии и трансмиграции клеток через кровеносные сосуды , поскольку он может связываться с компонентами внеклеточного матрикса и молекулами внутриклеточной адгезии (ICAM) на поверхности эндотелия . Этот процесс важен для рекрутирования лейкоцитов в очаг воспаления . [7]
Более того, существуют и другие важные процессы с участием CD11b, точнее с участием интегрина Mac-1 в целом. Одним из них является фагоцитоз опсонизированных частиц компонентом комплемента iC3b. Такими опсонизированными частицами могут быть бактерии , апоптотические клетки и даже иммунные комплексы . Связывание CD11b с iC3b приводит к выработке противовоспалительных цитокинов , например, интерлейкина 10 (IL-10) и фактора роста опухоли бета (TGFβ) . Этот процесс важен для регуляции воспалительной среды. [7] [11]
CD11b также участвует в дифференцировке остеокластов , клеток ремоделирования кости. Mac-1 экспрессируется в предшественниках остеокластов и, по-видимому, является частью отрицательной обратной связи остеокластогенеза. [11] CD11b также модулирует другие функции лейкоцитов, например, окислительный взрыв , апоптоз , связывание фибриногена и т. д. [12]
На циркулирующих лейкоцитах CD11b экспрессируется в закрытой конформации. активную конформацию происходит быстро после стимуляции toll-подобных рецепторов (TLR) лейкоцитов Переключение в . [7] После активации CD11b может связывать свои лиганды с высоким сродством, например, связывая молекулы ICAM-1 или ICAM-2 на эндотелии и последующей адгезии. Также известно, что передача сигналов CD11b мешает передаче сигналов TLR в клетке. Стимуляция TLR приводит к выработке провоспалительных цитокинов , например, IL-6 и IL-1β , посредством серии фосфорилирования сигнальных факторов, одним из которых является фактор транскрипции NF-κB . [13] На эту передачу сигналов фактически отрицательно влияет передача сигналов CD11b. Следовательно, это приводит к снижению активации NF-κB и снижению продукции вышеупомянутых провоспалительных цитокинов . В заключение можно сказать, что передача сигналов CD11b отрицательно регулирует активацию лейкоцитов после стимуляции TLR . [7] [12] Помимо передачи сигналов TLR , CD11b также отрицательно регулирует передачу сигналов рецептора В-клеток (BCR) и подавляет активацию Т-клеток , а также созревание и функцию дендритных клеток . [7]
Терапевтическое значение CD11b
[ редактировать ]Что касается функции CD11b, очевидно, что он играет важную роль в регуляции иммунных клеток. Нарушение этой регуляции может привести к повышению восприимчивости к воспалительным и аутоиммунным заболеваниям . Некоторыми примерами могут служить системная красная волчанка (СКВ) , волчаночный нефрит и некоторые виды рака . [12] [14]
Системная красная волчанка
[ редактировать ]Исследования общегеномных ассоциаций помогли выявить 3 основных однонуклеотидных полиморфизма (SNP) в CD11b, которые связаны с риском развития СКВ , сердечно-сосудистых заболеваний и волчаночного нефрита (осложнения, обычно возникающего одновременно с СКВ ). Этими SNP являются: rs1143679 (R77H), rs1143678 (P1146S) и rs1143683 (A858V), и они приводят к снижению способности CD11b правильно связывать ICAM-1 и iC3b , что приводит к снижению клеточной адгезии и фагоцитоза . снижение способности негативно регулировать выработку провоспалительных цитокинов IL-6 , IL-1β и фактора некроза опухоли α (TNFα) после стимуляции TLR также наблюдалось В этих мутациях . [12]
CD11b играет защитную роль при СКВ и волчаночном нефрите благодаря своим противовоспалительным свойствам. Волчаночный нефрит характеризуется накоплением иммунных комплексов в почках и общей иммунной инфильтрацией почек, что приводит к поражению почек. Это изнурительное осложнение СКВ связано с вышеупомянутыми мутациями CD11b. Пациенты с ITGAM SNP имеют более высокие уровни интерферона I типа (IFN-I) в сыворотке крови , что является одним из факторов риска развития СКВ и волчаночного нефрита . Более того, более высокие уровни других провоспалительных цитокинов IL-6 , IL-1β и TNFα после TLR стимуляции ITGAM , наблюдаемые у пациентов с SNP , еще больше стимулируют воспаление во время этого заболевания, вызывая большее повреждение тканей и создание иммунных комплексов . [7] [12]
Следовательно, CD11b представляет собой возможную терапевтическую мишень для лечения СКВ . Действительно, было предпринято множество попыток воздействовать на CD11b. Во-первых, терапия на основе антител , которая оказалась неэффективной в случае CD11b. [15] Однако другие методы лечения с использованием малых аллостерических агонистов CD11b кажутся многообещающим инструментом, поскольку их активация CD11b приводит к регуляции TLR -зависимых провоспалительных путей и защите от повреждения почек. [12]
Опухоли
[ редактировать ]CD11b, по-видимому, является мощным игроком в лечении некоторых типов солидных опухолей . Несмотря на то, что в настоящее время существует множество инструментов для лечения рака , многочисленные факторы этого заболевания остаются сложной темой. Одними из них являются миелоидные супрессорные клетки (MDSC) и опухолеассоциированные макрофаги (ТАМ) , которые представляют собой миелоидные клетки, присутствующие в микроокружении опухоли и обладающие супрессорными свойствами, что способствует росту опухоли . ТАМ , однако, обладают не только свойствами, способствующими развитию опухолей, они также могут проявлять свойства, ингибирующие опухоль. Это зависит от их стимуляции. Ингибирующие опухоли свойства включают выработку провоспалительных цитокинов и способность презентировать антигены . [14]
Использование агонистов CD11b, по-видимому, имеет важное значение в лечении опухолей . Агонисты, стабилизирующие CD11b в его активной конформации, приводят к более высокой адгезии CD11b к его эндотелиальным лигандам, что, как следствие, ухудшает способность трансэндотелиальной миграции к месту воспаления . Такая агонистическая терапия находится в стадии разработки, и один многообещающий кандидат, GB1275, в настоящее время находится на первой клинической фазе в начале 2023 года. Этот агонист CD11b демонстрирует нарушение трансмиграции супрессивных ТАМ в участок опухоли и модуляцию ТАМ в сторону провоспалительного фенотипа. с более высокой презентацией антигена и продукцией провоспалительных цитокинов . Таким образом, обещают лучшее ингибирование опухоли. [14]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Ensembl выпуск 89: ENSG00000169896 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000030786 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Jump up to: а б с д Соловьев Д.А., Плюскота Е., Плуг Э.Ф. (январь 2005 г.). «Различные роли альфа- и бета-субъединиц в функциях интегрина альфаМбета2» . Журнал биологической химии . 280 (2): 1336–1345. дои : 10.1074/jbc.M406968200 . PMID 15485828 .
- ^ Ларсон Р.С., Спрингер Т.А. (апрель 1990 г.). «Структура и функции интегринов лейкоцитов». Иммунологические обзоры . 114 : 181–217. дои : 10.1111/j.1600-065X.1990.tb00565.x . ПМИД 2196220 . S2CID 36709941 .
- ^ Jump up to: а б с д и ж г Хан SQ, Хан I, Гупта V (15 марта 2018 г.). «Активность CD11b модулирует патогенез волчаночного нефрита» . Границы в медицине . 5 : 52. doi : 10.3389/fmed.2018.00052 . ПМК 5862812 . ПМИД 29600248 .
- ^ Арнаут М.А., Тодд Р.Ф., Дана Н., Меламед Дж., Шлоссман С.Ф., Колтен Х.Р. (июль 1983 г.). «Ингибирование фагоцитоза частиц, покрытых комплементом C3 или иммуноглобулином G, а также связывания C3bi моноклональными антителами с гликопротеином мембраны моноцитов-гранулоцитов (Mol)» . Журнал клинических исследований . 72 (1): 171–179. дои : 10.1172/JCI110955 . ПМЦ 1129172 . ПМИД 6874946 .
- ^ МК Ворона (февраль 2008 г.). «Сотрудничество, генетические ассоциации и красная волчанка». Медицинский журнал Новой Англии . 358 (9): 956–961. дои : 10.1056/NEJMe0800096 . ПМИД 18204099 .
- ^ Хом Г., Грэм Р.Р., Модрек Б., Тейлор К.Е., Ортманн В., Гарнье С. и др. (февраль 2008 г.). «Ассоциация системной красной волчанки с C8orf13-BLK и ITGAM-ITGAX» . Медицинский журнал Новой Англии . 358 (9): 900–909. doi : 10.1056/NEJMoa0707865 . ПМИД 18204098 .
- ^ Jump up to: а б Беднарчик М., Стеге Х., Граббе С., Брос М. (февраль 2020 г.). «Интегрины β2 — многофункциональные лейкоцитарные рецепторы в здоровье и заболеваниях» . Международный журнал молекулярных наук . 21 (4): 1402. doi : 10.3390/ijms21041402 . ПМК 7073085 . ПМИД 32092981 .
- ^ Jump up to: а б с д и ж Вильянуэва В., Ли Х, Хименес В., Фариди Х.М., Гупта В. (июль 2022 г.). «Агонисты CD11b предлагают новый подход к лечению волчаночного нефрита» . Трансляционные исследования . 245 : 41–54. дои : 10.1016/j.trsl.2022.03.001 . ПМЦ 9167730 . ПМИД 35288363 .
- ^ Фицджеральд К.А., Каган Дж.К. (март 2020 г.). «Толл-подобные рецепторы и контроль иммунитета» . Клетка . 180 (6): 1044–1066. doi : 10.1016/j.cell.2020.02.041 . ПМЦ 9358771 . ПМИД 32164908 .
- ^ Jump up to: а б с ДеНардо Д.Г., Галкин А., Дюпон Дж., Чжоу Л., Бенделл Дж. (август 2021 г.). «GB1275, первый в своем классе модулятор CD11b: обоснование иммунотерапевтических комбинаций при солидных опухолях» . Журнал иммунотерапии рака . 9 (8): e003005. doi : 10.1136/jitc-2021-003005 . ПМК 8404448 . ПМИД 34452928 .
- ^ Кабанов Д.С., Грачев С.В., Прохоренко И.Р. (21.11.2020). «Моноклональные антитела к CD14, TLR4 или CD11b: влияние специфичности эпитопа и изотипа на генерацию АФК человеческими гранулоцитами и моноцитами» . Окислительная медицина и клеточное долголетие . 2020 : 5708692. doi : 10.1155/2020/5708692 . ПМК 7700042 . ПМИД 33294123 .
Дальнейшее чтение
[ редактировать ]- Стюарт М., Тиль М., Хогг Н. (октябрь 1995 г.). «Лейкоцитарные интегрины». Современное мнение в области клеточной биологии . 7 (5): 690–696. дои : 10.1016/0955-0674(95)80111-1 . ПМИД 8573344 .
- Тодд РФ, Petty HR (май 1997 г.). «Интегрины бета 2 (CD11/CD18) могут служить сигнальными партнерами для других лейкоцитарных рецепторов». Журнал лабораторной и клинической медицины . 129 (5): 492–498. дои : 10.1016/S0022-2143(97)90003-2 . ПМИД 9142045 .
- Шимеинский Дж., Моксай А., Вальцог Б. (август 2007 г.). «Активация нейтрофилов посредством бета2-интегринов (CD11/CD18): молекулярные механизмы и клинические последствия». Тромбоз и гемостаз . 98 (2): 262–273. дои : 10.1160/ч07-02-0156 . ПМИД 17721605 . S2CID 41094726 .
Внешние ссылки
[ редактировать ]- Интегрин + альфаМ в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- Таблица антигенов мышиного CD
- Таблица антигенов CD человека
- ITGAM Информация со ссылками на шлюзе Cell Migration Gateway. Архивировано 11 декабря 2014 г. на Wayback Machine.