CD36
| CD36 | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | CD36 , BDPLT10, CHDS7, FAT, GP3B, GP4, GPIV, PASIV, SCARB3, молекула CD36 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 173510 ; МГИ : 107899 ; Гомологен : 73871 ; Генные карты : CD36 ; ОМА : CD36 – ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
CD36 ( кластер дифференциации 36), также известный как тромбоцитарный гликопротеин 4 , транслоказа жирных кислот ( FAT ), член 3 класса рецепторов-мусорщиков B ( SCARB3 ) и гликопротеины 88 ( GP88 ), IIIb ( GPIIIB ) или IV ( GPIV ). белок , который у человека кодируется CD36 геном . Антиген CD36 представляет собой интегральный мембранный белок, обнаруженный на поверхности многих типов клеток у позвоночных животных. Он импортирует жирные кислоты внутрь клеток и является членом рецепторов-поглотителей семейства класса B белков клеточной поверхности. CD36 связывает многие лиганды, включая коллаген , [5] тромбоспондин , [6] эритроциты, зараженные Plasmodium falciparum , [7] окисленные липопротеины низкой плотности , [8] [9] нативные липопротеины , [10] окисленные фосфолипиды , [11] и длинноцепочечные жирные кислоты . [12]
Исследования на генетически модифицированных грызунах позволяют предположить роль CD36 в жирных кислот . метаболизме [13] [14] [15] сердечное заболевание , [16] вкус, [17] [18] [19] и переработка пищевых жиров в кишечнике . [20] Он может быть вовлечен в непереносимость глюкозы, атеросклероз , артериальную гипертензию , диабет , кардиомиопатию , болезнь Альцгеймера и различные виды рака , в основном эпителиального происхождения ( молочная железа , простата , яичники и толстая кишка ), а также карциномы печени и глиомы . [21] [22] [23]
Структура
[ редактировать ]Начальный
[ редактировать ]У людей , крыс и мышей CD36 состоит из 472 аминокислот с предполагаемой молекулярной массой примерно 53 000 Да . Однако CD36 сильно гликозилирован и имеет кажущуюся молекулярную массу 88 000 Да , определенную электрофорезом в полиакриламидном геле с ДСН . [24]
Третичный
[ редактировать ]Используя анализ Кайта-Дулитла , [25] Аминокислотная последовательность CD36 предсказывает наличие гидрофобной области возле каждого конца белка, достаточно большой, чтобы охватывать клеточные мембраны . Основываясь на этом представлении и наблюдении, что CD36 обнаруживается на поверхности клеток, считается, что CD36 имеет структуру, подобную шпильке, с α-спиралями на С- и N-концах, выступающими через мембрану , и более крупной внеклеточной петлей. (рис. 1). Эта топология подтверждается экспериментами по трансфекции культивируемых клеток с использованием делеционных мутантов CD36. [26] [27]
На основе кристаллической структуры гомологичного SCARB2 была создана модель внеклеточного домена CD36. [28] Предполагается, что, как и SCARB2, CD36 содержит антипараллельное ядро β-цилиндра с множеством украшающих его коротких α-спиралей. Предполагается, что структура будет содержать гидрофобный транспортный туннель. Дисульфидные связи между 4 из 6 остатков цистеина во внеклеточной петле необходимы для эффективного внутриклеточного процессинга и транспорта CD36 к плазматической мембране . [29] Неясно, какую роль эти связи играют в функции зрелого белка CD36 на поверхности клетки.
Посттрансляционная модификация
[ редактировать ]Помимо гликозилирования, дополнительных посттрансляционных модификациях сообщалось о CD36. CD36 модифицирован четырьмя пальмитоильными цепями , по две на каждом из двух внутриклеточных доменов. [27] Функция этих липидных модификаций в настоящее время неизвестна, но они, вероятно, способствуют ассоциации CD36 с мембраной и, возможно, липидными рафтами , которые, по-видимому, важны для некоторых функций CD36. [30] [31] CD36 также может быть фосфорилирован по Y62, T92, T323, [32] убиквитинирован по K56, K469, K472 и ацетилирован по K52, K56, K166, K231, K394, K398, K403. [33] [34] [35]
Белково-белковые взаимодействия
[ редактировать ]В отсутствие лиганда мембраносвязанный CD36 существует преимущественно в мономерном состоянии. Однако воздействие лиганда тромбоспондина вызывает димеризацию CD36. Было высказано предположение, что эта димеризация играет важную роль в передаче сигнала CD36 . [36]
Генетика
[ редактировать ]У человека этот ген расположен на длинном плече хромосомы 7 на участке 11.2 (7q11.2). [37] ) и кодируется 15 экзонами , длина которых превышает 32 килобаз . Как 5'-, так и 3'-нетранслируемые области содержат интроны : 5'-два и 3'-один. Экзоны 1, 2 и первые 89 нуклеотидов экзона 3, а также экзона 15 являются некодирующими. Экзон 3 содержит кодирующий N-концевой цитоплазматический и трансмембранный домены. С-концевые цитоплазматические и трансмембранные области кодируются экзоном 14. Внеклеточный домен кодируется 11 центральными экзонами. Альтернативный сплайсинг нетранслируемых областей приводит к образованию как минимум двух видов мРНК .
Сайт инициации транскрипции гена CD36 был картирован на 289 нуклеотидах выше трансляции стартового кодона и ТАТА-бокса , а несколько предполагаемых цис-регуляторных областей расположены дальше 5'. Сайт связывания факторов PEBP2/CBF был идентифицирован между -158 и -90, и нарушение этого сайта снижает экспрессию. Этот ген контролирует транскрипцию гетеродимера ядерного рецептора PPAR/RXR ( рецептор, активирующий пролифератор пероксисомы – рецептор ретиноида X ), и экспрессию гена можно регулировать с помощью синтетических и природных лигандов для PPAR и RXR, включая класс тиазолидиндионов , обладающих противодиабетическими свойствами. лекарства и метаболит витамина А 9-цис- ретиноевая кислота соответственно.
Распределение тканей
[ редактировать ]CD36 обнаруживается на тромбоцитах , эритроцитах , моноцитах , дифференцированных адипоцитах , скелетных мышцах, эпителиальных клетках молочной железы , клетках селезенки и некоторых кожи микродермы эндотелиальных клетках .
Функция
[ редактировать ]Сам белок принадлежит к семейству рецепторов-поглотителей класса B , которое включает рецепторы для селективного захвата эфиров холестерина, рецепторы-поглотители класса B типа I (SR-BI) и лизосомальный интегральный мембранный белок II (LIMP-II).
CD36 взаимодействует с рядом лигандов, включая коллаген типов I и IV, тромбоспондин , эритроциты, паразитированные Plasmodium falciparum , агглютинирующий тромбоциты белок p37, окисленный липопротеин низкой плотности и длинноцепочечные жирные кислоты . [38]
На макрофагах CD36 является частью неопсонического рецептора (комплекс рецептор-поглотитель CD36/ альфа-v-бета-3 ) и участвует в фагоцитозе . [39]
CD36 также участвует в гемостазе , тромбозе , малярии , воспалении , липидном обмене и атерогенезе . [40]
При связывании лиганда белок и лиганд интернализуются. Эта интернализация не зависит от макропиноцитоза и происходит по актин-зависимому механизму, требующему активации киназ Src-семейства, JNK и GTPases Rho-семейства. [41] В отличие от макропиноцитоза на этот процесс не влияют ингибиторы фосфатидилинозитол-3-киназы или Na. + /ЧАС + обмен.
Также было показано, что лиганды CD36 способствуют стерильному воспалению за счет сборки гетеродимера Toll-подобных рецепторов 4 и 6. [42]
Недавно CD36 был связан с депо-управляемым потоком кальция, активацией фосфолипазы А 2 и выработкой простагландина Е 2. [43]
Функция CD36 в захвате и передаче сигналов длинноцепочечных жирных кислот может быть необратимо ингибирована сульфо-N-сукцинимидилолеатом (SSO), который связывает лизин 164 внутри гидрофобного кармана, общего для нескольких лигандов CD36, например, жирных кислот и oxLDL. [34] Недавние исследования пришли к выводу, что CD36 участвует в передаче вкуса жира ( олеогустус ).
Клиническое значение
[ редактировать ]Малярия
[ редактировать ]Инфекции малярийным паразитом человека Plasmodium falciparum характеризуются секвестрацией эритроцитов, инфицированных зрелыми формами паразита, и было показано, что CD36 является основным рецептором секвестрации на микрососудистых эндотелиальных клетках. Паразитированные эритроциты прикрепляются к эндотелию на стадии трофозоитов / шизонтов одновременно с появлением var на поверхности эритроцитов продукта гена (мембранного белка эритроцитов 1). Появление Plasmodium falciparum мембранного белка 1 эритроцитов (PfEMP1) на поверхности эритроцитов является температурно -зависимым явлением, которое связано с увеличением переноса белка на поверхность эритроцитов при повышенной температуре. PfEMP1 может связывать другие эндотелиальные рецепторы - тромбоспондин (TSP) и молекулу межклеточной адгезии 1 ( ICAM-1 ) - в дополнение к CD36 - и гены, отличные от PfEMP1, также связываются с CD36: белок, связанный с цитоадгезией (clag) и секвестрин . Известно, что сайт связывания PfEMP1 на CD36 расположен на экзоне 5.
Было показано, что CD36 на поверхности тромбоцитов участвует в адгезии, но также происходит прямое прилипание к эндотелию инфицированных эритроцитов. Было показано, что аутоагрегация инфицированных эритроцитов тромбоцитами коррелирует с тяжелой малярией и, в частности, с церебральной малярией, и антитромбоцитарные антитела могут обеспечивать некоторую защиту.
Некоторые данные свидетельствуют о том, что мутации CD36 защищают от малярии: мутации в промоторах , внутри интронов и экзоне 5 снижают риск тяжелой формы малярии. Исследования разнообразия генов показывают, что по этому гену произошел положительный отбор, предположительно из-за давления малярийного отбора. Известны также несогласные мнения предполагая, что CD36 не является единственным фактором, определяющим тяжелую малярию. Кроме того, была обнаружена роль CD36 в клиренсе гаметоцитов (стадии I и II).
Было показано, что CD36 играет роль во врожденном иммунном ответе на малярию на мышиных моделях. [44] По сравнению с мышами дикого типа CD36 (-/-) реакция на индукцию цитокинов и клиренс паразитов были нарушены. Отмечены более ранние пиковые паразитемии, более высокая плотность паразитов и более высокая смертность. Считается, что CD36 участвует в Plasmodium falciparum активации гликофосфатидилинозитола (PfGPI), индуцированной MAPK , и секреции провоспалительных цитокинов. Когда макрофаги подвергались воздействию PfGPI, белки ERK1/2, JNK, p38 и c-Jun фосфорилировались. Все эти белки участвуют в качестве вторичных посредников в иммунном ответе. Эти ответы были притуплены у мышей CD36 (-/-). Также макрофаги CD36 (-/-) секретировали значительно меньше TNF-альфа при воздействии PfGPI. Продолжается работа по определению того, как именно эти меры обеспечивают защиту от малярии.
Дефицит CD36 и аллоиммунная тромбоцитопения
[ редактировать ]CD36 также известен как гликопротеин IV (gpIV) или гликопротеин IIIb (gpIIIb) в тромбоцитах и дает начало антигену Нака . Нулевой фенотип Нака встречается у 0,3% европеоидов и протекает бессимптомно. Нулевой фенотип чаще встречается у африканских (2,5%), японских и других азиатских популяций (5-11%).
Мутации в гене CD36 человека были впервые выявлены у пациента, у которого, несмотря на множественные тромбоцитов переливания , продолжал наблюдаться низкий уровень тромбоцитов. [45] [46] Это состояние известно как рефрактерность к переливанию тромбоцитов. Последующие исследования показали, что CD36 обнаруживается на поверхности тромбоцитов. Этот антиген распознается моноклональными антителами (MAbs) OKM5 и OKM8. Он связывается с Plasmodium falciparum белком секвестрином . [47]
В зависимости от характера мутации кодона 90 CD36 может отсутствовать как на тромбоцитах и моноцитах (тип 1), так и только на тромбоцитах (тип 2). Тип 2 разделён на два подтипа – а и б. Дефицит, ограниченный только тромбоцитами, известен как тип 2а; если CD36 также отсутствует в эритробластах, фенотип классифицируется как тип 2b. [48] Молекулярная основа для некоторых случаев известна: T1264G как у кенийцев , так и у гамбийцев ; C478T (50%), делеция 539 AC и вставка A 1159, делеция 1438-1449 и комбинированная делеция 839-841 GAG и вставка AAAAC на японском языке.
В исследовании с участием 827 практически здоровых японских добровольцев дефициты I и II типов были обнаружены у 8 (1,0%) и 48 (5,8%) соответственно. [49] У 1127 здоровых французских доноров крови (почти все из которых были белыми европейцами) не было обнаружено дефицита CD36. [50] Во второй группе только у 1 из 301 белого испытуемого был обнаружен дефицит CD36. У 16 из 206 чернокожих африканцев к югу от Сахары и у 1 из 148 чернокожих жителей Карибского бассейна были обнаружены CD36-ve. Трое из 13 обследованных CD36-ve человек имели антитела против CD36. В группе из 250 чернокожих американских доноров крови 6 (2,4%) оказались отрицательными по антигену Нака. [51]
Дефицит CD36 может быть причиной посттрансфузионной пурпуры . [52]
Артериальное давление
[ редактировать ]Уровень экспрессии CD36 в почках ниже нормального считается генетическим фактором риска гипертонии (высокого кровяного давления). [53]
Поглощение жирных кислот
[ редактировать ]Была отмечена связь с поглощением жирных кислот миокардом у человека. [54] Данные предполагают связь между гипертрофической кардиомиопатией и CD36, но это необходимо подтвердить.
Туберкулез
[ редактировать ]Скрининг РНКи на модели дрозофилы показал, что член семейства CD36 необходим для фагоцитоза микобактерий туберкулеза в фагосомы макрофагов. [55]
Токсоплазмоз
[ редактировать ]Авирулентные штаммы Toxoplasma gondii связываются с CD36, но вирулентные паразиты не способны связываться с CD36. У мышей CD36 необходим для толерантности к болезням, но не для развития иммунитета или резистентности. [56]
Ожирение
[ редактировать ]Связь CD36 со способностью ощущать вкус жиров сделала его объектом различных исследований, касающихся ожирения и изменения липидов вкуса . Было обнаружено, что экспрессия мРНК CD36 снижена в клетках вкусовых почек (TBC) песчаных крыс с ожирением ( P. obesus ) по сравнению с худыми контрольными животными, что указывает на связь между CD36 и ожирением. [57] Хотя фактические уровни белка CD36 не различались между клетками крыс с ожирением и контрольной группой, Abdoul-Azize et al. выдвинули гипотезу, что физическое распределение CD36 может различаться в клетках крыс с ожирением. [57] Изменения в кальциевой медиации также связаны с CD36 и ожирением. Клетки вкусовых почек (точнее, клетки околовалятных сосочков ), содержащие CD36, выделенные от мышей с ожирением, демонстрировали значительно меньшее увеличение содержания кальция после стимуляции жирными кислотами по сравнению с контрольными мышами: [58] Связанная с CD36 регуляция кальция нарушается, когда мыши страдают ожирением (но не у мышей с нормальным весом), и это может быть механизмом, способствующим изменениям поведения у мышей с ожирением, таким как снижение вкусовой чувствительности к липидам и снижение влечения к жирам. [58]
Также проводились исследования человеческого CD36. В исследовании изучалось пероральное обнаружение жира у людей с ожирением с генетическими основаниями для высокой, средней и низкой экспрессии рецептора CD36. Субъекты с высокой экспрессией CD36 были в восемь раз более чувствительны к определенным жирам ( олеиновой кислоте и триолеину ), чем субъекты с низкой экспрессией CD36. [18] Субъекты с промежуточным уровнем экспрессии CD36 были чувствительны к жиру на уровне между группами с высоким и низким уровнем. [18] Это исследование демонстрирует, что существует значительная взаимосвязь между чувствительностью к жиру в ротовой полости и уровнем экспрессии рецептора CD36, но дальнейшее изучение CD36 может быть полезно для получения дополнительной информации о дегустации липидов в контексте ожирения, поскольку CD36 может быть мишенью для терапии при ожирении. будущее.
Установление клеточного старения
[ редактировать ]Уменьшение нагрузки стареющих клеток или уменьшение их воспалительного секретома за счет нейтрализации CD36 ускоряет регенерацию у молодых и старых мышей. [59]
Рак
[ редактировать ]CD36 играет роль в регуляции ангиогенеза , что может быть терапевтической стратегией контроля распространения рака. [60] Некоторые данные исследований in vitro и на животных показали, что поглощение жирных кислот через CD36 может способствовать миграции и пролиферации раковых клеток при гепатоцеллюлярной карциноме, глиобластоме и, возможно, других видах рака; в ходе обсервационных исследований на людях были ограниченные данные о том, что низкий уровень CD36 может коррелировать с несколько лучшим исходом при глиобластоме. [61]
Взаимодействия
[ редактировать ]Было показано, что CD36 взаимодействует с FYN . [62] [63]
Родственные белки
[ редактировать ]| Семейство CD36 | |||
|---|---|---|---|
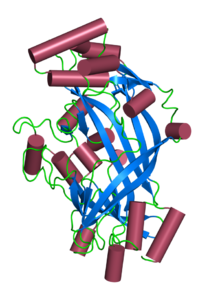 Структура Limp-II. Запись PDB 4f7b | |||
| Идентификаторы | |||
| Символ | CD36 | ||
| Пфам | PF01130 | ||
| ИнтерПро | ИПР002159 | ||
| |||
Другими человеческими рецепторами-мусорщиками, родственными CD36, являются SCARB1 и SCARB2 белки .
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000135218 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000002944 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Тандон Н.Н., Кралиш У., Джеймисон Г.А. (май 1989 г.). «Идентификация гликопротеина IV (CD36) как первичного рецептора адгезии тромбоцитов и коллагена» . Журнал биологической химии . 264 (13): 7576–83. дои : 10.1016/S0021-9258(18)83273-2 . ПМИД 2468670 .
- ^ Сильверстайн Р.Л., Бэрд М., Ло С.К., Йеснер Л.М. (август 1992 г.). «Трансфекция смысловой и антисмысловой кДНК CD36 (гликопротеина IV) в клетках меланомы. Роль CD36 как рецептора тромбоспондина» . Журнал биологической химии . 267 (23): 16607–12. дои : 10.1016/S0021-9258(18)42046-7 . ПМИД 1379600 .
- ^ Окендо П., Хундт Э., Лоулер Дж., Сид Б (июль 1989 г.). «CD36 непосредственно опосредует цитоадгезивность эритроцитов, зараженных Plasmodium falciparum». Клетка . 58 (1): 95–101. дои : 10.1016/0092-8674(89)90406-6 . ПМИД 2473841 . S2CID 22059108 .
- ^ Эндеманн Г., Стэнтон Л.В., Мэдден К.С., Брайант К.М., Уайт Р.Т., Проттер А.А. (июнь 1993 г.). «CD36 является рецептором окисленного липопротеина низкой плотности» . Журнал биологической химии . 268 (16): 11811–6. дои : 10.1016/S0021-9258(19)50272-1 . ПМИД 7685021 .
- ^ Николсон А.С., Фрида С., Пирс А., Сильверстайн Р.Л. (февраль 1995 г.). «Окисленный ЛПНП связывается с CD36 на макрофагах, полученных из моноцитов человека, и трансфицированных клеточных линиях. Доказательства того, что липидный фрагмент липопротеина является местом связывания» . Атеросклероз, тромбоз и сосудистая биология . 15 (2): 269–75. дои : 10.1161/01.ATV.15.2.269 . ПМИД 7538425 .
- ^ Кальво Д., Гомес-Коронадо Д., Суарес Ю., Ласунсьон М.А., Вега М.А. (апрель 1998 г.). «Человеческий CD36 является рецептором с высоким сродством к нативным липопротеинам ЛПВП, ЛПНП и ЛПОНП» . Журнал исследований липидов . 39 (4): 777–88. дои : 10.1016/S0022-2275(20)32566-9 . ПМИД 9555943 . [ постоянная мертвая ссылка ]
- ^ Подрез Е.А., Поляков Е., Шен З., Чжан Р., Дэн Ю., Сунь М. и др. (октябрь 2002 г.). «Идентификация нового семейства окисленных фосфолипидов, которые служат лигандами для рецептора-поглотителя макрофагов CD36» . Журнал биологической химии . 277 (41): 38503–16. дои : 10.1074/jbc.M203318200 . ПМИД 12105195 .
- ^ Бэйли А.Г., Коберн, Коннектикут, Абумрад Н.А. (сентябрь 1996 г.). «Обратимое связывание длинноцепочечных жирных кислот с очищенным жиром, гомологом CD36 жировой ткани». Журнал мембранной биологии . 153 (1): 75–81. дои : 10.1007/s002329900111 . ПМИД 8694909 . S2CID 5911289 .
- ^ Хаджри Т., Хан XX, Бонен А., Абумрад Н.А. (май 2002 г.). «Дефектное поглощение жирных кислот модулирует чувствительность к инсулину и метаболические реакции на диету у мышей с нулевым CD36» . Журнал клинических исследований . 109 (10): 1381–9. дои : 10.1172/JCI14596 . ПМК 150975 . ПМИД 12021254 .
- ^ Правенец М., Ланда В., Зидек В., Мусилова А., Каздова Л., Ци Н. и др. (2003). «Трансгенная экспрессия CD36 у крыс со спонтанной гипертензией связана с улучшением метаболических нарушений, но не влияет на гипертонию» (PDF) . Физиологические исследования . 52 (6): 681–8. doi : 10.33549/phyisolres.930380 . ПМИД 14640889 .
- ^ Мистри Дж.Дж., Боулз К.М., Рашворт С.А. (декабрь 2021 г.). «Транспорт свободных жирных кислот через CD36 управляет опосредованным β-окислением ответом гемопоэтических стволовых клеток на инфекцию» . Природные коммуникации . 12 (1): 7130. Бибкод : 2021NatCo..12.7130M . дои : 10.1038/s41467-021-27460-9 . ПМЦ 8655073 . ПМИД 34880245 .
- ^ Феббрайо М., Подрез Э.А., Смит Дж.Д., Хаджар Д.П., Хазен С.Л., Хофф Х.Ф. и др. (апрель 2000 г.). «Направленное разрушение рецептора-поглотителя CD36 класса B защищает от развития атеросклеротических поражений у мышей» . Журнал клинических исследований . 105 (8): 1049–56. дои : 10.1172/JCI9259 . ПМК 300837 . ПМИД 10772649 .
- ^ Ложеретт Ф., Пассильи-Деграс П., Патрис Б., Ниот И., Феббрайо М., Монмайер Ж.П., Беснар П. (ноябрь 2005 г.). «Участие CD36 в оросенсорном обнаружении пищевых липидов, спонтанном предпочтении жиров и пищеварительных секрециях» . Журнал клинических исследований . 115 (11): 3177–84. дои : 10.1172/JCI25299 . ПМЦ 1265871 . ПМИД 16276419 .
- ^ Jump up to: а б с Пепино М.Ю., Лав-Грегори Л., Кляйн С., Абумрад Н.А. (март 2012 г.). «Ген транслоказы жирных кислот CD36 и лингвальная липаза влияют на пероральную чувствительность к жиру у людей с ожирением» . Журнал исследований липидов . 53 (3): 561–6. дои : 10.1194/jlr.M021873 . ПМК 3276480 . ПМИД 22210925 .
- ^ ДиПатрицио Н.В. (сентябрь 2014 г.). «Готов ли жирный вкус к прайм-тайму?» . Физиология и поведение . 136 : 145–54. дои : 10.1016/j.physbeh.2014.03.002 . ПМК 4162865 . ПМИД 24631296 .
- ^ Дровер В.А., Аджмал М., Нассер Ф., Дэвидсон Н.О., Наули А.М., Саху Д. и др. (май 2005 г.). «Дефицит CD36 ухудшает секрецию липидов в кишечнике и выведение хиломикронов из крови» . Журнал клинических исследований . 115 (5): 1290–7. дои : 10.1172/JCI21514 . ПМЦ 1074677 . ПМИД 15841205 .
- ^ Рач М.Е., Сафранов К., Понцилюш В. (2007). «Молекулярные основы мутаций гена CD36 человека» . Молекулярная медицина . 13 (5–6): 288–96. дои : 10.2119/2006-00088.Rac . ЧВК 1936231 . ПМИД 17673938 .
- ^ Ана-Мария Энчу, Евгений Раду, Ионела Даниэла Попеску, Михаил Евгений Хинеску, Лаура Кристина Чефалан (2018). «Нацеливание на CD36 в качестве биомаркера для прогнозирования метастазов: насколько далеко от внедрения в клиническую практику?» . БиоМед Исследования Интернэшнл . 2018 : 1–12. дои : 10.1155/2018/7801202 . ПМК 6057354 . ПМИД 30069479 .
- ^ Цзинчунь Ван, Юншэн Ли (2019). «CD36 танго при раке: сигнальные пути и функции» . Тераностика . 9 (17): 4893–490. дои : 10.7150/thno.36037 . ПМК 6691380 . ПМИД 31410189 .
- ^ Гринвальт Д.Э., Ватт К.В., Со О.Ю., Дживани Н. (июль 1990 г.). «PAS IV, интегральный мембранный белок эпителиальных клеток молочной железы, связан с CD36 тромбоцитов и эндотелиальных клеток (GP IV)». Биохимия . 29 (30): 7054–9. дои : 10.1021/bi00482a015 . ПМИД 1699598 .
- ^ Кайт Дж., Дулитл РФ (май 1982 г.). «Простой метод отображения гидропатического характера белка». Журнал молекулярной биологии . 157 (1): 105–32. CiteSeerX 10.1.1.458.454 . дои : 10.1016/0022-2836(82)90515-0 . ПМИД 7108955 .
- ^ Груарин П., Торн Р.Ф., Дорахи Дж., Бернс Г.Ф., Ситиа Р., Алессио М. (август 2000 г.). «CD36 представляет собой дитопический гликопротеин с N-концевым доменом, участвующим во внутриклеточном транспорте». Связь с биохимическими и биофизическими исследованиями . 275 (2): 446–54. дои : 10.1006/bbrc.2000.3333 . ПМИД 10964685 .
- ^ Jump up to: а б Тао Н., Вагнер С.Дж., Люблин Д.М. (сентябрь 1996 г.). «CD36 пальмитоилирован как на N-, так и на C-концевых цитоплазматических хвостах» . Журнал биологической химии . 271 (37): 22315–20. дои : 10.1074/jbc.271.37.22315 . ПМИД 8798390 .
- ^ Некулай Д., Шваке М., Равичандран М., Зунке Ф., Коллинз Р.Ф., Питерс Дж. и др. (декабрь 2013 г.). «Структура LIMP-2 дает функциональную информацию, имеющую значение для SR-BI и CD36». Природа . 504 (7478): 172–6. Бибкод : 2013Natur.504..172N . дои : 10.1038/nature12684 . ПМИД 24162852 . S2CID 4395239 .
- ^ Груарин П., Ситиа Р., Алессио М. (декабрь 1997 г.). «Для внутриклеточного процессинга и транспорта CD36 необходимо образование одной или нескольких внутрицепочечных дисульфидных связей» . Биохимический журнал . 328 (2): 635–42. дои : 10.1042/bj3280635 . ПМК 1218965 . ПМИД 9371725 .
- ^ Цзэн Ю, Тао Н., Чунг К.Н., Хойзер Дж.Э., Люблин Д.М. (ноябрь 2003 г.). «Эндоцитоз окисленных липопротеинов низкой плотности через рецептор-поглотитель CD36 использует путь липидного рафта, который не требует кавеолина-1» . Журнал биологической химии . 278 (46): 45931–6. дои : 10.1074/jbc.M307722200 . ПМИД 12947091 .
- ^ Пол Дж., Ринг А., Коркмаз У., Эхалт Р., Штреммель В. (январь 2005 г.). «Опосредованное FAT/CD36 поглощение длинноцепочечных жирных кислот в адипоцитах требует плотов плазматической мембраны» . Молекулярная биология клетки . 16 (1): 24–31. дои : 10.1091/mbc.E04-07-0616 . ПМК 539148 . ПМИД 15496455 .
- ^ Хорнбек П.В., Корнхаузер Дж.М., Ткачев С., Чжан Б., Скшипек Е., Мюррей Б., Лэтэм В., Салливан М. «Страница белка CD36 (человеческого)» . ФосфоСайтПлюс . Cell Signaling Technology, Inc.
- ^ Смит Дж., Су Х., Эль-Маграби Р., Шталь П.Д., Абумрад Н.А. (май 2008 г.). «Противоположная регуляция убиквитинирования CD36 жирными кислотами и инсулином: влияние на поглощение жирных кислот» . Журнал биологической химии . 283 (20): 13578–85. дои : 10.1074/jbc.M800008200 . ПМК 2376227 . ПМИД 18353783 .
- ^ Jump up to: а б Куда О, Пьетка Т.А., Демьянова З, Кудова Е, Цвачка Дж, Копецкий Дж, Абумрад Н.А. (май 2013 г.). «Сульфо-N-сукцинимидилолеат (SSO) ингибирует захват жирных кислот и передачу сигналов внутриклеточного кальция посредством связывания лизина 164 CD36: SSO также ингибирует поглощение окисленных липопротеинов низкой плотности макрофагами» . Журнал биологической химии . 288 (22): 15547–55. дои : 10.1074/jbc.M113.473298 . ПМЦ 3668716 . ПМИД 23603908 .
- ^ Лундби А., Лаге К., Вайнерт Б.Т., Беккер-Йенсен Д.Б., Сечер А., Сковгаард Т. и др. (август 2012 г.). «Протеомный анализ сайтов ацетилирования лизина в тканях крыс выявляет органную специфичность и субклеточные структуры» . Отчеты по ячейкам . 2 (2): 419–31. дои : 10.1016/j.celrep.2012.07.006 . ПМК 4103158 . ПМИД 22902405 .
- ^ Дэвиет Л., Мальвуазен Э., Уайлд Т.Ф., МакГрегор Дж.Л. (август 1997 г.). «Тромбоспондин индуцирует димеризацию мембраносвязанного, но нерастворимого CD36». Тромбоз и гемостаз . 78 (2): 897–901. дои : 10.1055/s-0038-1657649 . ПМИД 9268192 . S2CID 43232897 .
- ^ Фернандес-Руис Э., Армесилья А.Л., Санчес-Мадрид Ф., Вега М.А. (сентябрь 1993 г.). «Ген, кодирующий коллаген типа I и рецептор тромбоспондина CD36, расположен на хромосоме 7q11.2». Геномика . 17 (3): 759–61. дои : 10.1006/geno.1993.1401 . hdl : 2436/7706 . ПМИД 7503937 .
- ^ Армесилла А.Л., Вега М.А. (июль 1994 г.). «Структурная организация гена гликопротеина CD36 человека» . Журнал биологической химии . 269 (29): 18985–91. дои : 10.1016/S0021-9258(17)32263-9 . hdl : 2436/7744 . ПМИД 7518447 .
- ^ Эрдман Л.К., Косио Г., Хелмерс А.Дж., Гауда Д.К., Гринштейн С., Кейн К.К. (ноябрь 2009 г.). «Взаимодействие CD36 и TLR при воспалении и фагоцитозе: последствия для малярии» . Журнал иммунологии . 183 (10): 6452–9. doi : 10.4049/jimmunol.0901374 . ПМЦ 2853812 . ПМИД 19864601 .
- ^ Дэвиет Л., МакГрегор Дж.Л. (июль 1997 г.). «Сосудистая биология CD36: роль этого нового семейства молекул адгезии в различных болезненных состояниях». Тромбоз и гемостаз . 78 (1): 65–9. дои : 10.1055/s-0038-1657502 . ПМИД 9198129 . S2CID 21113427 .
- ^ Коллинз Р.Ф., Туре Н., Кувата Х., Тандон Н.Н., Гринштейн С., Тримбл В.С. (октябрь 2009 г.). «Поглощение окисленного липопротеина низкой плотности CD36 происходит актин-зависимым путем, отличным от макропиноцитоза» . Журнал биологической химии . 284 (44): 30288–97. дои : 10.1074/jbc.M109.045104 . ПМЦ 2781584 . ПМИД 19740737 .
- ^ Стюарт Ч.Р., Стюарт Л.М., Уилкинсон К., ван Гилс Дж.М., Денг Дж., Галле А. и др. (февраль 2010 г.). «Лиганды CD36 способствуют стерильному воспалению посредством сборки гетеродимера Toll-подобных рецепторов 4 и 6» . Природная иммунология . 11 (2): 155–61. дои : 10.1038/ni.1836 . ПМК 2809046 . ПМИД 20037584 .
- ^ Куда О., Дженкинс К.М., Скиннер-младший, Мун С.Х., Су X, Гросс Р.В., Абумрад Н.А. (май 2011 г.). «Белок CD36 участвует в депо-управляемом потоке кальция, активации фосфолипазы А2 и выработке простагландина Е2» . Журнал биологической химии . 286 (20): 17785–95. дои : 10.1074/jbc.M111.232975 . ПМК 3093854 . ПМИД 21454644 .
- ^ Патель С.Н., Лу З., Айи К., Сергидес Л., Гауда Д.С., Каин К.К. (март 2007 г.). «Нарушение CD36 ухудшает ответ цитокинов на гликозилфосфатидилинозитол Plasmodium falciparum и повышает восприимчивость к тяжелой и смертельной малярии in vivo» . Журнал иммунологии . 178 (6): 3954–61. дои : 10.4049/jimmunol.178.6.3954 . ПМИД 17339496 .
- ^ Икеда Х., Митани Т., Онума М., Хага Х., Оцука С., Като Т. и др. (1989). «Новый тромбоцитарно-специфичный антиген, Нака, участвует в рефрактерности переливания HLA-совместимых тромбоцитов» . Вокс Сангвинис . 57 (3): 213–7. дои : 10.1111/j.1423-0410.1989.tb00826.x . ПМИД 2617957 . S2CID 39521299 .
- ^ Ямамото Н., Икеда Х., Тандон Н.Н., Херман Дж., Томияма Ю., Митани Т. и др. (ноябрь 1990 г.). «Дефицит гликопротеина мембраны тромбоцитов (GP) у здоровых доноров крови: у Нака-тромбоцитов отсутствует обнаруживаемый GPIV (CD36)» . Кровь . 76 (9): 1698–703. дои : 10.1182/blood.V76.9.1698.1698 . ПМИД 1699620 .
- ^ Окенхаус К.Ф., Клотц Ф.В., Тандон Н.Н., Джеймисон Г.А. (апрель 1991 г.). «Секвестрин, белок распознавания CD36 на эритроцитах, инфицированных малярией Plasmodium falciparum, идентифицированный антиидиотипическими антителами» . Труды Национальной академии наук Соединенных Штатов Америки . 88 (8): 3175–9. Бибкод : 1991PNAS...88.3175O . дои : 10.1073/pnas.88.8.3175 . ПМК 51408 . ПМИД 1707534 .
- ^ Тоба К., Ханава Х., Ватанабэ К., Фьюз И., Масуко М., Миядзима С. и др. (октябрь 2001 г.). «Вовлечение эритроидов при дефиците CD36» . Экспериментальная гематология . 29 (10): 1194–200. дои : 10.1016/S0301-472X(01)00691-9 . ПМИД 11602321 .
- ^ Янаи Х., Чиба Х., Фудзивара Х., Моримото М., Абэ К., Ёсида С. и др. (сентябрь 2000 г.). «Корреляция фенотип-генотип при дефиците CD36 типов I и II». Тромбоз и гемостаз . 84 (3): 436–41. дои : 10.1055/s-0037-1614041 . ПМИД 11019968 . S2CID 42193140 .
- ^ Ли К., Годо Б., Фромон П., Плонке А., Дебили Н., Башир Д. и др. (август 1999 г.). «Дефицит CD36 встречается часто и может вызвать иммунизацию тромбоцитов у африканцев» . Переливание . 39 (8): 873–9. дои : 10.1046/j.1537-2995.1999.39080873.x . ПМИД 10504124 . S2CID 21921171 .
- ^ Кертис Б.Р., Астер Р.Х. (апрель 1996 г.). «Заболеваемость Nak(a)-негативным фенотипом тромбоцитов у афроамериканцев аналогична таковой у азиатов». Переливание . 36 (4): 331–4. дои : 10.1046/j.1537-2995.1996.36496226147.x . ПМИД 8623134 . S2CID 10991605 .
- ^ Бирлинг П., Годо Б., Фромон П., Беттайеб А., Дебили Н., Эль-Кассар Н. и др. (сентябрь 1995 г.). «Синдром, похожий на посттрансфузионную пурпуру, связанный с изоиммунизацией CD36 (Нака)». Переливание . 35 (9): 777–82. дои : 10.1046/j.1537-2995.1995.35996029165.x . ПМИД 7570941 . S2CID 22706156 .
- ^ Правенец М., Черчилль П.С., Черчилль М.К., Виклицкий О., Каздова Л., Эйтман Т.Дж. и др. (август 2008 г.). «Идентификация почечного Cd36 как фактора артериального давления и риска гипертонии». Природная генетика . 40 (8): 952–4. дои : 10.1038/ng.164 . ПМИД 18587397 . S2CID 6857655 .
- ^ Окамото Ф., Танака Т., Сохмия К., Кавамура К. (июль 1998 г.). «Нарушение CD36 и нарушение поглощения длинноцепочечных жирных кислот миокардом у пациентов с гипертрофической кардиомиопатией» . Японский тиражный журнал . 62 (7): 499–504. дои : 10.1253/jcj.62.499 . ПМИД 9707006 .
- ^ Филипс Дж. А., Рубин Э. Дж., Перримон Н. (август 2005 г.). «Скрининг RNAi дрозофилы выявляет члена семейства CD36, необходимого для микобактериальной инфекции» . Наука . 309 (5738): 1251–3. Бибкод : 2005Sci...309.1251P . дои : 10.1126/science.1116006 . ПМИД 16020694 . S2CID 26751583 .
- ^ Чжао Ю., Рейес Дж., Ровира-Диас Э., Фокс Б.А., Бзик Д., Яп Г.С. (август 2021 г.). «CD36 опосредует тропизм фагоцитов и авирулентность Toxoplasma gondii» . Журнал иммунологии . 207 (6): 1507–1512. doi : 10.4049/jimmunol.2100605 . ISSN 0022-1767 . ПМЦ 8429199 . ПМИД 34400524 . S2CID 237148810 .
- ^ Jump up to: а б Абдул-Азизе С., Атек-Мебарки Ф., Битам А., Саду Х., Косейр Э.А., Хан Н.А. (2013). «Оро-вкусовое восприятие пищевых липидов и передача сигналов кальция в клетках вкусовых рецепторов изменяются у Psammomys obesus, склонного к алиментарному ожирению» . ПЛОС ОДИН . 8 (8): e68532. Бибкод : 2013PLoSO...868532A . дои : 10.1371/journal.pone.0068532 . ПМЦ 3731325 . ПМИД 23936306 .
- ^ Jump up to: а б Шеврот М., Бернард А., Ансель Д., Баттет М., Мартин С., Абдул-Азизе С. и др. (сентябрь 2013 г.). «Ожирение изменяет вкусовое восприятие липидов у мышей: вероятное участие лингвального CD36» . Журнал исследований липидов . 54 (9): 2485–94. дои : 10.1194/jlr.M039446 . ПМЦ 3735945 . ПМИД 23840049 .
- ^ Моисеева В и др. (2022). «Атлас старения обнаруживает воспаленную нишу, напоминающую старость, которая притупляет регенерацию мышц» . Природа . 612 (7941): 169–178. дои : 10.1038/s41586-022-05535-x . ПМЦ 9812788 . ПМИД 36544018 .
 В эту статью включен текст из этого источника, доступного по лицензии CC BY 3.0 .
В эту статью включен текст из этого источника, доступного по лицензии CC BY 3.0 . - ^ Ge Y, Эльгетани MT (2005). «CD36: мультилигандная молекула». Лаборатория гематологии . 11 (1): 31–7. дои : 10.1532/LH96.04056 . ПМИД 15790550 .
- ^ Селван Э.М., Финикл Б.Т., Ким С.М., Эдингер А.Л. (апрель 2016 г.). «Атака на фургоны снабжения, чтобы заморить раковые клетки голодом» . Письма ФЭБС . 590 (7): 885–907. дои : 10.1002/1873-3468.12121 . ПМЦ 4833639 . ПМИД 26938658 .
- ^ Хуанг ММ, Болен Дж.Б., Барнуэлл Дж.В., Шаттил С.Дж., Брюгге Дж.С. (сентябрь 1991 г.). «Мембранный гликопротеин IV (CD36) физически связан с протеин-тирозинкиназами Fyn, Lyn и Yes в тромбоцитах человека» . Труды Национальной академии наук Соединенных Штатов Америки . 88 (17): 7844–8. Бибкод : 1991PNAS...88.7844H . дои : 10.1073/pnas.88.17.7844 . ПМК 52400 . ПМИД 1715582 .
- ^ Булл Х.А., Брикелл П.М., Дауд П.М. (август 1994 г.). «Src-связанные протеинтирозинкиназы физически связаны с поверхностным антигеном CD36 в эндотелиальных клетках дермальных микрососудистых сосудов человека». Письма ФЭБС . 351 (1): 41–4. дои : 10.1016/0014-5793(94)00814-0 . ПМИД 7521304 . S2CID 45071719 .
Дальнейшее чтение
[ редактировать ]- Рен Х., Хань Р., Чен Х, Лю Х, Ван Дж, Ван Л, Ян Х, Ван Дж (май 2020 г.). «Потенциальные терапевтические мишени для воспаления, связанного с внутримозговым кровоизлиянием: обновленная информация» . J Метаболия кровотока головного мозга . 40 (9): 1752–1768. дои : 10.1177/0271678X20923551 . ПМЦ 7446569 . ПМИД 32423330 .
- Феббрайо М., Сильверстайн Р.Л. (2007). «CD36: последствия сердечно-сосудистых заболеваний» . Международный журнал биохимии и клеточной биологии . 39 (11): 2012–30. doi : 10.1016/j.biocel.2007.03.012 . ПМК 2034445 . ПМИД 17466567 .
- Абумрад Н.А., Аджмал М., Потакос К., Робинсон Дж.К. (сентябрь 2005 г.). «Экспрессия CD36 и функция мозга: влияет ли дефицит CD36 на способность к обучению?». Простагландины и другие липидные медиаторы . 77 (1–4): 77–83. doi : 10.1016/j.prostaglandins.2004.09.012 . ПМИД 16099393 .
- Бьелло Д. (2 ноября 2005 г.). «Идентифицирован потенциальный вкусовой рецептор жира» . Научный американец. Архивировано из оригинала 26 сентября 2007 г. Проверено 5 августа 2008 г.




