Плазмодий фальципарум
| Плазмодий фальципарум | |
|---|---|
 | |
| Макрогаметоцит (слева) и микрогаметоцит (справа) P. falciparum. | |
| Научная классификация | |
| Домен: | Эукариоты |
| Клэйд : | потогонные средства |
| Клэйд : | САР |
| Клэйд : | Альвеолата |
| Тип: | Апикомплекса |
| Сорт: | Аконоидазид |
| Заказ: | Гемоспорорида |
| Семья: | Плазмодииды |
| Род: | Плазмодий |
| Разновидность: | П. фальципарум |
| Биномиальное имя | |
| Плазмодий фальципарум ( Уэлч , 1897 г.) | |
| Синонимы [1] | |
| |
Plasmodium falciparum — одноклеточный простейший паразит человека и самый смертоносный вид Plasmodium , вызывающий малярию у людей. [2] Паразит передается через укус самки Anopheles комара и вызывает наиболее опасную форму заболевания — малярию falciparum. На него приходится около 50% всех случаев малярии. [3] [4] Поэтому P. falciparum считается самым смертоносным паразитом человека. Он также связан с развитием рака крови ( лимфомы Беркитта ) и классифицируется как канцероген группы 2А (вероятный) .
Этот вид произошел от малярийного паразита Laverania , обнаруженного у горилл около 10 000 лет назад. [5] [6] Альфонс Лаверан был первым, кто идентифицировал паразита в 1880 году и назвал его Oscillaria malariae . Рональд Росс обнаружил передачу вируса через комаров в 1897 году. Джованни Баттиста Грасси выяснил полную передачу инфекции от самки анофелинового комара человеку в 1898 году. В 1897 году Уильям Х. Уэлч создал название Plasmodium falciparum , которое ICZN официально приняла в 1954 году. P. falciparum. в течение своего жизненного цикла принимает несколько различных форм. Человекоинфекционная стадия – спорозоиты из слюнной железы комара . Спорозоиты растут и размножаются в печени , превращаясь в мерозоиты . Эти мерозоиты проникают в эритроциты (эритроциты) с образованием трофозоитов , шизонтов и гаметоцитов , во время которых возникают симптомы малярии. У комара гаметоциты подвергаются половому размножению до зиготы , которая превращается в оокинету . Оокинета образует ооциты , из которых образуются спорозоиты.
В 2022 году около 249 миллионов случаев малярии во всем мире привели, по оценкам, к 608 000 смертей, из которых 80 процентов были в возрасте 5 лет или меньше. [7] Почти все случаи смерти от малярии вызваны P. falciparum , и 95% таких случаев приходится на Африку . В странах Африки к югу от Сахары почти 100% случаев были вызваны P. falciparum , тогда как в большинстве других малярийных стран преобладают другие, менее вирулентные виды плазмодий. [8]
История
[ редактировать ]
Малярия Falciparum была знакома еще древним грекам , давшим общее название πυρετός ( pyretós ) «лихорадка». [9] Гиппократ (ок. 460–370 гг. до н. э.) дал несколько описаний трехдневной и четырехдневной лихорадок . [10] Он был распространен во всех древнеегипетских и римских цивилизациях. [11] Именно римляне назвали болезнь «малярией» — мала — плохо, а ария — воздух, поскольку они считали, что болезнь распространяется через загрязненный воздух, или миазмы . [10] [12]
Открытие
[ редактировать ]Немецкий врач Иоганн Фридрих Меккель , должно быть, был первым, кто увидел P. falciparum, но не знал, что это такое. В 1847 году он сообщил о наличии гранул черного пигмента в крови и селезенке больного, умершего от малярии. Врач французской армии Шарль Луи Альфонс Лаверан , работая в больнице Бон (ныне Аннаба в Алжире), в 1880 году правильно идентифицировал паразита как возбудителя малярии. Он представил свое открытие Французской медицинской академии в Париже и опубликовал его. в журнале «Ланцет» в 1881 году. Он дал ему научное название Oscillaria malariae . [12] Однако его открытие было встречено со скептицизмом, главным образом потому, что к тому времени такие ведущие врачи, как Теодор Альбрехт, Эдвин Клебс и Коррадо Томмази-Крудели, утверждали, что открыли бактерию (которую они назвали Bacillus Malariae ) как возбудителя малярии. Открытие Лаверана получило широкое признание только через пять лет, когда Камилло Гольджи подтвердил наличие паразита, используя более совершенные микроскопы и методы окрашивания. Лаверан был удостоен Нобелевской премии по физиологии и медицине в 1907 году за свою работу. В 1900 году итальянский зоолог Джованни Баттиста Грасси классифицировал виды Plasmodium в зависимости от времени возникновения лихорадки у пациента; злокачественная третичная малярия была вызвана Laverania malariae (ныне P. falciparum ), доброкачественная третичная малярия - Haemamoeba vivax (ныне P. vivax ), а четырехдневная малярия - Haemamoebamalariae (теперь P.malariae ). [13]
Британский врач Патрик Мэнсон сформулировал теорию комариной малярии в 1894 году; до этого времени считалось, что малярийные паразиты распространяются в воздухе в виде миазмов, что по-гречески означает загрязнение. [12] Его коллега Рональд Росс из Индийской медицинской службы подтвердил эту теорию, работая в Индии. В 1897 году Росс обнаружил, что малярийные паразиты обитают в некоторых комарах. В следующем году он продемонстрировал, что малярийный паразит птиц может передаваться комарами от одной птицы к другой. Примерно в то же время Грасси продемонстрировал, что P. falciparum передается человеку только самками комаров-анофелинов (в его случае Anopheles claviger ). [14] Росс, Мэнсон и Грасси были номинированы на Нобелевскую премию по физиологии и медицине в 1902 году. При спорных обстоятельствах на эту награду был выбран только Росс. [15]
По поводу таксономии шли долгие дебаты. И только в 1954 году Международная комиссия по зоологической номенклатуре официально одобрила биноминальный Plasmodium falciparum . [16] Действительный род Plasmodium был создан двумя итальянскими врачами Этторе Марчиафава и Анджело Челли в 1885 году. Греческое слово «плазма» означает «плесень» или «форма»; oeidēs означает «видеть» или «знать». Видовое название было введено американским врачом Уильямом Генри Уэлчем в 1897 году. [17] Оно происходит от латинского слова falx , что означает «серп», и parum, что означает «подобный или равный другому». [16]
Происхождение и эволюция
[ редактировать ]В настоящее время общепринято считать, что P. falciparum произошел от вида Laverania (подрод Plasmodium, обнаруженного у обезьян), присутствующего у горилл в Западной Африке. [18] [19] Генетическое разнообразие указывает на то, что простейшие человека появились около 10 000 лет назад. [5] [6] Ближайшим родственником P. falciparum является P. praefalciparum , паразит горилл , что подтверждается последовательностями митохондриальной , апикопластической и ядерной ДНК . [20] [21] [22] Эти два вида тесно связаны с шимпанзе паразитом P. reichenowi , который ранее считался ближайшим родственником P. falciparum . Когда-то считалось, что P. falciparum произошел от паразита птиц. [23]
Уровни генетического полиморфизма чрезвычайно низки в геноме P. falciparum по сравнению с таковыми у близкородственных видов Plasmodium , инфицирующих обезьян (включая P. praefalciparum ). [24] [20] Это говорит о том, что P. falciparum у людей появился недавно, поскольку единственный штамм P. praefalciparum стал способен заражать человека. [20] Генетическая информация P. falciparum сигнализирует о недавней экспансии, совпавшей с сельскохозяйственной революцией. Вполне вероятно, что развитие экстенсивного сельского хозяйства увеличило плотность популяции комаров за счет появления большего количества мест размножения, что могло спровоцировать эволюцию и распространение P. falciparum . [25]
Структура
[ редактировать ]

P. falciparum не имеет фиксированной структуры, но претерпевает постоянные изменения в течение своего жизненного цикла. Спорозоит имеет веретенообразную форму, длину 10–15 мкм. В печени он разрастается в яйцевидный шизонт диаметром 30–70 мкм. Каждый шизонт производит мерозоиты, каждый из которых имеет длину примерно 1,5 мкм и диаметр 1 мкм. В эритроците мерозоиты образуют кольцевую структуру, превращаясь в трофозоит. Трофозоит питается гемоглобином и образует зернистый пигмент, называемый гемозоином . В отличие от гаметоцитов других видов Plasmodium , гаметоциты P. falciparum имеют удлиненную форму и серповидную форму, по которой их иногда идентифицируют. Зрелый гаметоцит имеет длину 8–12 мкм и ширину 3–6 мкм. Оокинета также удлиненная, ее размеры составляют около 18–24 мкм. Ооциста имеет округлую форму и может достигать 80 мкм в диаметре. [26] При микроскопическом исследовании мазка крови выявляют только ранние (кольцевые) трофозоиты и гаметоциты, находящиеся в периферической крови. Зрелые трофозоиты или шизонты в мазках периферической крови, поскольку они обычно секвестрируются в тканях. Иногда на поверхности эритроцитов наблюдаются слабые красные точки в форме запятых. Эти точки представляют собой расщелину Маурера и секреторные органеллы, которые производят белки и ферменты, необходимые для поглощения питательных веществ и процессов уклонения от иммунитета. [27]
Апикальный комплекс, который на самом деле представляет собой комбинацию органелл, представляет собой важную структуру. Он содержит секреторные органеллы, называемые роптриями и микронемами, которые жизненно важны для подвижности, адгезии, инвазии в клетки-хозяева и образования паразитофорных вакуолей. [28] Как апикомплексан , он содержит пластиду, апикопласт , похожий на растительные хлоропласты , который они, вероятно, приобрели, поглотив (или подвергнувшись вторжению) эукариотической водоросли и сохранив пластиду водоросли как отличительную органеллу, заключенную в четыре мембраны . Апикопласт участвует в синтезе липидов и ряда других соединений и представляет собой привлекательную мишень для лекарств. На бесполой стадии инфекции важной функцией апикопласта является выработка предшественников изопреноидов изопентенилпирофосфата (IPP) и диметилаллилпирофосфата (DMAPP) через MEP (немевалонатный) путь . [29]
Геном
[ редактировать ]В 1995 году был запущен проект «Геном малярии» для секвенирования генома P. falciparum . О геноме его митохондрий было сообщено в 1995 году, о геноме нефотосинтетической пластиды, известной как апикопласт, - в 1996 году. [30] и последовательность первой ядерной хромосомы (хромосома 2) в 1998 году. Последовательность хромосомы 3 была опубликована в 1999 году, а весь геном - 3 октября 2002 года. [31] Геном размером примерно 24 мегабазы чрезвычайно богат АТ (около 80%) и организован в 14 хромосом. Было описано чуть более 5300 генов. Многие гены, участвующие в антигенной изменчивости, расположены в субтеломерных областях хромосом. Они делятся на семейства var , rif и stevor . В геноме существует 59 var , 149 rif и 28 stevor генов, а также множество псевдогенов и усечений. Подсчитано, что 551, или примерно 10% предсказанных ядерно-кодируемых белков нацелены на апикопласт , в то время как 4,7% протеома нацелены на митохондрии. [31]
Жизненный цикл
[ редактировать ]
Человек является промежуточным хозяином, у которого происходит бесполое размножение, а самки комаров-анофелинов являются окончательными хозяевами, находящимися на стадии полового размножения. [32]
У людей
[ редактировать ]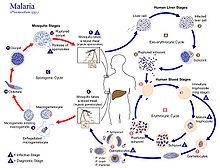
Заражение человека начинается с укуса инфицированной самки комара Anopheles . Из примерно 460 видов Anopheles комаров более 70 видов являются переносчиками малярии falciparum. [33] Anopheles gambiae — один из наиболее известных и распространенных переносчиков, особенно в Африке. [34]
Инфекционная стадия, называемая спорозоитом, выделяется из слюнных желез через хоботок комара и проникает через кожу во время кормления. [35] Слюна комара содержит антигемостатические и противовоспалительные ферменты, которые нарушают свертываемость крови и подавляют болевую реакцию. Обычно каждый инфицированный укус содержит 20–200 спорозоитов. [28] Часть спорозоитов проникает в клетки печени ( гепатоциты ). [36] Спорозоиты перемещаются в кровотоке путем скольжения , которое приводится в движение двигателем, состоящим из белков актина и миозина под их плазматической мембраной . [37]
Печеночная стадия или экзоэритроцитарная шизогония.
[ редактировать ]Попадая в гепатоциты, паразит теряет апикальный комплекс и поверхностную оболочку и превращается в трофозоит . Внутри паразитофорной вакуоли гепатоцита он подвергается 13–14 циклам митоза, в результате которых образуется синцитиальная клетка ( ценоцит ), называемая шизонтом. Этот процесс называется шизогонией. Шизонт содержит десятки тысяч ядер. На поверхности шизонта появляются десятки тысяч гаплоидных (1n) дочерних клеток, называемых мерозоитами. На стадии печени может образовываться до 90 000 мерозоитов. [38] которые в конечном итоге попадают в кровоток в виде пузырьков, заполненных паразитами, называемых меросомами. [39]
Стадия крови или эритроцитарная шизогония
[ редактировать ]Мерозоиты используют органеллы апикомплексной инвазии ( апикальный комплекс , пелликула и поверхностную оболочку) для распознавания и проникновения эритроцитов хозяина ( эритроцитов ). Мерозоиты сначала связываются с эритроцитом в случайной ориентации. Затем он переориентируется так, что апикальный комплекс оказывается вблизи мембраны эритроцита. Паразит образует паразитофорную вакуоль, позволяющую ему развиваться внутри эритроцита . [40] Этот инфекционный цикл происходит очень синхронно, при этом примерно все паразиты в крови находятся на одной и той же стадии развития. Было показано, что этот точный механизм синхронизации зависит от собственного циркадного ритма человека-хозяина . [41]
Внутри эритроцита метаболизм паразита зависит от переваривания гемоглобина . Клинические симптомы малярии, такие как лихорадка, анемия и неврологические расстройства, возникают на стадии крови. [36]
Паразит также может изменить морфологию эритроцитов, вызывая появление выступов на мембране эритроцитов. Инфицированные эритроциты часто секвестрируются в различных тканях и органах человека, таких как сердце, печень и мозг. Это вызвано тем, что на мембране эритроцитов присутствуют белки клеточной поверхности, полученные от паразитов, и именно эти белки связываются с рецепторами на клетках человека. Секвестрация в головном мозге вызывает церебральную малярию, очень тяжелую форму заболевания, которая увеличивает вероятность смерти жертвы. [42]
Трофозоит
[ редактировать ]После проникновения в эритроцит паразит теряет свои специфические органеллы инвазии (апикальный комплекс и поверхностную оболочку) и дедифференцируется в круглый трофозоит, расположенный внутри паразитофорной вакуоли. Трофозоит питается гемоглобином эритроцита, переваривая его белки и превращая (путем биокристаллизации ) оставшийся гем в нерастворимые и химически инертные кристаллы β-гематина , называемые гемозоином. [43] [44] Молодой трофозоит (или стадия «кольца» из-за его морфологии на окрашенных мазках крови) существенно растет, прежде чем приступить к размножению. [45]
Шизонт
[ редактировать ]На стадии шизонта паразит многократно реплицирует свою ДНК, и множественные митотические деления происходят асинхронно. [46] [47] Деление и размножение клеток в эритроците называется эритроцитарной шизогонией. Каждый шизонт образует 16-18 мерозоитов. [45] Эритроциты разрушаются мерозоитами. Освободившиеся мерозоиты внедряются в свежие эритроциты. Свободный мерозоит находится в кровотоке примерно 60 секунд, прежде чем попадет в другой эритроцит. [40]
Продолжительность одной полной эритроцитарной шизогонии составляет примерно 48 часов. Это вызывает характерные клинические проявления малярии, вызванные falciparum, такие как лихорадка и озноб, соответствующие синхронному разрыву инфицированных эритроцитов. [48]
Гаметоцит
[ редактировать ]Некоторые мерозоиты дифференцируются в половые формы — мужские и женские гаметоциты . Этим гаметоцитам требуется примерно 7–15 дней, чтобы достичь полной зрелости в ходе процесса, называемого гаметоцитогенезом. Затем они поглощаются самкой комара Anopheles во время еды с кровью. [49]
Период инкубации
[ редактировать ]Время появления симптомов инфекции (называемое инкубационным периодом ) является самым коротким для P. falciparum среди видов Plasmodium . Средний инкубационный период составляет 11 дней, [48] но может варьироваться от 9 до 30 дней. В единичных случаях регистрировались продолжительные инкубационные периоды, достигающие 2, 3 и даже 8 лет. [50] Беременность и коинфекция ВИЧ являются важными условиями для задержки симптомов. [51] Паразитов можно обнаружить в пробах крови к 10-му дню после заражения (предпатентный период). [48]
У комаров
[ редактировать ]В средней кишке комара процесс созревания женских гамет влечет за собой небольшие морфологические изменения: они становятся более увеличенными и сферическими. Мужской гаметоцит подвергается быстрому ядерному делению в течение 15 минут, образуя восемь жгутиковых микрогамет в результате процесса, называемого эксфлагелляцией. [52] Жгутиковая микрогамета оплодотворяет женскую макрогамету с образованием диплоидной клетки, называемой зиготой . Затем зигота развивается в оокинету . Оокинета — подвижная клетка, способная проникать в другие органы комара. Он пересекает перитрофическую мембрану средней кишки комара и эпителий средней кишки. Пройдя через эпителий, оокинета попадает в базальную пластинку и образует неподвижную ооцисту . В течение нескольких дней ооциста подвергается 10–11 циклам клеточного деления с образованием синцитиальной клетки ( споробласта ), содержащей тысячи ядер. Мейоз происходит внутри споробласта, в результате чего на поверхности материнской клетки образуется более 3000 гаплоидных дочерних клеток, называемых спорозоитами. [53] Незрелые спорозоиты прорываются через стенку ооцисты в гемолимфу . Они мигрируют в слюнные железы комаров, где подвергаются дальнейшему развитию и становятся заразными для человека. [36]
Влияние вторичных метаболитов растений на P. falciparum
Известно, что комары питаются нектаром растений для получения сахарной муки, основного источника энергии и питательных веществ для их выживания и других биологических процессов, таких как поиск хозяином крови или мест откладки яиц. [54] Исследователи недавно обнаружили, что комары очень избирательны в отношении источников сахарной муки. [55] Например, комары Anopheles предпочитают одни растения другим, особенно те, которые содержат соединения, которые препятствуют развитию и выживанию малярийных паразитов внутри комара. [56] Это открытие дает возможность изучить, что может играть роль в изменениях поведения комаров, а также выяснить, что они поглощают, когда питаются выбранными растениями. В других исследованиях было показано, что источники сахаров и некоторые вторичные метаболиты, например рицинин, оказывают разнонаправленное воздействие на способность комаров передавать паразитов малярии. [57]
Мейоз
[ редактировать ]Plasmodium falciparum является гаплоидным (один набор хромосом) на репродуктивных стадиях в крови и печени человека. Когда комар питается кровью человека-хозяина, инфицированного плазмодием , эта еда может включать гаплоидные микрогаметы и макрогаметы . Такие гаметы могут сливаться внутри комара с образованием диплоидной (2N) зиготы плазмодия — единственной диплоидной стадии жизненного цикла этих паразитов. [58] Зигота может пройти еще один раунд репликации хромосом с образованием оокинеты (4N) (см. Рисунок: Жизненный цикл плазмодия). Оокинета, которая дифференцируется из зиготы, представляет собой высокомобильную стадию, проникающую в среднюю кишку комара. Оокинеты могут подвергаться мейозу с участием двух мейотических делений, приводящих к высвобождению гаплоидных спорозоитов (см. Рисунок). [58] Спорозоит представляет собой удлиненную инвазивную стадию серповидной формы. Эти спорозоиты могут мигрировать в слюнные железы комара и проникать в человека-хозяина, когда комар питается кровью. Затем спорозоиты могут перемещаться в печень человека-хозяина и инфицировать гепатоциты .
Профиль генов, кодируемых плазмодием и участвующих в мейозе, в некоторой степени совпадает с профилем генов, участвующих в мейозе у других, более хорошо изученных организмов, но более расходится и в нем отсутствуют некоторые компоненты мейотического процесса, обнаруженные у других организмов. [58] Во время мейоза плазмодия, как и у других организмов, происходит рекомбинация между гомологичными хромосомами.
Взаимодействие с иммунной системой человека
[ редактировать ]Иммунный ответ
[ редактировать ]В экспериментальных условиях один комар-анофелин может передать сотни спорозоитов P. falciparum за один укус, но в природе их число обычно не превышает 80. [59] Спорозоиты не попадают непосредственно в кровоток, а остаются в коже в течение двух-трех часов. Около 15–20% спорозоитов попадают в лимфатическую систему, где активируют дендритные клетки , которые отправляют их на разрушение Т-лимфоцитами ( CD8+ Т-клетками ). Через 48 часов после заражения плазмодий -специфичные CD8+ Т-клетки можно обнаружить в лимфатических узлах, связанных с клетками кожи. [60] Большинство спорозоитов, остающихся в тканях кожи, впоследствии уничтожаются врожденной иммунной системой . Спорозоитный гликопротеин специфически активирует тучные клетки . Тучные клетки затем производят сигнальные молекулы, такие как TNFα и MIP-2, которые активируют пожирателей клеток (профессиональных фагоцитов), таких как нейтрофилы и макрофаги . [61]
Лишь небольшое количество (0,5-5%) спорозоитов попадает с током крови в печень. В печени активированные CD8+ Т-клетки из лимфы связывают спорозоиты через белок циркумспорозоитов (CSP). [60] Презентация антигена дендритными клетками кожной ткани Т-клеткам также является важным процессом. Начиная с этой стадии, паразиты производят различные белки, которые помогают подавлять связь иммунных клеток. [62] Даже в разгар инфекции, когда эритроциты (эритроциты) разрушаются, иммунные сигналы недостаточно сильны, чтобы активировать макрофаги или естественные клетки-киллеры . [63]
Уклонение иммунной системы
[ редактировать ]Хотя P. falciparum легко распознается иммунной системой человека в кровотоке, он уклоняется от иммунитета, продуцируя более 2000 антигенов клеточных мембран. [64] Спорозоиты начальной инфекционной стадии продуцируют циркумспорозоитный белок (CSP), который связывается с гепатоцитами. [65] Связыванию гепатоцитов и проникновению в них способствует связанный с тромбоспондином анонимный белок (TRAP). [66] TRAP и другие секреторные белки (включая белок микронемы спорозоита, необходимый для прохождения клеток 1, SPECT1 и SPECT2) из микронемы позволяют спорозоиту перемещаться по крови, избегая иммунных клеток и проникая в гепатоциты. [67]
Во время инвазии эритроцитов мерозоиты высвобождают белок-1 кэпа мерозоита (MCP1), апикальный мембранный антиген 1 (AMA1), эритроцитсвязывающие антигены (EBA), белок, взаимодействующий с хвостовым доменом миозина А (MTIP) и поверхностные белки мерозоитов (MSP). [64] Из этих MSP MSP1 и MSP2 в первую очередь отвечают за избегание иммунных клеток. [68] Вирулентность P. falciparum опосредуется мембранными белками эритроцитов, которые продуцируются шизонтами и трофозоитами внутри эритроцитов и отображаются на мембране эритроцитов. PfEMP1 является наиболее важным, способным действовать как антиген, так и молекула адгезии. [69]
Патогенность
[ редактировать ]Клинические симптомы малярии falciparum обусловлены разрывом и разрушением эритроцитов мерозоитами. Высокая температура, называемая пароксизмом, является основным признаком. Лихорадка имеет характерный цикл: горячая стадия, холодная стадия и стадии потоотделения. [70] Поскольку каждая эритроцитарная шизогония занимает цикл в 48 часов, т. е. два дня, то лихорадочный симптом появляется через каждые три дня. По этой причине инфекцию классически называют третичной злокачественной лихорадкой (tertian, производное от латинского слова, означающего «третий»). [71] [72] Наиболее распространенными симптомами являются лихорадка (>92% случаев), озноб (79%), головные боли (70%) и потливость (64%). головокружение , недомогание , мышечные боли , боли в животе , тошнота , рвота , легкая диарея и сухой кашель Также обычно сопровождаются учащенное сердцебиение , желтуха , бледность , ортостатическая гипотония , увеличение печени и селезенки . . Также диагностируются [48]
Нерастворимые кристаллы β-гематина, гемозоин, образующиеся в результате расщепления гемоглобина эритроцитов, являются основным агентом, влияющим на органы тела. Действуя как токсин крови, гемозоинсодержащие эритроциты не могут быть атакованы фагоцитами во время иммунного ответа на малярию. [73] Фагоциты могут поглощать свободные гемозоины, высвобождаемые после разрыва эритроцитов, что побуждает их инициировать цепочки воспалительных реакций , приводящих к повышению температуры. [74] [75] Именно гемозоин откладывается в таких органах тела, как селезенка и печень, а также в почках и легких, вызывая их увеличение и изменение цвета. [76] [77] Из-за этого гемозоин также известен как малярийный пигмент. [78] [79]
В отличие от других малярий, которые характеризуются регулярной периодичностью лихорадки, falciparum, хотя и имеет 48-часовой цикл, обычно проявляется нерегулярными приступами лихорадки . Это различие обусловлено способностью мерозоитов P. falciparum инвазировать большое количество эритроцитов последовательно без согласованных интервалов, чего не наблюдается у других малярийных паразитов. [70] Таким образом, P. falciparum является причиной почти всех тяжелых заболеваний и смертей людей от малярии в состоянии, называемом злокачественной, осложненной или тяжелой малярией. Осложненная малярия чаще возникает у детей в возрасте до 5 лет. [48] а иногда и у беременных женщин (состояние, специально называемое малярией, связанной с беременностью ). [80] Женщины становятся восприимчивыми к тяжелой форме малярии во время первой беременности. Восприимчивость к тяжелой форме малярии снижается при последующих беременностях из-за повышения уровня антител против вариантов поверхностных антигенов , которые появляются на инфицированных эритроцитах. [81] Но повышенный иммунитет матери увеличивает восприимчивость новорожденных к малярии. [80]
P. falciparum действует посредством секвестрации - процесса, при котором группы инфицированных эритроцитов группируются, чего не наблюдается ни у каких других видов малярийных паразитов. [82] Зрелые шизонты изменяют свойства поверхности инфицированных эритроцитов, вызывая их прилипание к стенкам кровеносных сосудов (цитоадгезия). Это приводит к обструкции микроциркуляции и дисфункции многих органов, например головного мозга при церебральной малярии . [83]
Церебральная малярия — самое опасное состояние любой малярийной инфекции и самая тяжелая форма неврологических расстройств . Согласно определению ВОЗ, клиническим симптомом является кома, а диагноз – высокий уровень мерозоитов в образцах периферической крови. [84] [85] Это самая смертоносная форма малярии, и на ее счету от 0,2 до более миллиона ежегодных смертей на протяжении веков. Большинство смертей приходится на детей в возрасте до 5 лет. [86] [87] Это происходит, когда мерозоиты проникают в мозг и вызывают его повреждение различной степени. Смерть вызвана кислородным голоданием (гипоксией) из-за воспалительной продукции цитокинов и утечки сосудов, вызванной мерозоитами. [88] Среди выживших людей существуют стойкие заболевания, такие как неврологические нарушения, умственная отсталость и поведенческие проблемы . Среди них эпилепсия является наиболее распространенным заболеванием, а церебральная малярия является основной причиной приобретенной эпилепсии среди африканских детей. [89]
Повторное появление симптома falciparum, явление, называемое рецидивом, часто наблюдается у выживших. [90] Рецидив может произойти даже после успешного лечения противомалярийными препаратами. [91] [92] Это может занять несколько месяцев или даже несколько лет. У некоторых людей это занимает до трех лет. [93] В единичных случаях продолжительность может достигать и превышать 10 лет. [94] [95] Это также распространенное явление среди беременных женщин. [96] [97]
Распространение и эпидемиология
[ редактировать ]
P. falciparum эндемичен в 84 странах. [99] и встречается на всех континентах, кроме Европы. Исторически он присутствовал в большинстве европейских стран, но улучшение состояния здоровья привело к исчезновению в начале 20 века. [100] Единственная европейская страна, где она исторически была распространена и откуда мы получили название малярии, Италия была объявлена страной, искоренившей малярию. В 1947 году итальянское правительство запустило Национальную программу ликвидации малярии, а затем была проведена кампания по борьбе с комарами с использованием ДДТ. [101] В 1970 году ВОЗ объявила Италию свободной от малярии. [102]
В 2021 году во всем мире было зарегистрировано 247 миллионов случаев малярии, в результате чего, по оценкам, погибло 619 000 человек. [99] Инфекция наиболее распространена в Африке, где происходит 94% случаев смерти от малярии. Больше всего страдают дети в возрасте до пяти лет, и 67% случаев смерти от малярии приходится на эту возрастную группу. 80% инфекции обнаруживается в странах Африки к югу от Сахары, 7% — в Юго-Восточной Азии и 2% — в Восточном Средиземноморье. Нигерия имеет самый высокий уровень заболеваемости: 27% от общего числа случаев в мире. За пределами Африки самый высокий уровень заболеваемости наблюдается в Индии, на которую приходится 4,5% мирового бремени. Европа считается регионом, свободным от малярии. Исторически этот паразит и его болезнь были наиболее известны в Европе. Но медицинские программы начала 20-го века, такие как распыление инсектицидов, медикаментозная терапия и экологическая инженерия, привели к полному искоренению этого вида в 1970-х годах. [103] По оценкам, около 2,4 миллиарда человек подвергаются постоянному риску заражения. [104]
Уход
[ редактировать ]История
[ редактировать ]В 1640 году Хуан дель Вего впервые применил настойку коры хинного дерева для лечения малярии; коренные индейцы Перу и Эквадора еще раньше использовали его для лечения лихорадок. Томпсон (1650 г.) привез эту «кору иезуитов » в Англию . Первое зарегистрированное его использование там было сделано Джоном Метфордом из Нортгемптона в 1656 году. Мортон (1696) представил первое подробное описание клинической картины малярии и ее лечения хинным маслом. Жиз (1816) изучал экстракцию кристаллического хинина из коры хинного дерева, а Пеллетье и Кавенту (1820) во Франции выделили чистые алкалоиды хинина , которые они назвали хинин и цинхонин . [105] [106] Полный синтез хинина был достигнут американскими химиками Р.Б. Вудвордом и У.Э. Дерингом в 1944 году. Вудворд получил Нобелевскую премию по химии в 1965 году. [107]
Попытки создать синтетические противомалярийные препараты начались в 1891 году. Атабрин , разработанный в 1933 году, широко использовался по всему Тихоокеанскому региону во время Второй мировой войны, но был непопулярен из-за своих побочных эффектов. [108] В конце 1930-х годов немцы разработали хлорохин , который использовался в кампаниях в Северной Африке. Создавая секретный военный проект под названием «Проект 523» , Мао Цзэдун призвал китайских учёных найти новые противомалярийные препараты после того, как увидел жертвы во Вьетнамской войне. Ту Юю обнаружил артемизинин в 1970-х годах из полыни сладкой ( Artemisia annua ). Этот препарат стал известен западным ученым в конце 1980-х – начале 1990-х годов и сейчас является стандартным методом лечения. Ту получил Нобелевскую премию по физиологии и медицине в 2015 году. [109]
Неосложненная малярия
[ редактировать ]Согласно рекомендациям ВОЗ 2010 г. [110] Комбинированная терапия на основе артемизинина (АКТ) является рекомендуемым лечением первой линии противомалярийным при неосложненной малярии, вызванной P. falciparum . ВОЗ рекомендует такие комбинации, как артеметер/люмефантрин , артесунат/амодиахин , артесунат/мефлохин , артесунат/сульфадоксин/пириметамин и дигидроартемизинин/пиперахин . [110]
Выбор АКТ основан на уровне устойчивости к компонентам комбинации. Артемизинин и его производные не подходят для монотерапии. В качестве противомалярийного лечения второй линии, когда первоначальное лечение не дает результатов, рекомендуется использовать альтернативную АКТ, которая, как известно, эффективна в данном регионе, например артесунат плюс тетрациклин или доксициклин или клиндамицин , а также хинин плюс тетрациклин или доксициклин или клиндамицин. Любую из этих комбинаций следует давать в течение 7 дней. Для беременных женщин рекомендуемая терапия первой линии в первом триместре — хинин плюс клиндамицин в течение 7 дней. [110] Артесунат плюс клиндамицин в течение 7 дней показан в случае неэффективности этого лечения. Путешественникам, возвращающимся в неэндемичные страны, атоваквон / прогуанил , артеметер/люмефантрианий и хинин плюс доксициклин или клиндамицин. рекомендуются [110]
Тяжелая малярия
[ редактировать ]Взрослым внутривенное (ВВ) или внутримышечное (ВМ) артесунат. рекомендуется [110] Хинин является приемлемой альтернативой, если парентеральный артесунат недоступен. [110]
Детям, особенно в эндемичных по малярии районах Африки, рекомендуются артесунат внутривенно или внутримышечно, хинин (внутривенно или дробно внутримышечно) и артеметер внутримышечно. [110]
Парентеральные противомалярийные препараты следует назначать в течение как минимум 24 часов, независимо от способности пациента ранее переносить пероральные препараты. [110] После этого рекомендуется полное лечение, включая полный курс АКТ или хинина плюс клиндамицин или доксициклин. [110]
Вакцинация
[ редактировать ]RTS,S — единственный кандидат на роль вакцины против малярии, прошедший клинические испытания. [111] Анализ результатов исследования III фазы (проведенного в период с 2011 по 2016 год) выявил довольно низкую эффективность (20-39% в зависимости от возраста, до 50% у детей в возрасте 5-17 месяцев), что указывает на то, что вакцина будет не приводят к полной защите и искоренению. [112]
6 октября 2021 года Всемирная организация здравоохранения рекомендовала вакцинацию от малярии детям из группы риска. [113]
Рак
[ редактировать ]Международное агентство по изучению рака (IARC) классифицировало малярию, вызываемую P. falciparum , как канцероген группы 2А, что означает, что этот паразит, вероятно, является агентом, вызывающим рак у людей. [114] его связь с раком клеток крови ( лимфоцитов ), называемым лимфомой Беркитта Установлена . Лимфома Беркитта была обнаружена Денисом Беркиттом в 1958 году у африканских детей, а позже он предположил, что рак, вероятно, возник из-за определенных инфекционных заболеваний. В 1964 году из раковых клеток был идентифицирован вирус, позже названный вирусом Эпштейна-Барра (ЭБВ) в честь первооткрывателей. Впоследствии было доказано, что вирус является непосредственным канцерогеном и теперь классифицируется как канцероген группы 1 . [115]
В 1989 году стало понятно, что ВЭБ требует наличия других инфекций, например, малярии, чтобы вызвать трансформацию лимфоцитов. Сообщалось, что заболеваемость лимфомой Беркитта снизилась при эффективном лечении малярии в течение нескольких лет. [116] Фактическая роль P. falciparum оставалась неясной в течение следующих двух с половиной десятилетий. Известно, что ВЭБ индуцирует превращение лимфоцитов в раковые, используя свои вирусные белки (такие антигены, как EBNA-1 , EBNA-2 , LMP1 и LMP2A ). [117] [118] С 2014 года стало ясно, что P. falciparum способствует развитию лимфомы. Эритроциты, инфицированные P. falciparum, напрямую связываются с B-лимфоцитами через домен CIDR1α PfEMP1. Это связывание активирует toll-подобные рецепторы ( TLR7 и TLR10 ), вызывая непрерывную активацию лимфоцитов для пролиферации и дифференцировки в плазматические клетки , тем самым увеличивая секрецию IgM и цитокинов . [119] Это, в свою очередь, активирует фермент, называемый цитидиндезаминазой, индуцированной активацией (AID), который имеет тенденцию вызывать мутацию в ДНК (путем двухцепочечного разрыва ) лимфоцитов, инфицированных ВЭБ. Поврежденная ДНК подвергается неконтролируемой репликации , что делает клетку раковой. [120]
Влияние на геном человека
[ редактировать ]Высокая смертность и заболеваемость, вызванная P. falciparum, оказала огромное селективное давление на геном человека . Некоторые генетические факторы обеспечивают некоторую устойчивость к Plasmodium инфекции , в том числе серповидноклеточный признак , признаки талассемии , дефицит глюкозо-6-фосфатдегидрогеназы и отсутствие антигенов Даффи на эритроцитах. [121] [122] Е. А. Бит, врач, работавший в Южной Родезии (ныне Зимбабве ), в 1948 году заметил, что серповидно-клеточная анемия связана с более низким уровнем заболеваемости малярией. [123] Это предположение было повторено Дж.Б.С. Холдейном в 1948 году, который предположил, что талассемия может обеспечивать аналогичную защиту. [124] Эта гипотеза с тех пор была подтверждена и распространена на гемоглобин E. [125] и гемоглобин С. [126]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Коатни Г.Р., Коллинз В.Е., Уоррен М., Контакос П.Г. (1971). «22 Plasmodium falciparum (Welch, 1897)» . Малярия приматов . Отдел паразитарных заболеваний, CDC. п. 263.
- ^ Рич, С.М.; Лендерц, Ф.Х.; Сюй, Г.; Лебретон, М.; Джоко, CF; Аминаке, Миннесота; Таканг, Э.Э.; Диффо, JLD; Пайк, БЛ; Розенталь, Б.М.; Форменти, П.; Бош, К.; Аяла, Ф.Дж.; Вулф, Северная Дакота (2009). «Происхождение злокачественной малярии» . Труды Национальной академии наук . 106 (35): 14902–14907. Бибкод : 2009PNAS..10614902R . дои : 10.1073/pnas.0907740106 . ПМК 2720412 . ПМИД 19666593 .
- ^ Перкинс, диджей; Были, Т.; Давенпорт, Греция; Кемпайя, П.; Хиттнер, Дж.Б.; Онг'Эча, Дж. М. (2011). «Тяжелая малярийная анемия: врожденный иммунитет и патогенез» . Международный журнал биологических наук . 7 (9): 1427–1442. дои : 10.7150/ijbs.7.1427 . ПМК 3221949 . ПМИД 22110393 .
- ^ Перлманн, П; Трой-Бломберг, М (2000). «Малярия на стадии крови и контроль над ней иммунной системой». Фолиа биологическая . 46 (6): 210–8. ПМИД 11140853 .
- ^ Jump up to: а б Лой, Дороти Э.; Лю, Вэйминь; Ли, Иньин; Учись, Джеральд Х.; Плендерлейт, Линдси Дж.; Сундарараман, Сеш А.; Шарп, Пол М.; Хан, Беатрис Х. (2017). «Из Африки: происхождение и эволюция паразитов малярии человека Plasmodium falciparum и Plasmodium vivax » . Международный журнал паразитологии . 47 (2–3): 87–97. дои : 10.1016/j.ijpara.2016.05.008 . ПМК 5205579 . ПМИД 27381764 .
- ^ Jump up to: а б Шарп, Пол М.; Плендерлейт, Линдси Дж.; Хан, Беатрис Х. (2020). «Обезьянье происхождение малярии у человека» . Ежегодный обзор микробиологии . 74 : 39–63. doi : 10.1146/annurev-micro-020518-115628 . ПМЦ 7643433 . ПМИД 32905751 .
- ^ «Мировой доклад о малярии 2022» . www.who.int . Проверено 30 января 2024 г.
- ^ ВОЗ (2021 г.). Всемирный доклад о малярии, 2021 год . Швейцария: Всемирная организация здравоохранения. ISBN 978-92-4-004049-6 .
- ^ Барон, Кристофер; Хэмлин, Кристофер (2015). «Малярия и упадок Древней Греции: пересмотр гипотезы Джонса в эпоху междисциплинарности». Минерва . 53 (4): 327–358. дои : 10.1007/s11024-015-9280-7 . S2CID 142602810 .
- ^ Jump up to: а б Хемпельманн, Эрнст; Крафтс, Кристина (2013). «Плохой воздух, амулеты и комары: 2000 лет изменения взглядов на малярию» . Журнал малярии . 12 (1): 232. дои : 10.1186/1475-2875-12-232 . ПМЦ 3723432 . ПМИД 23835014 .
- ^ Нерлих, А (2016). «Палеопатология и палеомикробиология малярии». Палеомикробиология человека . Том. 4. С. 155–160. doi : 10.1128/microbiolspec.PoH-0006-2015 . ISBN 9781555819163 . ПМИД 27837743 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Jump up to: а б с Лалчхандама, К. (2014). «Создание современной малярии: от миазмов до теории комарной малярии» (PDF) . Научное видение . 14 (1): 3–17. Архивировано из оригинала (PDF) 27 апреля 2014 г.
- ^ Кокс, Фрэнсис Э.Г. (2010). «История открытия малярийных паразитов и их переносчиков» . Паразиты и переносчики . 3 (1): 5. дои : 10.1186/1756-3305-3-5 . ПМЦ 2825508 . ПМИД 20205846 .

- ^ Баччетти, Б. (2008). «История ранней систематики двукрылых в Италии: от Линчеи до Баттисты Грасси». Паразитология . 50 (3–4): 167–172. ПМИД 20055226 .
- ^ Капанна, Э (2006). «Грасси против Росса: кто разгадал загадку малярии?». Международная микробиология . 9 (1): 69–74. ПМИД 16636993 .
- ^ Jump up to: а б Брюс-Чватт, LJ (1987). «Номенклатура Falciparum». Паразитология сегодня . 3 (8): 252. дои : 10.1016/0169-4758(87)90153-0 . ПМИД 15462972 .
- ^ Кристоферс, Р; Синтон, Дж. А. (1938). «Правильное название злокачественного терцианского паразита» . Британский медицинский журнал . 2 (4065): 1130–1134. дои : 10.1136/bmj.2.4065.1130 . ПМК 2211005 . ПМИД 20781927 .
- ^ Лю, В; Ли, Ю; Учись, ГХ; Рудиселл, RS ; Робертсон, доктор медицинских наук; Кил, БФ; Хаус, Джей Би; Санс, СМ; и др. (2010). «Происхождение малярийного паразита человека Plasmodium falciparum у горилл» . Природа 467 (7314): 420–5. Бибкод : 2010Nature.467..420L . дои : 10.1038/nature09442 . ПМК 2997044 . ПМИД 20864995 .
- ^ Холмс, Эдвард К. (2010). «Малярия: связь с гориллами» . Природа . 467 (7314): 404–405. Бибкод : 2010Natur.467..404H . дои : 10.1038/467404a . ПМИД 20864986 . S2CID 205058952 .
- ^ Jump up to: а б с Лю, В; Ли Ю, Жир Г.Х., Рудиселл Р.С., Робертсон Дж.Д., Кил Б.Ф., Нджанго Дж.Н., Санс К.М., Морган Д.Б., Локателли С., Гондер М.К., Кранцуш П.Дж., Уолш П.Д., Делапорте Э., Георгиев А.В., Мюллер М.Н., Шоу Г.М., Питерс М. , Sharp PM, Rayner JC, Hahn BH (2010). «Происхождение малярийного паразита человека Plasmodium falciparum у горилл» . Природа 467 (7314): 420–5. Бибкод : 2010Nature.467..420L . дои : 10.1038/nature09442 . ПМК 2997044 . ПМИД 20864995 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Дюваль, Л; М. Фурман, Э. Неррине, Д. Руссе, С.А. Саде, С.М. Гудман, Н.В. Андриахолинирина, М. Рандрианаривелойосия, Р.Е. Пол, В. Роберт, Ф. Дж. Айала, Ф. Ари (2010). «Африканские обезьяны как резервуары Plasmodium falciparum , а также происхождение и разнообразие подрода Laverania» . Труды Национальной академии наук Соединенных Штатов Америки . 107 (23): 10561–6. Бибкод : 2010PNAS..10710561D . дои : 10.1073/pnas.1005435107 . ПМК 2890828 . ПМИД 20498054 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Рейнер, Дж; В.М. Лю, М. Питерс, П. М. Шарп, Б. Х. Хан (2011). «Множество видов Plasmodium у диких обезьян: источник заражения человека?» . Тенденции в паразитологии . 27 (5): 222–229. дои : 10.1016/J.Pt.2011.01.006 . ПМК 3087880 . ПМИД 21354860 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Ратор, Д; Уол А.М., Салливан М., Маккатчан Т.Ф. (25 апреля 2001 г.). «Филогенетическое сравнение генных деревьев, построенных из пластидной, митохондриальной и геномной ДНК видов Plasmodium » . Молекулярная и биохимическая паразитология . 114 (1): 89–94. дои : 10.1016/S0166-6851(01)00241-9 . ПМИД 11356517 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Хартл, Д.Х. (январь 2004 г.). «Происхождение малярии: смешанные сообщения о генетическом разнообразии». Обзоры природы Микробиология . 2 (1): 15–22. дои : 10.1038/nrmicro795 . ПМИД 15035005 . S2CID 11020105 .
- ^ Хьюм, Дж. К.; Лайонс, Э.Дж.; День, КП (2003). «Миграция человека, комары и эволюция Plasmodium falciparum ». Тенденции Паразитол . 19 (3): 144–9. дои : 10.1016/s1471-4922(03)00008-4 . ПМИД 12643998 .
- ^ Люциус, Р.; Робертс, CW (2017). «Биология паразитических простейших» . В Люциусе, Р.; Лоос-Франк, Б.; Лейн, РП; Пулен, Р.; Робертс, CW; Гренсис, Р.К. (ред.). Биология паразитов . Джон Уайли и сыновья. стр. 190–198. ISBN 978-3-527-32848-2 .
- ^ Ланцер, Майкл; Викерт, Ханнес; Кроне, Георг; Винченсини, Летиция; Браун Бретон, Кэтрин (2006). «Расщелина Маурера: новая многофункциональная органелла в цитоплазме эритроцитов, инфицированных Plasmodium falciparum ». Международный журнал паразитологии . 36 (1): 23–36. дои : 10.1016/j.ijpara.2005.10.001 . ПМИД 16337634 .
- ^ Jump up to: а б Гарсия, Дж. Э.; Пуэнтес, А.; Патарройо, Мэн (2006). «Биология развития взаимодействий спорозоит-хозяин при малярии Plasmodium falciparum : значение для разработки вакцин» . Обзоры клинической микробиологии . 19 (4): 686–707. дои : 10.1128/CMR.00063-05 . ПМЦ 1592691 . ПМИД 17041140 .
- ^ Да, Эллен; ДеРизи, Джозеф Л. (30 августа 2011 г.). «Химическое спасение малярийных паразитов, не имеющих апикопласта, определяет функцию органелл в Plasmodium falciparum на стадии крови » . ПЛОС Биол . 9 (8): e1001138. дои : 10.1371/journal.pbio.1001138 . ISSN 1545-7885 . ПМК 3166167 . ПМИД 21912516 .
- ^ Уилсон Р.Дж.; Денни П.В.; Прайзер PR; и др. (август 1996 г.). «Полная карта генов пластидоподобной ДНК малярийного паразита Plasmodium falciparum ». Журнал молекулярной биологии . 261 (2): 155–72. дои : 10.1006/jmbi.1996.0449 . ПМИД 8757284 .
- ^ Jump up to: а б Гарднер М.Дж.; Зал Н; Фунг Э; и др. (октябрь 2002 г.). «Последовательность генома малярийного плазмодия человека Plasmodium falciparum » . Природа . 419 (6906): 498–511. Бибкод : 2002Natur.419..498G . дои : 10.1038/nature01097 . ПМЦ 3836256 . PMID 12368864 .
- ^ Ли, Венн-Чьяу; Рассел, Брюс; Рения, Лоран (2019). «Придерживаться дела: парадигма цитоадгерентности малярийных паразитов Falciparum» . Границы в иммунологии . 10 : 1444. дои : 10.3389/fimmu.2019.01444 . ПМК 6610498 . ПМИД 31316507 .
- ^ Молина-Круз, Альваро; Зилверсмит, Мартина М.; Нифси, Дэниел Э.; Хартл, Дэниел Л.; Барильяс-Мюри, Каролина (2016). «Комары-переносчики и глобализация малярии Plasmodium falciparum » . Ежегодный обзор генетики . 50 (1): 447–465. doi : 10.1146/annurev-genet-120215-035211 . ПМИД 27732796 .
- ^ Синка, Марианна Э; Бэнгс, Майкл Дж; Манген, Сильви; Кутзи, Морин; Мбого, Чарльз М; Хемингуэй, Джанет; Патил, Ананд П; Темперли, Уилл Х; Гетинг, Питер В.; Кабария, Кэролайн В.; Окара, Роби М; Ван Бекель, Томас; Годфрей, Х. Чарльз Дж; Харбах, Ральф Э; Привет, Саймон I (2010). «Доминирующие переносчики малярии человека Anopheles в Африке, Европе и на Ближнем Востоке: данные о встречаемости, карты распространения и биономическая практика» . Паразиты и переносчики . 3 (1): 117. дои : 10.1186/1756-3305-3-117 . ПМК 3016360 . ПМИД 21129198 .
- ^ Менар, Р; Таварес, Дж; Кокберн, я; Маркус, М; Завала, Ф; Амино, Р. (2013). «Заглянуть под кожу: первые шаги в борьбе с малярией и иммунитет» . Обзоры природы Микробиология . 11 (10): 701–712. дои : 10.1038/nrmicro3111 . ПМИД 24037451 . S2CID 21437365 .
- ^ Jump up to: а б с Джеральд, Н.; Махаджан, Б.; Кумар, С. (2011). «Митоз малярийного паразита человека Plasmodium falciparum » . Эукариотическая клетка . 10 (4): 474–482. дои : 10.1128/EC.00314-10 . ПМК 3127633 . ПМИД 21317311 .
- ^ Каппе, SH; Бускалья, Калифорния; Бергман, ЛВ; Коппенс, я; Нусенцвейг, В. (2004). «Апикомплексная скользящая подвижность и инвазия клеток-хозяев: пересмотр моторной модели». Тенденции в паразитологии . 20 (1): 13–16. CiteSeerX 10.1.1.458.5746 . дои : 10.1016/j.pt.2003.10.011 . ПМИД 14700584 .
- ^ Воган, Эшли М.; Каппе, Стефан Х.И. (2017). «Малярийная инфекция печени и экзоэритроцитарная биология» . Перспективы Колд-Спринг-Харбора в медицине . 7 (6): а025486. doi : 10.1101/cshperspect.a025486 . ПМЦ 5453383 . ПМИД 28242785 .
- ^ Штурм, А. (2006). «Манипулирование гепатоцитами хозяина малярийным паразитом для доставки в синусоиды печени» . Наука . 313 (5791): 1287–1290. Бибкод : 2006Sci...313.1287S . дои : 10.1126/science.1129720 . ПМИД 16888102 . S2CID 22790721 .
- ^ Jump up to: а б Коуман, Алан Ф.; Крабб, Брендан С. (2006). «Инвазия эритроцитов малярийными паразитами» . Клетка . 124 (4): 755–766. дои : 10.1016/j.cell.2006.02.006 . ПМИД 16497586 . S2CID 14972823 .
- ^ «Электронный модуль малярии – СИНХРОННОСТЬ» .
- ^ Дженсен, Аня Рамстедт; Адамс, Ивонн; Хвиид, Ларс (2020). «Малярия церебрального Plasmodium falciparum: роль PfEMP1 в ее патогенезе и иммунитете, а также вакцины на основе PfEMP1 для ее предотвращения» . Иммунологические обзоры . 293 (1): 230–252. дои : 10.1111/imr.12807 . ПМК 6972667 . ПМИД 31562653 .
- ^ Пагола С., Стивенс П.В., Боле Д.С., Косар А.Д., Мэдсен С.К. (2000). «Строение малярийного пигмента бета-гематина». Природа . 404 (6775): 307–310. Бибкод : 2000Natur.404..307P . дои : 10.1038/35005132 . ПМИД 10749217 . S2CID 4420567 .
- ^ Хемпельманн Э (2007). «Биокристаллизация гемозоина у Plasmodium falciparum и противомалярийная активность ингибиторов кристаллизации» . Исследования паразитов . 100 (4): 671–676. дои : 10.1007/s00436-006-0313-x . ПМИД 17111179 . S2CID 30446678 . Архивировано из оригинала 10 июня 2011 г.
- ^ Jump up to: а б «Электронный модуль малярии – БЕСПОЛОВЫЕ ЭРИТРОЦИТАРНЫЕ СТАДИИ» .
- ^ Прочтите, М.; Шервин, Т.; Холлоуэй, СП; Галл, К.; Хайд, Дж. Э. (1993). «Микротубулярная организация, визуализируемая с помощью иммунофлуоресцентной микроскопии во время эритроцитарной шизогонии у Plasmodium falciparum , и исследование посттрансляционных модификаций тубулина паразита». Паразитология . 106 (3): 223–232. дои : 10.1017/s0031182000075041 . ПМИД 8488059 . S2CID 24655319 .
- ^ Арно, Делавэр; Ронандер, Э.; Бенгтссон, округ Колумбия (2011). «Прогрессирование внутриэритроцитарного клеточного цикла Plasmodium falciparum и роль центриолярных бляшек в асинхронном митотическом делении во время шизогонии». Межд. Дж. Паразитол . 41 (1): 71–80. дои : 10.1016/j.ijpara.2010.07.012 . ПМИД 20816844 .
- ^ Jump up to: а б с д и Трампуз, Андрей; Джереб, Матьяз; Музлович, Игорь; Прабху, Раджеш М. (2003). «Клинический обзор: Тяжелая малярия» . Критическая помощь . 7 (4): 315–23. дои : 10.1186/cc2183 . ПМК 270697 . ПМИД 12930555 .
- ^ Талман, Артур М; Домарль, Оливье; Маккензи, Ф; Арье, Фредерик; Роберт, Винсент (2004). «Гаметоцитогенез: половое созревание Plasmodium falciparum » . Журнал малярии . 3 (1): 24. дои : 10.1186/1475-2875-3-24 . ПМК 497046 . ПМИД 15253774 .
- ^ Бартолони, А; Заммарки, Л. (2012). «Клинические аспекты неосложненной и тяжелой малярии» . Средиземноморский журнал гематологии и инфекционных заболеваний . 4 (1): e2012026. дои : 10.4084/MJHID.2012.026 . ПМЦ 3375727 . ПМИД 22708041 .
- ^ Д'Ортензио, Э; Годино, Н.; Фонтане, А; Хауз, С; Бушо, О; Матерон, С; Ле Бра, Ж (2008). «Длительная инфекция Plasmodium falciparum у иммигрантов, Париж» . Новые инфекционные заболевания . 14 (2): 323–326. дои : 10.3201/eid1402.061475 . ПМК 2600192 . ПМИД 18258132 .
- ^ Синден, Р.Э.; Каннинг, ЕС; Брей, РС; Смолли, Мэн (1978). «Развитие гаметоцитов и гамет у Plasmodium falciparum ». Труды Королевского общества B: Биологические науки . 201 (1145): 375–399. Бибкод : 1978РСПСБ.201..375С . дои : 10.1098/rspb.1978.0051 . ПМИД 27809 . S2CID 27083717 .
- ^ Рунгсивонгсе, Джараспорн; Розенберг, Рональд (1991). «Количество спорозоитов, продуцируемых отдельными ооцистами малярии». Американский журнал тропической медицины и гигиены . 45 (5): 574–577. дои : 10.4269/ajtmh.1991.45.574 . ПМИД 1951866 .
- ^ Фостер, Вашингтон (1 января 1995 г.). «Сахарное питание комаров и репродуктивная энергетика» . Ежегодный обзор энтомологии . 40 (1): 443–474. дои : 10.1146/annurev.ento.40.1.443 .
- ^ Ньясембе, Винсент О.; Тил, Питер Э.А.; Сава, Патрик; Тумлинсон, Джеймс Х.; Боргемейстер, Кристиан; Торто, Болдуин (январь 2014 г.). «Инфекция Plasmodium falciparum увеличивает привлечение Anopheles gambiae к источникам нектара и поглощение сахара» . Современная биология . 24 (2): 217–221. Бибкод : 2014CBio...24..217N . дои : 10.1016/j.cub.2013.12.022 . ПМЦ 3935215 . ПМИД 24412210 .
- ^ Хиен, Домонбабеле Ф. д. С.; Дабире, Кунбобр Р.; Рош, Бенджамин; Диабате, Абдулай; Йербанга, Ракисвенде С.; Коуэ, Анна; Ямеого, Добро пожаловать К.; Гуанья, Луи-Клеман; Хопкинс, Ричард Дж.; Уэдраого, Жорж А.; Симар, Фредерик; Уэдраого, Жан-Боско; Игнелл, Рикард; Лефевр, Тьерри (04 августа 2016 г.). Верник, Кеннет Д. (ред.). «Воздействие растений на способность комаров передавать малярию человека» . ПЛОС Патогены . 12 (8): e1005773. дои : 10.1371/journal.ppat.1005773 . ISSN 1553-7374 . ПМЦ 4973987 . ПМИД 27490374 .
- ^ Хиен, Домонбабеле FDS; Паре, Приска С.Л.; Купер, Аманда; Коама, Бенджамин К.; Гиссу, Эдвиг; Ямеого, Кудраого Б.; Йербанга, Ракисвенде С.; Фаррелл, Иэн В.; Уэдраого, Жан Б.; Гнанкинэ, Оливье; Игнелл, Рикард; Коуэ, Анна; Дабире, Рох К.; Стивенсон, Филип К.; Лефевр, Тьерри (декабрь 2021 г.). «Контрастное влияние алкалоида рицинина на способность Anopheles gambiae и Anopheles coluzzii передавать Plasmodium falciparum» . Паразиты и переносчики . 14 (1): 479. doi : 10.1186/s13071-021-04992-z . ISSN 1756-3305 . ПМЦ 8444468 . ПМИД 34526119 .
- ^ Jump up to: а б с Гаттери Д.С., Зишан М., Холдер А.А., Тромер ЕС, Тевари Р. Мейоз у плазмодия: как это работает? Тенденции Паразитол. Октябрь 2023 г.;39(10):812-821. дои : 10.1016/j.pt.2023.07.002 . Epub, 2 августа 2023 г. PMID 37541799.
- ^ Бейер, Дж. К.; Оньянго, ФК; Корос, Дж. К.; Рамадан, М; Огванг, Р; Вирц, РА; Коеч, ДК; Робертс, ЧР (1991). «Количественное определение спорозоитов малярии, передаваемых in vitro во время слюноотделения дикими афротропическими Anopheles». Медицинская и ветеринарная энтомология . 5 (1): 71–9. дои : 10.1111/j.1365-2915.1991.tb00523.x . ПМИД 1768903 . S2CID 27449694 .
- ^ Jump up to: а б Чакраварти, Сумана; Кокберн, Ян А; Кук, Салих; Оверстрит, Майкл Дж; Сакчи, Джон Б; Завала, Фидель (2007). «CD8+ Т-лимфоциты, защищающие печень от малярии, активируются в дренирующих кожу лимфатических узлах» . Природная медицина . 13 (9): 1035–1041. дои : 10.1038/nm1628 . ПМИД 17704784 . S2CID 17601147 .
- ^ Хопп, Кристин С.; Синнис, Фотини (2015). «Врожденный и адаптивный ответ на слюну комаров и спорозоиты Plasmodium в коже» . Анналы Нью-Йоркской академии наук . 1342 (1): 37–43. Бибкод : 2015NYASA1342...37H . дои : 10.1111/nyas.12661 . ПМЦ 4405444 . ПМИД 25694058 .
- ^ Гомес, Поллианна С.; Бхардвадж, Джьоти; Ривера-Корреа, Хуан; Фрейре-Де-Лима, Селио Г.; Морро, Александр (2016). «Стратегии иммунного спасения от малярийных паразитов» . Границы микробиологии . 7 : е1617. дои : 10.3389/fmicb.2016.01617 . ПМК 5066453 . ПМИД 27799922 .
- ^ Артаванис-Цаконас, К; Тонгрен, Дж. Э.; Райли, EM (август 2003 г.). «Война между малярийным паразитом и иммунной системой: иммунитет, иммунорегуляция и иммунопатология» . Клиническая и экспериментальная иммунология . 133 (2): 145–152. дои : 10.1046/j.1365-2249.2003.02174.x . ПМК 1808775 . ПМИД 12869017 .

- ^ Jump up to: а б Флоренс, Лоуренс; Уошберн, Майкл П.; Рейн, Дж. Дейл; Энтони, Роберт М.; Грейнджер, Мунира; Хейнс, Дж. Дэвид; Мок, Дж. Кэтлин; Мастер, Немоне; и др. (3 октября 2002 г.). «Протеомный взгляд на жизненный цикл Plasmodium falciparum » . Природа . 419 (6906): 520–526. Бибкод : 2002Natur.419..520F . дои : 10.1038/nature01107 . ПМИД 12368866 . S2CID 4412848 .
- ^ Черами, Карла; Фреверт, Ют; Синнис, Фотини; Такач, Бела; Клавихо, Педро; Сантос, Мануэль Дж.; Нусенцвейг, Виктор (1992). «Базолатеральный домен плазматической мембраны гепатоцитов несет рецепторы для циркумспорозоитного белка спорозоитов Plasmodium falciparum ». Клетка . 70 (6): 1021–1033. дои : 10.1016/0092-8674(92)90251-7 . ПМИД 1326407 . S2CID 8825913 .
- ^ Бальдаччи, Патрисия; Менар, Робер (2004). «Неуловимый спорозоит малярии в организме млекопитающего» . Молекулярная микробиология . 54 (2): 298–306. дои : 10.1111/j.1365-2958.2004.04275.x . ПМИД 15469504 . S2CID 30488807 .
- ^ Воган, Эшли М.; Али, Ахмед С.И.; Каппе, Стефан Х.И. (2008). «Малярийная паразитарная инфекция на преэритроцитарной стадии: скольжение и сокрытие» . Клетка-хозяин и микроб . 4 (3): 209–218. дои : 10.1016/j.chom.2008.08.010 . ПМК 2610487 . ПМИД 18779047 .
- ^ Сэтчвелл, Ти Джей (2016). «Рецепторы инвазии эритроцитов Plasmodium falciparum : новые и старые» . Трансфузиологическая медицина . 26 (2): 77–88. дои : 10.1111/tme.12280 . hdl : 1983/2945cc98-49e8-4c37-a392-88e35fab588c . ПМИД 26862042 . S2CID 7811400 .
- ^ Лалчхандама, Холхринг (2017). « Plasmodium falciparum Белок 1 мембраны эритроцитов » . Викижурнал медицины . 4 (1): 1–8. дои : 10.15347/wjm/2017.004 .
- ^ Jump up to: а б Кратчер, Джеймс М.; Хоффман, Стивен Л. (1996), Бэрон, Сэмюэл (редактор), «Малярия» , Медицинская микробиология (4-е изд.), Галвестон (Техас): Медицинское отделение Техасского университета в Галвестоне, ISBN 978-0-9631172-1-2 , PMID 21413352 , получено 1 февраля 2022 г.
- ^ Бьюкенен, Эндрю (1901). «Злокачественная трехдневная лихорадка» . Индийский медицинский вестник . 36 (7): 256–258. ISSN 0019-5863 . ПМК 5164271 . ПМИД 29004267 .
- ^ Хеммер, CJ; Леберманн, М.; Райзингер, ЕС (2016). «Лихорадка после путешествия в тропические регионы: малярия и другие чрезвычайные ситуации» . Notfall и Rettungsmedizin . 19 (4): 263–268. дои : 10.1007/s10049-016-0176-3 . ISSN 1434-6222 . ПМК 7101662 . ПМИД 32288635 .
- ^ Корбетт, Иоланда; Парапини, Сильвия; Перего, Федерика; Мессина, Валерия; Дельбю, Серена; Мизиано, Паола; Фальчи, Марио; Сильвестрини, Франческо; Тарамелли, Донателла; Базилико, Николетта; Д'Алессандро, Сара (2021). «Фагоцитоз и активация макрофагов костномозгового происхождения гаметоцитами Plasmodium falciparum» . Журнал малярии . 20 (1): 81. дои : 10.1186/s12936-021-03589-2 . ISSN 1475-2875 . ПМЦ 7874634 . ПМИД 33568138 .
- ^ Коронадо, Лорена М.; Надович, Кристофер Т.; Спадафора, Карменца (2014). «Малярийный гемозоин: от мишени к инструменту» . Biochimica et Biophysical Acta (BBA) – Общие предметы . 1840 (6): 2032–2041. дои : 10.1016/j.bbagen.2014.02.009 . ISSN 0006-3002 . ПМК 4049529 . ПМИД 24556123 .
- ^ Тибергейн, Ариана; Дерост, Катриен; Шварцер, Эвелин; Арезе, Паоло; Ван ден Стин, Филипп Э. (2014). «Иммунопатологические эффекты малярийного пигмента или гемозоина и других кристаллов» . Биофакторы . 40 (1): 59–78. дои : 10.1002/биоф.1119 . ISSN 1872-8081 . ПМИД 23907956 . S2CID 45386035 .
- ^ Дерост, Катриен; Лэйс, Наташа; Ноппен, Сэм; Мартенс, Эрик; Опденаккер, Гислен; Ван ден Стин, Филипп Э. (2012). «Усовершенствованные методы количественного определения гемозоина в тканях дают информацию, специфичную для органов и паразитов у мышей, инфицированных малярией» . Журнал малярии . 11 :166. дои : 10.1186/1475-2875-11-166 . ISSN 1475-2875 . ПМЦ 3473299 . ПМИД 22583751 .
- ^ Пек, Рини Х.; Юань, Сяоцзин; Ритцшель, Николь; Чжан, Цзяньбин; Джексон, Лори; Нисибори, Эйдзи; Рибейро, Ана; Симмонс, Уильям; Джагадиш, Джая; Сугимото, Хироши; Алам, Мэриленд Захидул (2019). «Гемозоин, вырабатываемый млекопитающими, придает толерантность к гему» . электронная жизнь . 8 : е49503. doi : 10.7554/eLife.49503 . ISSN 2050-084X . ПМК 6773446 . ПМИД 31571584 .
- ^ Оливер, Мартин; Ван Ден Хэм, Кристина; Шио, ВМС Тьеми; Кассир, Фикрегабраил Аберра; Фужере, Софи (2014). «Малярийный пигмент гемозоин и врожденная воспалительная реакция» . Границы в иммунологии . 5:25 . дои : 10.3389/fimmu.2014.00025 . ISSN 1664-3224 . ПМЦ 3913902 . ПМИД 24550911 .
- ^ Шио, Марина Т.; Касса, Фикрегабраил А.; Бельмар, Мари-Жозе; Оливье, Мартин (2010). «Врожденная воспалительная реакция на малярийный пигмент гемозоин» . Микробы и инфекции . 12 (12–13): 889–899. дои : 10.1016/j.micinf.2010.07.001 . ISSN 1769-714X . ПМИД 20637890 .
- ^ Jump up to: а б Мойя-Альварес, Виолета; Абеллана, Роза; Кот, Мишель (2014). «Малярия, связанная с беременностью, и малярия у младенцев: старая проблема с нынешними последствиями» . Журнал малярии . 13 (1): 271. дои : 10.1186/1475-2875-13-271 . ПМЦ 4113781 . ПМИД 25015559 .
- ^ Куртис, Афина П.; Прочтите, Дженнифер С.; Джеймисон, Дениз Дж. (2014). «Беременность и инфекция» . Медицинский журнал Новой Англии . 370 (23): 2211–2218. дои : 10.1056/NEJMra1213566 . ПМЦ 4459512 . ПМИД 24897084 .
- ^ Тембо, Думизулу Л.; Ньони, Бенджамин; Муриколи, Река В.; Мукака, Мавуто; Милнер, Дэнни А.; Берриман, Мэтью; Роджерсон, Стивен Дж.; Тейлор, Терри Э.; Молинье, Малькольм Э.; Мандала, Уилсон Л.; Крейг, Алистер Г. (2014). «Дифференциальная экспрессия PfEMP1 связана с патологией церебральной малярии» . ПЛОС Патогены . 10 (12): e1004537. дои : 10.1371/journal.ppat.1004537 . ПМЦ 4256257 . ПМИД 25473835 .
- ^ Дондорп А.М., Понгпонратн Э., Уайт, Нью-Джерси (февраль 2004 г.). «Снижение микроциркуляторного кровотока при тяжелой малярии falciparum: патофизиология и электронно-микроскопическая патология». Акта Троп . 89 (3): 309–17. doi : 10.1016/j.actatropica.2003.10.004 . ПМИД 14744557 .
- ^ Аноним (2000). «Тяжелая малярия falciparum. Всемирная организация здравоохранения, Кластер инфекционных заболеваний» . Труды Королевского общества тропической медицины и гигиены . 94 (Приложение 1): С1–90. ISSN 0035-9203 . ПМИД 11103309 .
- ^ Омар, Мохамед; Маркионни, Луиджи; Хакер, Георг; Бадр, Мохамед Тарек (2021). «Сигнатуры генов крови хозяина могут обнаружить прогрессирование тяжелой и церебральной малярии» . Границы клеточной и инфекционной микробиологии . 11 : 743616. doi : 10.3389/fcimb.2021.743616 . ISSN 2235-2988 . ПМК 8569259 . ПМИД 34746025 .
- ^ Мерфи, Южная Каролина; Бреман, Дж. Г. (2001). «Пробелы в бремени малярии среди детей в Африке: церебральная малярия, неврологические последствия, анемия, респираторный дистресс, гипогликемия и осложнения беременности» . Американский журнал тропической медицины и гигиены . 64 (1-2 Приложение): 57–67. дои : 10.4269/ajtmh.2001.64.57 . ПМИД 11425178 . S2CID 847217 .
- ^ Бреман, Дж. Г. (2001). «Уши бегемота: проявления, детерминанты и оценки бремени малярии» . Американский журнал тропической медицины и гигиены . 64 (1-2 Приложение): 1–11. дои : 10.4269/ajtmh.2001.64.1 . ISSN 0002-9637 . ПМИД 11425172 .
- ^ Лузоло, Анж Ландела; Нгойи, Дьедонне Мумба (2019). «Церебральная малярия» . Бюллетень исследований мозга . 145 : 53–58. дои : 10.1016/j.brainresbull.2019.01.010 . ISSN 1873-2747 . ПМИД 30658131 . S2CID 58560596 .
- ^ Идро, Ричард; Марш, Кевин; Джон, Ченди С; Ньютон, Чарльз Р.Дж. (2010). «Церебральная малярия; механизмы черепно-мозговой травмы и стратегии улучшения нейрокогнитивных результатов» . Педиатрические исследования . 68 (4): 267–274. дои : 10.1203/PDR.0b013e3181eee738 . ISSN 0031-3998 . ПМК 3056312 . ПМИД 20606600 .
- ^ Шанкс, Г. Деннис (2015). «Исторический обзор: провоцирует ли стресс рецидив Plasmodium falciparum?» . Труды Королевского общества тропической медицины и гигиены . 109 (6): 360–365. дои : 10.1093/trstmh/trv032 . ISSN 1878-3503 . ПМИД 25918217 .
- ^ Тойшер, Франка; Гаттон, Мишель Л.; Чен, Наньхуа; Питерс, Дженнифер; Кайл, Деннис Э.; Ченг, Цинь (2010). «Вызванный артемизинином покой Plasodium falciparum: продолжительность, скорость выздоровления и последствия неудачи лечения» . Журнал инфекционных болезней . 202 (9): 1362–1368. дои : 10.1086/656476 . ISSN 1537-6613 . ПМЦ 2949454 . ПМИД 20863228 .
- ^ Всемирная сеть по борьбе с малярийной резистентностью (WWARN), Исследовательская группа по люмефантрину ФК/ПД (2015 г.). «Лечение артеметер-люмефантрином неосложненной малярии Plasmodium falciparum: систематический обзор и метаанализ концентраций люмефантрина на 7-й день и терапевтического ответа с использованием индивидуальных данных пациентов» . БМК Медицина . 13 : 227. дои : 10.1186/s12916-015-0456-7 . ISSN 1741-7015 . ПМЦ 4574542 . ПМИД 26381375 .
- ^ Аль Хаммади, Ахмед; Митчелл, Майкл; Авраам, Джордж М.; Ван, Дженнифер П. (2017). «Возрождение Plasmodium falciparum у первобеременных после почти 3 лет латентного периода» . Американский журнал тропической медицины и гигиены . 96 (3): 642–644. дои : 10.4269/ajtmh.16-0803 . ISSN 1476-1645 . ПМК 5361538 . ПМИД 28044045 .
- ^ Салас-Коронас, Хоакин; Сориано-Перес, Мануэль Хесус; Лозано-Серрано, Ана Б.; Перес-Мояно, Росарио; Поррино-Эррера, Кармен; Кабесас-Фернандес, Мария Тереза (2017). «Симптоматическая малярия Falciparum после проживания в неэндемической зоне в течение 10 лет: рецидив или местная передача?» . Американский журнал тропической медицины и гигиены . 96 (6): 1427–1429. дои : 10.4269/ajtmh.17-0031 . ISSN 1476-1645 . ПМЦ 5462582 . ПМИД 28719260 .
- ^ Исмаил, Ариф; Оклер, Франсуа; Маккарти, Энн Э. (2020). «Рецидив хронической малярии Plasmodium falciparum через 13 лет после заражения» . Туристическая медицина и инфекционные заболевания . 33 : 101518. doi : 10.1016/j.tmaid.2019.101518 . ISSN 1873-0442 . ПМИД 31712180 . S2CID 207949553 .
- ^ Мэр Альфредо; Серра-Джасас, Элиза; Бардаджи, Асусена; Меняйся, Сержи; Пуйоль, Лаура; Систеро, Пол; Сигаук, Бетуэль; Командир Игнатий; Апонте, Джон Дж.; Алонсо, Педро Л.; Менендес, Клара (2009). «Субмикроскопические инфекции и долгосрочное обострение Plasmodium falciparum у беременных женщин Мозамбика» . Журнал малярии . 8 :9. дои : 10.1186/1475-2875-8-9 . ISSN 1475-2875 . ПМК 2633011 . ПМИД 19134201 .
- ^ Лаочан, Наттапон; Залумис, Софи Г.; Имвонг, Маллика; Лек-Утай, США; Брокман, Алан; Шриправат, Канлайя; Виладфаингерн, Яхер; Уайт, Николас Дж.; Ностен, Франсуа; МакГриди, Роуз (2015). «Интервалы до рецидива Plasmodium falciparum после противомалярийного лечения во время беременности: продольная проспективная когорта» . Журнал малярии . 14 : 221. дои : 10.1186/s12936-015-0745-9 . ISSN 1475-2875 . ПМЦ 4449611 . ПМИД 26017553 .
- ^ Татем А.Дж., Цзя П., Орданович Д., Фолкнер М., Хуан З., Хоуз Р.; и др. (2017). «География завоза малярии в неэндемичные страны: метаанализ национальной статистики» . Ланцет Инфекционный Дис . 17 (1): 98–107. дои : 10.1016/S1473-3099(16)30326-7 . ПМЦ 5392593 . ПМИД 27777030 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Jump up to: а б ВОЗ (2022 г.). Всемирный доклад о малярии, 2022 год . Швейцария: Всемирная организация здравоохранения. ISBN 978-92-4-006489-8 .
- ^ Майори, Джанкарло (2012). «Краткая история малярии и ее искоренения в Италии с краткими заметками о борьбе с инфекцией в Средиземноморском бассейне» . Средиземноморский журнал гематологии и инфекционных заболеваний . 4 (1): e2012016. дои : 10.4084/MJHID.2012.016 . ISSN 2035-3006 . ПМК 3340992 . ПМИД 22550561 .
- ^ Китрон, У.; Спилман, А. (1989). «Подавление передачи малярии путем сокращения источников: антианофелиновые меры, применяемые в Израиле, США и Италии» . Обзоры инфекционных болезней . 11 (3): 391–406. дои : 10.1093/clinids/11.3.391 . ISSN 0162-0886 . ПМИД 2665000 .
- ^ Мартини, Мариано; Ангебен, Андреа; Риккарди, Никколо; Орсини, Давиде (2021). «Пятьдесят лет после искоренения малярии в Италии. Долгий путь к этой великой цели и текущие риски для здоровья, связанные с завозной малярией» . Патогены и глобальное здоровье . 115 (4): 215–223. дои : 10.1080/20477724.2021.1894394 . ISSN 2047-7732 . ПМЦ 8168761 . ПМИД 33734023 .
- ^ Пипераки, ET; Дайкос, GL (2016). «Малярия в Европе: новая угроза или незначительная неприятность?» . Клиническая микробиология и инфекции . 22 (6): 487–493. дои : 10.1016/j.cmi.2016.04.023 . ПМИД 27172807 .
- ^ Боусема, Т.; Дрейкли, К. (2011). «Эпидемиология и инфекционность гаметоцитов Plasmodium falciparum и Plasmodium vivax в отношении контроля и ликвидации малярии» . Обзоры клинической микробиологии . 24 (2): 377–410. дои : 10.1128/CMR.00051-10 . ПМК 3122489 . ПМИД 21482730 .
- ^ Гринвуд, Дэвид (1992). «Хининовая связь». Журнал антимикробной химиотерапии . 30 (4): 417–427. дои : 10.1093/jac/30.4.417 . ПМИД 1490916 .
- ^ Кауфман, Теодоро С.; Руведа, Эдмундо А. (28 января 2005 г.). «В поисках хинина: те, кто выиграл битвы, и те, кто выиграл войну». Angewandte Chemie, международное издание . 44 (6): 854–885. дои : 10.1002/anie.200400663 . ПМИД 15669029 .
- ^ Тодд, Л.; Корнфорт, Дж.; Т., АР; К., Дж.В. (1981). «Роберт Бернс Вудворд. 10 апреля 1917 г. - 8 июля 1979 г.». Биографические мемуары членов Королевского общества . 27 : 628–695. дои : 10.1098/rsbm.1981.0025 . S2CID 71742454 .
- ^ Бисфам, WN (1941). «Токсические реакции после использования атабрина при малярии 1». Американский журнал тропической медицины и гигиены . с1-21 (3): 455–459. дои : 10.4269/ajtmh.1941.s1-21.455 .
- ^ Су, Синь-Чжуань; Миллер, Луи Х. (2015). «Открытие артемизинина и Нобелевская премия по физиологии и медицине» . Наука Китай Науки о жизни . 58 (11): 1175–1179. дои : 10.1007/s11427-015-4948-7 . ПМЦ 4966551 . ПМИД 26481135 .
- ^ Jump up to: а б с д и ж г час я Руководство по лечению малярии, второе издание Авторы: ВОЗ. Количество страниц: 194. Дата издания: 2010 г. Языки: английский. ISBN 978-92-4-154792-5
- ^ Матушевский, Кай (2017). «Вакцины против малярии – еще долгий путь» . Журнал ФЭБС . 284 (16): S0264–410X(16)30982–3. дои : 10.1111/февраль 14107 . ПМИД 28500775 .
- ^ Махмуди, Шима; Кешаварц, Хосейн (2017). «Эффективность фазы 3 испытания вакцины против малярии RTS, S/AS01: необходимость альтернативного плана развития» . Человеческие вакцины и иммунотерапия . 13 (9): 2098–2101. дои : 10.1080/21645515.2017.1295906 . ПМЦ 5612527 . ПМИД 28272979 .
- ^ «ВОЗ рекомендует революционную вакцину против малярии для детей из группы риска» . www.who.int . Проверено 15 ноября 2021 г.
- ^ Де Флора, С; Ла Маэстра, С (2015). «Эпидемиология раковых заболеваний инфекционного происхождения и стратегии профилактики» . Журнал профилактической медицины и гигиены . 56 (1): Е15–20. дои : 10.15167/2421-4248/jpmh2015.56.1.470 . ПМЦ 4718340 . ПМИД 26789827 .

- ^ Бувар, Вероника; Бан, Роберт; Стрейф, Курт; Гросс, Янн; Секретан, Беатрис; Гиссасси, Фатиха Эль; Бенбрахим-Талла, Ламия; Гуха, Нила; и др. (2009). «Обзор канцерогенов для человека. Часть B: биологические агенты» (PDF ) Ланцет онкологии . 10 (4): 321–322. дои : 10.1016/S1470-2045(09) 70096-8 ПМИД 19350698 .
- ^ Гесер, А.; Брубейкер, Г.; Дрейпер, CC (1989). «Влияние программы подавления малярии на заболеваемость африканской лимфомой Беркитта». Американский журнал эпидемиологии . 129 (4): 740–752. doi : 10.1093/oxfordjournals.aje.a115189 . ПМИД 2923122 .
- ^ Райчани, Юлиус; Сенте, Кальман; Банати, Ференц; Сатмари, Сьюзен (2014). «Обзор иммуногенных белков вируса Эпштейна-Барра (EBV) и их эпитопов: значение для подготовки вакцин». Недавние патенты на открытие противоинфекционных препаратов . 9 (1): 62–76. дои : 10.2174/1574891X09666140828114812 . ПМИД 25164057 .
- ^ Ван, Юян; Банерджи, Шувомой; Дин, Линг; Кай, Канкун; Вэй, Фанг; Цай, Цилян (2017). «Регуляторная роль фосфорилирования белков при раке, связанном с гаммагерпевирусом человека» . Вирусология Синика . 32 (5): 357–368. дои : 10.1007/s12250-017-4081-9 . ПМК 6704201 . ПМИД 29116588 .
- ^ ван Тонг, Хоанг; Бриндли, Пол Дж.; Мейер, Кристиан Г.; Велаван, Тирумаайсами П. (2017). «Паразитарная инфекция, канцерогенез и злокачественные новообразования человека» . Электронная биомедицина . 15 :12–23. дои : 10.1016/j.ebiom.2016.11.034 . ПМК 5233816 . ПМИД 27956028 .

- ^ Торли-Лоусон, Дэвид; Дейч, Кирк В.; Дука, Карен А.; Торгбор, Чарльз; Нолл, Лаура Дж (2016). «Связь между малярией Plasmodium falciparum и эндемической лимфомой Беркитта — новый взгляд на загадку 50-летней давности» . ПЛОС Патогены . 12 (1): e1005331. дои : 10.1371/journal.ppat.1005331 . ПМЦ 4721646 . ПМИД 26794909 .

- ^ Квятковский Д.П. (2005). «Как малярия повлияла на геном человека и что генетика человека может рассказать нам о малярии» . Американский журнал генетики человека . 77 (2): 171–92. дои : 10.1086/432519 . ПМЦ 1224522 . ПМИД 16001361 .

- ^ Хедрик П.В. (2011). «Популяционная генетика устойчивости человека к малярии» . Наследственность . 107 (4): 283–304. дои : 10.1038/hdy.2011.16 . ПМЦ 3182497 . ПМИД 21427751 .

- ^ Свекла, Э.А. (1946). «Серповидноклеточная анемия в районе Баловале Северной Родезии». Восточноафриканский медицинский журнал . 23 : 75–86. ПМИД 21027890 .
- ^ Хедрик, PW (2011). «Популяционная генетика устойчивости человека к малярии» . Наследственность . 107 (4): 283–304. дои : 10.1038/hdy.2011.16 . ПМЦ 3182497 . ПМИД 21427751 .
- ^ Чотиванич, К; Удомсангпетч, Р; Паттанапаньясат, К; Чиеракул, Ж; Симпсон, Дж; Лооарисуван, С; Уайт, Н. (2002). «Гемоглобин Е: сбалансированный полиморфизм, защищающий от высокой паразитемии и, следовательно, от тяжелой малярии, вызванной P falciparum» . Кровь . 100 (4): 1172–6. doi : 10.1182/blood.V100.4.1172.h81602001172_1172_1176 . ПМИД 12149194 .
- ^ Верра, Федерика; Симпор, Джеймс; Воин, Джордж М.; Теттех, Кевин К.; Ховард, Тевис; Осьер, Фейт И; Банконе, Германия; Авеллино, Памела; и др. (3 октября 2007 г.). «Роль гемоглобина C и S в приобретенном иммунитете против Plasmodium falciparum малярии » . ПЛОС ОДИН 2 (10): e9 Бибкод : 2007PLoSO...2..978V . дои : 10.1371/journal.pone.0000978 . ЧВК 1991593 . ПМИД 17912355 .
Дальнейшее чтение
[ редактировать ]- Колумбийские ученые разрабатывают вычислительный инструмент для обнаружения Plasmodium falciparum (на испанском языке)
- Эллисон, AC (февраль 1954 г.). «Защита, обеспечиваемая серповидноклеточной формой от субтертиевой малярийной инфекции» . Бр Мед Дж . 1 (4857): 290–4. дои : 10.1136/bmj.1.4857.290 . ПМК 2093356 . ПМИД 13115700 .
- Эллисон, AC (1964). «Полиморфизм и естественный отбор в человеческих популяциях». Холодный источник Харб. Симп. Квант. Биол . 29 : 137–49. дои : 10.1101/sqb.1964.029.01.018 . ПМИД 14278460 .
- Холера, Р; Бриттен, Нью-Джерси; Джиллри М.Р.; и др. (январь 2008 г.). «Нарушение цитоадгезии эритроцитов, инфицированных Plasmodium falciparum, содержащих серповидный гемоглобин» . Учеб. Натл. акад. наук. США . 105 (3): 991–6. Бибкод : 2008PNAS..105..991C . дои : 10.1073/pnas.0711401105 . ПМК 2242681 . ПМИД 18192399 .
- Мокенгаупт, ФП; Эрхардт, С; Отчвема, Р; и др. (май 2004 г.). «Ограниченное влияние вариантов гемоглобина на аллели Plasmodium falciparum msp1 и msp2 при симптоматической малярии». Пер. Р. Сок. Троп. Мед. Хиг . 98 (5): 302–10. дои : 10.1016/j.trstmh.2003.10.001 . ПМИД 15109555 .
- Робертс, Ларри С.; Янови, Джон (2005). Основы паразитологии (7-е изд.). McGraw-Hill Education (выпуски ISE). ISBN 978-0-07-111271-0 .
Внешние ссылки
[ редактировать ]- Информация о видах малярии в CDC
- Веб-атлас медицинской паразитологии
- Профиль вида в Энциклопедии жизни
- Таксономия в UniProt
- Профиль в журнале «Ученые против малярии»
- Информация о геноме в Wellcome Trust Sanger Institute
- PlasmoDB: ресурс генома плазмодия
- Браузер UCSC Plasmodium Falciparum
- Информация о генах в Киотском университете