Толл-подобный рецептор
| Толл-подобный рецептор | |
|---|---|
 Изогнутая богатая лейцином повторяющаяся область толл-подобных рецепторов, представленная здесь TLR3. | |
| Идентификаторы | |
| Символ | Толл-подобный рецептор |
| Мембраном | 7 |
| ПИРСФ037595 | |
Toll-подобные рецепторы ( TLR ) представляют собой класс белков , которые играют ключевую роль во врожденной иммунной системе . Это одноразовые рецепторы, обычно экспрессируемые на сторожевых клетках, таких как макрофаги и дендритные клетки , которые распознают структурно консервативные молекулы, полученные из микробов . Как только эти микробы достигают физических барьеров, таких как кожа или кишечника слизистая оболочка , они распознаются TLR, которые активируют иммунных клеток реакцию . TLR включают TLR1 , TLR2 , TLR3 , TLR4 , TLR5 , TLR6 , TLR7 , TLR8 , TLR9 , TLR10 , TLR11 , TLR12 и TLR13 . У людей отсутствуют гены TLR11, TLR12 и TLR13. [1] а у мышей отсутствует функциональный ген TLR10. [2] Рецепторы TLR1, TLR2, TLR4, TLR5, TLR6 и TLR10 расположены на клеточной мембране , тогда как TLR3, TLR7, TLR8 и TLR9 расположены во внутриклеточных везикулах (поскольку они являются сенсорами нуклеиновых кислот ). [3]
TLR получили свое название из-за сходства с белком, кодируемым геном toll . [4]
Функция
[ редактировать ]Способность иммунной системы распознавать молекулы , которые широко распространены среди патогенов , отчасти обусловлена наличием иммунных рецепторов, называемых толл-подобными рецепторами (TLR), которые экспрессируются на мембранах лейкоцитов , включая дендритные клетки , макрофаги , природные клетки-киллеры , клетки адаптивного иммунитета Т-клетки и В-клетки , а также неиммунные клетки ( эпителиальные и эндотелиальные клетки и фибробласты ). [5]
Связывание лигандов — либо в форме адъюванта, используемого при вакцинации , либо в форме инвазивных фрагментов во время естественной инфекции — с TLR отмечает ключевые молекулярные события, которые в конечном итоге приводят к врожденным иммунным ответам и развитию антигенспецифических приобретенных иммунитет. [6] [7]
После активации TLR рекрутируют адаптерные белки (белки, которые опосредуют другие белок-белковые взаимодействия) в цитозоле иммунной клетки для распространения антиген-индуцированного пути передачи сигнала . Эти рекрутированные белки затем отвечают за последующую активацию других нижестоящих белков, включая протеинкиназы (IKKi, IRAK1 , IRAK4 и TBK1 ), которые дополнительно усиливают сигнал и в конечном итоге приводят к активации или подавлению генов , которые управляют воспалительными реакциями и другими транскрипционными реакциями. события. Некоторые из этих событий приводят к цитокинов , тогда как другие приводят к усилению адаптивного иммунитета. выработке, пролиферации и выживанию [7] Если лиганд является бактериальным фактором, патоген может быть фагоцитирован и переварен, а его антигены представлены CD4+ Т-клеткам .В случае вирусного фактора инфицированная клетка может прекратить синтез белка и подвергнуться запрограммированной гибели клеток ( апоптоз ). Иммунные клетки, обнаружившие вирус, также могут выделять противовирусные факторы, такие как интерфероны .
Также было показано, что Toll-подобные рецепторы являются важным связующим звеном между врожденным и адаптивным иммунитетом благодаря их присутствию в дендритных клетках . [8] Флагеллин , лиганд TLR5, индуцирует секрецию цитокинов при взаимодействии с TLR5 на Т-клетках человека. [8]
Суперсемья
[ редактировать ]
TLR представляют собой тип рецептора распознавания образов (PRR) и распознают молекулы, которые в целом являются общими для патогенов , но отличаются от молекул хозяина, что в совокупности называется молекулярными паттернами, связанными с патогенами (PAMP). Помимо распознавания экзогенных PAMP, TLR могут также связываться с эндогенными молекулярными структурами, связанными с повреждением (DAMP), такими как белки теплового шока (HSP) или компоненты плазматической мембраны. [9] TLR вместе с рецепторами интерлейкина-1 рецепторов образуют суперсемейство , известное как «суперсемейство рецепторов интерлейкина-1/толл-подобных рецепторов»; все члены этого семейства имеют общий так называемый домен TIR (рецептор toll-IL-1).
Существуют три подгруппы доменов TIR. Белки с TIR-доменами подгруппы 1 являются рецепторами интерлейкинов , которые продуцируются макрофагами , моноцитами и дендритными клетками , и все они имеют внеклеточные домены иммуноглобулина (Ig). Белки с TIR-доменами подгруппы 2 представляют собой классические TLR и прямо или косвенно связываются с молекулами микробного происхождения. Третья подгруппа белков, содержащих TIR-домены, состоит из адаптерных белков , которые являются исключительно цитозольными и опосредуют передачу сигналов от белков подгрупп 1 и 2.
Большая семья
[ редактировать ]В этом разделе отсутствует информация о TLR хоанофлагеллят (pmid29848444). ( декабрь 2021 г. ) |
TLRs присутствуют как у позвоночных, так и у беспозвоночных . Молекулярные строительные блоки TLRs представлены в бактериях и растениях, а рецепторы распознавания образов растений, как хорошо известно, необходимы для защиты хозяина от инфекции. Таким образом, TLRs являются одним из самых древних и консервативных компонентов иммунной системы .
В последние годы TLR были идентифицированы и в нервной системе млекопитающих. Члены семейства TLR были обнаружены в глии, нейронах и нейрональных клетках-предшественниках, в которых они регулируют решение клеточной судьбы. [10]
Было подсчитано, что большинство видов млекопитающих имеют от десяти до пятнадцати типов толл-подобных рецепторов. Тринадцать TLR (названных просто от TLR1 до TLR13) были идентифицированы вместе у людей и мышей, а эквивалентные формы многих из них были обнаружены у других видов млекопитающих. [11] [12] [13] Однако эквиваленты некоторых TLR, обнаруженные у человека, присутствуют не у всех млекопитающих. Например, ген, кодирующий белок, аналогичный TLR10 у людей, присутствует у мышей , но, по-видимому, в какой-то момент в прошлом он был поврежден ретровирусом . С другой стороны, мыши экспрессируют TLR 11, 12 и 13, ни один из которых не представлен у человека. Другие млекопитающие могут экспрессировать TLR, которых нет у человека. , направленный против клеточной стенки Другие виды, не относящиеся к млекопитающим, могут иметь TLR, отличные от млекопитающих, о чем свидетельствует TLR14 , который обнаружен у рыбы-фугу Такифугу . [14] Это может усложнить процесс использования экспериментальных животных в качестве моделей врожденного иммунитета человека.
TLR позвоночных делятся по сходству на семейства TLR 1/2/6/10/14/15, TLR 3, TLR 4, TLR 5, TLR 7/8/9 и TLR 11/12/13/16/21. /22/23. [14]
TLR в дрозофилы иммунитете
[ редактировать ]
Участие toll-сигналов в иммунитете было впервые продемонстрировано на плодовой мушке Drosophila melanogaster . [19] У плодовых мушек есть только врожденные иммунные реакции, что позволяет исследованиям избежать вмешательства адаптивных иммунных механизмов в передачу сигнала. Реакция мух на грибковую или бактериальную инфекцию происходит через два различных сигнальных каскада, один из которых представляет собой путь платных сигналов, а другой — путь иммунодефицита . Путь toll подобен передаче сигналов TLR млекопитающих, но в отличие от TLR млекопитающих, toll не активируется непосредственно патоген-ассоциированными молекулярными паттернами ( PAMPs ). Его рецепторный эктодомен распознает расщепленную форму цитокина spätzle, который секретируется в гемолимфе как неактивный димерный предшественник. Toll-рецептор разделяет цитоплазматический домен TIR с TLR млекопитающих, но эктодомен и внутрицитоплазматический хвост различны. Это различие может отражать функцию этих рецепторов как цитокиновых рецепторов, а не PRR .
Платный путь активируется различными стимулами, такими как грамположительные бактерии , грибы и факторы вирулентности . [17] [20] Во-первых, процессирующий фермент Spätzle (SPE) активируется в ответ на инфекцию и расщепляет spätzle ( spz ). Расщепленный spätzle затем связывается с платным рецептором и сшивает его эктодомены. Это запускает конформационные изменения в рецепторе, приводящие к передаче сигналов через toll. С этого момента сигнальный каскад очень похож на передачу сигналов млекопитающих через TLR. Toll-индуцированный сигнальный комплекс (TICS) состоит из MyD88 , Tube и Pelle (ортолога IRAK млекопитающих). Сигнал от TICS затем передается в Cactus (гомолог IκB млекопитающих ), фосфорилированный Cactus полиубиквитилируется и деградирует, обеспечивая ядерную транслокацию DIF (дорсального фактора иммунитета; гомолог NF-κB млекопитающих ) и индукцию транскрипции генов антимикробного действия. пептиды (AMP), такие как дрозомицин . [21]
дрозофилы Всего у 9 генов семейства toll и 6 генов семейства spz , которые в разной степени взаимодействуют друг с другом. [22]
ТЛР2
[ редактировать ]TLR2 также обозначают как CD282 (кластер дифференцировки 282).
ТЛР3
[ редактировать ]TLR3 не использует MyD88-зависимый путь. Его лигандом является ретровирусная двухцепочечная РНК ( дсРНК ), которая активирует TRIF- зависимый сигнальный путь. Чтобы изучить роль этого пути в ретровирусном перепрограммировании, были разработаны методы нокдауна TLR3 или TRIF, и результаты показали, что только путь TLR3 необходим для полной индукции экспрессии целевого гена вектором экспрессии ретровируса. Эта ретровирусная экспрессия четырех транскрипционных факторов ( Oct4 , Sox2 , Klf4 и c-Myc ; OSKM) индуцирует плюрипотентность в соматических клетках. Это подтверждается исследованием, которое показывает, что эффективность и количество генерации ИПСК человека с использованием ретровирусных векторов снижаются при нокдауне этого пути пептидными ингибиторами или shRNA нокдауне TLR3 или его адаптерного белка TRIF. В совокупности стимуляция TLR3 вызывает большие изменения в ремоделировании хроматина и ядерном перепрограммировании, и для этих изменений необходима активация воспалительных путей, индукция генов плюрипотентности и создание колоний индуцированных человеком плюрипотентных стволовых клеток (ИПСК). [23]
ТЛР11
[ редактировать ]Как отмечалось выше, клетки человека не экспрессируют TLR11 , а клетки мыши — экспрессируют. TLR11, специфичный для мышей, распознает уропатогенную E.coli и апикомплексного паразита Toxoplasma gondii . У токсоплазмы его лигандом является белок профилин, а у E. coli — флагеллин . Флагеллин энтеропатогена Salmonella также распознается TLR11. [24]
Поскольку мышиный TLR11 способен эффективно распознавать сальмонеллу , нормальные мыши не заражаются пероральной сальмонеллой Typhi , которая вызывает у людей пищевой и водный гастроэнтерит и брюшной тиф . TLR11 С другой стороны, мыши с нокаутом эффективно заражаются. В результате эта нокаутная мышь может служить моделью брюшного тифа человека. [25]
Краткое изложение известных TLR млекопитающих
[ редактировать ]Толл-подобные рецепторы связываются и активируются разными лигандами, которые, в свою очередь, расположены на разных типах организмов или структур. Они также имеют разные адаптеры, реагирующие на активацию, и расположены иногда на поверхности клетки, а иногда и во внутренних отсеках клетки . [26] Кроме того, они экспрессируются различными типами лейкоцитов или другими типами клеток :
| Рецептор | Лиганд(ы) [27] | Расположение лиганда [27] | Адаптер(ы) | Расположение | Типы ячеек [27] |
|---|---|---|---|---|---|
| ТЛР 1 | несколько триациллипопептидов | Бактериальный липопротеин | MyD88 /МАЛ | клеточная поверхность |
|
| ТЛР 2 | несколько гликолипидов | Бактериальные пептидогликаны | MyD88/МАЛ | клеточная поверхность |
|
| несколько липопептидов и протеолипидов | Бактериальные пептидогликаны | ||||
| липотейхоевая кислота | Грамположительные бактерии | ||||
| HSP70 | Клетки-хозяева | ||||
| зимозан ( бета-глюкан ) | Грибы | ||||
| Многие другие | |||||
| ТЛР 3 | двухцепочечная РНК , поли I:C | вирусы | ТРИФ | клеточный отсек |
|
| ТЛР 4 | липополисахарид | Грамотрицательные бактерии | MyD88/MAL/ TRIF /TRAM | клеточная поверхность |
|
| несколько белков теплового шока | Бактерии и клетки-хозяева | ||||
| фибриноген | клетки-хозяева | ||||
| гепарансульфата фрагменты | клетки-хозяева | ||||
| гиалуроновой кислоты фрагменты | клетки-хозяева | ||||
| никель [32] | |||||
| Различные опиоидные препараты | |||||
| ТЛР 5 | Бактериальный флагеллин | Бактерии | МойD88 | клеточная поверхность |
|
| Профиль [33] | Токсоплазма гондии | ||||
| ТЛР 6 | несколько диациллипопептидов | Микоплазма | MyD88/МАЛ | клеточная поверхность |
|
| ТЛР 7 | имидазохинолин | небольшие синтетические соединения | МойD88 | клеточный отсек |
|
| локсорибин ( аналог гуанозина ) | |||||
| бропиримин | |||||
| резиквимод | |||||
| одноцепочечная РНК | РНК-вирусы | ||||
| ТЛР 8 | небольшие синтетические соединения; одноцепочечная вирусная РНК, фагоцитированная бактериальная РНК(24) | МойD88 | клеточный отсек |
| |
| ТЛР 9 | неметилированная CpG-олигодезоксинуклеотида ДНК | Бактерии, ДНК-вирусы | МойD88 | клеточный отсек |
|
| 10 турецких лир | триацилированные липопептиды [35] | неизвестный | клеточная поверхность | ||
| ТЛР 11 | Профиль | Токсоплазма гондии [39] | МойD88 | клеточный отсек [40] |
|
| Флагеллин | Бактерии ( кишечная палочка , сальмонелла ) [24] | ||||
| ТЛР 12 | Профиль | Токсоплазма гондии [41] | МойD88 | клеточный отсек |
|
| ТЛР 13 [43] [44] | последовательность бактериальной рибосомальной РНК «CGGAAAGACC» (но не метилированная версия) [45] | Вирус, бактерия | MyD88, ТАК-1 | клеточный отсек |
|
Лиганды
[ редактировать ]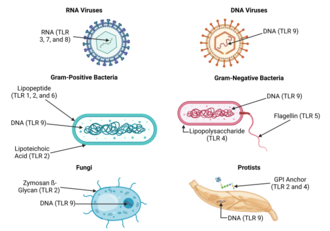
Из-за специфичности толл-подобных рецепторов (и других рецепторов врожденного иммунитета) их нелегко изменить в ходе эволюции. Эти рецепторы распознают молекулы, которые постоянно связаны с угрозами (т. е. с патогеном или клеточным стрессом) и высокоспецифичны для эти угрозы (т.е. их нельзя спутать с собственными молекулами, которые обычно экспрессируются в физиологических условиях). Считается, что ассоциированные с патогеном молекулы, отвечающие этому требованию, имеют решающее значение для функции патогена и их трудно изменить путем мутации; Говорят, что они эволюционно консервативны. Несколько консервативные свойства патогенов включают бактериальной клеточной поверхности липополисахариды (ЛПС), липопротеины , липопептиды и липоарабиноманнан ; белки, такие как флагеллин бактериальных жгутиков ; двухцепочечная РНК вирусов; или неметилированные CpG- островки бактериальной и вирусной ДНК ; а также CpG-островков, обнаруженных в промоторах эукариотической ДНК; а также некоторые другие молекулы РНК и ДНК. Поскольку лиганды TLR присутствуют в большинстве патогенов, они также могут присутствовать в вакцинах, полученных из патогенов (например, вакцинах против MMR, гриппа, полиомиелита). Большинство коммерчески доступных вакцин были оценены на предмет присущей им способности лигандов TLR активировать отдельные подмножества иммунных клеток. [46] [47] Для большинства TLR специфичность распознавания лигандов теперь установлена с помощью генного нацеливания (также известного как «нокаут гена»): метода, с помощью которого отдельные гены могут быть выборочно удалены у мышей. [48] [49] В таблице выше приведена сводная информация об известных лигандах TLR.
Эндогенные лиганды
[ редактировать ]Стереотипная воспалительная реакция, вызванная активацией toll-подобных рецепторов, привела к предположению, что эндогенные активаторы toll-подобных рецепторов могут участвовать в аутоиммунных заболеваниях. Предполагается, что TLR связываются с молекулами хозяина, включая фибриноген (участвующий в свертывании крови ), белки теплового шока (HSP), HMGB1 , компоненты внеклеточного матрикса и собственную ДНК (обычно она разрушается нуклеазами, но при воспалительных и аутоиммунных состояниях может образовывать комплекс с эндогенными белками, становятся устойчивыми к этим нуклеазам и получают доступ к эндосомальным TLRs как TLR7 или TLR9). Эти эндогенные лиганды обычно образуются в результате нефизиологической гибели клеток. [50]
Сигнализация
[ редактировать ]
Считается, что TLR функционируют как димеры . Хотя большинство TLR, по-видимому, функционируют как гомодимеры , TLR2 образует гетеродимеры с TLR1 или TLR6, причем каждый димер имеет разную лигандную специфичность. TLRs также могут зависеть от других корецепторов для обеспечения полной чувствительности к лигандам, например, в случае распознавания TLR4 LPS , для которого требуется MD-2. Известно, что CD14 и LPS-связывающий белок ( LBP ) облегчают презентацию LPS MD-2.
Набор эндосомальных TLR, включающий TLR3, TLR7, TLR8 и TLR9, распознает нуклеиновую кислоту, полученную из вирусов, а также эндогенные нуклеиновые кислоты в контексте патогенных событий. Активация этих рецепторов приводит к выработке воспалительных цитокинов , а также интерферонов типа I ( интерферон типа I ), которые помогают бороться с вирусной инфекцией.
Также были нацелены на адаптерные белки и киназы, которые опосредуют передачу сигналов TLR. Кроме того, случайный мутагенез зародышевой линии с помощью ENU для расшифровки сигнальных путей TLR использовался . При активации TLR рекрутируют адаптерные молекулы в цитоплазме клеток для распространения сигнала. Известно, что в передаче сигнала участвуют четыре адаптерные молекулы. Эти белки известны как MyD88 , TIRAP (также называемый Mal), TRIF и TRAM (адаптерная молекула, связанная с TRIF). [51] [52] [53]
Передача сигналов TLR разделена на два отдельных сигнальных пути: MyD88-зависимый и TRIF-зависимый путь.
MyD88-зависимый путь
[ редактировать ]MyD88-зависимый ответ возникает при димеризации TLR и используется всеми TLR, кроме TLR3. Его основным эффектом является активация NFκB и митоген-активируемой протеинкиназы . Связывание лиганда и конформационные изменения, происходящие в рецепторе, привлекают адаптерный белок MyD88, член семейства TIR . MyD88 затем набирает IRAK4 , IRAK1 и IRAK2 . Затем киназы IRAK фосфорилируют и активируют белок TRAF6 , который, в свою очередь, полиубиквинизирует белок TAK1, а также сам по себе, чтобы облегчить связывание с IKK-β . При связывании TAK1 фосфорилирует IKK-β, который затем фосфорилирует IκB, вызывая его деградацию и позволяя NFκB диффундировать в ядро клетки и активировать транскрипцию и, как следствие, индукцию воспалительных цитокинов. [50]
TRIF-зависимый путь
[ редактировать ]И TLR3, и TLR4 используют TRIF-зависимый путь, который запускается дцРНК и ЛПС соответственно. Для TLR3 дсРНК приводит к активации рецептора, рекрутируя адаптер TRIF . TRIF активирует киназы TBK1 и RIPK1 , что создает ветвь сигнального пути. Сигнальный комплекс TRIF/TBK1 фосфорилирует IRF3, обеспечивая его транслокацию в ядро и продукцию интерферона типа I. Между тем, активация RIPK1 вызывает полиубиквитинирование и активацию транскрипции TAK1 и NFκB таким же образом, как и MyD88-зависимый путь. [50]
Передача сигналов TLR в конечном итоге приводит к индукции или подавлению генов, которые управляют воспалительной реакцией. В целом тысячи генов активируются посредством передачи сигналов TLR, и в совокупности TLRs представляют собой один из наиболее плейотропных , но жестко регулируемых шлюзов для генной модуляции.
TLR4 — единственный TLR, использующий все четыре адаптера. Комплекс, состоящий из TLR4, MD2 и LPS, рекрутирует TIR-домен-содержащие адаптеры TIRAP и MyD88 и, таким образом, инициирует активацию NFκB (ранняя фаза) и MAPK. Комплекс TLR4-MD2-LPS затем подвергается эндоцитозу и в эндосоме образует сигнальный комплекс с адаптерами TRAM и TRIF. Этот TRIF-зависимый путь снова приводит к активации IRF3 и выработке интерферонов типа I, но он также активирует позднюю фазу активации NFκB. Для продукции воспалительных цитокинов необходима как поздняя, так и ранняя фаза активации NFκB. [50]
Медицинская значимость
[ редактировать ]Имиквимод (широко используемый в дерматологии ) является агонистом TLR7, а его преемник резиквимод — агонистом TLR7 и TLR8. [54] Недавно резиквимод был исследован в качестве средства иммунотерапии рака. [55] действуя посредством стимуляции опухолеассоциированных макрофагов.
Некоторые лиганды TLR находятся в клинической разработке или тестируются на животных моделях в качестве адъювантов для вакцин . [56] с первым клиническим применением на людях рекомбинантной вакцины против опоясывающего герпеса в 2017 году, которая содержит компонент монофосфориллипида А.
Сообщалось об уровнях экспрессии информационной РНК TLR7 у молочных животных при естественной вспышке ящура. [57]
Было показано, что TLR4 важен для долгосрочных побочных эффектов опиоидов . Его активация приводит к высвобождению модуляторов воспаления, включая TNF-α и IL-1β , и считается, что постоянное высвобождение этих модуляторов на низком уровне со временем снижает эффективность лечения опиоидными препаратами и участвует в толерантности к опиоидам. [58] [59] гипералгезия и аллодиния . [60] [61] Морфин-индуцированная активация TLR4 ослабляет боли подавление опиоидами и усиливает развитие толерантности к опиоидам и зависимости , злоупотребления наркотиками и других негативных побочных эффектов, таких как угнетение дыхания и гипералгезия. [62] Было показано, что препараты, блокирующие действие TNF-α или IL-1β, усиливают анальгетический эффект опиоидов и уменьшают развитие толерантности и других побочных эффектов. [63] [64] и это также было продемонстрировано на препаратах, которые блокируют сам TLR4.
«Неестественные» энантиомеры опиоидных препаратов, таких как (+)-морфин и (+)-налоксон, лишены сродства к опиоидным рецепторам, но по-прежнему производят ту же активность в отношении TLR4, что и их «нормальные» энантиомеры. [65] [66] Таким образом, «неприродные» энтианомеры опиоидов, такие как (+)-налоксон, могут быть использованы для блокирования активности TLR4 опиоидных анальгетиков, не обладая при этом каким-либо сродством к мю-опиоидному рецептору. [67] [66] [68]
Открытие
[ редактировать ]Когда микробы были впервые признаны причиной инфекционных заболеваний, сразу стало ясно, что многоклеточные организмы должны быть способны распознавать их при заражении и, следовательно, способны распознавать молекулы, уникальные для микробов. Большой объем литературы, охватывающий большую часть прошлого столетия, свидетельствует о поиске ключевых молекул и их рецепторов. Более 100 лет назад Ричард Пфайффер , ученик Роберта Коха , ввёл термин « эндотоксин » для описания вещества, вырабатываемого грамотрицательными бактериями , которое могло провоцировать лихорадку и шок у экспериментальных животных . В последующие десятилетия эндотоксин был химически охарактеризован и идентифицирован как липополисахарид (ЛПС), продуцируемый большинством грамотрицательных бактерий. Этот липополисахарид является неотъемлемой частью мембраны грамотрицательных бактерий и высвобождается при разрушении бактерии. Было показано, что другие молекулы (бактериальные липопептиды , флагеллин и неметилированная ДНК ), в свою очередь, провоцируют реакции хозяина, которые обычно являются защитными. Однако эти реакции могут быть вредными, если они чрезмерно продолжительны или интенсивны. Логически отсюда следовало, что должны существовать рецепторы для таких молекул, способные предупредить хозяина о наличии инфекции, но они оставались неуловимыми в течение многих лет. Толл-подобные рецепторы теперь причисляются к ключевым молекулам, которые предупреждают иммунитета к присутствию микробных инфекций.
Прототипический член семейства, толл- рецептор ( P08953 ; Tl) у плодовой мухи Drosophila melanogaster , был открыт в 1985 году лауреатами Нобелевской премии 1995 года Кристианой Нюсляйн-Фольхард и Эриком Вишаусом и их коллегами. Он был известен своей функцией развития в эмбриогенезе путем установления дорсально - вентральной оси. Он был назван в честь восклицания Кристианы Нюсляйн-Фольхард в 1985 году: « Das ist ja toll ! » («Это потрясающе!»), В отношении недоразвитой брюшной части личинки плодовой мухи. [4] Он был клонирован лабораторией Кэтрин Андерсон в 1988 году. [69] В 1996 году что толл и его коллеги обнаружили, Жюль А. Хоффманн играет важную роль в иммунитете мух к грибковой инфекции , чего он достигает за счет активации синтеза антимикробных пептидов. [19]
Первый зарегистрированный человеческий толл-подобный рецептор был описан Номурой и его коллегами в 1994 году. [70] картирован на хромосоме Тагучи и его коллегами в 1996 году. [71] Поскольку иммунная функция toll у дрозофилы тогда не была известна, предполагалось, что TIL (теперь известный как TLR1) может участвовать в развитии млекопитающих. Однако в 1991 г. (до открытия TIL) было обнаружено, что молекула, играющая явную роль в иммунной функции млекопитающих, рецептор интерлейкина-1 (IL-1), также гомологична toll дрозофилы; цитоплазматические части обеих молекул были сходны. [72]
В 1997 году Чарльз Джейнвей и Руслан Меджитов показали, что толл-подобный рецептор, ныне известный как TLR4, может при искусственном лигировании с помощью антител вызывать активацию определенных генов, необходимых для инициации адаптивного иммунного ответа . [7] Функция TLR 4 как рецептора, воспринимающего ЛПС, была обнаружена Брюсом А. Бейтлером и его коллегами. [73] Эти исследователи использовали позиционное клонирование , чтобы доказать, что у мышей, которые не могли реагировать на ЛПС, были мутации, которые нарушали функцию TLR4. Это идентифицировало TLR4 как один из ключевых компонентов рецептора ЛПС.

В свою очередь, другие гены TLR были удалены у мышей путем генного таргетинга, в основном в лаборатории Шизуо Акиры и его коллег. Сейчас считается, что каждый TLR обнаруживает дискретный набор молекул – некоторые микробного происхождения и некоторые продукты повреждения клеток – и сигнализирует о наличии инфекций. [74]
Растительные гомологи toll были обнаружены Памелой Рональд в 1995 году (рис XA21). [75] и Томас Боллер в 2000 г. ( Arabidopsis FLS2). [76]
В 2011 году Бойтлер и Хоффманн были удостоены Нобелевской премии по медицине и физиологии за свою работу. [77] Хоффманн и Акира получили Международную премию Канады Гайрднера в 2011 году. [78]
Примечания и ссылки
[ редактировать ]- ^ Махла Р.С., Редди MC, Прасад Д.В., Кумар Х (сентябрь 2013 г.). «Подслащивающие PAMP: роль PAMP в комплексе с сахаром во врожденном иммунитете и биологии вакцин» . Границы в иммунологии . 4 : 248. дои : 10.3389/fimmu.2013.00248 . ПМЦ 3759294 . ПМИД 24032031 .
- ^ Вперёд, Фейт; Индрипутри, Вырезать; Мамуце, Джанет; Нуграха, Джусак (2020). «TLR10 и его уникальные противовоспалительные свойства и потенциальное использование в качестве мишени в терапии» . Иммунная сеть . 20 (3): е21. дои : 10.4110/in.2020.20.e21 . ISSN 1598-2629 . ПМЦ 7327153 . ПМИД 32655969 .
- ^ Кембалл CC, Алирезаи М, Уиттон Дж.Л. (2010). «Вирусы Коксаки типа B и их взаимодействие с врожденной и адаптивной иммунной системой» . Будущая микробиология . 5 (9): 1329–1347. дои : 10.2217/fmb.10.101 . ПМК 3045535 . ПМИД 20860480 .
- ^ Перейти обратно: а б Ханссон Г.К., Эдфельдт К. (июнь 2005 г.). «Плата взимается при входе в стенку судна» . Атеросклероз, тромбоз и сосудистая биология . 25 (6): 1085–7. дои : 10.1161/01.ATV.0000168894.43759.47 . ПМИД 15923538 .
- ^ Дельнесте Ю., Бовиллен С., Жаннен П. (январь 2007 г.). «[Врожденный иммунитет: структура и функции TLRs]» . Медицина/Науки . 23 (1): 67–73. дои : 10.1051/medsci/200723167 . ПМИД 17212934 .
- ^ Такеда К., Акира С. (январь 2005 г.). «Толл-подобные рецепторы врожденного иммунитета». Международная иммунология . 17 (1): 1–14. дои : 10.1093/intimm/dxh186 . ПМИД 15585605 .
- ^ Перейти обратно: а б с Меджитов Р., Престон-Хёрлберт П., Джейнвей, Калифорния (июль 1997 г.). «Человеческий гомолог белка Toll дрозофилы сигнализирует об активации адаптивного иммунитета» . Природа . 388 (6640): 394–7. Бибкод : 1997Natur.388..394M . дои : 10.1038/41131 . ПМИД 9237759 .
- ^ Перейти обратно: а б Шарма Н., Ахаде А.С., Кадри А. (апрель 2013 г.). «Сфингозин-1-фосфат подавляет TLR-индуцированную секрецию CXCL8 из Т-клеток человека». Журнал биологии лейкоцитов . 93 (4): 521–8. дои : 10.1189/jlb.0712328 . ПМИД 23345392 .
- ^ Самир А.С., Ниссар С. Toll-подобные рецепторы (TLR): структура, функции, передача сигналов и роль их полиморфизмов в предрасположенности к колоректальному раку. Биомед Рес Инт. 12 сентября 2021 г.; 2021 г.: 1157023. дои: 10.1155/2021/1157023. ПМИД 34552981; PMCID: PMC8452412.
- ^ Роллс А., Шехтер Р., Лондон А., Зив Ю., Ронен А., Леви Р., Шварц М. (сентябрь 2007 г.). «Толл-подобные рецепторы модулируют нейрогенез гиппокампа взрослых». Природная клеточная биология . 9 (9): 1081–8. дои : 10.1038/ncb1629 . ПМИД 17704767 . S2CID 12517461 .
- ^ Ду Х, Полторак А, Вэй Ю, Бойтлер Б (сентябрь 2000 г.). «Три новых толл-подобных рецептора млекопитающих: структура гена, экспрессия и эволюция» . Европейская цитокиновая сеть . 11 (3): 362–71. ПМИД 11022119 .
- ^ Чуанг Т.Х., Улевич Р.Дж. (сентябрь 2000 г.). «Клонирование и характеристика подсемейства толл-подобных рецепторов человека: hTLR7, hTLR8 и hTLR9» . Европейская цитокиновая сеть . 11 (3): 372–8. ПМИД 11022120 .
- ^ Табета К., Джорджель П., Янссен Э., Ду Х, Хоэбе К., Кроза К. и др. (март 2004 г.). «Toll-подобные рецепторы 9 и 3 как важные компоненты врожденной иммунной защиты против цитомегаловирусной инфекции мышей» . Труды Национальной академии наук Соединенных Штатов Америки . 101 (10): 3516–21. Бибкод : 2004PNAS..101.3516T . дои : 10.1073/pnas.0400525101 . ПМЦ 373494 . ПМИД 14993594 .
- ^ Перейти обратно: а б Роуч Дж.К., Глусман Г., Роуэн Л., Каур А., Перселл М.К., Смит К.Д. и др. (июль 2005 г.). «Эволюция Toll-подобных рецепторов позвоночных» . Труды Национальной академии наук Соединенных Штатов Америки . 102 (27): 9577–82. Бибкод : 2005PNAS..102.9577R . дои : 10.1073/pnas.0502272102 . ПМЦ 1172252 . ПМИД 15976025 .
- ^ Леметр Б., Хоффманн Дж. (2007). «Защита хозяина Drosophila melanogaster» . Ежегодный обзор иммунологии . 25 : 697–743. doi : 10.1146/annurev.immunol.25.022106.141615 . ПМИД 17201680 .
- ^ Валанн С., Ван Дж. Х., Рамет М. (январь 2011 г.). «Сигнальный путь дрозофилы Toll» . Журнал иммунологии . 186 (2): 649–56. doi : 10.4049/jimmunol.1002302 . ПМИД 21209287 .
- ^ Перейти обратно: а б Дуджич Дж.П., Хансон М.А., Яценко И., Кондо С., Леметр Б. (апрель 2019 г.). «Больше, чем черное или белое: меланизация и регуляторные сериновые протеазы у дрозофилы» . Отчеты по ячейкам . 27 (4): 1050–1061.e3. дои : 10.1016/j.celrep.2019.03.101 . ПМИД 31018123 .
- ^ Хэнсон М.А., Гамильтон П.Т., Перлман С.Дж. (октябрь 2016 г.). «Иммунные гены и дивергентные антимикробные пептиды у мух подрода Drosophila» . Эволюционная биология BMC . 16 (1): 228. doi : 10.1186/s12862-016-0805-y . ПМК 5078906 . ПМИД 27776480 .
- ^ Перейти обратно: а б Леметр Б., Николя Э., Мишо Л., Райххарт Дж. М., Хоффманн Дж. А. (сентябрь 1996 г.). «Дорсовентральная регуляторная кассета генов spätzle/Toll/cactus контролирует мощный противогрибковый ответ у взрослых дрозофил» . Клетка . 86 (6): 973–83. дои : 10.1016/s0092-8674(00)80172-5 . ПМИД 8808632 . S2CID 10736743 .
- ^ Исса Н., Гийомо Н., Лорет Э., Мэтт Н., Шеффер-Рейсс С., Ван Дорселер А. и др. (февраль 2018 г.). «Циркулирующая протеаза Персефона является иммунным сенсором микробной протеолитической активности выше пути дрозофилы» . Молекулярная клетка . 69 (4): 539–550.e6. doi : 10.1016/j.molcel.2018.01.029 . ПМЦ 5823974 . ПМИД 29452635 .
- ^ Феррандон Д., Имлер Дж.Л., Хетру С., Хоффманн Дж.А. (ноябрь 2007 г.). «Системный иммунный ответ дрозофилы: восприятие и передача сигналов во время бактериальных и грибковых инфекций». Обзоры природы. Иммунология . 7 (11): 862–74. дои : 10.1038/nri2194 . ПМИД 17948019 . S2CID 11104900 .
- ^ Чоудхури М., Ли К.Ф., Хэ З., Лу Ю., Лю К.С., Ван Ю.Ф. и др. (июнь 2019 г.). «Дрозофила» . Журнал биологической химии . 294 (26): 10172–10181. дои : 10.1074/jbc.RA118.006804 . ПМК 6664172 . ПМИД 31088910 .
- ^ Ли Дж., Сайед Н., Хантер А., Ау К.Ф., Вонг В.Х., Мокарски Э.С. и др. (октябрь 2012 г.). «Для эффективного ядерного перепрограммирования необходима активация врожденного иммунитета» . Клетка . 151 (3): 547–58. дои : 10.1016/j.cell.2012.09.034 . ПМЦ 3506423 . ПМИД 23101625 .
- ^ Перейти обратно: а б Хатай, Хироцугу; Лепелли, Алиса; Цзэн, Ванъён; Хайден, Мэтью С.; Гош, Санкар (2016). «Толл-подобный рецептор 11 (TLR11) взаимодействует с флагеллином и профилином посредством различных механизмов» . ПЛОС ОДИН . 11 (2): e0148987. Бибкод : 2016PLoSO..1148987H . дои : 10.1371/journal.pone.0148987 . ISSN 1932-6203 . ПМЦ 4747465 . ПМИД 26859749 .
- ^ Матур Р., О Х., Чжан Д., Пак С.Г., Со Дж., Коблански А. и др. (октябрь 2012 г.). «Мышиная модель инфекции Salmonella typhi» . Клетка . 151 (3): 590–602. дои : 10.1016/j.cell.2012.08.042 . ПМЦ 3500584 . ПМИД 23101627 .
- ^ Флайник, Мартин Ф.; Сингх, Невил Дж.; Холланд, Стивен М., ред. (2023). «Глава 12 Рецепторы распознавания образов и семейство IL-1». Фундаментальная иммунология Пола (8-е изд.). Филадельфия Балтимор Нью-Йорк Лондон Буэнос-Айрес Гонконг Сидней Токио: Уолтерс Клювер/Липпинкотт Уильямс и Уилкинс. ISBN 978-1-9751-4251-3 .
В широком смысле TLR 1, 2, 4–6 и 10 экспрессируются на плазматической мембране, а TLR 3, 7–9 и 11–13 ограничены эндосомами.
- ^ Перейти обратно: а б с Если в полях не указано иное, ссылка равна: Уолтенбо С., Доан Т., Мелволд Р., Визелли С. (2008). Иммунология . Иллюстрированные обзоры Липпинкотта. Филадельфия: Wolters Kluwer Health/Lippincott Williams & Wilkins. п. 17. ISBN 978-0-7817-9543-2 .
- ^ Перейти обратно: а б Сабро I, Дауэр С.К., Уайт М.К. (ноябрь 2005 г.). «Роль Toll-подобных рецепторов в регуляции миграции, активации и апоптоза нейтрофилов» . Клинические инфекционные болезни . 41 (Приложение 7): S421-6. дои : 10.1086/431992 . ПМИД 16237641 .
- ^ Перейти обратно: а б с д Саллюсто Ф, Ланзавеккья А (2002). «Поучительная роль дендритных клеток в ответах Т-клеток» . Исследования артрита . 4 (Приложение 3): С127-32. дои : 10.1186/ar567 . ПМК 3240143 . ПМИД 12110131 .
- ^ Герондакис С., Грумонт Р.Дж., Банерджи А. (2007). «Регуляция активации и выживания B-клеток в ответ на сигналы TLR» . Иммунология и клеточная биология . 85 (6): 471–5. дои : 10.1038/sj.icb.7100097 . ПМИД 17637697 . S2CID 30443009 .
- ^ Карио Э., Розенберг И.М., Брандвейн С.Л., Бек П.Л., Райнекер Х.К., Подольский Д.К. (январь 2000 г.). «Липополисахарид активирует различные сигнальные пути в линиях эпителиальных клеток кишечника, экспрессирующих Toll-подобные рецепторы» . Журнал иммунологии . 164 (2): 966–72. дои : 10.4049/jimmunol.164.2.966 . ПМИД 10623846 .
- ^ Пеана М., Здыб К., Медичи С., Пелучелли А., Симула Г., Гумиенна-Контецка Е., Зородду М.А. (декабрь 2017 г.). «Взаимодействие Ni (II) с пептидной моделью эктодомена TLR4 человека». Журнал микроэлементов в медицине и биологии . 44 : 151–160. дои : 10.1016/j.jtemb.2017.07.006 . ПМИД 28965571 .
- ^ Салазар Гонсалес Р.М., Шехата Х., О'Коннелл М.Дж., Ян Й., Морено-Фернандес М.Е., Шугнет К.А., Алиберти Дж. (2014). «Профилин, полученный из Toxoplasma gondii, запускает продукцию цитокинов, зависимую от толл-подобного рецептора 5 человека» . Журнал врожденного иммунитета . 6 (5): 685–94. дои : 10.1159/000362367 . ПМК 4141014 . ПМИД 24861338 .
- ^ Seizer L, Rahimi S, Santos-Sierra S, Drexel M (2022) Экспрессия толл-подобного рецептора 8 (TLR8) в определенных группах интернейронов гиппокампа мыши. PLoS ONE 17(5): e0267860. https://doi.org/10.1371/journal.pone.0267860
- ^ Гуань Ю, Раноа Д.Р., Цзян С., Мутха С.К., Ли Х, Бодри Дж., Таппинг Р.И. (май 2010 г.). «Человеческие TLR 10 и 1 имеют общие механизмы врожденного иммунного восприятия, но не передачи сигналов» . Журнал иммунологии . 184 (9): 5094–103. doi : 10.4049/jimmunol.0901888 . ПМИД 20348427 .
- ^ Чуанг Т., Улевич Р.Дж. (март 2001 г.). «Идентификация hTLR10: нового человеческого Toll-подобного рецептора, преимущественно экспрессируемого в иммунных клетках». Biochimica et Biophysical Acta (BBA) – Структура и экспрессия генов . 1518 (1–2): 157–61. дои : 10.1016/s0167-4781(00)00289-x . ПМИД 11267672 .
- ^ Хорнунг В., Ротенфуссер С., Бритш С., Круг А., Ярсдёрфер Б., Гизе Т., Эндрес С., Хартманн Г. (май 2002 г.). «Количественная экспрессия мРНК toll-подобного рецептора 1-10 в клеточных субпопуляциях мононуклеарных клеток периферической крови человека и чувствительность к олигодезоксинуклеотидам CpG» . Журнал иммунологии . 168 (9). Балтимор, Мэриленд: 1950: 4531–7. дои : 10.4049/jimmunol.168.9.4531 . ПМИД 11970999 .
{{cite journal}}: CS1 maint: местоположение ( ссылка ) - ^ Перейти обратно: а б Риган Т., Нелли К., Кармоди Р., Хьюстон А., Шанахан Ф., Макшарри Дж., Бринт Э. (декабрь 2013 г.). «Идентификация TLR10 как ключевого медиатора воспалительной реакции на Listeria monocytogenes в эпителиальных клетках кишечника и макрофагах» . Журнал иммунологии . 191 (12): 6084–92. doi : 10.4049/jimmunol.1203245 . ПМИД 24198280 .
- ^ Яровинский Ф., Чжан Д., Андерсен Дж.Ф., Банненберг Г.Л., Серхан К.Н., Хайден М.С. и др. (июнь 2005 г.). «Активация TLR11 дендритных клеток профилиноподобным белком простейших» . Наука . 308 (5728): 1626–9. Бибкод : 2005Sci...308.1626Y . дои : 10.1126/science.1109893 . ПМИД 15860593 . S2CID 34165967 .
- ^ Пайфер Р., Бенсон А., Стердж Ч.Р., Яровинский Ф. (февраль 2011 г.). «UNC93B1 необходим для активации TLR11 и IL-12-зависимой устойчивости хозяина к Toxoplasma gondii» . Журнал биологической химии . 286 (5): 3307–14. дои : 10.1074/jbc.M110.171025 . ПМК 3030336 . ПМИД 21097503 .
- ^ Кобланский А.А., Янкович Д., О Х., Хиени С., Сунгнак В., Матур Р. и др. (январь 2013 г.). «Распознавание профилина Toll-подобным рецептором 12 имеет решающее значение для устойчивости хозяина к Toxoplasma gondii» . Иммунитет . 38 (1): 119–30. doi : 10.1016/j.immuni.2012.09.016 . ПМК 3601573 . ПМИД 23246311 .
- ^ Мишра Б.Б., Гундра УМ, Тил Дж.М. (декабрь 2008 г.). «Экспрессия и распределение Toll-подобных рецепторов 11-13 в головном мозге во время мышиного нейроцистицеркоза» . Журнал нейровоспаления . 5:53 . дои : 10.1186/1742-2094-5-53 . ПМЦ 2631477 . ПМИД 19077284 .
- ^ Ши З, Цай З, Санчес А, Чжан Т, Вэнь С, Ван Дж и др. (февраль 2011 г.). «Новый Toll-подобный рецептор, распознающий вирус везикулярного стоматита» . Журнал биологической химии . 286 (6): 4517–24. дои : 10.1074/jbc.M110.159590 . ПМК 3039399 . ПМИД 21131352 .
- ^ Ольденбург М., Крюгер А., Ферстл Р., Кауфман А., Нис Г., Зигмунд А. и др. (август 2012 г.). «TLR13 распознает бактериальную 23S рРНК, лишенную модификации, формирующей устойчивость к эритромицину». Наука . 337 (6098): 1111–5. Бибкод : 2012Sci...337.1111O . дои : 10.1126/science.1220363 . ПМИД 22821982 . S2CID 206540638 .
- ^ Хохрейн Х., Киршнинг С.Дж. (март 2013 г.). «Бактерии уклоняются от иммунного распознавания через TLR13 и связывания своей 23S рРНК антибиотиками MLS по тем же механизмам» . Онкоиммунология . 2 (3): e23141. дои : 10.4161/onci.23141 . ПМЦ 3661153 . ПМИД 23802068 .
- ^ Шрайбельт, Герти; Бенитес-Рибас, Даниэль; Шуурхейс, Данита; Ламбек, Аннешин Дж.А.; ван Хаут-Куйер, Маайке; Шафт, Нильс; Пунт, Корнелис Дж.А.; Фигдор, Карл Г.; Адема, Госс Дж.; де Врис, И. Иоланда М. (29 июля 2010 г.). «Обычно используемые профилактические вакцины в качестве альтернативы синтетически полученным лигандам TLR для созревания дендритных клеток, полученных из моноцитов» . Кровь . 116 (4): 564–574. дои : 10.1182/кровь-2009-11-251884 . hdl : 2066/89493 . ISSN 1528-0020 . ПМИД 20424184 .
- ^ Алейник, Марк; Свенссон-Арвелунд, Юдит; Панцулая, Гванца; Ким, Кристи; Роуз, Сэмюэл А.; Упадхьяй, Ранджан; Йеллин, Майкл; Марш, Генри; Орепер, Дэниел; Джунджхунвала, Сушит; Муссион, Кристин Карин; Мерад, Мириам; Браун, Брайан Д.; Броуди, Джошуа Д. (июль 2023 г.). «Агонисты рецепторов распознавания образов в вакцинах против патогенов опосредуют перекрестное праймирование противоопухолевых Т-клеток» . Журнал иммунотерапии рака . 11 (7): e007198. doi : 10.1136/jitc-2023-007198 . ISSN 2051-1426 . ПМЦ 10373699 . ПМИД 37487664 .
- ^ Хоэбе К., Ду Икс, Джорджель П., Янссен Э., Табета К., Ким СО и др. (август 2003 г.). «Идентификация Lps2 как ключевого преобразователя независимой от MyD88 передачи сигналов TIR». Природа . 424 (6950): 743–8. Бибкод : 2003Natur.424..743H . дои : 10.1038/nature01889 . ПМИД 12872135 . S2CID 15608748 .
- ^ Хемми Х., Такеучи О., Каваи Т., Кайшо Т., Сато С., Сандзё Х. и др. (декабрь 2000 г.). «Toll-подобный рецептор распознает бактериальную ДНК». Природа . 408 (6813): 740–5. Бибкод : 2000Natur.408..740H . дои : 10.1038/35047123 . ПМИД 11130078 . S2CID 4405163 .
- ^ Перейти обратно: а б с д Каваи Т., Акира С. (май 2010 г.). «Роль рецепторов распознавания образов во врожденном иммунитете: обновленная информация о Toll-подобных рецепторах» . Природная иммунология . 11 (5): 373–84. дои : 10.1038/ni.1863 . ПМИД 20404851 . S2CID 39414949 .
- ^ Шигеока А.А., Холшер Т.Д., Кинг А.Дж., Холл Ф.В., Киоссес В.Б., Тобиас П.С. и др. (май 2007 г.). «TLR2 конститутивно экспрессируется в почках и участвует в ишемическом повреждении почек как через MyD88-зависимый, так и через MyD88-независимый пути» . Журнал иммунологии . 178 (10): 6252–8. дои : 10.4049/jimmunol.178.10.6252 . ПМИД 17475853 .
- ^ Ямамото М., Сато С., Хемми Х., Уемацу С., Хосино К., Кайшо Т. и др. (ноябрь 2003 г.). «TRAM специфически участвует в MyD88-независимом сигнальном пути, опосредованном Toll-подобным рецептором 4». Природная иммунология . 4 (11): 1144–50. дои : 10.1038/ni986 . ПМИД 14556004 . S2CID 13016860 .
- ^ Ямамото М., Сато С., Хемми Х., Сандзё Х., Уемацу С., Кайшо Т. и др. (ноябрь 2002 г.). «Основная роль TIRAP в активации сигнального каскада, общего для TLR2 и TLR4». Природа . 420 (6913): 324–9. Бибкод : 2002Natur.420..324Y . дои : 10.1038/nature01182 . ПМИД 12447441 . S2CID 16163262 .
- ^ Питер Фрич (2004). Дерматология-венерология: Основы. Клиника. Атлас (на немецком языке). Берлин: Шпрингер. ISBN 3-540-00332-0 .
- ^ Роделл CB, Арлаукас С.П., Куккарезе М.Ф., Гаррис К.С., Ли Р., Ахмед М.С. и др. (август 2018 г.). «Нагруженные агонистами TLR7/8 наночастицы способствуют поляризации опухолеассоциированных макрофагов, что усиливает иммунотерапию рака» . Природная биомедицинская инженерия . 2 (8): 578–588. дои : 10.1038/s41551-018-0236-8 . ПМК 6192054 . ПМИД 31015631 .
- ^ Тусси Д.Н., Массари П. (апрель 2014 г.). «Иммунный адъювантный эффект молекулярно определенных лигандов толл-подобных рецепторов» . Вакцина . 2 (2): 323–53. doi : 10.3390/vaccines2020323 . ПМЦ 4494261 . ПМИД 26344622 .
- ^ Аударья, СД; Паттнаик, Б.; Саньял, А.; Мохапатра, Дж. К. (2017). «Уровни экспрессии рибонуклеиновой кислоты мессенджера рецептора 7 у молочных животных во время вспышки ящура» (PDF) . Бюллетень Буффало . 36 (3). Архивировано из оригинала (PDF) 28 апреля 2021 года.
- ^ Шавит Ю., Вольф Г., Гошен И., Лившиц Д., Йирмия Р. (май 2005 г.). «Интерлейкин-1 противодействует морфиновой анальгезии и лежит в основе толерантности к морфину». Боль . 115 (1–2): 50–9. дои : 10.1016/j.pain.2005.02.003 . ПМИД 15836969 . S2CID 7286123 .
- ^ Мохан С., Дэвис Р.Л., ДеСильва Ю., Стивенс К.В. (октябрь 2010 г.). «Двойная регуляция мю-опиоидных рецепторов в клетках нейробластомы SK-N-SH с помощью морфина и интерлейкина-1β: доказательства перекрестных помех между опиоидами и иммунитетом» . Журнал нейроиммунологии . 227 (1–2): 26–34. дои : 10.1016/j.jneuroim.2010.06.007 . ПМЦ 2942958 . ПМИД 20615556 .
- ^ Комацу Т., Сакурада С., Кацуяма С., Санаи К., Сакурада Т. (2009). Механизм аллодинии, вызываемой интратекально морфин-3-глюкуронидом у мышей . Международное обозрение нейробиологии. Том. 85. стр. 207–19. дои : 10.1016/S0074-7742(09)85016-2 . ISBN 9780123748935 . ПМИД 19607972 .
- ^ Льюис С.С., Хатчинсон М.Р., Резвани Н., Лорам Л.К., Чжан Й., Майер С.Ф., Райс К.К., Уоткинс Л.Р. (январь 2010 г.). «Доказательства того, что интратекальный морфин-3-глюкуронид может вызывать усиление боли через толл-подобный рецептор 4/MD-2 и интерлейкин-1бета» . Нейронаука . 165 (2): 569–83. doi : 10.1016/j.neuroscience.2009.10.011 . ПМК 2795035 . ПМИД 19833175 .
- ^ Драль С. (22 августа 2012 г.). «Малые молекулы нацелены на толл-подобные рецепторы» . Новости химии и техники .
- ^ Шен Ч., Цай Р.Ю., Ши М.С., Лин С.Л., Тай Ю.Х., Чиен К.С., Вонг К.С. (февраль 2011 г.). «Этанерцепт восстанавливает антиноцицептивный эффект морфина и подавляет нейровоспаление позвоночника у устойчивых к морфию крыс» . Анестезия и анальгезия . 112 (2): 454–9. дои : 10.1213/ANE.0b013e3182025b15 . ПМИД 21081778 . S2CID 12295407 .
- ^ Хук М.А., Уошберн С.Н., Морено Г., Воллер С.А., Пуга Д., Ли К.Х., Грау Дж.В. (февраль 2011 г.). «Антагонист рецептора IL-1 блокирует вызванное морфином замедление двигательного восстановления после травмы спинного мозга» . Мозг, поведение и иммунитет . 25 (2): 349–59. дои : 10.1016/j.bbi.2010.10.018 . ПМК 3025088 . ПМИД 20974246 .
- ^ Уоткинс Л.Р., Хатчинсон М.Р., Райс К.К., Майер С.Ф. (ноябрь 2009 г.). «Плата» от опиоид-индуцированной активации глии: повышение клинической эффективности опиоидов за счет воздействия на глию» . Тенденции в фармакологических науках . 30 (11): 581–91. дои : 10.1016/j.tips.2009.08.002 . ПМЦ 2783351 . ПМИД 19762094 .
- ^ Перейти обратно: а б Хатчинсон М.Р., Чжан Ю., Браун К., Коутс Б.Д., Шридхар М., Шолар П.В., Патель С.Дж., Крисдейл Нью-Йорк, Харрисон Дж.А., Майер С.Ф., Райс К.К., Уоткинс Л.Р. (июль 2008 г.). «Нестереоселективное устранение нейропатической боли налоксоном и налтрексоном: вовлечение toll-подобного рецептора 4 (TLR4)» . Европейский журнал неврологии . 28 (1): 20–9. дои : 10.1111/j.1460-9568.2008.06321.x . ПМК 2588470 . ПМИД 18662331 .
- ^ Хатчинсон М.Р., Коутс Б.Д., Льюис С.С., Чжан Ю., Спрунгер Д.Б., Резвани Н., Бейкер Э.М., Джекич Б.М., Визелер Дж.Л., Сомоджи А.А., Мартин Д., Пул С., Джадд К.М., Майер С.Ф., Уоткинс Л.Р. (ноябрь 2008 г.). «Провоспалительные цитокины противодействуют острой и хронической анальгезии, вызванной опиоидами» . Мозг, поведение и иммунитет . 22 (8): 1178–89. дои : 10.1016/j.bbi.2008.05.004 . ПМЦ 2783238 . ПМИД 18599265 .
- ^ Хатчинсон М.Р., Льюис С.С., Коутс Б.Д., Резвани Н., Чжан Й., Визелер Дж.Л., Сомоги А.А., Инь Х., Майер С.Ф., Райс К.К., Уоткинс Л.Р. (май 2010 г.). «Возможное участие в активности толл-подобного рецептора 4/миелоидного фактора дифференцировки-2 неактивных изомеров опиоидов вызывает провоспаление позвоночника и связанные с ним поведенческие последствия» . Нейронаука . 167 (3): 880–93. doi : 10.1016/j.neuroscience.2010.02.011 . ПМЦ 2854318 . ПМИД 20178837 .
- ^ Хашимото С., Хадсон К.Л., Андерсон К.В. (январь 1988 г.). «Ген Toll дрозофилы, необходимый для дорсально-вентральной эмбриональной полярности, по-видимому, кодирует трансмембранный белок». Клетка . 52 (2): 269–79. дои : 10.1016/0092-8674(88)90516-8 . ПМИД 2449285 . S2CID 19439405 .
- ^ Номура Н., Миядзима Н., Сазука Т., Танака А., Каварабаяси Ю., Сато С. и др. (1994). «Прогнозирование кодирующих последовательностей неопознанных генов человека. I. Кодирующие последовательности 40 новых генов (KIAA0001-KIAA0040), полученные путем анализа случайно выбранных клонов кДНК из линии незрелых миелоидных клеток человека KG-1» . Исследование ДНК . 1 (1): 27–35. дои : 10.1093/dnares/1.1.27 . ПМИД 7584026 .
- ^ Тагучи Т., Митчем Дж.Л., Дауэр С.К., Симс Дж.Э., Теста Дж.Р. (март 1996 г.). «Хромосомная локализация TIL, гена, кодирующего белок, родственный трансмембранному рецептору Toll дрозофилы, на хромосоме 4p14 человека». Геномика . 32 (3): 486–8. дои : 10.1006/geno.1996.0150 . ПМИД 8838819 .
- ^ Гей, Нью-Джерси, Кейт Ф.Дж. (май 1991 г.). «Дрозофила Toll и рецептор IL-1». Природа . 351 (6325): 355–6. Бибкод : 1991Natur.351..355G . дои : 10.1038/351355b0 . ПМИД 1851964 . S2CID 1700458 .
- ^ Полторак А., Хе Х, Смирнова И., Лю М.Ю., Ван Хаффель С., Ду Х. и др. (декабрь 1998 г.). «Дефектная передача сигналов LPS у мышей C3H/HeJ и C57BL/10ScCr: мутации в гене Tlr4». Наука . 282 (5396): 2085–8. Бибкод : 1998Sci...282.2085P . дои : 10.1126/science.282.5396.2085 . ПМИД 9851930 .
- ^ Хосино К., Такеучи О., Каваи Т., Сандзё Х., Огава Т., Такеда Ю. и др. (апрель 1999 г.). «Авангард: мыши с дефицитом Toll-подобного рецептора 4 (TLR4) гипочувствительны к липополисахариду: доказательства того, что TLR4 является продуктом гена Lps» . Журнал иммунологии . 162 (7): 3749–52. дои : 10.4049/jimmunol.162.7.3749 . ПМИД 10201887 . S2CID 7419784 .
- ^ Сонг В.И., Ван Г.Л., Чен Л.Л., Ким Х.С., Пи Л.И., Хольстен Т. и др. (декабрь 1995 г.). «Рецепторно-киназоподобный белок, кодируемый геном устойчивости риса к болезням Xa21» . Наука . 270 (5243): 1804–6. Бибкод : 1995Sci...270.1804S . дои : 10.1126/science.270.5243.1804 . ПМИД 8525370 . S2CID 10548988 .
- ^ Гомес-Гомес Л., Боллер Т. (июнь 2000 г.). «FLS2: киназа, подобная рецептору LRR, участвующая в восприятии бактериального элиситорного флагеллина у Arabidopsis» . Молекулярная клетка . 5 (6): 1003–11. дои : 10.1016/S1097-2765(00)80265-8 . ПМИД 10911994 .
- ^ «Нобелевская премия по физиологии и медицине 2011 года» . Нобель Медиа АБ . 3 октября 2011 г.
- ^ Митчелл Б. (23 марта 2011 г.). «Врач из Британской Колумбии получил престижную медицинскую премию» . Звезда .
См. также
[ редактировать ]Внешние ссылки
[ редактировать ]- Toll-подобные + рецепторы в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- Toll + белок, + Drosophila в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- TollML: база данных Toll-подобных рецепторов и лигандов . Мюнхенского университета
- Семейство Toll-подобных рецепторов рецепторов врожденного иммунитета (pdf)
- Путь Toll-подобного рецептора
- Бионаучные анимации