Аллодиния
| Аллодиния | |
|---|---|
 | |
| Специальность | Неврология |
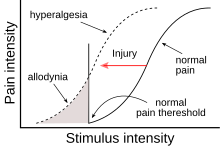
Аллодиния – это состояние, при котором боль вызывается раздражителем , который в норме не вызывает боли. [1] Например, солнечный ожог может вызвать временную аллодинию, поэтому обычно безболезненные раздражители, такие как ношение одежды или обливание холодной или теплой водой, могут быть очень болезненными. Это отличается от гипералгезии , преувеличенной реакции на обычно болевой раздражитель. Этот термин происходит от древнегреческого άλλος (állos) «другой» и οδύνη (odúnē) «боль».
Типы
[ редактировать ]Существуют различные виды или типы аллодинии:
- Механическая аллодиния (также известная как тактильная аллодиния)
- Термическая (горячая или холодная) аллодиния – боль от обычно легкой температуры кожи в пораженной области.
- Движительная аллодиния – боль, вызванная нормальным движением суставов или мышц.
Причины
[ редактировать ]Аллодиния является клиническим признаком многих болезненных состояний, таких как невропатии , [4] комплексный регионарный болевой синдром , постгерпетическая невралгия , фибромиалгия и мигрень . Аллодиния также может быть вызвана некоторыми популяциями стволовых клеток, используемых для лечения повреждений нервов, включая травмы спинного мозга . [5]
Патофизиология
[ редактировать ]Клеточный уровень
[ редактировать ]Механорецепторы могут влиять на продукцию ноцицепторов, устанавливая связи с теми же интернейронами , активация которых может уменьшить или устранить ощущение боли. Другой способ модулировать передачу болевой информации — через нисходящие волокна мозга. Эти волокна действуют через разные интернейроны, блокируя передачу информации от ноцицепторов к вторичным нейронам. [6]
Оба эти механизма модуляции боли вовлечены в патологию аллодинии. Некоторые исследования показывают, что повреждение спинного мозга может привести к потере и реорганизации ноцицепторов, механорецепторов и интернейронов, что приводит к передаче болевой информации механорецепторами. [7] [8] Другое исследование сообщает о появлении нисходящих волокон в месте травмы. [9] Все эти изменения в конечном итоге влияют на схемы внутри спинного мозга, и измененный баланс сигналов, вероятно, приводит к интенсивному ощущению боли, связанному с аллодинией.
Различные типы клеток также связаны с аллодинией. Например, есть сообщения о том, что микроглия таламуса может способствовать аллодинии, изменяя свойства вторичных ноцицепторов. [10] Тот же эффект достигается в спинном мозге за счет привлечения клеток иммунной системы, таких как моноциты / макрофаги и Т-лимфоциты . [11]
Молекулярный уровень
[ редактировать ]Имеются убедительные доказательства того, что возникновению аллодинии способствует так ЦНС . называемая сенсибилизация Сенсибилизация означает повышенную реакцию нейронов после повторяющейся стимуляции. Помимо повторяющейся активности, повышенные уровни некоторых соединенийпривести к сенсибилизации. Работа многих исследователей привела к выяснению путей, которые могут привести к сенсибилизации нейронов как в таламусе, так и в задних рогах. Оба пути зависят от продукции хемокинов и других молекул, важных для воспалительной реакции. [ нужна ссылка ]
Важной молекулой в таламусе, по-видимому, является цистеин-цистеиновый хемокиновый лиганд 21 (CCL21). Концентрация этого хемокина увеличивается в вентральном заднелатеральном ядре таламуса, где вторичные ноцицептивные нейроны устанавливают связи с другими нейронами. Источник CCL21 точно неизвестен, но существуют две возможности. Во-первых, он может вырабатываться в первичных ноцицептивных нейронах и транспортироваться в таламус. Скорее всего, по крайней мере часть его составляют нейроны, присущие вентральному заднелатеральному ядру. [10] В любом случае CCL21 связывается с рецепторами хемокинов CC 7 типа хемокинов CXCR3 и рецепторами на микроглии таламуса. [12] Физиологической реакцией на связывание, вероятно, является продукция простагландина Е 2 (PGE 2 ) циклооксигеназой 2 (ЦОГ-2). [13] Активированная микроглия, вырабатывающая PGE 2, может затем сенсибилизировать ноцицептивные нейроны, что проявляется в их пониженном болевом пороге. [14]
Механизм сенсибилизации ЦНС на уровне спинного мозга иной, чем в таламусе. Фактор некроза опухоли-альфа (TNF-альфа) и его рецептор являются молекулами, которые, по-видимому, ответственны за сенсибилизацию нейронов в дорсальных рогах спинного мозга. Макрофаги и лимфоциты проникают в спинной мозг, например, из-за травмы, и выделяют TNF-альфа и другие провоспалительные молекулы. [15] Затем TNF-альфа связывается с рецепторами TNF, экспрессируемыми на ноцицепторах, активируя MAPK / NF-каппа B. пути Это приводит к выработке большего количества TNF-альфа, его высвобождению и связыванию с рецепторами на клетках, которые его высвободили ( аутокринная передача сигналов ). [11] Этот механизм также объясняет сохранение сенсибилизации и, следовательно, аллодинии. TNF-альфа может также увеличивать количество АМРА-рецепторов и уменьшать количество ГАМК-рецепторов на мембране ноцицепторов, оба из которых могут изменить ноцицепторы таким образом, чтобы облегчить их активацию. [16] Другим результатом повышения уровня TNF-альфа является высвобождение PGE2 , механизм и эффект которого аналогичен таковому в таламусе. [17]
Уход
[ редактировать ]Лекарства
[ редактировать ]Многочисленные соединения облегчают боль от аллодинии. Некоторые из них специфичны для определенных типов аллодинии, а другие являются общими. Они включают в себя: [18]
- Динамическая механическая аллодиния – соединения, воздействующие на разные ионные каналы ; опиоиды
- Мексиканский
- Лидокаин (в/в/местно)
- Трамадол
- Морфин (IV)
- Альфентанил (IV)
- Кетамин (IV)
- Метилпреднизолон ( интратекально )
- Аденозин
- глицина Антагонист
- Дезипрамин
- Венлафаксин
- Прегабалин
- Статическая механическая аллодиния – блокаторы натриевых каналов , опиоиды
- Лидокаин (IV)
- Альфентанил (IV)
- Аденозин (IV)
- Кетамин (IV)
- Антагонист глицина
- Венлафаксин
- Габапентин (также может быть полезен при холодовых и динамических аллодиниях)
- Холодная аллодиния
- Ламотриджин
- Лидокаин (IV)
Список соединений, которые можно использовать для лечения аллодинии, еще длиннее. Например, многие нестероидные противовоспалительные препараты , такие как напроксен , могут ингибировать ЦОГ-1 и/или ЦОГ-2, предотвращая тем самым сенсибилизацию центральной нервной системы. Другим эффектом напроксена является снижение реакции механо- и терморецепторов на раздражители. [19]
Другие соединения действуют на молекулы, важные для передачи потенциала действия от одного нейрона к другому. Примеры этого включают вмешательство в рецепторы нейротрансмиттеров или ферменты , которые удаляют нейротрансмиттеры, не связанные с рецепторами.
Эндоканнабиноиды — это молекулы, которые могут облегчить боль, модулируя ноцицептивные нейроны. Когда анандамид , эндоканнабиноид , высвобождается, болевые ощущения уменьшаются. Позже анандамид транспортируется обратно к нейронам, высвобождая его с помощью ферментов-переносчиков на плазматической мембране , что в конечном итоге приводит к подавлению восприятия боли. Однако этот обратный захват может блокироваться AM404 , что увеличивает продолжительность подавления боли. [20]
Известные люди
[ редактировать ]- Говард Хьюз Считается, что в последние годы жизни страдал аллодинией; он редко мылся, носил одежду и редко стриг ногти и волосы, возможно, из-за боли, которую причиняли ему эти обычно нормальные действия. [21]
Ссылки
[ редактировать ]- ^ Он, Юси; Ким, Пегги Ю. (2020), «Allodynia» , StatPearls , StatPearls Publishing, PMID 30725814 , получено 4 марта 2020 г.
- ^ Атталь Н., Брассер Л., Шовен М., Буассира Д. (1999). «Влияние однократного и повторного применения крема эвтектической смеси местных анестетиков (ЭМЛА) на спонтанную и вызванную боль при постгерпетической невралгии». Боль . 81 (1–2): 203–9. дои : 10.1016/S0304-3959(99)00014-7 . ПМИД 10353509 . S2CID 1822523 .
- ^ ЛоПинто С., Янг ВБ, Ашкенази А (2006). «Сравнение динамической (кисть) и статической (надавливание) механической аллодинии при мигрени» . Цефалгия . 26 (7): 852–6. дои : 10.1111/j.1468-2982.2006.01121.x . ПМИД 16776701 . S2CID 9163847 .
- ^ Ландерхольм, А. (2010). Нейропатическая боль: соматосенсорные функции, связанные со спонтанной продолжающейся болью, механической аллодинией и облегчением боли. Диссертация. Стокгольм: Каролинский институт http://diss.kib.ki.se/2010/978-91-7457-025-0/thesis.pdf
- ^ Хофстеттер К.П., Хольмстрём Н.А., Лиля Дж.А. (март 2005 г.). «Аллодиния ограничивает полезность интраспинальных трансплантатов нервных стволовых клеток; направленная дифференцировка улучшает результат». Природная неврология . 8 (3): 346–53. дои : 10.1038/nn1405 . HDL : 10616/38300 . ПМИД 15711542 . S2CID 22387113 .
- ^ Фитцпатрик, Дэвид; Первс, Дейл; Августин, Джордж (2004). Нейронаука . Сандерленд, Массачусетс: Синауэр. стр. 231–250 . ISBN 978-0-87893-725-7 .
- ^ Васнер Г., Налещинский Д., Барон Р. (2007). «Роль периферических афферентов в патофизиологии и лечении нейропатической боли на уровне спинного мозга? Отчет о случае». Боль . 131 (1–2): 219–25. дои : 10.1016/j.pain.2007.03.005 . ПМИД 17509762 . S2CID 22331115 .
- ^ Езерский Р.П., Лю С., Руенес Г.Л., Каяндер К.Дж., Брюэр К.Л. (1998). «Экситотоксическое повреждение спинного мозга: поведенческие и морфологические характеристики модели центральной боли». Боль . 75 (1): 141–55. дои : 10.1016/S0304-3959(97)00216-9 . ПМИД 9539683 . S2CID 28700511 .
- ^ Калус А., Осборн П.Б., Кист-младший (2007). «Острые и хронические изменения иннервации дорсальных рогов первичными афферентами и нисходящими супраспинальными путями после травмы спинного мозга». Дж. Комп. Нейрол . 504 (3): 238–53. дои : 10.1002/cne.21412 . ПМИД 17640046 . S2CID 37627042 .
- ^ Jump up to: а б Чжао П., Ваксман С.Г., Хайнс BC (2007). «Модуляция таламической ноцицептивной обработки после травмы спинного мозга посредством удаленной активации таламической микроглии с помощью цистеинового цистеинового хемокинового лиганда 21» . Дж. Нейроски . 27 (33): 8893–902. doi : 10.1523/JNEUROSCI.2209-07.2007 . ПМК 6672166 . ПМИД 17699671 .
- ^ Jump up to: а б Вэй XH, Занг Ю, Ву CY, Сюй JT, Синь WJ, Лю XG (2007). «Перишиатическое введение рекомбинантного крысиного TNF-альфа вызывает механическую аллодинию за счет повышения регуляции TNF-альфа в ганглиях дорсальных корешков и в дорсальных рогах спинного мозга: роль пути NF-каппа B». Эксп. Нейрол . 205 (2): 471–84. doi : 10.1016/j.expneurol.2007.03.012 . ПМИД 17459378 . S2CID 54415092 .
- ^ Дейкстра И.М., де Хаас А.Х., Брауэр Н., Боддеке Х.В., Бибер К. (2006). «Провокация врожденными и белковыми антигенами индуцирует экспрессию CCR7 микроглией in vitro и in vivo» . Глия . 54 (8): 861–72. дои : 10.1002/glia.20426 . ПМИД 16977602 . S2CID 24110610 .
- ^ Алике М., Эрреро Х.Ф., Лусио-Казана Ф.Д. (2007). «Полностью транс-ретиноевая кислота индуцирует синтез ЦОГ-2 и простагландина E2 в клетках нейробластомы человека SH-SY5Y: участие рецепторов ретиноевой кислоты и внеклеточно-регулируемой киназы 1/2» . J Нейровоспаление . 4 :1. дои : 10.1186/1742-2094-4-1 . ПМК 1769480 . ПМИД 17204142 .
- ^ Руквид Р., Чиж Б.А., Лоренц У (2007). «Потенцирование ноцицептивных ответов на инъекции простагландина Е2 с низким pH у людей» . Джей Пейн . 8 (5): 443–51. дои : 10.1016/j.jpain.2006.12.004 . ПМИД 17337250 .
- ^ Хаско Г., Пачер П., Дейч Э.А., Визи Э.С. (2007). «Формирование функции моноцитов и макрофагов аденозиновыми рецепторами» . Фармакол. Там . 113 (2): 264–75. doi : 10.1016/j.pharmthera.2006.08.003 . ПМК 2228265 . ПМИД 17056121 .
- ^ Stellwagen D, Beattie EC, Seo JY, Malenka RC (2005). «Дифференциальная регуляция трафика рецепторов AMPA и рецепторов GABA с помощью фактора некроза опухоли-альфа» . Дж. Нейроски . 25 (12): 3219–28. doi : 10.1523/JNEUROSCI.4486-04.2005 . ПМК 6725093 . ПМИД 15788779 .
- ^ Куто А., Адам Ф., Виллер Дж.К., Ле Барс Д. (2005). «Гипералгезия и аллодиния: периферические механизмы». Суставные кости позвоночника . 72 (5): 359–71. дои : 10.1016/j.jbspin.2004.01.010 . ПМИД 16214069 .
- ^ Гранот Р., Дэй Р.О., Коэн М.Л., Мернион Б., Гаррик Р. (2007). «Таргетная фармакотерапия вызванных явлений при нейропатической боли: обзор современных данных» . Боль Мед . 8 (1): 48–64. дои : 10.1111/j.1526-4637.2007.00156.x . ПМИД 17244104 .
- ^ Якубовский М., Леви Д., Кайнц В., Чжан XC, Косарас Б., Бурштейн Р. (2007). «Сенсибилизация центральных тригеминоваскулярных нейронов: блокада внутривенным введением напроксена» . Нейронаука . 148 (2): 573–83. doi : 10.1016/j.neuroscience.2007.04.064 . ПМК 2710388 . ПМИД 17651900 .
- ^ Хушманд, Хушанг (1993). Хроническая боль: профилактика и лечение рефлекторной симпатической дистрофии . Бока-Ратон, Флорида: CRC Press LLC. п. 44 . ISBN 978-0-8493-8667-1 .
- ^ Теннант, Форест (июль – август 2007 г.). «Говард Хьюз и псевдозависимость» (PDF) . Практическое управление болью . 6 (7). Монтклер, Нью-Джерси: PPM Communications, Inc.: 12–29. Архивировано из оригинала (PDF) 25 сентября 2007 года . Проверено 7 января 2011 г.