Интегральный мембранный белок
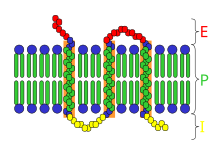
Интегральный . , или внутренний , мембранный белок ( IMP ) [1] представляет собой тип мембранного белка , который постоянно прикреплен к биологической мембране . Все трансмембранные белки можно отнести к ИМФ, но не все ИМФ являются трансмембранными белками. [2] организма ИМФ составляют значительную часть белков, закодированных в геноме . [3] Белки , пересекающие мембрану, окружены кольцевыми липидами , которые определяются как липиды, находящиеся в непосредственном контакте с мембранным белком. Такие белки можно отделить от мембран только с помощью детергентов , неполярных растворителей или иногда денатурирующих агентов.
Белки, которые лишь временно прикрепляются к клеточным мембранам, известны как белки периферических мембран . Эти белки могут либо ассоциироваться с интегральными мембранными белками, либо независимо встраиваться в липидный бислой несколькими способами.
Структура
[ редактировать ]Трехмерные структуры примерно 160 различных интегральных мембранных белков были определены с атомным разрешением методами рентгеновской кристаллографии или ядерного магнитного резонанса спектроскопии . Они являются сложными объектами для изучения из-за трудностей, связанных с экстракцией и кристаллизацией . Кроме того, белковых доступны структуры многих водорастворимых доменов IMP в Банке данных белков . Их прикрепленные к мембране α-спирали были удалены, чтобы облегчить экстракцию и кристаллизацию . Поиск интегральных мембранных белков в PDB (на основе классификации онтологии генов )
ИМП можно разделить на две группы:
- Интегральные политопные белки (Трансмембранные белки)
- Интегральные монотопные белки
Интегральный политопный белок
[ редактировать ]Наиболее распространенным типом ИМФ является трансмембранный белок , охватывающий всю биологическую мембрану . Однопроходные мембранные белки пересекают мембрану только один раз, тогда как многопроходные мембранные белки вплетаются и выходят, пересекая мембрану несколько раз. Однопроходные мембранные белки можно отнести к типу I, которые расположены так, что их карбоксильный конец обращен к цитозолю , или к типу II, у которого аминоконец обращен к цитозолю. Белки типа III имеют несколько трансмембранных доменов в одном полипептиде, тогда как тип IV состоит из нескольких разных полипептидов, собранных вместе в канале через мембрану. Белки типа V прикреплены к липидному бислою посредством ковалентно связанных липидов. Наконец, белки типа VI имеют как трансмембранные домены, так и липидные якоря. [4]
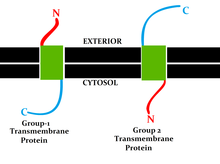
Интегральные монотопные белки
[ редактировать ]Интегральные монотопные белки связаны с мембраной с одной стороны, но не охватывают полностью липидный бислой.
Добыча
[ редактировать ]Многие проблемы, стоящие перед изучением интегральных мембранных белков, связаны с экстракцией этих белков из фосфолипидного бислоя . Поскольку интегральные белки охватывают всю ширину фосфолипидного бислоя, их экстракция включает разрушение окружающих их фосфолипидов , не вызывая каких-либо повреждений, которые могли бы нарушить функцию или структуру белков. Доступно несколько успешных методов экстракции, включая использование «моющих средств, низкоионной соли (высаливание), силы сдвига и быстрого изменения давления». [5]
Определение структуры белка
[ редактировать ]Инициатива по структуре белка (PSI), финансируемая Национальным институтом общих медицинских наук США (NIGMS), входящим в состав Национальных институтов здравоохранения (NIH), имеет среди своих целей определение трехмерных белковых структур и разработку методов их использования. в структурной биологии , в том числе для мембранных белков. Моделирование гомологии можно использовать для построения модели «целевого» интегрального белка с атомным разрешением на основе его аминокислотной последовательности и экспериментальной трехмерной структуры родственного гомологичного белка. Эта процедура широко использовалась для рецепторов, связанных с лигандом - G-белком (GPCR) и их комплексов. [6]
Функция
[ редактировать ]IMP включают транспортеры , линкеры, каналы , рецепторы , ферменты , структурные домены, закрепляющиеся на мембране, белки, участвующие в накоплении и , и передаче энергии белки, ответственные за клеточную адгезию . Классификацию транспортеров можно найти в базе данных классификации транспортеров . [7]
В качестве примера взаимосвязи между ИМФ (в данном случае бактериальным фотоулавливающим пигментом бактериородопсином) и мембраной, образованной фосфолипидным бислоем, проиллюстрирован ниже. В этом случае интегральный мембранный белок семь раз охватывает фосфолипидный бислой. Часть белка, встроенная в гидрофобные области бислоя, является альфа-спиральной и состоит преимущественно из гидрофобных аминокислот. С-концевой конец белка находится в цитозоле, а N-концевой участок — снаружи клетки. Мембрана, содержащая этот конкретный белок, способна функционировать в фотосинтезе. [8]
Примеры
[ редактировать ]Примеры интегральных мембранных белков:
- Рецептор инсулина
- Некоторые типы клеточной адгезии белков или молекул клеточной адгезии (CAM), такие как интегрины , кадгерины , NCAM или селектины.
- Некоторые типы рецепторных белков
- Гликофорин
- Родопсин
- Группа 3
- CD36
- Глюкоза пермеаза
- Ионные каналы и ворота
- щелевых соединений Белки
- Рецепторы, связанные с G-белком (например, бета-адренергический рецептор )
- Мыло
- Фотосистема I [9]
См. также
[ редактировать ]- Мембранный белок
- Трансмембранный белок
- Периферический мембранный белок
- Кольцевая липидная оболочка
- График гидрофильности
- Белок внутренней ядерной мембраны
Ссылки
[ редактировать ]- ^ «внутренний белок | биология» . Британника . Проверено 4 июля 2022 г.
- ^ Стивен Р. Гудман (2008). Медицинская клеточная биология . Академическая пресса. стр. 37–. ISBN 978-0-12-370458-0 . Проверено 24 ноября 2010 г.
- ^ Валлин Э., фон Хейне Г. (1998). «Полногеномный анализ интегральных мембранных белков эубактериальных, архейных и эукариотических организмов» . Белковая наука . 7 (4): 1029–38. дои : 10.1002/pro.5560070420 . ПМК 2143985 . ПМИД 9568909 .
- ^ Нельсон, Д.Л., и Кокс, М.М. (2008). Принципы биохимии (5-е изд., стр. 377). Нью-Йорк, штат Нью-Йорк: WH Freeman and Company.
- ^ Муинао, Тингрейла; Пал, Минту; Боруа, Хари Прасанна Дека (2018). «Методы цитозольной и трансмембранной экстракции белка из клеток рака молочной железы и яичников: сравнительное исследование» . Журнал биомолекулярных методов . 29 (3): 71–78. дои : 10.7171/jbt.18-2903-002 . ISSN 1524-0215 . ПМК 6091320 . ПМИД 30174558 .
- ^ Фрюшар-Маркер С, Фрюшар-Гайяр С, Летелье Г, Маркон Е, Мурье Г, Зинн-Жюстин С, Менез А, Сервент Д, Жилкин Б (сентябрь 2011 г.). «Структурная модель комплекса рецептора, связанного с белком лиганд-G (GPCR), основанная на экспериментальных данных двойного мутантного цикла: змеиный токсин MT7, связанный с димерным мускариновым рецептором hM1» . J Биол Хим . 286 (36): 31661–75. дои : 10.1074/jbc.M111.261404 . ПМК 3173127 . ПМИД 21685390 .
- ^ Сайер М.Х., Йен М.Р., Ното К., Таманг Д.Г., Элкан С. (январь 2009 г.). «База данных классификации транспортеров: последние достижения» . Нуклеиновые кислоты Рез . 37 (Проблема с базой данных): D274–8. дои : 10.1093/нар/gkn862 . ПМЦ 2686586 . ПМИД 19022853 .
- ^ «Интегральные мембранные белки» . Academic.brooklyn.cuny.edu . Архивировано из оригинала 1 февраля 2015 года . Проверено 29 января 2015 г.
- ^ Гольбек, Дж. Х. (1987). «Структура, функции и организация комплекса реакционного центра Фотосистема I» . Biochimica et Biophysica Acta (BBA) - Обзоры по биоэнергетике . 895 (3): 167–204. дои : 10.1016/s0304-4173(87)80002-2 . ПМИД 3333014 .