Рак яичников
| Рак яичников | |
|---|---|
 | |
| Микрофотография карциномы муцинового яичника, окрашенная H & E | |
| Специальность | Онкология , гинекология |
| Симптомы | Раннее : смутный [ 1 ] Позднее : вздутие живота , боль в тазовом точке , запоры , набухание живота, потеря аппетита [ 1 ] |
| Обычное начало | Обычный возраст диагноза 63 года [ 2 ] |
| Типы |
|
| Факторы риска | Никогда не иметь детей , гормональная терапия после менопаузы , лекарства от фертильности , ожирение , генетика [ 4 ] [ 5 ] [ 6 ] |
| Диагностический метод | Тканевая биопсия [ 1 ] |
| Уход | Хирургия, лучевая терапия , химиотерапия [ 1 ] |
| Прогноз | Пятилетняя выживаемость c. 49% (США) [ 7 ] |
| Частота | 1,2 миллиона (2015) [ 8 ] |
| Летальные исходы | 161,100 (2015) [ 9 ] |
Рак является раковой опухолью яичника . яичников [ 10 ] Он может происходить из самого яичника или чаще из -за передачи близлежащих структур, таких как фаллопиевые трубки или внутреннюю слизистую оболочку живота . [ 3 ] [ 11 ] Яичник состоит из трех различных типов клеток, включая эпителиальные клетки, зародышевые клетки и стромальные клетки. [ 12 ] Когда эти клетки становятся ненормальными, они обладают способностью разделять и образовывать опухоли. Эти клетки также могут вторгаться или распространяться на другие части тела. [ 13 ] Когда этот процесс начинается, может быть никаких или только расплывчатых симптомов. [ 1 ] Симптомы становятся более заметными по мере развития рака. [ 1 ] [ 14 ] Эти симптомы могут включать вздутие живота , влагалищное кровотечение, боль в таза , а также набухание в животе , запоры и потерю аппетита . [ 1 ] Общие зоны, на которые может распространяться рак, включают в себя слизистую оболочку живота , лимфатические узлы , легкие и печень . [ 15 ]
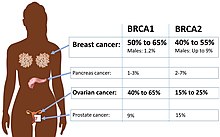
Риск рака яичников увеличивается с возрастом. Большинство случаев рака яичников развивается после менопаузы. [ 16 ] Это также чаще встречается у женщин, у которых овулировали больше на протяжении всей своей жизни. [ 17 ] Это включает в себя тех, у кого никогда не было детей , тех, кто начал овуляцию в более молодом возрасте, и тех, кто достигает менопаузы в старшем возрасте. [ 5 ] Другие факторы риска включают гормональную терапию после менопаузы , лекарства от фертильности и ожирение . [ 4 ] [ 6 ] Факторы, которые снижают риск, включают в себя гормональный контроль над рождаемостью , перевязку труб , беременность и кормление груди . [ 6 ] Около 10% случаев связаны с наследственным генетическим риском; Женщины с мутациями в генах BRCA1 или BRCA2 имеют около 50% вероятность развития заболевания. [ 5 ] Некоторые синдромы рака семьи, такие как наследственный неполипоз рак толстой кишки и синдром Пьюц-Джегера, также увеличивают риск развития рака яичников. [ 16 ] Эпителиальная карцинома яичника является наиболее распространенным типом рака яичников, составляющий более 95% случаев. [ 5 ] Существует пять основных подтипов карциномы яичника, наиболее распространенной наиболее распространенной высококлассной серозной карциномы (HGSC). [ 5 ] Менее распространенные типы рака яичников включают опухоли зародышевых клеток [ 18 ] и секс -шнурные стромальные опухоли . [ 5 ] Диагноз рака яичников подтверждается с помощью биопсии ткани, обычно удаляемой во время операции. [ 1 ]
Скрининг не рекомендуется у женщин с средним риском, поскольку доказательства не подтверждают снижение смерти, и высокий уровень ложных положительных тестов может привести к ненужной операции, что сопровождается его собственными рисками. [ 19 ] Те, кто с очень высоким риском может удалить свои яичники в качестве профилактической меры. [ 4 ] Если он поймал и лечится на ранней стадии, рак яичников часто излечим. [ 1 ] Лечение обычно включает в себя некоторую комбинацию хирургии, лучевой терапии и химиотерапии . [ 1 ] Результаты зависят от степени заболевания, подтипа присутствующего рака и других заболеваний. [ 5 ] [ 20 ] Общая пятилетняя выживаемость в Соединенных Штатах составляет 49%. [ 7 ] Результаты хуже в развивающемся мире. [ 5 ]
В 2020 году новые случаи произошли примерно у 313 000 женщин. [ 21 ] В 2019 году в Соединенных Штатах это привело к 13 445 смертям. [ 22 ] Смерть от рака яичников увеличилась во всем мире в период с 1990 по 2017 год на 84,2%. [ 23 ] Рак яичников является вторым самым распространенным гинекологическим раком в Соединенных Штатах. Это вызывает больше смертей, чем любой другой рак женской репродуктивной системы. [ 24 ] Среди женщин он занимает пятое место по смерти, связанной с раком. [ 25 ] Типичный возраст диагноза составляет 63. [ 2 ] Смерть от рака яичников чаще встречается в Северной Америке и Европе, чем в Африке и Азии. [ 5 ] В Соединенных Штатах это чаще встречается у белых и латиноамериканских женщин, чем у чернокожих или американских индейцев. [ 22 ]
Признаки и симптомы
[ редактировать ]Ранние симптомы
[ редактировать ]
Ранние признаки и симптомы рака яичников могут отсутствовать или тонкий. В большинстве случаев симптомы существуют в течение нескольких месяцев, прежде чем их распознавать и диагностировать . [ 26 ] [ 27 ] Симптомы часто могут быть неправильно диагностированы как синдром раздражительного кишечника . [ 28 ] Ранние стадии рака яичников, как правило, безболезнены, что затрудняет обнаружение его на ранней стадии. Симптомы могут варьироваться в зависимости от подтипа. [ 26 ] яичников Опухоли пограничных , также известные как опухоли яичников с низким содержанием злокачественного потенциала (LMP), не вызывают повышения уровня CA125 и не идентифицируются с помощью ультразвука. Типичные симптомы опухоли LMP могут включать в себя растяжение в животе или боль в области таза. Особенно большие массы имеют тенденцию быть доброкачественными или пограничными. [ 29 ] [ 26 ]
Наиболее типичные симптомы рака яичников включают , таза или дискомфорт, боль в постменопаузальное , влагалищное боль менструацию кровотечение живота вздутие боль спине в животе или , кровоточи или нерегулярную или Тошнота , чувство полной и, возможно, симптомы мочи (включая частое мочеиспускание и срочное мочеиспускание ). [ 27 ]
Более поздние симптомы
[ редактировать ]
Более поздние симптомы рака яичников обусловлены растущей массой, вызывающей боль, нажимая на другие органы живота или метастазы. [ 26 ] [ 30 ] [ 31 ] Из -за анатомического расположения яичников в глубине таза большинство масс большие и продвинутые во время диагноза. [ 14 ] Растущая масса может вызвать боль, если развивается кручение яичника . Если эти симптомы начинают происходить чаще или более серьезно, чем обычно, особенно после отсутствия значительного анамнеза таких симптомов, рассматривается рак яичников. [ 26 ] [ 29 ] Метастазы могут вызвать сестру Марию Джозеф узел . [ 31 ] Редко тератомы могут вызывать растущий синдром тератомы или перитонеальный глиоматоз . [ 31 ] Некоторые испытывают менометроррагию и аномальное влагалищное кровотечение после менопаузы в большинстве случаев. Другие общие симптомы включают гирсутизм , боль в животе, вирилизацию и массу придачи . [ 32 ]
Дети
[ редактировать ]У подростков или детей с опухолями яичников симптомы могут включать сильную боль в животе, раздражение брюшины или кровотечение . [ 33 ] Стромальные опухоли половой шнуры производят гормоны, которые могут привести к преждевременному развитию вторичных половых характеристик. Секс-болотные-силовые опухоли у препубертатных детей могут проявляться признаками раннего полового созревания ; Боль в животе и растяжение также распространены. У подростков с половым пусковым пусковым пусковым пусковым опухолями могут быть аменорея . По мере того, как рак становится более продвинутым, он может вызвать накопление жидкости в животе и привести к растяжению. Если злокачественная опухоль не была диагностирована к тому времени, когда он вызывает асцит, вскоре после этого он диагностируется. [ 26 ] Усовершенствованный рак также может вызвать массы брюшной полости, массы лимфатических узлов или плевральный выпот . [ 31 ]
Факторы риска
[ редактировать ]Есть много известных факторов риска, которые могут увеличить риск развития рака яичников. Риск развития рака яичников связан с количеством времени, которое женщина тратит на овуляцию. [ 34 ] Факторы, которые увеличивают количество овуляторных циклов, которые подвергается женщинам, могут увеличить риск развития рака яичников. [ 34 ] Во время овуляции клетки стимулируют разделение. Если это разделение является аномально регулируемой, могут образовываться опухоли, которые могут быть злокачественными. Раннее менарх и поздняя менопауза увеличивают количество овуляторных циклов, которые женщина подвергает своей жизни и увеличивает риск развития рака яичников. [ 29 ] [ 34 ] [ 35 ] Поскольку овуляция подавляется во время беременности, отсутствие детей также увеличивает риск рака яичников. [ 35 ] Поэтому женщины, которые не родили детей, находятся в два раза больше риска рака яичников, чем те, у кого есть. [ 26 ] Как ожирение, так и гормональная терапия также повышают риск. [ 26 ]
Риск развития рака яичников меньше для женщин, у которых меньше менструальных циклов, ни менструальных циклов, кормления грудью , оральные контрацептивы, не имеют множественных беременностей и беременности в раннем возрасте. Риск развития рака яичников снижается у женщин, у которых была перевязанность труб (в разговорной разговорке как есть «трубки, связанные»), как яичники, или гистерэктомия (операция, при которой матка удаляется). [ 27 ] Возраст также является фактором риска. [ 26 ] [ 20 ] Негенетические факторы, такие как сахарный диабет, высокий индекс массы тела и употребление табака, также являются факторами риска рака яичников. [ 23 ]
Гормоны
[ редактировать ]Использование лекарств от фертильности может способствовать формированию опухоли яичников , но связь между ними оспаривается и трудно изучать. [ 28 ] Препараты для фертильности могут быть связаны с более высоким риском пограничных опухолей. [ 31 ] Те, кто проходил лечение от бесплодия, но остаются нулипарными, подвержены более высокому риску рака эпителиального яичника из -за гормонального воздействия, которое может привести к пролиферации клеток. Тем не менее, те, кто успешно лечится от бесплодия и впоследствии рожает, не подвергаются более высоким риску. Это может быть связано с выбросом предраковых клеток во время беременности, но причина остается неясной. [ 29 ] Вместо этого фактор риска может быть бесплодием, а не лечением. [ 34 ]
Гормональные состояния, такие как синдром поликистозных яичников и эндометриоз, связаны с раком яичников, но связь не полностью подтверждена. [ 28 ] Заместительная терапия в постменопаузе (ЗГТ) с эстрогеном, вероятно, увеличивает риск рака яичников. Ассоциация не была подтверждена в крупномасштабном исследовании, [ 29 ] [ 36 ] Но заметные исследования, включая исследование «Миллион женщин», поддержали эту связь. Постменопаузальный HRT с комбинированным эстрогеном и прогестероном может увеличить современный риск, если он используется более 5 лет, но этот риск возвращается к нормальности после прекращения терапии. [ 34 ] Эстроген HRT с или без прогестинов увеличивает риск эндометриоидных и серозных опухолей, но снижает риск возникновения слизистых опухолей. Более высокие дозы эстрогена увеличивают этот риск. [ 31 ] Эндометриоз является еще одним фактором риска рака яичников, [ 34 ] как боль с менструацией. Эндометриоз связан с прозрачными и эндометриоидными подтипами, низкоклассными серозными опухолями, опухолями I и II стадии, опухолями 1 степени и более низкой смертностью. [ 31 ]
До менопаузы ожирение может увеличить риск рака яичников, но этот риск не присутствует после менопаузы. Этот риск также актуален у тех, кто оба страдают ожирением и никогда не использовали HRT. Аналогичная связь с раком яичников появляется у более высоких женщин. [ 34 ]
Генетика
[ редактировать ]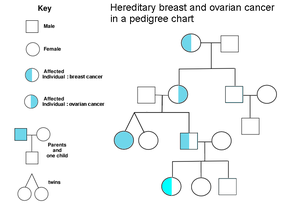
Семейная история рака яичников является фактором риска рака яичников. Женщины с наследственным неполипозом рака толстой кишки (синдром Линча) и женщины с генетическими нарушениями BRCA-1 и BRCA-2 подвержены повышенному риску.
Основным генетическим фактором риска рака яичников является мутация в генах BRCA1 или BRCA2 или в генах репарации несоответствия ДНК , которые присутствуют в 10% случаев рака яичников. Только один аллель должен быть мутировал, чтобы поставить человека с высоким риском. Ген может быть унаследован по материнской или отцовской линии, но имеет переменную пенетранскую . [ 26 ] [ 29 ] Хотя мутации в этих генах обычно ассоциируются с повышенным риском рака молочной железы, они также несут существенный риск рака яичников в течение жизни, что является риском, который достигает пика в 40 -х и 50 -х годах. Наиболее низкий риск составляет 30% и самые высокие 60%. [ 28 ] [ 26 ] [ 29 ] Мутации в BRCA1 имеют пожизненный риск развития рака яичников 15–45%. [ 31 ] Мутации в BRCA2 менее рискованны, чем мутации с BRCA1 , с риском жизни 10% (самый низкий риск цитируется) до 40% (наибольший риск цитируется). [ 26 ] [ 31 ] В среднем раковые заболевания, связанные с BRCA, развиваются за 15 лет до их спорадических аналогов, потому что людям, которые наследуют мутации на одной копии своего гена, нуждается только в одной мутации, чтобы начать процесс канцерогенеза, тогда как люди с двумя нормальными генами должны были приобрести две мутации. [ 29 ]
В Соединенных Штатах пятеро из 100 женщин с родственником первой степени с раком яичников в конечном итоге сами получит рак яичников, поставив людей с пострадавшими членами семьи в тройном риске женщин с незатронутыми членами семьи. Семь из 100 женщин с двумя или более родственниками с раком яичников в конечном итоге получат рак яичников. [ 29 ] [ 37 ] В целом, 5–10% случаев рака яичников имеют генетическую причину. [ 29 ] Мутации BRCA связаны с высококачественным серозным непредубийным эпителиальным раком яичников. [ 31 ]
Сильная семейная история рака эндометрия , рака толстой кишки или других желудочно -кишечных раков может указывать на наличие синдрома, известного как наследственный неполипоз колоректальный рак (также известный как синдром Линча), который обеспечивает более высокий риск развития ряда раковых заболеваний, включая яичники яичника. рак. Синдром Линча вызван мутациями в генах восстановления несоответствия, включая MSH2 , MLH1 , MLH6 , PMS1 и PMS2 . [ 26 ] Риск рака яичников для человека с синдромом Линча составляет от 10 до 12 процентов. [ 26 ] [ 29 ] Женщины исландского происхождения , европейского еврейского происхождения / ашкеназийского еврейского происхождения и венгерского происхождения подвержены более высокому риску рака эпителиальных яичников. [ 29 ] Бета -ген рецептора эстрогена ( ESR2 ), по -видимому, является ключом к патогенезу и реакции на терапию. [ 38 ] Другими генами, которые были связаны с раком яичников, являются BRIP1 , MSH6 , RAD51C и RAD51D . [ 39 ] CDH1 , CHEK2 , PALB2 и RAD50 также были связаны с раком яичников. [ 40 ]
Несколько редких генетических расстройств связаны со специфическими подтипами рака яичников. Синдром Путца -Джерса , редкое генетическое заболевание, также предрасполагает женщин к половой пусковой опухоли с кольцевыми канальцами . [ 28 ] [ 26 ] Болезнь Оллие и синдром Маффуччи связана с опухолями гранулезой клеток у детей, а также может быть связано с опухолями Сертоли-Лейдига. Доброкачественные фибромы связаны с синдромом невоидного базального рака . [ 26 ]
Диета
[ редактировать ]Потребление алкоголя , по -видимому, не связано с раком яичников. [ 31 ] [ 41 ]
Американское онкологическое общество рекомендует здоровый схему питания, который включает в себя множество фруктов, овощей, цельных зерен и диеты, которая избегает или ограничивает красное и обработанное мясо и обработанное сахар. [ 42 ] Высокое потребление общего, насыщенного и транс-фата увеличивает риск рака яичников. [ 43 ] Обзор зонтика 2021 года показал, что потребление кофе, яйца и жира значительно увеличивает риск рака яичников. [ 44 ] Существуют смешанные данные из исследований по риску рака яичников и потреблению молочных продуктов . [ 45 ] [ 46 ]
Факторы окружающей среды
[ редактировать ]Промышленно развитые страны, за исключением Японии, имеют высокий уровень эпителиального рака яичников, что может быть связано с диетой в этих странах. Белые женщины находятся на 30–40% выше риска рака яичников по сравнению с чернокожими женщинами и латиноамериканцами, вероятно, из -за социально -экономических факторов; У белых женщин, как правило, есть меньше детей и различные показатели гинекологических операций, которые влияют на риск рака яичников. [ 29 ]
Предварительные данные свидетельствуют о том, что тальк , пестициды и гербициды увеличивают риск рака яичников. [ 47 ] Американское онкологическое общество отмечает, что на данный момент ни одно исследование не смогло точно связать какое -либо единственное химическое вещество в окружающей среде или в рационе человека, непосредственно с мутациями, которые вызывают рак яичников. [ 48 ]
Другой
[ редактировать ]Другие факторы, которые были исследованы, такие как курение , низкий уровень витамина D в крови, [ 49 ] Наличие кист яичника включения и инфекция вирусом папилломы человека (причина некоторых случаев рака шейки матки ) были опровергнуты как факторы риска рака яичников. [ 28 ] [ 31 ] Канцерогенность промежности талька является противоречивой, потому что он может действовать как раздражитель, если он проходит через репродуктивный тракт в яичники. [ 31 ] [ 29 ] [ 34 ] Исследования случай-контроля показали, что использование промежности талька увеличивает риск рака яичников, но использование талька чаще не создает большего риска. [ 31 ] Использование талька в других местах организма не связано с раком яичников. [ 34 ] Регулярно сидеть в течение длительных периодов связано с более высокой смертностью от эпителиального рака яичников. Риск не отрицается регулярными физическими упражнениями, хотя он снижен. [ 50 ]
Увеличение возраста (до 70 -х годов) является фактором риска рака эпителиального яичника, поскольку больше мутаций в клетках может накапливать и в конечном итоге вызывать рак. Те, кто старше 80, имеют немного более низкий риск. [ 29 ]
Курение табака связано с более высоким риском рака муцинозного яичника ; После прекращения курения риск в конечном итоге возвращается к норме. Более высокие уровни С-реактивного белка связаны с более высоким риском развития рака яичников. [ 31 ]
Защитные факторы
[ редактировать ]Подавление овуляции, которая в противном случае вызовет повреждение эпителия яичника и, следовательно, воспаления , как правило, является защитным. Этот эффект может быть достигнут путем наличия детей , взятия комбинированных оральных противозачаточных средств и кормления груди , которые являются защитными факторами. [ 26 ] Более длительный период грудного вскармливания коррелирует с большим снижением риска рака яичников. [ 34 ] Каждое рождение больше снижает риск рака яичников, и этот эффект наблюдается с пятью родами. Комбинированные пероральные контрацептивы снижают риск рака яичников до 50%, а защитный эффект комбинированных пероральных контрацептивов может длиться 25–30 лет после их прекращения. [ 29 ] [ 34 ] Регулярное использование исследования аспирина ( Малова (злокачественный рак яичников)) [ 51 ] [ 52 ] или ацетаминофен (парацетамол) может быть связан с более низким риском рака яичников; Другие НПВП, похоже, не имеют аналогичного защитного эффекта. [ 31 ]
Лигирование труб является защитной, потому что канцерогены не могут добраться до яичника и фимбрии через влагалище, матку и маточные трубки. [ 26 ] Тубальская перевязка также защищает у женщин с мутацией BRCA1, но не мутацией BRCA2. [ 31 ] Гистерэктомия снижает риск, а удаление как маллопийских трубок, так и яичников (двусторонняя сальпингоофоректомия ) резко снижает риск не только рака яичников, но и рака молочной железы. [ 28 ] Это все еще является темой исследования, поскольку связь между гистерэктомией и более низким риском рака яичников является спорной. Причины, по которой гистерэктомия может быть защитной, не были выяснены с 2015 года. [ 34 ]
Диета, которая включает в себя большое количество каротина , клетчатки и витаминов с низким количеством жира,-в частности, диета с нехватчивыми овощами (например, брокколи и лук ), может быть защитной. [ 29 ] Диетическое волокно связано со значительным снижением риска рака яичников. [ 53 ] Обзор 2021 года показал, что зеленые листовые овощи, овощи Allium, клетчатка, флаваноиды и потребление зеленого чая могут значительно снизить риск рака яичников. [ 54 ]
Патофизиология
[ редактировать ]| Джин мутировал | Тип мутации | Подтип | Распространенность |
|---|---|---|---|
| Akt1 | усиление | 3% | |
| AKT2 | усиление/мутация | 6%, [ 28 ] 20% [ 55 ] | |
| Arid1a | точечная мутация | Эндометриоид и четкий | |
| Бекн1 | удаление | ||
| Брут | точечная мутация | низкокачественный серозный | 0.5% |
| KRCA1 | Черноть мутация | Высококачественный серозный | 5% |
| BRCA2 | мутация сдвига кадров | Высококачественный серозный | 3% |
| CCND1 | усиление | 4% | |
| CCND2 | активация | 15% | |
| CCNE1 | усиление | 20% | |
| CDK12 | Высококачественный серозный | ||
| CDKN2A | подавление (30%) и делеция (2%) | 32% | |
| Ctnnb1 | чисто-ячейка | ||
| Dicer1 | Миссенс -мутация (соматическая) | непителиальный | 29% |
| Dynlrb1 (KM23) | мутация | 42% | |
| EGFR | усиление/сверхэкспрессия | 20% | |
| Erbb2 (HER2/или) | усиление/сверхэкспрессия | слизистый и низкокачественный серозный | 30% |
| Фс | Коэкспрессия с CSF-1 | 50% | |
| Foxl2 | точечная мутация (от 402 с до г) | Взрослый гранулеза | ~100% |
| I1 | усиление | 2% | |
| I2 | усиление | 3% | |
| Крас | усиление | слизистый и низкокачественный серозный | 11% |
| Maml1 | усиление и точечная мутация | 2% | |
| Еде | усиление и точечная мутация | 4% | |
| Maml3 | усиление | 2% | |
| MLH1 | 1% | ||
| NF1 | удаление (8%) и точечная мутация (4%) | Высококачественный серозный | 12% |
| Notch3 | усиление и точечная мутация | 11% | |
| NRAS | низкокачественный серозный | ||
| Pik3c3 (pi3k3) | усиление/мутация | 12–20% | |
| Pik3ca | усиление | Эндометриоид и четкий | 18% |
| PPP2R1A | Эндометриоид и четкий | ||
| Птенс | удаление | Эндометриоид и четкий | 7% |
| RB1 | удаление (8%) и точечная мутация (2%) | 10% | |
| TGF-β | Мутация/сверхэкспрессия | 12% | |
| TP53 | Мутация/сверхэкспрессия | Высококачественный серозный | 20–50% |
| TβRI | мутация | 33% | |
| TβRIA | мутация | 25% | |
| USP36 | Сверхэкспрессия |
Рак яичников образуется, когда возникают ошибки в нормальном росте клеток яичников . Обычно, когда клетки стареют или повреждены, они умирают , а новые клетки занимают их место. Рак начинается, когда новые клетки образуют ненужные, а старые или поврежденные клетки не умирают, как должны. Создание дополнительных клеток часто образует массу ткани, называемую опухолью яичника или ростом. Эти аномальные раковые клетки имеют много генетических нарушений , которые заставляют их расти чрезмерно. [ 56 ] Когда яичник выпускает яйцо , яичный фолликул открывается открытым и становится люкером корпуса . Эта структура должна быть восстановлена путем деления клеток в яичнике. [ 34 ] Непрерывная овуляция в течение длительного времени означает большее восстановление яичника путем деления клеток, которые могут приобретать мутации в каждом разделении. [ 29 ]
В целом, наиболее распространенные генные мутации при раке яичников встречаются в NF1 , BRCA1, BRCA2 и CDK12 . Рак яичников типа I, которые имеют тенденцию быть менее агрессивным, имеют тенденцию обладать нестабильностью микросателлитов в нескольких генах, в том числе как онкогенами (особенно BRAF и KRAS ), так и опухолевые супрессоры (особенно PTEN ). [ 28 ] Наиболее распространенными мутациями при раке I типа являются KRAS, BRAF, ERBB2, PTEN, PIK3CA и ARID1A. [ 31 ] Рак типа II, более агрессивный тип, имеют различные гены, мутированные, включая p53 , BRCA1 и BRCA2 . [ 28 ] Низкокачественный рак, как правило, имеет мутации в KRAS, тогда как рак любого уровня, который развивается из опухолей с низким содержанием злокачественных потенциалов, имеет тенденцию иметь мутации в p53. [ 29 ] Рак типа I имеет тенденцию развиваться из поражений предшественников, тогда как рак типа II может развиваться из серозной трубной внутриэпителиальной карциномы . [ 31 ] Серозные раковые заболевания , которые имеют мутации BRCA, также неизбежно имеют мутации p53, что указывает на то, что удаление обоих функциональных генов важно для развития рака. [ 29 ]
При 50% высококлассных серозных раковых заболеваний гомологичная рекомбинация ДНК является дисфункциональным, как и сигнальные пути Notch и Foxm1 . У них также почти всегда есть мутации p53. Кроме этого, мутации при высококлассной серозной карциноме трудно охарактеризовать за пределами их высокой степени геномной нестабильности . BRCA1 и BRCA2 необходимы для гомологичной реконбинации ДНК рекомбинации, а мутации зародышевой линии в этих генах обнаруживаются у 15% женщин с раком яичников. [ 28 ] Наиболее распространенными мутациями в BRCA1 и BRCA2 являются мутации FrameShift , которые возникли в небольшом основании евреев ашкенази. [ 29 ]
Почти 100% редких муцинозных карциномов имеют мутации в KRAS и амплификации ERBB2 (также известного как HER2/NEU ). [ 28 ] В целом, 20% рака яичников имеют мутации в HER2/NEU . [ 26 ]
Серозные карциномы могут развиваться из серозной трудной интраэпителиальной карциномы , а не развиваться спонтанно из ткани яичников. Другие карциномы развиваются из кист кортикальной включения , которые представляют собой группы эпителиальных яичников внутри стромы . [ 29 ]
Диагноз
[ редактировать ]Экзамен
[ редактировать ]
Диагноз рака яичников начинается с физического обследования (включая исследование таза ), анализ крови (для CA-125 , а иногда и других маркеров) и трансвагинального ультразвука . [ 26 ] [ 57 ] Иногда ректавагинальное обследование используется, чтобы помочь спланировать операцию. [ 29 ] Диагноз должен быть подтвержден операцией, чтобы осмотреть полость брюшной полости , взять биопсию (образцы ткани для микроскопического анализа ) и поиска раковых клеток в брюшной жидкости. Это помогает определить, является ли яичника доброкачественной или злокачественной. [ 26 ]
Ранние стадии рака яичников (I/II) трудно диагностировать, потому что большинство симптомов неспецифичны и, следовательно, мало используются в диагностике; В результате он редко диагностируется до тех пор, пока не распространяется и достигает более поздних стадий (III/IV). [ 58 ] Кроме того, симптомы рака яичников могут показаться похожим на синдром раздраженного кишечника . У женщин, у которых беременность возможно, уровень BHCG может быть измерен во время процесса диагностики. Сывороточный альфа-фетопротеин , нейрон-специфическая энолаза и лактатдегидрогеназа могут быть измерены у молодых девушек и подростков с подозрением на опухоли яичников , поскольку молодые женщины с раком яичников с большей вероятностью имеют злокачественные опухоли зарядных клеток. [ 26 ] [ 31 ]
Физикальное обследование, включая исследование таза и ультразвук таза (трансвагинальный или иным образом), оба необходимы для диагностики: физическое обследование может выявить увеличение обхвата живота и/или асцита (жидкость в пределах брюшной полости), в то время как исследование в ломаре может выявить яичники (жидко или брюшная масса. [ 28 ] Места аднекса является значительным открытием, которое часто указывает на рак яичников, особенно если она фиксированная, узловая, нерегулярная, твердая и/или двусторонняя. 13–21% масс аднекса вызваны злокачественными новообразованиями; Тем не менее, существуют и другие доброкачественные причины масс аднексала, включая яичную фолликулярную кисту , лейомиому , эндометриоз , эктопическую беременность , гидросасальпинкс приложение для абссцентра, неровный SHEAT, неровный SHEAT , , тубоовариатный абсцесс , торсион яичников , циста дермаида , цистаденома (серовая или муциновая), варьилярный или неровный SHEAT, неровный SHEAT, неровный SHEAT, неровный SHEAT, неровный SHEAT, неровный SHEAT, неровный SHEAT, неровный SHEAT, неровный SHEAT, неровный SHEAT , неровный SHEAT , неровный SHEAT, неровный SHEAT , нев. Тазовая почка , мочеточника или дивертикулум мочевого пузыря , доброкачественная кистозная мезотелиома брюшина , брюшного туберкулеза или параовариационной кисты . Яичники, которые можно ощущать, также являются признаком рака яичников у женщин в постменопаузе. Другие части физического обследования на наличие подозрений на рак яичников могут включать обследование молочной железы и цифровой ректальный экзамен . Пальпация надполневых , подмышечных и паховых лимфатических узлов может выявлять лимфаденопатию , которая может указывать на метастазирование. Другим показателем может быть наличие плевральный выпот , который можно отметить на аускультации . [ 31 ]
Когда злокачественная опухоль яичника включена в список диагностических возможностей, указано ограниченное количество лабораторных испытаний. Обычно получается полный тест на кровь и сывороточный электролит; [ 59 ] Когда присутствует рак яичника, эти тесты часто показывают большое количество тромбоцитов (20–25% пациентов) и низкого уровня натрия в крови из -за химических сигналов, секретируемых опухолью. [ 29 ] Положительный тест на ингибин A и ингибин B может указывать на опухоль клеток гранулезы. [ 31 ]
Анализ крови для маркерной молекулы, называемой CA-125, полезен при дифференциальной диагностике и при наблюдении за заболеванием, но само по себе не было показано, что он является эффективным методом для скрининга на раннюю стадию рака яичников из-за его неприемлемого низкого Чувствительность и специфичность. [ 59 ] Уровни CA-125 у женщин в пременопаузе более 200 ед/мл могут указывать на рак яичников, как и любое повышение в CA-125 выше 35 ед/мл у женщин в постменопаузе. Уровни CA-125 не являются точными при ранней стадии рака яичников, поскольку половина пациентов с раком яичников I стадии I имеет нормальный уровень CA-125. [ 31 ] [ 29 ] CA-125 также может быть повышен в доброкачественных (незвуковых) состояниях, включая эндометриоз , беременность , миома матки , менструацию , кисты яичников , системную эритематозу , заболевание печени , воспалительное заболевание кишечника , воспалительное заболевание такого табачка и лейомиома . [ 31 ] [ 60 ] HE4 является еще одним кандидатом на тестирование рака яичников, хотя он не был тщательно протестирован. Другие опухолевые маркеры для рака яичников включают CA19-9 , CA72-4 , CA15-3 , иммуносупрессивный кислотный белок , гаптоглобин-альфа , OVX1 , мезотелин , лизофосфатидная кислота , остеопонтин и фактор роста фибробластов 23 . [ 31 ]
Использование панелей анализа крови может помочь в диагностике. [ 31 ] [ 59 ] Панель OVA1 включает в себя CA-125, бета-2 микроглобулин , трансферрин , аполипопротеин A1 и транстиретин . OVA1 выше 5,0 у женщин в пременопаузе и 4,4 у женщин в постменопаузе указывает на высокий риск развития рака. [ 29 ] Другой набор лабораторных испытаний используется для обнаружения половых пуно-силовых опухолей. Высокий уровень тестостерона или дегидроэпиандростерона сульфата , в сочетании с другими симптомами и высоким уровнем ингибина А и ингибина В может указывать на SCST любого типа. [ 32 ]
Текущие исследования рассматривают способы рассмотрения протеомики опухолевого маркера в сочетании с другими показателями заболевания (то есть радиологии и/или симптомов) для повышения точности диагностики. Задача такого подхода заключается в том, что разнородная распространенность рака яичников означает, что даже тестирование с очень высокой чувствительностью и специфичностью все равно приведет к ряду ложных положительных результатов, что, в свою очередь, может привести к таким проблемам, как выполнение хирургических процедур, при которых рак рак не найден во время операции. [ Цитация необходима ] Подходы к геномике еще не были разработаны для рака яичников. [ 31 ]
КТ -сканирование предпочтительнее оценить степень опухоли в полости брюшной полости, хотя магнитно -резонансную томографию . также можно использовать [ 28 ] КТ -сканирование также может быть полезно для поиска олайцевой каскаки или дифференцировки жидкости от твердой опухоли в животе, особенно в опухолях с низким содержанием злокачественных потенциалов. Однако это может не обнаружить меньшие опухоли. Иногда рентген грудной клетки используется для обнаружения метастазов в груди или плевральном выпоте . Другим тестом на метастатическую болезнь, хотя он редко используется, является клизма бария , которая может показать, участвует ли ректосигмоидная толстая кишка. Позитронно -эмиссионная томография , сканирование костей и парацентез имеют ограниченное использование; Фактически, парацентез может привести к образованию метастазов в месте вставки иглы и может не предоставить полезные результаты. [ 29 ] Тем не менее, парацентез может быть использован в тех случаях, когда тазовая масса и асцит все еще присутствует. [ 29 ] Врач, подозревающий рак яичников, также может выполнять маммографию или биопсию эндометрия (в случае аномального кровотечения), чтобы оценить возможность злокачественных новообразований молочной железы и злокачественных новообразований эндометрия, соответственно. Ультрасонография влагалища часто является исследованием визуализации первой линии, выполняемое при обнаружении массы аднекса. Несколько характеристик приданной массы указывают на злокачественную опухоль яичников; Обычно они твердые, нерегулярные, многоокулярные и/или большие; И они, как правило, имеют папиллярные особенности, центральные сосуды и/или нерегулярные внутренние перегородки. [ 31 ] Тем не менее, SCST не имеет определенных характеристик на рентгенографическом исследовании. [ 32 ]
Чтобы окончательно диагностировать рак яичников, требуется хирургическая процедура для проверки живота. Это может быть открытой процедурой ( лапаротомия , разрез через брюшную стенку ) или операция по замочной скважине ( лапароскопия ). Во время этой процедуры подозрительная ткань удаляется и отправляется для микроскопического анализа . Обычно это включает в себя одностороннюю сальпингоофориэктомию , удаление одного пораженного яичника и фаллопийской трубки. Жидкость из брюшной полости также может быть проанализирована на раковые клетки . Если рак обнаружен, эта процедура также может быть использована для определения степени его распространения (которая является формой постановки опухоли ). [ 26 ]
Паолоциация указана . для использования у взрослых с раком яичников, чтобы помочь выявить раковые поражения во время операции [ 61 ] Это диагностический агент, который вводится в форме внутривенной инъекции перед операцией. [ 61 ]
Риск забить
[ редактировать ]Широко признанным методом оценки риска злокачественного рака яичников является риск индекса злокачественных новообразований (RMI), рассчитанного на основе начальной работы . [ 28 ] [ 62 ] Обычно считается, что оценка RMI более 200 или 250 указывает на высокий риск рака яичников. [ 28 ] [ 31 ]
RMI рассчитывается как:
- RMI = Ультразвуковой балл × Менопаузальный балл x CA-125 Уровень в U/ML. [ 28 ]
Два метода могут быть использованы для определения ультразвукового балла и оценки менопауза, причем результирующие оценки называются RMI 1 и RMI 2, соответственно, в зависимости от того, какой метод используется.
| Особенность | RMI 1 [ 28 ] | RMI 2 [ 31 ] [ 63 ] |
|---|---|---|
|
Ультразвуковые аномалии:
|
|
|
| Менопаузальный счет |
|
|
| CA-125 | Количество в U/ML | Количество в U/ML |
Другим методом количественной оценки риска рака яичников является риск алгоритма рака яичников (ROCA), который со временем наблюдает за уровнями и определяет, достаточно ли они увеличиваются, чтобы гарантировать трансвагинальное ультразвук. [ 29 ] Риск алгоритма злокачественных новообразований в яичниках использует уровни CA-125 и уровни HE4 для расчета риска рака яичников; Это может быть более эффективным, чем RMI. Модели IOTA могут использоваться для оценки вероятности того, что аднексальная опухоль является злокачественной. [ 64 ] Они включают в себя модель риска LR2, расчет простого риска правил (SRRISK) и оценка различных неоплазий в модели ADNEXA (ADNEX), которые могут быть использованы для оценки риска злокачественных новообразований в массе придачи, основанной на ее характеристиках и факторах риска. Алгоритм QCancer (яичника) используется для прогнозирования вероятности рака яичников от факторов риска. [ 31 ]
Система отчетности и данных яичника (ORADS) -это стандартизированная система, разработанная Американским колледжем радиологии для улучшения управления и диагностики масс яичников и приливок. Он обеспечивает постоянную основу для интерпретации результатов визуализации, особенно из ультразвука, и назначает категории стратификации риска, которые руководят клиническим принятием принятия решений. Используя четкий набор критериев и терминологии, Orads стремится улучшить связь между поставщиками здравоохранения, повысить точность диагностики и в конечном итоге улучшить результаты пациентов при оценке патологий яичников и придачи. Кроме того, доступен специализированный калькулятор Orads для облегчения отчетности, помогая радиологам и клиницистам быстро и точно классифицировать результаты в соответствии с руководящими принципами системы. [ 65 ]
Патология
[ редактировать ]
Рак яичников классифицируется в соответствии с микроскопическим появлением их структур ( гистология или гистопатология ). Гистология диктует многие аспекты клинического лечения, лечения и прогноза . Валовая патология рака яичников очень похожа, независимо от гистологического типа: опухоли яичников имеют твердую и кистозную массу. [ 29 ] По словам Сира , виды рака яичников у женщин в возрасте 20 лет и старше: [ 66 ]
| Процент рак яичников у женщин возраст 20+ |
Процент рак яичников у женщин Возраст 20+ за подразделение |
Гистология | Пять лет RSR |
|---|---|---|---|
| 89.7 | Поверхностная эпителиальная-сильная опухоль ( аденокарцинома ) | 54.4 | |
| 26.4 | Папиллярная серозная цистаденокарцинома | 21.0 | |
| 15.9 | Пограничная аденокарцинома (Недооценка - короткий интервал сбора данных) |
98.2 | |
| 12.6 | Аденокарцинома, не указанная иным | 18.3 | |
| 9.8 | Эндометриоидная опухоль | 70.9 | |
| 5.8 | Серозная конкуренция | 44.2 | |
| 5.5 | Папиллярный | 21.0 | |
| 4.2 | Муциновая цистаденокарцинома | 77.7 | |
| 4.0 | Яичниковая карцинома | 61.5 | |
| 3.4 | Муцинозная аденокарцинома | 49.1 | |
| 1.3 | Конкурскарцинома | 50.7 | |
| 5.5 | Карцинома | ||
| 4.1 | Карцинома не указана | 26.8 | |
| 1.1 | Секс-болотная-сильная опухоль | 87.8 | |
| 0.3 | Другие карциномы, указанные | 37.3 | |
| 1.7 | Мюллеровская опухоль | 29.8 | |
| 1.5 | Опухоль зародышевых клеток | 91.0 | |
| 0.8 | Тератома | 89.1 | |
| 0.5 | Дисперминома | 96.8 | |
| 0.3 | Другое, указано | 85.1 | |
| 0.6 | Не указано иное | 23.0 | |
| 0.5 | Плоскоклеточная карцинома яичников (эпидермоид) | 51.3 | |
| 0.2 | Опухоль горелки | 67.9 | |
| 0.2 | Другое, указано | 71.7 |
Рак яичников гистологически и генетически разделен на тип I или типа II. Рак типа I имеет низкую гистологическую степень и включает в себя эндометриоидные, муциновые и четкоклеточные карциномы. Рак типа II имеет более высокую гистологическую степень и включает в себя серозной карциномы и карциносаркомы. [ 28 ]
Эпителиальная карцинома
[ редактировать ]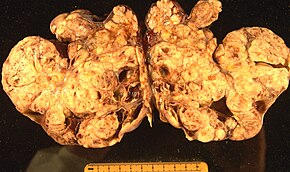
Рак эпителиального яичника обычно демонстрирует на продвинутой стадии и происходит от злокачественной трансформации эпителия поверхности яичника, брюшины или фаллопийской трубки. [ 67 ] Это наиболее распространенная причина гинекологической смерти рака. [ 67 ] Существуют различные типы рака эпителиальных яичников, включая серозную опухоль, эндометриоидную опухоль, опухоль чистых клеток, слизистую опухоль и недифференцированные или неклассифицированные опухоли. [ 68 ] Ежегодно по всему миру будет диагностировано 230 000 женщин, а 150 000 человек умрут. [ 69 ] Он имеет 46% 5 -летнюю выживаемость после постановки диагноза из -за продвинутой стадии заболевания во время диагноза. [ 69 ] Как правило, около 75% пациентов диагностируются как имеющая усовершенствованную стадию заболевания из -за бессимптомной природы ее представления. [ 69 ] Существует геномная предрасположенность к эпителиальному раку яичника, и было обнаружено, что гены BRCA1 и BRCA2 являются причинными генами в 65–75% наследственного рака яичников эпителиального эпителия. [ 69 ]
Серозная карцинома
[ редактировать ]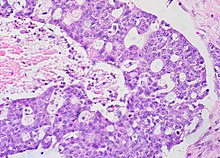
Рак серозного яичника является наиболее распространенным типом эпителиального рака яичников, и на него приходится около двух третей случаев рака эпителиальных яичников. [ 28 ] Низкокачественная серозная карцинома менее агрессивная, чем высококачественные серозные карциномы, хотя обычно она не очень хорошо реагирует на химиотерапию или гормональную процедуру. [ 28 ] Считается, что серозные карциномы начинаются в флопийской трубе . [ 70 ] [ 71 ] Высококлассная серозная карцинома составляет 75% всего эпителиального рака яичников. [ 69 ] Около 15–20% высококачественной серозной карциномы имеют мутации зародышевой линии BRCA1 и BRCA2. [ 69 ] Гистологически характер роста высококачественной серозной карциномы является гетерогенной и имеет некоторые папиллярные или твердые паттерны роста. [ 69 ] Опухолевые клетки нетипичны с большими, нерегулярными ядрами. [ 69 ] Он имеет высокий уровень пролиферации. [ 69 ] В 50% случаев серозные карциномы являются двусторонними, а в 85% случаев они распространялись за пределы яичника во время диагноза. [ 72 ]
В настоящее время признается, что интраэпителиальная карцинома (Stic) в серозной трубе является поражением предшественника наиболее называемых яичников высококачественных серозных карциномов. [ 72 ] Stic характеризуется
- Аномальное окрашивание P53
- Индекс пролиферации KI67 превышает 10%
- Положительный WT1 (исключить метастазы) [ 72 ]
Маленькая клеточная карцинома
[ редактировать ]
Маленький яичный карцинома встречается редко и агрессивен, с двумя основными подтипами: гиперкальемическим и легочным. [ 73 ] Эта редкая злокачественная опухоль чаще всего затрагивает молодых женщин в возрасте до 40 лет, и в возрасте от 14 месяцев до 58 лет. [ 73 ] Средний возраст диагноза 24 года. [ 73 ] Приблизительно две трети пациентов будут иметь паранеопластическую гиперкальциемию, что означает, что у них высокий уровень кальция в крови по неизвестной причине. [ 73 ] [ 74 ] Опухоль выделяет белок, связанный с паратиреоидным гормоном, который действует аналогично ПТГ и связывает рецепторы ПТГ в кости и почках, вызывающую гиперкальциемию. [ 73 ] Недавние исследования обнаружили инактивирующую зародышевую линию и соматическую мутацию гена smarca4 . [ 73 ] [ 75 ] Гиперкальциемический подтип очень агрессивный и имеет общую выживаемость 16% с уровнем рецидивов 65% у пациентов, которые получают лечение. [ 73 ] Пациенты с распространением заболевания в другие части тела, как правило, умирают через 2 года после диагноза. [ 73 ] Экстра-яистовое распространение участвует в 50% случаев, а распространение лимфатических узлов присутствует в 55% случаев. [ 74 ] Наиболее распространенным начальным представлением является быстро растущая односторонняя тазовая масса со средним размером 15 см. [ 73 ] Гистологически это характеризуется многими листами небольших, круглых, плотно упакованных клеток с кластерами, гнездами и шнурами. [ 73 ] [ 74 ] Иммуногистохимия, как правило, положительна для виментина, цитокератина, CD10, P53 и WT-1. [ 73 ] [ 75 ]
Маленькая клеточная яичница карциномы легочного подтипа отличается от гиперкальемического подтипа. [ 73 ] Как правило, легочные малые клеточные рак яичников обычно поражают как яичники пожилых женщин, и выглядит как овсяная карцинома легких . [ 29 ] Средний возраст начала заболевания составляет 59 лет, и приблизительно 45% случаев являются двусторонними для легочного подтипа. [ 73 ] Кроме того, несколько гормонов могут быть повышены в легочном подтипе, включая серотонин, соматостатин, инсулин, гастрин и кальцитонин. [ 73 ]
Первичная брюшная карцинома
[ редактировать ]Первичные брюшины рак развиваются из брюшины , мембраны, которая покрывает брюшную полость , которая имеет то же эмбриональное происхождение, что и яичник. Они часто обсуждаются и классифицируются с раком яичников, когда они влияют на яичник. [ 70 ] [ 76 ] Они могут развиваться даже после того, как яичники были удалены и могут показаться похожими на мезотелиому . [ 29 ]
Четкий карцинома
[ редактировать ]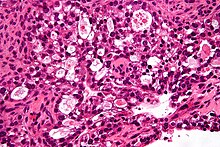
Яичница чисто-клеточная карцинома является редким подтипом эпителиального рака яичников. Те, кто диагностирован с карциномой четкой клеток яичника, обычно моложе в возрасте диагностики и диагностируются на более ранних стадиях, чем другие подтипы эпителиального рака яичников. [ 77 ] [ 78 ] Самая высокая частота яйцеклеточной карциномы яичника наблюдалась среди молодых азиатских женщин, особенно на корейском, тайваньском и японском происхождении. [ 77 ] [ 78 ] Эндометриоз был связан с тем, чтобы быть основным фактором риска развития четкого карциномы яичника, и было обнаружено, что у 50% женщин диагноз яйцеклеточная карцинома яичника. [ 77 ] Сообщается, что развитие сгустков в ногах, таких как тромбоэмболия в глубокой вене или в легких с легочной эмболией, на 40% выше у пациентов с четким карциномой, чем в других подтипах рака эпителиальных яичников. [ 78 ] Было обнаружено, что мутации в молекулярных путях, таких как ARID1A, PIK3 и PIK3CA, связаны с карциномой четкого клеток. [ 77 ] [ 78 ] Они обычно присутствуют в виде большой односторонней массы, со средним размером от 13 до 15 см. [ 77 ] 90% случаев односторонние. [ 77 ] Оваристный карцинома яичника обычно не реагирует на химиотерапию из-за внутренней химиорезистентности, поэтому лечение обычно проводится с агрессивной циторедуктивной хирургией и химиотерапией на основе платины. [ 28 ] [ 77 ]
Чистокклеточная аденокарцинома
[ редактировать ]
Чистые клетки аденокарциномы гистопатологически сходны с другими чистыми карциномами , с чистыми клетками и клетками хобналоса . Они представляют приблизительно 5–10% рака эпителиальных яичников и связаны с эндометриозом в полости таза. Как правило, они являются на ранней стадии и, следовательно, излечимы от хирургии, но усовершенствованные четкие аденокарциномы (приблизительно 20%) имеют плохой прогноз и часто устойчивы к химиотерапии платины. [ 29 ]
Эндометриоид
[ редактировать ]Эндометриоидные аденокарциномы составляют приблизительно 13–15% всех раков яичников. [ 79 ] Поскольку они, как правило, низкие, эндометриоидные аденокарциномы имеют хороший прогноз. [ 79 ] Средний возраст диагноза составляет около 53 лет. [ 79 ] Эти опухоли часто совпадают с эндометриозом или раком эндометрия. [ 29 ] [ 79 ] Уровни Antigen 125 рака обычно повышаются, и семейный анамнез первой степени относительно с эндометриоидным раком яичников связан с повышенным риском развития рака эндометриоидных яичников. [ 79 ] Средний размер опухоли больше 10 см. [ 79 ]
Злокачественная смешанная мюллеровская опухоль (Carcinosarcoma)
[ редактировать ]Смешанные мюллеровские опухоли составляют менее 1% рака яичников. У них есть эпителиальные и мезенхимальные клетки, которые имеют тенденцию иметь плохой прогноз. [ 29 ]
Слизистый
[ редактировать ]Муцинозные опухоли включают слизистую аденокарциному и слизистую цистаденокарциному. [ 29 ]
Муцинозная аденокарцинома
[ редактировать ]Муцинозные аденокарциномы составляют 5–10% рака эпителиальных яичников. Гистологически они похожи на аденокарциномы кишечника или шейки матки и часто на самом деле являются метастазами при аппендициал или рака толстой кишки . У распространенных муцинозных аденокарциномы плохой прогноз, как правило, хуже, чем серозные опухоли, и часто устойчивы к платиновой химиотерапии, хотя они редки. [ 29 ]
Псевдомиксома брюшины
[ редактировать ]
Псевдомиксома Peritonei относится к набору инкапсулированного слизи или желатинового материала в полости брюшной полости, которая очень редко вызвана первичной опухолью яичника из муцинового яичника. Чаще всего это связано с метастазами яичников рака кишечника. [ 29 ]
Недифференцированный эпителиальный
[ редактировать ]Недифференцированные раковые заболевания - те, где тип ячейки не может быть определен - составляют около 10% рака эпителиальных яичников и имеют сравнительно плохой прогноз. [ 29 ] [ 70 ] При исследовании под микроскопом эти опухоли имеют очень аномальные клетки, которые расположены в комки или простынях. Обычно внутри опухоль существуют узнаваемые комки серозных клеток. [ 29 ]
Злокачественная опухоль Бреннера
[ редактировать ]
Злокачественные опухоли Бреннера редки. Гистологически они имеют плотную волокнистую строму с областями переходного эпителия и некоторой плоско -дифференцировкой. Чтобы быть классифицированным как злокачественная опухоль Бреннера, она должна иметь очаги опухоли Бреннера и переходной клеточный рак. Компонент переходной клеточной карциномы обычно плохо дифференцирован и напоминает рак мочевыводящих путей. [ 29 ]
Переходной клеточный рак
[ редактировать ]Переходные клеточные карциномы составляют менее 5% рака яичников. Гистологически они похожи на карциному мочевого пузыря . Прогноз промежуточный - лучше, чем большинство раковых заболеваний эпителия, но хуже, чем злокачественные опухоли Бреннера. [ 29 ]
Секс-болотная-сильная опухоль
[ редактировать ]Sex cord-stromal tumor, including estrogen-producing granulosa cell tumor, the benign thecoma, and virilizing Sertoli-Leydig cell tumor or arrhenoblastoma, accounts for 7% of ovarian cancers. They occur most frequently in women between 50 and 69 years of age but can occur in women of any age, including young girls. They are not typically aggressive and are usually unilateral;[26] they are therefore usually treated with surgery alone. Sex cord-stromal tumors are the main hormone-producing ovarian tumors.[32]
Several different cells from the mesenchyme can give rise to sex-cord or stromal tumors. These include fibroblasts and endocrine cells. The symptoms of a sex-cord or stromal ovarian tumor can differ from other types of ovarian cancer. Common signs and symptoms include ovarian torsion, hemorrhage from or rupture of the tumor, an abdominal mass, and hormonal disruption. In children, isosexual precocious pseudopuberty may occur with granulosa cell tumors since they produce estrogen. These tumors cause abnormalities in menstruation (excessive bleeding, infrequent menstruation, or no menstruation) or postmenopausal bleeding. Because these tumors produce estrogen, they can cause or occur at the same time as endometrial cancer or breast cancer. Other sex-cord/stromal tumors present with distinct symptoms. Sertoli-Leydig cell tumors cause virilization and excessive hair growth due to the production of testosterone and androstenedione, which can also cause Cushing's syndrome in rare cases. Also, sex-cord stromal tumors occur that do not cause a hormonal imbalance, including benign fibromas, which cause ascites and hydrothorax.[26] With germ cell tumors, sex cord-stromal tumors are the most common ovarian cancer diagnosed in women under 20.[32]
Granulosa cell tumor
[edit]Granulosa cell tumors are the most common sex-cord stromal tumors, making up 70% of cases, and are divided into two histologic subtypes: adult granulosa cell tumors, which develop in women over 50, and juvenile granulosa tumors, which develop before puberty or before the age of 30. Both develop in the ovarian follicle from a population of cells that surrounds germinal cells.[32]
Adult granulosa cell tumor
[edit]Adult granulosa cell tumors are characterized by later onset (30+ years, 50 on average). These tumors produce high levels of estrogen, which causes its characteristic symptoms: menometrorrhagia; endometrial hyperplasia; tender, enlarged breasts; postmenopausal bleeding; and secondary amenorrhea. The mass of the tumor can cause other symptoms, including abdominal pain and distension, or symptoms similar to an ectopic pregnancy if the tumor bleeds and ruptures.[32]
Juvenile granulosa cell tumor
[edit]Sertoli-Leydig cell tumor
[edit]Sertoli-Leydig tumors are most common in women before the age of 30, and particularly common before puberty.[32]
Sclerosing stromal tumors
[edit]Sclerosing stromal tumors typically occur in girls before puberty or women before the age of 30.[32]
Germ cell tumor
[edit]Germ cell tumors of the ovary develop from the ovarian germ cells.[70] Germ cell tumor accounts for about 30% of ovarian tumors, but only 5% of ovarian cancers, because most germ-cell tumors are teratomas and most teratomas are benign. Malignant teratomas tend to occur in older women, when one of the germ layers in the tumor develops into a squamous cell carcinoma.[26] Germ-cell tumors tend to occur in young women (20s–30s) and girls, making up 70% of the ovarian cancer seen in that age group.[33] Germ-cell tumors can include dysgerminomas, teratomas, yolk sac tumors/endodermal sinus tumors, and choriocarcinomas, when they arise in the ovary. Some germ-cell tumors have an isochromosome 12, where one arm of chromosome 12 is deleted and replaced with a duplicate of the other.[26] Most germ-cell cancers have a better prognosis than other subtypes and are more sensitive to chemotherapy. They are more likely to be stage I at diagnosis.[32] Overall, they metastasize more frequently than epithelial ovarian cancers. In addition, the cancer markers used vary with tumor type: choriocarcinomas are monitored with beta-HCG and endodermal sinus tumors with alpha-fetoprotein.[26]
Germ-cell tumors are typically discovered when they become large, palpable masses. However, like sex cord tumors, they can cause ovarian torsion or hemorrhage and, in children, isosexual precocious puberty. They frequently metastasize to nearby lymph nodes, especially para-aortic and pelvic lymph nodes.[26] The most common symptom of germ cell tumors is subacute abdominal pain caused by the tumor bleeding, necrotizing, or stretching the ovarian capsule. If the tumor ruptures, causes significant bleeding, or torses the ovary, it can cause acute abdominal pain, which occurs in less than 10% of those with germ-cell tumors. They can also secrete hormones which change the menstrual cycle. In 25% of germ-cell tumors, the cancer is discovered during a routine examination and does not cause symptoms.[32]
Diagnosing germ cell tumors may be difficult because the normal menstrual cycle and puberty can cause pain and pelvic symptoms, and a young woman may even believe these symptoms to be those of pregnancy, and not seek treatment due to the stigma of teen pregnancy. Blood tests for alpha-fetoprotein, karyotype, human chorionic gonadotropin, and liver function are used to diagnose germ cell tumor and potential co-occurring gonadal dysgenesis. A germ cell tumor may be initially mistaken for a benign ovarian cyst.[32]
Dysgerminoma
[edit]
Dysgerminoma accounts for 35% of ovarian cancer in young women and is the most likely germ cell tumor to metastasize to the lymph nodes; nodal metastases occur in 25–30% of cases.[33][32] These tumors may have mutations in the KIT gene, a mutation known for its role in gastrointestinal stromal tumor. People with an XY karyotype and ovaries (gonadal dysgenesis) or an X,0 karyotype and ovaries (Turner syndrome) who develop a unilateral dysgerminoma are at risk for a gonadoblastoma in the other ovary, and in this case, both ovaries are usually removed when a unilateral dysgerminoma is discovered to avoid the risk of another malignant tumor. Gonadoblastomas in people with Swyer or Turner syndrome become malignant in approximately 40% of cases. However, in general, dysgerminomas are bilateral 10–20% of the time.[26][32]
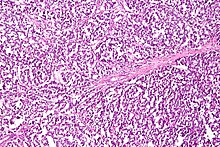
They are composed of cells that cannot differentiate further and develop directly from germ cells or from gonadoblastomas. Dysgerminomas contain syncytiotrophoblasts in approximately 5% of cases, and can therefore cause elevated hCG levels. On gross appearance, dysgerminomas are typically pink to tan-colored, have multiple lobes, and are solid. Microscopically, they appear identical to seminomas and very close to embryonic primordial germ cells, having large, polyhedral, rounded clear cells. The nuclei are uniform and round or square with prominent nucleoli and the cytoplasm has high levels of glycogen. Inflammation is another prominent histologic feature of dysgerminomas.[32]
Choriocarcinoma
[edit]Choriocarcinoma can occur as a primary ovarian tumor developing from a germ cell, though it is usually a gestational disease that metastasizes to the ovary. Primary ovarian choriocarcinoma has a poor prognosis and can occur without a pregnancy. They produce high levels of hCG and can cause early puberty in children or menometrorrhagia (irregular, heavy menstruation) after menarche.[32]
Immature (solid) teratoma
[edit]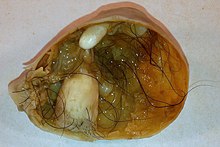
Immature, or solid, teratomas are the most common type of ovarian germ cell tumor, making up 40–50% of cases. Teratomas are characterized by the presence of disorganized tissues arising from all three embryonic germ layers: ectoderm, mesoderm, and endoderm; immature teratomas also have undifferentiated stem cells that make them more malignant than mature teratomas (dermoid cysts). The different tissues are visible on gross pathology and often include bone, cartilage, hair, mucus, or sebum, but these tissues are not visible from the outside, which appears to be a solid mass with lobes and cysts. Histologically, they have large amounts of neuroectoderm organized into sheets and tubules along with glia; the amount of neural tissue determines the histologic grade. Immature teratomas usually only affect one ovary (10% co-occur with dermoid cysts) and usually metastasize throughout the peritoneum. They can also cause mature teratoma implants to grow throughout the abdomen in a disease called growing teratoma syndrome; these are usually benign but will continue to grow during chemotherapy, and often necessitate further surgery. Unlike mature teratomas, immature teratomas form many adhesions, making them less likely to cause ovarian torsion. There is no specific marker for immature teratomas, but carcinoembryonic antigen (CEA), CA-125, CA19-9, or AFP can sometimes indicate an immature teratoma.[32]
Stage I teratomas make up the majority (75%) of cases and have the best prognosis, with 98% of patients surviving five years; if a Stage I tumor is also grade 1, it can be treated with unilateral surgery only. Stage II though IV tumors make up the remaining quarter of cases and have a worse prognosis, with 73–88% of patients surviving five years.[32]
Mature teratoma (dermoid cyst)
[edit]Mature teratomas, or dermoid cysts, are rare tumors consisting of mostly benign tissue that develop after menopause. The tumors consist of disorganized tissue with nodules of malignant tissue, which can be of various types. The most common malignancy is squamous cell carcinoma, but adenocarcinoma, basal-cell carcinoma, carcinoid tumor, neuroectodermal tumor, malignant melanoma, sarcoma, sebaceous tumor, and struma ovarii can also be part of the dermoid cyst. They are treated with surgery and adjuvant platinum chemotherapy or radiation.[32]
Yolk sac tumor/endodermal sinus tumor
[edit]Yolk sac tumors, formerly called endodermal sinus tumors, make up approximately 10–20% of ovarian germ cell malignancies, and have the worst prognosis of all ovarian germ cell tumors. They occur both before menarche (in one-third of cases) and after menarche (the remaining two-thirds of cases). Half of the people with yolk sac tumors are diagnosed in stage I. Typically, they are unilateral until metastasis, which occurs within the peritoneal cavity and via the bloodstream to the lungs. Yolk sac tumors grow quickly and recur easily, and are not easily treatable once they have recurred. Stage I yolk sac tumors are highly treatable, with a 5-year disease-free survival rate of 93%, but stage II-IV tumors are less treatable, with survival rates of 64–91%.[32]
Their gross appearance is solid, friable, and yellow, with necrotic and hemorrhagic areas. They also often contain cysts that can degenerate or rupture. Histologically, yolk sac tumors are characterized by the presence of Schiller-Duval bodies (which are pathognomonic for yolk sac tumors) and a reticular pattern. Yolk sac tumors commonly secrete alpha-fetoprotein and can be immunohistochemically stained for its presence; the level of alpha-fetoprotein in the blood is a useful marker of recurrence.[32]
Embryonal carcinoma
[edit]Embryonal carcinomas, a rare tumor type usually found in mixed tumors, develop directly from germ cells but are not terminally differentiated; in rare cases, they may develop in dysgenetic gonads. They can develop further into a variety of other neoplasms, including choriocarcinoma, yolk sac tumor, and teratoma. They occur in younger people, with an average age at diagnosis of 14, and secrete both alpha-fetoprotein (in 75% of cases) and hCG.[32]
Histologically, embryonal carcinoma appears similar to the embryonic disc, made up of epithelial, anaplastic cells in disorganized sheets, with gland-like spaces and papillary structures.[32]
Polyembryoma
[edit]Polyembryomas, the most immature form of teratoma and very rare ovarian tumors, are histologically characterized by having several embryo-like bodies with structures resembling a germ disk, yolk sac, and amniotic sac. Syncytiotrophoblast giant cells also occur in polyembryomas.[32]
Squamous cell carcinoma
[edit]Primary ovarian squamous cell carcinomas are rare and have a poor prognosis when advanced. More typically, ovarian squamous cell carcinomas are cervical metastases, areas of differentiation in an endometrioid tumor, or derived from a mature teratoma.[29]
Mixed tumors
[edit]Mixed tumors contain elements of more than one of the above classes of tumor histology. To be classed as a mixed tumor, the minor type must make up more than 10% of the tumor.[31] Though mixed carcinomas can have any combination of cell types, mixed ovarian cancers are typically serous/endometrioid or clear-cell/endometrioid.[29] Mixed germ cell tumors make up approximately 25–30% of all germ cell ovarian cancers, with combinations of dysgerminoma, yolk sac tumor, and/or immature teratoma. The prognosis and treatment vary based on the component cell types.[32]
Secondary ovarian cancer
[edit]Ovarian cancer can also be a secondary cancer, the result of metastasis from a primary cancer elsewhere in the body.[26] About 5–30% of ovarian cancers are due to metastases, while the rest are primary cancers.[80] Common primary cancers are breast cancer, colon cancer, appendiceal cancer, and stomach cancer (primary gastric cancers that metastasize to the ovary are called Krukenberg tumors).[26] Krukenberg tumors have signet ring cells and mucinous cells.[29] Endometrial cancer and lymphomas can also metastasize to the ovary.[81]
Borderline tumors
[edit]Ovarian borderline tumors, sometimes called low malignant potential (LMP) ovarian tumors, have some benign and some malignant features.[29] LMP tumors make up approximately 10–15% of all ovarian tumors.[31][70] They develop earlier than epithelial ovarian cancer, around the age of 40–49. They typically do not have extensive invasion; 10% of LMP tumors have areas of stromal microinvasion (<3mm, <5% of tumor). LMP tumors have other abnormal features, including increased mitosis, changes in cell size or nucleus size, abnormal nuclei, cell stratification, and small projections on cells (papillary projections). Serous and/or mucinous characteristics can be seen on histological examination, and serous histology makes up the overwhelming majority of advanced LMP tumors. More than 80% of LMP tumors are Stage I; 15% are stage II and III and less than 5% are stage IV.[29] Implants of LMP tumors are often non-invasive.[70]
Staging
[edit]Ovarian cancer is staged using the FIGO staging system and uses information obtained after surgery, which can include a total abdominal hysterectomy via midline laparotomy, removal of (usually) both ovaries and Fallopian tubes, (usually) the omentum, pelvic (peritoneal) washings, assessment of retroperitoneal lymph nodes (including the pelvic and para-aortic lymph nodes), appendectomy in suspected mucinous tumors, and pelvic/peritoneal biopsies for cytopathology.[28][26][31][82] Around 30% of ovarian cancers that appear confined to the ovary have metastasized microscopically, which is why even stage-I cancers must be staged completely.[26] 22% of cancers presumed to be stage I are observed to have lymphatic metastases.[31] The AJCC stage is the same as the FIGO stage. The AJCC staging system describes the extent of the primary tumor (T), the absence or presence of metastasis to nearby lymph nodes (N), and the absence or presence of distant metastasis (M).[83] The most common stage at diagnosis is stage IIIc, with over 70% of diagnoses.[26]
FIGO
[edit]
| Stage | Description | |||
|---|---|---|---|---|
| I | Cancer is completely limited to the ovary | |||
| IA | involves one ovary, capsule intact, no tumor on ovarian surface, negative washings | |||
| IB | involves both ovaries; capsule intact; no tumor on ovarian surface; negative washings | |||
| IC | tumor involves one or both ovaries | |||
| IC1 | surgical spill | |||
| IC2 | capsule has ruptured or tumor on ovarian surface | |||
| IC3 | positive ascites or washings | |||
| II | pelvic extension of the tumor (must be confined to the pelvis) or primary peritoneal tumor, involves one or both ovaries | |||
| IIA | tumor found on uterus or fallopian tubes | |||
| IIB | tumor elsewhere in the pelvis | |||
| III | cancer found outside the pelvis or in the retroperitoneal lymph nodes, involves one or both ovaries | |||
| IIIA | metastasis in retroperitoneal lymph nodes or microscopic extrapelvic metastasis | |||
| IIIA1 | metastasis in retroperitoneal lymph nodes | |||
| IIIA1(i) | the metastasis is less than 10 mm in diameter | |||
| IIIA1(ii) | the metastasis is greater than 10 mm in diameter | |||
| IIIA2 | microscopic metastasis in the peritoneum, regardless of retroperitoneal lymph node status | |||
| IIIB | metastasis in the peritoneum less than or equal to 2 cm in diameter, regardless of retroperitoneal lymph node status; or metastasis to liver or spleen capsule | |||
| IIIC | metastasis in the peritoneum greater than 2 cm in diameter, regardless of retroperitoneal lymph node status; or metastasis to liver or spleen capsule | |||
| IV | distant metastasis (i.e. outside of the peritoneum) | |||
| IVA | pleural effusion containing cancer cells | |||
| IVB | metastasis to distant organs (including the parenchyma of the spleen or liver), or metastasis to the inguinal and extra-abdominal lymph nodes |
-
Stage 1 ovarian cancer
-
Stage 2 ovarian cancer
-
Stage 3 ovarian cancer
-
Stage 4 ovarian cancer
AJCC/TNM
[edit]The AJCC/TNM staging system indicates where the tumor has developed, spread to lymph nodes, and metastasis.[31]
| Stage | Description | ||
|---|---|---|---|
| T | Primary tumor | ||
| Tx | Cannot be assessed | ||
| T0 | No evidence | ||
| T1 | Tumor limited to ovary/ovaries | ||
| T1a | One ovary with intact capsule, no surface tumor, and negative ascites/peritoneal washings | ||
| T1b | Both ovaries with intact capsules, no surface tumor, and negative ascites/peritoneal washings | ||
| T1c | One or both ovaries with ruptured capsule or capsules, surface tumor, positive ascites/peritoneal washings | ||
| T2 | Tumor is in ovaries and pelvis (extension or implantation) | ||
| T2a | Expansion to uterus or Fallopian tubes, negative ascites/peritoneal washings | ||
| T2b | Expansion in other pelvic tissues, negative ascites/peritoneal washings | ||
| T2c | Expansion to any pelvic tissue, positive ascites/peritoneal washings | ||
| T3 | Tumor is in ovaries and has metastasized outside the pelvis to the peritoneum (including the liver capsule) | ||
| T3a | Microscopic metastasis | ||
| T3b | Macroscopic metastasis less than 2 cm diameter | ||
| T3c | Macroscopic metastasis greater than 2 cm diameter | ||
| N | Regional lymph node metastasis | ||
| Nx | Cannot be assessed | ||
| N0 | No metastasis | ||
| N1 | Metastasis present | ||
| M | Distant metastasis | ||
| M0 | No metastasis | ||
| M1 | Metastasis present (excluding liver capsule, including liver parenchyma and cytologically confirmed pleural effusion) |
The AJCC/TNM stages can be correlated with the FIGO stages:[31]
| FIGO | T | N | M |
|---|---|---|---|
| I | T1 | N0 | M0 |
| IA | T1a | N0 | M0 |
| IB | T1b | N0 | M0 |
| IC | T1c | N0 | M0 |
| II | T2 | N0 | M0 |
| IIA | T2a | N0 | M0 |
| IIB | T2b | N0 | M0 |
| IIC | T2c | N0 | M0 |
| III | T3 | N0 | M0 |
| IIIA | T3a | N0 | M0 |
| IIIB | T3b | N0 | M0 |
| IIIC | T3c | N0/N1 | M0 |
| IV | Any | Any | M1 |
Grading
[edit]Grade 1 tumors have well differentiated cells (look very similar to the normal tissue) and are the ones with the best prognosis. Grade 2 tumors are also called moderately well-differentiated and they are made up of cells that resemble the normal tissue. Grade 3 tumors have the worst prognosis and their cells are abnormal, referred to as poorly differentiated.[84]
Metastasis in ovarian cancer is very common in the abdomen and occurs via exfoliation, where cancer cells burst through the ovarian capsule and are able to move freely throughout the peritoneal cavity. Ovarian cancer metastases usually grow on the surface of organs rather than the inside; they are also common on the omentum and the peritoneal lining. Cancer cells can also travel through the lymphatic system and metastasize to lymph nodes connected to the ovaries via blood vessels; i.e. the lymph nodes along the infundibulopelvic ligament, the broad ligament, and the round ligament. The most commonly affected groups include the paraaortic, hypogastric, external iliac, obturator, and inguinal lymph nodes. Usually, ovarian cancer does not metastasize to the liver, lung, brain, or kidneys unless it is a recurrent disease; this differentiates ovarian cancer from many other forms of cancer.[29]
Prevention
[edit]Women with strong genetic risk for ovarian cancer may consider the surgical removal of their ovaries as a preventive measure. This is often done after completion of childbearing years. This reduces the chances of developing both breast cancer (by around 50%) and ovarian cancer (by about 96%) in women at high risk. Women with BRCA gene mutations usually also have their Fallopian tubes removed at the same time (salpingo-oophorectomy), since they also have an increased risk of Fallopian tube cancer. However, these statistics may overestimate the risk reduction because of how they have been studied.[26][85]
Because a large fraction of ovarian cancers originate in the fallopian tubes,[86] the Ovarian Cancer Research Alliance and the Society of Gynecologic Oncology now recommend that women who are not planning on having additional children and who are undergoing surgical procedures such as tubal ligation (having one's "tubes tied") undergo opportunistic salpingo-oophorectomy — i.e. simultaneously having their fallopian tubes removed.[87] OVCARE — BC Cancer's multi-institutional and multidisciplinary ovarian research group — began recommending salpingectomy at the time of hysterectomy and in place of tubal ligation in 2010.[88]
Women with a significant family history for ovarian cancer are often referred to a genetic counselor to see if testing for BRCA mutations would be beneficial.[29] The use of oral contraceptives, the absence of 'periods' during the menstrual cycle, and tubal ligation reduce the risk.[89] There may an association of developing ovarian cancer and ovarian stimulation during infertility treatments. Endometriosis has been linked to ovarian cancers. Human papillomavirus infection, smoking, and talc have not been identified as increasing the risk for developing ovarian cancer.[28]
Screening
[edit]There is no simple and reliable way to test for ovarian cancer in women who do not have any signs or symptoms. Screening is not recommended in women who are at average risk, as evidence does not support a reduction in death and the high rate of false positive tests may lead to unneeded surgery, which is accompanied by its own risks.[19] Women with high risk of ovarian cancer that are currently identified based on family history and genetic testing may benefit from screening.[90] The Pap test does not screen for ovarian cancer.[27]
Ovarian cancer is usually only palpable in advanced stages.[29] This high risk group has benefited with earlier detection.[28][26][85] Screening is not recommended using CA-125 measurements, HE4 levels, ultrasound, or adnexal palpation in women who are at average risk. Currently there is no national screening programme in the UK for ovarian cancer. CA125 and transvaginal ultrasound can be utilised but there is minimal evidence to suggest this decreases mortality . More recently, the Risk of Ovarian Cancer Algorithm (ROMA) has been shown to detect earlier cancers using CA125 and age but again does not provide a robust measure to decrease mortality at present.[91]
Ovarian cancer has low prevalence, even in the high-risk group of women from the ages of 50 to 60 (about one in 2000), and screening of women with average risk is more likely to give ambiguous results than detect a problem that requires treatment. Because ambiguous results are more likely than detection of a treatable problem, and because the usual response to ambiguous results is invasive interventions, in women of average risk, the potential harms of having screening without an indication outweigh the potential benefits. The purpose of screening is to diagnose ovarian cancer at an early stage when it is more likely to be treated successfully.[26][85]
Screening with transvaginal ultrasound, pelvic examination, and CA-125 levels can be used instead of preventive surgery in women who have BRCA1 or BRCA2 mutations. This strategy has shown some success.[29]
Screening for CA125, a chemical released by ovarian tumours, with follow-up using ultrasound, was shown to be ineffective in reducing mortality in a large-scale UK study.[92]
There have been some screening trials that have used age, family history of ovarian cancer, and mutation status to identify target populations for screening.[90]
Management
[edit]Once it is determined that ovarian, fallopian tube or primary peritoneal cancer is present, treatment is scheduled by a gynecologic oncologist (a physician trained to treat cancers of a woman's reproductive system). Gynecologic oncologists can perform surgery on and give chemotherapy to women with ovarian cancer. A treatment plan is developed.[93]
Treatment usually involves surgery and chemotherapy, and sometimes radiotherapy, regardless of the subtype of ovarian cancer.[70][94] Surgical treatment may be sufficient for well-differentiated malignant tumors and confined to the ovary. Addition of chemotherapy may be required for more aggressive tumors confined to the ovary. For patients with advanced disease, a combination of surgical reduction with a combination chemotherapy regimen is standard. Since 1980, platinum-based drugs have had an important role in treating ovarian cancer.[citation needed] Borderline tumors, even following spread outside of the ovary, are managed well with surgery, and chemotherapy is not seen as useful.[95] Second-look surgery and maintenance chemotherapy have not been shown to provide benefit.[29]
Surgery
[edit]Surgery has been the standard of care for decades and may be necessary for obtaining a specimen for diagnosis. The surgery depends upon the extent of nearby invasion of other tissues by the cancer when it is diagnosed. This extent of the cancer is described by assigning it a stage, the presumed type, and the grade of cancer. The gynecological surgeon may remove one (unilateral oophorectomy) or both ovaries (bilateral oophorectomy). The Fallopian tubes (salpingectomy), uterus (hysterectomy), and the omentum (omentectomy) may also be removed. Typically, all of these organs are removed.[96]
For those who test positive for faulty BRCA1 or BRCA2 genes having a risk-reducing surgery is an option. An increasing number of women choose this. At the same time the average waiting time for undergoing the procedure is two-years which is much longer than recommended.[97][98]
For low-grade, unilateral stage-IA cancers, only the involved ovary (which must be unruptured) and Fallopian tube will be removed. This can be done especially in young people who wish to preserve their fertility. However, a risk of microscopic metastases exists and staging must be completed.[28] If any metastases are found, a second surgery to remove the remaining ovary and uterus is needed.[95] Tranexamic acid can be administered prior to surgery to reduce the need for blood transfusions due to blood loss during the surgery.[31]
If a tumor in a premenopausal woman is determined to be a low malignant potential tumor during surgery, and it is clearly stage I cancer, only the affected ovary is removed. For postmenopausal women with low malignant potential tumors, hysterectomy with bilateral salpingo-oophorectomy is still the preferred option. During staging, the appendix can be examined or removed. This is particularly important with mucinous tumors.[29] In children or adolescents with ovarian cancer, surgeons typically attempt to preserve one ovary to allow for the completion of puberty, but if the cancer has spread, this is not always possible. Dysgerminomas, in particular, tend to affect both ovaries: 8–15% of dysgerminomas are present in both ovaries.[33] People with low-grade (well-differentiated) tumors are typically treated only with surgery,[26] which is often curative.[70] In general, germ cell tumors can be treated with unilateral surgery unless the cancer is widespread or fertility is not a factor.[32] In women with surgically staged advanced epithelial ovarian cancer (stages III and IV), studies suggest all attempts should be made to reach complete cytoreduction (surgical efforts to remove the bulk of the tumor).[99]
In advanced cancers, where complete removal is not an option, as much tumor as possible is removed in a procedure called debulking surgery. This surgery is not always successful, and is less likely to be successful in women with extensive metastases in the peritoneum, stage- IV disease, cancer in the transverse fissure of the liver, mesentery, or diaphragm, and large areas of ascites. Debulking surgery has usually only been done once[28] but a recent study has shown a longer overall survival in recurrent ovarian cancer when surgery combined with chemotherapy was performed compared to treatment with chemotherapy alone.[100] Computed tomography (abdominal CT) is often used to assess if primary debulking surgery is possible, but low certainty evidence also suggests fluorodeoxyglucose‐18 (FDG) PET/CT and MRI may be useful as an addition for assessing macroscopic incomplete debulking.[101] More complete debulking is associated with better outcomes: women with no macroscopic evidence of disease after debulking have a median survival of 39 months, as opposed to 17 months with less complete surgery.[26] By removing metastases, many cells that are resistant to chemotherapy are removed, and any clumps of cells that have died are also removed. This allows chemotherapy to better reach the remaining cancer cells, which are more likely to be fast-growing and therefore chemosensitive.[29]
Interval debulking surgery is another protocol used, where neoadjuvant chemotherapy is given, debulking surgery is performed, and chemotherapy is finished after debulking.[95] Though no definitive studies have been completed, it is shown to be approximately equivalent to primary debulking surgery in terms of survival and shows slightly lower morbidity.[29] Previous studies have shown different results from primary debulking versus interval debulking. The ongoing TRUST study may clarify selection criteria for each surgical approach.[102]
There are several different surgical procedures that can be employed to treat ovarian cancer. For stage I and II cancer, laparoscopic (keyhole) surgery can be used, but metastases may not be found. For advanced cancer, laparoscopy is not used, since debulking metastases requires access to the entire peritoneal cavity. Depending on the extent of the cancer, procedures may include a bilateral salpingo-oophorectomy, biopsies throughout the peritoneum and abdominal lymphatic system, omentectomy, splenectomy, bowel resection, diaphragm stripping or resection, appendectomy, or even a posterior pelvic exenteration.[29]
To fully stage ovarian cancer, lymphadenectomy can be included in the surgery, However, it has not offered benefits in terms of survival in either HGSOC[103] or LGSOC.[104] This is particularly important in germ cell tumors because they frequently metastasize to nearby lymph nodes.[26]
If ovarian cancer recurs, secondary surgery is sometimes a treatment option. This depends on how easily the tumor can be removed, how much fluid has accumulated in the abdomen, and overall health.[28] Effectivenes of this surgery depends on surgical technique, completeness of cytoreduction, and extent of disease.[105] It also can be helpful in people who had their first surgery done by a generalist and in epithelial ovarian cancer.[31] Secondary surgery can be effective in dysgerminomas and immature teratomas.[32] Evidence suggests surgery in recurrent epithelial ovarian cancer may be associated with prolonging life in some women with platinum-sensitive disease.[106]
The major side effect of oophorectomy in younger women is early menopause, which can cause osteoporosis. After surgery, hormone replacement therapy can be considered, especially in younger women. This therapy can consist of a combination of estrogen and progesterone, or estrogen alone. Estrogen alone is safe after hysterectomy; when the uterus is still present, unopposed estrogen dramatically raises the risk of endometrial cancer.[28] Estrogen therapy after surgery does not change survival rates.[31] People having ovarian cancer surgery are typically hospitalized afterwards for 3–4 days and spend around a month recovering at home.[107] Surgery outcomes are best at hospitals that do a large number of ovarian cancer surgeries.[29]
It is unclear if laparoscopy or laparotomy is better or worse for FIGO stage I ovarian cancer.[108] There is also no apparent difference between total abdominal hysterectomy and supracervical hysterectomy for advanced cancers. Approximately 2.8% of people having a first surgery for advanced ovarian cancer die within two weeks of the surgery (2.8% perioperative mortality rate).[31] More aggressive surgeries are associated with better outcomes in advanced (stage III or IV) ovarian cancer.[29]
Chemotherapy
[edit]Chemotherapy has been a general standard of care for ovarian cancer for decades, although with variable protocols. Chemotherapy is used after surgery to treat any residual disease, if appropriate. In some cases, there may be reason to perform chemotherapy first, followed by surgery. This is called "neoadjuvant chemotherapy", and is common when a tumor cannot be completely removed or optimally debulked via surgery. Though it has not been shown to increase survival, it can reduce the risk of complications after surgery. If a unilateral salpingo-oophorectomy or other surgery is performed, additional chemotherapy, called "adjuvant chemotherapy", can be given.[28][31] Adjuvant chemotherapy is used in stage 1 cancer typically if the tumor is of a high histologic grade (grade 3) or the highest substage (stage 1c), provided the cancer has been optimally staged during surgery.[31][95] Bevacizumab may be used as an adjuvant chemotherapy if the tumor is not completely removed during surgery or if the cancer is stage IV; it can extend progression-free survival but has not been shown to extend overall survival.[31] Chemotherapy is curative in approximately 20% of advanced ovarian cancers;[29] it is more often curative with malignant germ cell tumors than epithelial tumors.[32] Adjuvant chemotherapy has been found to improve survival and reduce the risk of ovarian cancer recurring compared to no adjuvant therapy in women with early stage epithelial ovarian cancer.[109]
Chemotherapy in ovarian cancer typically consists of platins, a group of platinum-based drugs, combined with non-platins.[110] Platinum-based drugs have been used since 1980. Common therapies can include paclitaxel, cisplatin, topotecan, doxorubicin, epirubicin, and gemcitabine. Carboplatin is typically given in combination with either paclitaxel or docetaxel; the typical combination is carboplatin with paclitaxel.[28][31] Carboplatin is superior to cisplatin in that it is less toxic and has fewer side effects, generally allowing for an improved quality of life in comparison, though both are similarly effective.[31] Three-drug regimens have not been found to be more effective,[28] and platins alone or nonplatins alone are less effective than platins and nonplatins in combination.[31] There is a small benefit in platinum‐based chemotherapy compared with non‐platinum therapy.[111] Platinum combinations can offer improved survival over single platinum. In people with relapsed ovarian cancer, evidence suggests topotecan has a similar effect on overall survival as paclitaxel and topotecan plus thalidomide, whilst it is superior to treosulfan and not as effective as pegylated liposomal doxorubicin in platinum-sensitive people.[112]
Chemotherapy can be given intravenously or in the peritoneal cavity.[26] Though intraperitoneal chemotherapy is associated with longer progression-free survival and overall survival, it also causes more adverse side effects than intravenous chemotherapy.[31] It is mainly used when the cancer has been optimally debulked. Intraperitoneal chemotherapy can be highly effective because ovarian cancer mainly spreads inside the peritoneal cavity, and higher doses of the drugs can reach the tumors this way.[29]
Chemotherapy can cause anemia; intravenous iron has been found to be more effective than oral iron supplements in reducing the need for blood transfusions.[31] Typical cycles of treatment involve one treatment every 3 weeks, repeated for 6 weeks or more.[113] Fewer than 6 weeks (cycles) of treatment is less effective than 6 weeks or more.[31] Germ-cell malignancies are treated differently than other ovarian cancers — a regimen of bleomycin, etoposide, and cisplatin (BEP) is used with 5 days of chemotherapy administered every 3 weeks for 3 to 4 cycles.[26][32] Chemotherapy for germ cell tumors has not been shown to cause amenorrhea, infertility, birth defects, or miscarriage.[32] Maintenance chemotherapy has not been shown to be effective.[31]
In people with BRCA mutations, platinum chemotherapy is more effective.[28] Germ-cell tumors and malignant sex-cord/stromal tumors are treated with chemotherapy, though dysgerminomas and sex-cord tumors are not typically very responsive.[26][33]
Platinum-sensitive or platinum-resistant
[edit]If ovarian cancer recurs, it is considered partially platinum-sensitive or platinum-resistant, based on the time since the last recurrence treated with platins: partially platinum-sensitive cancers recurred 6–12 months after last treatment, and platinum-resistant cancers have an interval of less than 6 months. Second-line chemotherapy can be given after the cancer becomes symptomatic because no difference in survival is seen between treating asymptomatic (elevated CA-125) and symptomatic recurrences.[medical citation needed]
For platinum-sensitive tumors, platins are the drugs of choice for second-line chemotherapy, in combination with other cytotoxic agents. Regimens include carboplatin combined with pegylated liposomal doxorubicin, gemcitabine, or paclitaxel.[26] Carboplatin-doublet therapy can be combined with paclitaxel for increased efficacy in some cases. Another potential adjuvant therapy for platinum-sensitive recurrences is olaparib, which may improve progression-free survival but has not been shown to improve overall survival.[31] (Olaparib, a PARP inhibitor, was approved by the US FDA for use in BRCA-associated ovarian cancer that had previously been treated with chemotherapy.[114][115]) For recurrent germ cell tumors, an additional 4 cycles of BEP chemotherapy is the first-line treatment for those who have been treated with surgery or platins.
If the tumor is determined to be platinum-resistant, vincristine, dactinomycin, and cyclophosphamide (VAC) or some combination of paclitaxel, gemcitabine, and oxaliplatin may be used as a second-line therapy.[32]
For platinum-resistant tumors, there are no high-efficacy chemotherapy options. Single-drug regimens (doxorubicin or topotecan) do not have high response rates,[28] but single-drug regimens of topotecan, pegylated liposomal doxorubicin, or gemcitabine are used in some cases.[26][31] Topotecan cannot be used in people with an intestinal blockage. Paclitaxel used alone is another possible regimen, or it may be combined with liposomal doxorubicin, gemcitabine, cisplatin, topotecan, etoposide, or cyclophosphamide.[113] ( See also Palliative care below.)
Novel agents are being developed to inhibit the development of new blood vessels (angiogenesis) for women with ovarian cancer who develop resistance to chemotherapy drugs. As of 2023 there would appear to be a role for these treatments but due to the additional treatment burden and cost of maintenance treatments the risk versus benefits require careful consideration.[116]
Novocure sponsored a phase-2 trial proving efficacy of tumor treating fields in recurrent platinum-resistant ovarian carcinoma, in conjunction with weekly paclitaxel chemotherapy.[45]
Radiation therapy
[edit]Dysgerminomas are most effectively treated with radiation,[33] though this can cause infertility and is being phased out in favor of chemotherapy.[26] Radiation therapy does not improve survival in people with well-differentiated tumors.[26]
In stage 1c and 2 cancers, radiation therapy is used after surgery if there is the possibility of residual disease in the pelvis but the abdomen is cancer-free. Radiotherapy can also be used in palliative care of advanced cancers. A typical course of radiotherapy for ovarian cancer is 5 days a week for 3–4 weeks. Common side effects of radiotherapy include diarrhea, constipation, and frequent urination.[117]
Hormonal therapy
[edit]Despite the fact that 60% of ovarian tumors have estrogen receptors, ovarian cancer is only rarely responsive to hormonal treatments. A Cochrane review found a lack of evidence about the effects of tamoxifen in people with relapsed ovarian cancer.[118] Estrogen alone does not have an effect on the cancer, and tamoxifen and letrozole are rarely effective.[28] "Some women with borderline malignancy ovarian cancer and stromal ovarian cancer may receive hormonal therapy."[96]
Immunotherapy
[edit]Immunotherapy is a topic of current research in ovarian cancer. In some cases, the antibody drug bevacizumab, though still a topic of active research, is used to treat advanced cancer along with chemotherapy.[95] It has been approved for this use in the European Union.[119]
Follow-up
[edit]Specific follow-up depends on, for example, the type and stage of ovarian cancer, the treatment, and the presence of any symptoms. Usually, a check-up appointment is made about every 2 to 3 months initially, followed by twice per year for up to 5 years.[120] For epithelial ovarian cancers, the most common test upon follow-up is CA-125 level. However, treatment based only on elevated CA-125 levels and not any symptoms can increase side effects without any prolongation of life, so the implication of the outcome of a CA-125 test can be discussed before taking it.[121] The recommendation as of 2014 is recurrent cancer may be present if the CA-125 level is twice normal.[28] Treating a recurrence detected by CA-125 does not improve survival.[31]
For women with germ-cell tumors, follow-up tests generally include alpha-fetoprotein (AFP) and/or human chorionic gonadotropin. For women with stromal cancers, tests for hormones like estrogen, testosterone, and inhibin are sometimes helpful.[121] Inhibin can also be useful for monitoring the progress of sex-cord tumors, along with Müllerian inhibiting substance. AFP can also be used to monitor Sertoli-Leydig tumors.[26] In dysgerminomas, lactate dehydrogenase and its two isozymes (LDH-1 and LDH-2) are used to test for recurrence.[32]
Women with ovarian cancer may not need routine surveillance imaging to monitor the cancer unless new symptoms appear or tumor markers begin rising.[122] Imaging without these indications is discouraged because it is unlikely to detect a recurrence, improve survival, and because it has its own costs and side effects.[122] However, CT imaging can be used if desired, though this is not common.[28] If a tumor is easily imaged, imaging may be used to monitor the progress of treatment.[123]
Palliative care
[edit]Palliative care focuses on relieving symptoms and increasing or maintaining quality of life. This type of treatment's purpose is not to cure the cancer but to make the woman more comfortable while living with cancer that can not be cured. It has been recommended as part of the treatment plan for any person with advanced ovarian cancer or patients with significant symptoms.[124] In platinum-refractory and platinum-resistant cases, other palliative chemotherapy is the main treatment.[29][96]
Palliative care can entail treatment of symptoms and complications of the cancer, including pain, nausea, constipation, ascites, bowel obstruction, edema, pleural effusion, and mucositis. Especially if the cancer advances and becomes incurable, treatment of symptoms becomes one of the main goals of therapy. Palliative care can also entail helping with decision-making such as if or when hospice care is appropriate, and the preferred place for the patient at end of life care.[31]
Bowel obstruction can be treated with palliative surgery (colostomy, ileostomy, or internal bypass) or medicine, but surgery has been shown to increase survival time.[28][31] Palliative surgery may result in short bowel syndrome, enterocutaneous fistula, or re-obstruction; or may not be possible due to the extent of obstruction.[29] Other treatments of complications can include total parenteral nutrition, a low-residue diet, palliative gastrostomy, and adequate pain control.[28] Bowel obstruction can also be treated with octreotide when palliative surgery is not an option. Cancer can also block the ureters, which can be relieved by a nephrostomy or a ureteric stent. Ascites can be relieved by repeated paracentesis or placement of a drain to increase comfort.[125] Pleural effusions can be treated in a similar manner, with repeated thoracentesis, pleurodesis, or placement of a drain.[29]
Radiation therapy can be used as part of the palliative care of advanced ovarian cancer, since it can help to shrink tumors that are causing symptoms.[96] Palliative radiotherapy typically lasts for only a few treatments, a much shorter course of therapy than non-palliative radiotherapy.[117] It is also used for palliation of chemotherapy-resistant germ cell tumors.[32]
Psychosocial care
[edit]Ovarian cancer has a significant effect on quality of life, psychological health and well-being. Interventions are available to help with the needs and social support. Many ovarian cancer survivors report a good quality of life and optimism. Others reported a "spiritual change" that helped them find meaning during their experience. Others have described their loss of faith after their diagnosis with ovarian cancer. Those who have gone through treatment sometimes experience social isolation but benefit from having relationships with other survivors. Frustration and guilt have been described by some who have expressed their inability to care for their family.[126]
Self-esteem and body image changes can occur due to hair loss, removal of ovaries and other reproductive structures, and scars. There is some improvement after hair grows in. Sexual issues can develop. The removal of ovaries results in surgically induced menopause that can result in painful intercourse, vaginal dryness, loss of sexual desire and being tired. Though prognosis is better for younger survivors, the impact on sexuality can still be substantial.[126]
Anxiety, depression and distress is present in those surviving ovarian cancer at higher rates than in the general population.[126][127] The same psychosocial problems can develop in family members. Emotional effects can include a fear of death, sadness, memory problems and difficulty in concentrating. When optimism was adopted by those at the beginning of their treatment, they were less likely to develop distress. Those who have fear of the cancer recurring may have difficulty in expressing joy even when disease-free. The more treatments that a woman undergoes, the more likely the loss of hope is expressed. Women often can cope and reduce negative psychosocial effects by a number of strategies. Activities such as traveling, spending additional time with family and friends, ignoring statistics, journaling and increasing involvement in spiritually-based events are adaptive.[ 126 ]
Женщины с раком яичников также могут испытывать трудности со своей диетой и подвержены риску недоедания. [ 128 ]
Прогноз
[ редактировать ]
Рак яичников обычно имеет относительно плохой прогноз . Это непропорционально смертельно, потому что в нем отсутствует какое -либо четкое раннее обнаружение или скрининг, что означает, что большинство случаев не диагностируются до тех пор, пока они не достигнут передовых стадий. [ 122 ] [ 28 ]
Рак яичников метастазирует в начале своего развития, часто до того, как он был диагностирован. Высококачественные опухоли метастазируются более легко, чем опухоли низкого уровня. Как правило, опухолевые клетки начинают метастазироваться, растут в брюшной полости. [ 26 ] Более 60% женщин, занимающихся раком яичников, имеют рак III или IV стадии, когда он уже распространился за яичники. Рак яичников теряет клетки в естественную жидкость в брюшной полости. Эти клетки могут затем имплантировать на другие брюшные (брюшные) структуры, включая матку, мочевой мочевой пузырь , кишечник , слизистую оболочку стенки кишечника и Omentum , образуя новые рост опухоли до того, как рак будет подозреваться.
Пятилетняя выживаемость на всех этапах рака яичников составляет 46%; Процент выживаемости на годику составляет 72%, а десятилетняя выживаемость составляет 35%. [ 130 ] В случаях, когда диагноз ставится на ранних стадиях заболевания, когда рак все еще ограничен первичным местом, пятилетняя выживаемость составляет 92,7%. [ 131 ] Около 70% женщин с прогрессирующим заболеванием реагируют на начальное лечение, большинство из которых достигают полной ремиссии, но половина этих женщин испытывает рецидив через 1–4 года после лечения. [ 26 ] Метастазирование головного мозга чаще встречается при раке III/IV стадии, но все еще может возникать при раке, установленных в I/II. Люди с метастазами головного мозга переживают среднюю 8,2 месяца, хотя хирургия, химиотерапия и лучевая терапия мозга могут улучшить выживаемость. [ 31 ]
Выживаемость рака яичников значительно варьируется в зависимости от подтипа. Дисгерминомы имеют очень благоприятный прогноз. На ранних стадиях у них пятилетняя выживаемость составляет 96,9%. [ 33 ] Около двух третей дисгерминомы диагностируется на стадии I. [ 32 ] Дисгерминомы на стадии III имеют пятилетнюю выживаемость 61%; При обработке химиотерапии BEP после неполного хирургического удаления дискгерминомы имеют 95% двухлетнюю выживаемость. Секс-корковые злокачественные новообразования также имеют благоприятный прогноз; Поскольку они медленно растут, даже те, у кого метастатические заболевания, могут выжить десять или более лет. [ 26 ] Низкие злокачественные потенциальные опухоли обычно имеют плохой прогноз только тогда, когда в брюшной полости обнаружены инвазивные опухолевые имплантаты. [ 29 ]
Осложнения рака яичников могут включать распространение рака на другие органы, прогрессирующую потерю функции различных органов, асцит и инструкций кишечника, которые могут быть смертельными. Кишечные препятствия в нескольких местах являются наиболее распространенной непосредственной причиной смерти. [ 28 ] Инструкция кишечника при раке яичников может быть либо истинной обструкцией, где опухоль блокирует просвет кишечника , либо псевдо-обтяжением, когда опухоль предотвращает нормальную перистальтику . [ 132 ] Непрерывное накопление асцита может быть обработано путем размещения канализации, который может быть самостоятельно дренирован. [ 28 ]
Прогностические факторы
[ редактировать ]Существует ряд прогностических факторов при раке яичников. Положительные прогностические факторы - те, которые указывают на более высокие шансы на выживаемость - включают отсутствие остаточного заболевания после операции (стадия III/IV), полную макроскопическую резекцию (стадия IV), мутации BRCA2, молодой возраст (до 45 лет), бессмысленный тип, низкий гистологический уровень, степень Ранняя стадия, совпадение с раком эндометрия и низкие уровни CA-125. Существуют противоречивые доказательства для BRCA1 как прогностического фактора. И наоборот, негативные прогностические факторы-те, которые указывают на худшую вероятность выживания-включают разрыв капсулы яичников во время операции, старший возраст (старше 45 лет), муциновый тип, стадия IV, высокий гистологический класс, тип чистых клеток, вовлечение верхней полосы живота , высокие уровни CA-125, наличие опухолевых клеток в крови и повышенная циклооксигеназа-2 . [ 31 ]
Экспрессия различных мРНК также может быть прогностическим для рака яичников. Высокие уровни Drosha и Dicer связаны с улучшением выживаемости, тогда как высокие уровни полимеразы LET-7B , HIF1A , EPHA1 и поли (ADP-рибозы) связаны с худшей выживаемостью. Рак, положительный для WT1, несут худший прогноз; Эстроген-рецептор положительный рак имеет лучший прогноз. [ 31 ]
Выживаемость
[ редактировать ]Общая пятилетняя выживаемость для всех типов рака яичников представлена ниже на стадии и гистологической степени: [ 26 ]
| Этап | Выживание |
|---|---|
| я | 90–95% |
| II | 70–80% |
| Iii | 20–50% |
| IV | 1–5% |
| Гистологический класс | Выживание |
|---|---|
| Низкий уровень | 88% |
| Промежуточный класс | 58% |
| Высокий класс | 27% |
показатели выживаемости, приведенные ниже для различных типов рака яичников По данным Американского общества рака, . [ 129 ] Они поступают из Национального института рака , SEER , и основаны на пациентах с диагнозом с 2004 по 2010 год.
| Инвазивный эпителиальный рак яичников | |
|---|---|
| Этап | Относительно пятилетний Выживаемость |
| я | 90% |
| Это | 94% |
| Одинокий | 92% |
| IC | 85% |
| II | 70% |
| Iia | 78% |
| IIB | 73% |
| Iii | 39% |
| IIIA | 59% |
| IIIB | 52% |
| IIIC | 39% |
| IV | 17% |
| Яичники стромальных опухолей | |
|---|---|
| Этап | Относительно пятилетний Выживаемость |
| я | 95% |
| II | 78% |
| Iii | 65% |
| IV | 35% |
| Опухоли зародышевых клеток яичника | |
|---|---|
| Этап | Относительно пятилетний Выживаемость |
| я | 98% |
| II | 94% |
| Iii | 87% |
| IV | 69% |
| Фаллопиевая трубка карцинома | |
|---|---|
| Этап | Относительно пятилетний Выживаемость |
| я | 87% |
| II | 86% |
| Iii | 52% |
| IV | 40% |
| Низкий злокачественный потенциал опухоли [ 29 ] | |
|---|---|
| Этап | Относительно пятилетний Выживаемость |
| я | 99% |
| II | 98% |
| Iii | 96% |
| IV | 77% |
Показатели повторения
[ редактировать ]Рак яичников часто повторяется после лечения. В целом, за 5-летний период 20% рака I и II стадии повторяются. Большинство рецидивов в животе. [ 29 ] Если рецидив возникает при прогрессирующем заболевании, это обычно происходит в течение 18 месяцев после начального лечения ( выживаемость без прогрессирования ). Рецидивы можно лечить, но бескресный интервал имеет тенденцию сокращать, а хеморезистентность увеличивается с каждым рецидивом. [ 28 ] Когда дисгерминома повторяется, она, скорее всего, повторяется в течение года после диагноза, а другие опухоли злокачественных зародышевых клеток рецидились в течение 2 лет 90% случаев. Опухоли зародышевых клеток, кроме дисгерминомы, имеют плохой прогноз при рецидиве, с 10% долгосрочной выживаемостью. [ 32 ] Низкий злокачественный потенциал опухоли редко рецидирует, даже когда выбор операции по сдерживанию фертильности является выбором. 15% опухолей LMP рецидится после односторонней хирургии в ранее незатронутом яичнике, и их обычно легко лечится операцией. Более продвинутые опухоли могут занять до 20 лет, чтобы рецидивировать, если они вообще рецидивируют и получают только хирургическое вмешательство, если опухоль не изменила его гистологические характеристики или очень быстро выросла. В этих случаях, и когда есть значительный асцит, также может использоваться химиотерапия. Рецидив обычно обозначается повышением уровня CA-125, а затем переходит к симптоматическому рецидиву в течение 2–6 месяцев. [ 29 ] Рецидивирующие секс-силовые опухоли, как правило, не реагируют на лечение, но не агрессивны. [ 32 ]
Это самый смертельный гинекологический рак. [ 29 ]
Эпидемиология
[ редактировать ]
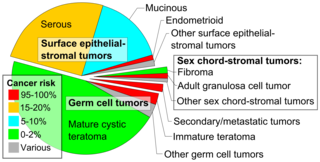
Во всем мире, в 2018 году заболеваемость раком яичников составляла 6,6 на 100 000, а смертность составляла 3,9. [ 135 ] Во всем мире около 160 000 человек погибли от рака яичников в 2010 году. Это было увеличено по сравнению с 113 000 в 1990 году. [ 136 ] Количество новых случаев в год в Европе составляет приблизительно 5–15 на 100 000 женщин. [ 31 ] В Европе Литва , Латвия , Ирландия , Словакия и Чешская Республика имеют самые высокие случаи рака яичников, тогда как Португалия и Кипр имеют самые низкие случаи. [ 31 ] В 2008 году пятилетняя выживаемость составила 44%. Это увеличилось с 1977 года, когда выживаемость составляла 36%. [ 126 ]
Соединенные Штаты
[ редактировать ]

В 2022 году в Соединенных Штатах было диагностировано 19 880 новых случаев, а 12 810 женщин умерли от рака яичников. [ 138 ] 5-летняя относительная выживаемость составляет 49,7%. [ 139 ] Около 57% случаев метастазировали во время диагноза. [ 139 ]
В 2014 году более 220 000 диагнозов эпителиального рака яичников были выполнены ежегодно. [ 28 ] Общий риск жизни в США составляет около 1,6% [ 26 ] [ 31 ] В США рак яичников поражает 1,3–1,4% и является причиной смерти около 1% женщин. [ 29 ] [ 140 ] В Соединенных Штатах это также пятый самый распространенный рак у женщин, но четвертая по величине причина смерти от рака. [ 31 ] Это снижение сделало его девятым чащевым раком у женщин. [ 29 ]
Риски от разработки конкретных типов рака яичников варьируются. Опухоли зародышевых клеток и половые пузырьковые опухоли встречаются реже, чем эпителиальные опухоли. Количество новых случаев в год в США составляет 0,4 на 100 000 женщин и 0,2 на 100 000 женщин соответственно. У молодых людей половые корковые стромальные опухоли и опухоли зародышевых клеток всего 1% от общего рака яичников. [ 32 ] Рак яичников составляет приблизительно 4% рака, диагностированных у женщин. [ 31 ]
Великобритания
[ редактировать ]Это 5-й самый распространенный рак у женщин Великобритании (около 7100 были диагностированы в 2011 году) и 5-й по величине причина смерти от рака у женщин (около 4300 человек погибли в 2012 году). [ 141 ] [ 31 ] [ 34 ] Уровень заболеваемости по всему населению Великобритании составляет 21,6 на 100 000.
По состоянию на 2014 год в Великобритании приходилось примерно 7 000–7 100 ежегодных диагнозов с 4200 смертей. [ 28 ] [ 34 ] Статья 2022 года из «Таймс» размещала оценку в 7500 новых случаев ежегодно в Британии. [ 142 ] Ранние симптомы часто принимаются за общие состояния, такие как цистит или синдром раздраженного кишечника, и около 40 процентов британских женщин ошибочно считают, что скрининг шейки матки обнаруживает рак яичников, увеличившись с 30 процентов в 2016 году. [ 142 ] Ашкенази еврейские женщины несут мутированные аллели BRCA в пять раз чаще, чем остальная часть населения, что дает им более высокий риск развития рака яичников. [ 28 ]
Этническая принадлежность
[ редактировать ]Чернокожие женщины вдвое больше риска для половых пусковых-силовых опухолей по сравнению с не черными женщинами. [ 32 ] Самая высокая распространенность заключается в кавказских и латиноамериканских женщинах, за которыми следуют афроамериканские и азиатские женщины. [ 135 ] Самая высокая смертность от рака яичников заключается в афро-американских женщинах. [ 135 ]
Пожилые женщины
[ редактировать ]В США уровень заболеваемости у женщин старше 50 лет составляет приблизительно 33 на 100 000. [ 143 ] Уровень рака яичников в период между 1993 и 2008 годами снизился у женщин 40–49 возрастной когорты и в возрастной когорте 50–64. [ 28 ] Рак яичников чаще всего диагностируется после менопаузы, [ 34 ] В возрасте от 60 до 64 лет. Девяносто процентов рака яичников встречается у женщин старше 45 и 80% у женщин старше 50 лет. [ 31 ] Пожилые женщины с большей вероятностью будут представлены с усовершенствованным раком яичников. [ 20 ]
Во время беременности
[ редактировать ]Злокачественные опухоли зародышевых клеток являются типом рака яичников, скорее всего, возникают во время беременности . Обычно они диагностируются, когда на обследовании обнаружена аднексальная масса (у 1–2% всех беременностей), опухоль наблюдается на ультразвуковом исследовании, или уровень альфа-фетопротеина повышается. Дермоидные кисты и дисгерминомы являются наиболее распространенными опухолями зародышевых клеток во время беременности. Опухоли зародышевых клеток, диагностированные во время беременности, вряд ли будут метастазированы и могут лечиться хирургическим вмешательством, а в некоторых случаях - химиотерапия, которая несет риск врожденных дефектов. Опухоли желточного мешка и незрелые тератомы растут особенно быстро и обычно получают химиотерапию даже во время беременности; Тем не менее, дисгерминомы, которые были оптимально дебютировать, могут рассматриваться после родов. [ 32 ]
Другие животные
[ редактировать ]Опухоли яичников сообщались в для лошадей кобыле . Сообщается о типах опухолей включает тератому, [ 144 ] [ 145 ] Конкуренция , [ 146 ] и особенно опухоль гранулеза . [ 147 ] [ 148 ] [ 149 ] [ 150 ] [ 151 ] [ чрезмерные цитаты ]
Исследовать
[ редактировать ]Скрининг
[ редактировать ]Разрабатывается скрининг с помощью гистероскопии для получения образцов клеток, полученных для гистологического исследования. Это похоже на текущий мазок PAP, который используется для обнаружения рака шейки матки. [ 152 ] Совместное исследование в Великобритании по скринингу рака яичников проверяет метод скрининга, который сочетает в себе анализы крови CA-125 с трансвагинальным ультразвуком. [ 28 ] Другие исследования показывают, что эта процедура скрининга может быть эффективной. [ 119 ] Хотя результаты, опубликованные в 2015 году, не были окончательными, были некоторые доказательства того, что скрининг может спасти жизни в долгосрочной перспективе. [ 153 ] В результате исследование было расширено и опубликует окончательные результаты в конце 2019 года. Одной из основных проблем с скринингом является неясное прогрессирование заболевания от стадии I (неинвазивного) до стадии III (инвазивной), и это может Нельзя найти рак, прежде чем они достигнут стадии III. Другая проблема заключается в том, что методы скрининга, как правило, находят слишком много подозрительных поражений, большинство из которых не являются раком, но злокачественные новообразования можно оценить только при операции. [ 28 ] Метод ROCA в сочетании с трансвагинальной ультрасонографией исследуется у женщин с высоким риском, чтобы определить, является ли это жизнеспособным методом скрининга. Он также исследуется у женщин с нормальным риском, поскольку он показал перспективу в более широком населении. [ 29 ] Исследования также продолжаются, чтобы определить, помогает ли скрининг обнаружить рак раньше у людей с мутациями BRCA. [ 119 ]
Исследователи из BGI Genomics и Fudan University выявили значительные результаты по раку яичника (OV) у китайских пациентов, выявляя уникальный вариант Rad51d, который может служить терапевтической мишенью [ 12 ] Полем Опубликованное в JCO Global Oncology , исследование выявило обогащенный вариант RAD51D, связанный с ростом опухоли. Примечательно, что вариант RAD51D K91FS был обнаружен, повышает чувствительность к ингибиторам PAR
Исследование прогноза
[ редактировать ]Исследование различных прогностических факторов для рака яичников также проводится. Недавние исследования показывают, что тромбоцитоз предсказывает более низкую выживаемость и рак более высокой стадии. [ 28 ] Продолжающиеся исследования также изучают преимущества хирургического вмешательства по поводу рецидивирующего рака яичников. [ 119 ]
Иммунотерапия
[ редактировать ]В то время как активная область исследований, по состоянию на 2018 год нет хороших доказательств того, что иммунотерапия эффективна для рака яичников. [ 154 ] Тем не менее, испытания антитела и VEGF ингибитора Бевацизумаб , который может замедлить рост новых кровеносных сосудов при раке, показали многообещающие результаты, особенно в сочетании с пазопанибом , что также замедляет процесс роста кровеносных сосудов. Бевацизумаб был особенно эффективен в предварительных исследованиях на раке стадии III и -II [ 28 ] и был назван как минимум 15% ответа. [ 26 ] Он изучается, в частности, при раке муцинозных яичников. [ 119 ]
Фармакология
[ редактировать ]Ингибиторы mTOR были высоко исследованным потенциальным лечением в 2000 -х и 2010 -х годах, но побочные эффекты этих препаратов (особенно гипергликемия и гиперлипидемия ) не были хорошо переносятся, а выгода выживаемости не подтверждается. Ингибиторы киназы PI3 представляют интерес, но они, как правило, являются высокотоксичными и вызывают диарею . Другим исследованным препаратом является селуметиниб , ингибитор MAPK . Это улучшило выживание, но не коррелировало с какими -либо мутациями, обнаруженными в опухолях. [ 28 ]
Бевацизумаб также можно объединить с платиновой химиотерапией, комбинация, которая дала положительные предварительные результаты в PFS, но двусмысленные результаты, касающиеся общей выживаемости. Одним из недостатков для этих обработок является профиль побочного эффекта, который включает в себя высокое кровяное давление и протеинурию . Препарат также может усугубить заболевание кишечника, что приводит к перфорации фистул или кишечника . Винтафолид , который состоит из антифолата, конъюгированного с винбластином , также находится в клинических испытаниях; Это может оказаться полезным, потому что рецепторы фолата сверхэкспрессируются при многих раке яичников. [ 28 ] Другой потенциальной иммунотерапией является трастузумаб , который активен против опухолей, положительных для мутаций HER2/Neu. [ 26 ] Другие ингибиторы ангиогенеза также исследуются как потенциальное лечение рака яичников. Комбретастатин и пазопаниб изучаются в комбинации для рецидивирующего рака яичников. Trebananib и Tasquinimod являются другими исследованными ингибиторами ангиогенеза. Моноклональное антитело Farletuzumab исследуется как адъювант к традиционной химиотерапии. Другой тип иммунотерапии включает в себя вакцины , включая Trovax . [ 119 ]
Альтернатива химиотерапии BEP, режим 3 циклов карбоплатина и этопозида , является современной темой исследования злокачественных новообразований за половые клетки. [ 32 ]
Внутрибрюшинная химиотерапия также проводилась в рамках 2000 -х и 2010 -х годов за его потенциал для обеспечения более высоких доз цитотоксического агента в опухоли. Предварительные испытания с цисплатином и паклитакселом показали, что они не очень переносятся, но улучшают выживаемость, и исследуются более терпимые схемы. [ 28 ] Цисплатин и паклитаксел исследуются как внутрибрюшинные химиотерапевтические средства. Специфический режим химиотерапии для редкого рака с чистым клетками также исследуется: иринотекан в сочетании с цисплатином. [ 119 ]
Ингибиторы PARP также продемонстрировали перспективы в ранних исследованиях, особенно у людей с мутациями гена BRCA , поскольку белок BRCA взаимодействует с путем PARP. Он также изучается в рецидивирующем раке яичников в целом, где предварительные исследования показали более длительные PFS. В частности, Олапариб показал большую выживаемость по сравнению с доксорубицином, хотя это лечение все еще исследуется. Пока не ясно, какие биомаркеры предсказывают реагирование на ингибиторы PARP. [ 28 ] Rucaparib -еще один ингибитор PARP, который исследован в BRCA-позитивном и BRCA-негативном рецидивирующем раке яичников. Нирапариб является ингибитором PARP, проведенным в BRCA-позитивном рецидивирующем раке яичников. [ 119 ]
Ингибиторы тирозинкиназы являются еще одним исследовательским классом лекарств, который может иметь применение при раке яичников. Также было показано, что ингибиторы ангиогенеза в рецепторной группе ингибиторов тирозинкиназы , в том числе Пазопаниб , Седираниб и Нинедеданиб , увеличивают выживаемость без прогрессирования (PFS), но их выгода для общей выживаемости не была исследована с 2015 года. [ 28 ] Предварительные исследования показали, что cediranib в сочетании с платинами при рецидивирующем раке яичников увеличил время до второго рецидива на 3–4 месяца и увеличена выживаемость на 3 месяца. [ 119 ] MK-1775 является ингибитором тирозинкиназы, который используется в сочетании с паклитакселом и карбоплатином при платино-чувствительном раке с мутациями p53. Nintedanib исследуется как потенциальная терапия в сочетании с циклофосфамидом для людей с рецидивами. [ 119 ]
Ингибиторы гистондеацетилазы (HDACI) являются еще одной областью исследований.
Гормоны и радиация
[ редактировать ]Гормональная терапия является темой современного исследования рака яичников, в частности, ценность определенных лекарств, используемых для лечения рака молочной железы. К ним относятся тамоксифен , летрозол и анастрозол . Предварительные исследования показали пользу для тамоксифена у небольшого числа людей с усовершенствованным раком яичников. Летрозол может помочь замедлить или остановить рост рецептора эстрогена, положительного рака яичников. Анастрозол исследуется у людей в постменопаузе с рецептором рецептора эстрогена раком. [ 119 ]
Исследование смягчающих побочных эффектов лечения рака яичников также продолжается. Облученный фиброз , образование рубцовой ткани в области, обработанной радиацией, может быть облегчено с помощью гипербарической кислородной терапии , но исследования не были завершены в этой области. Лечение рака яичников также может привести к тому, что люди испытывают психические трудности, включая депрессию . Продолжаются исследования, чтобы определить, как консультирование и психотерапия могут помочь людям, которые имеют рак яичников во время лечения. [ 119 ]
Воспаление
[ редактировать ]Есть некоторые признаки того, что воспалительные заболевания таза могут быть связаны с раком яичников, особенно в незападных странах. Это может быть связано с воспалительным процессом с воспалительным заболеванием таза. [ 155 ]
Клинические испытания
[ редактировать ]Клинические испытания контролируются и финансируются правительственными организациями США для проверки вариантов лечения, чтобы увидеть, безопасны ли они и эффективны. К ним относятся исследования клинических исследований NIH и вы ( Национальные институты здравоохранения ), [ 156 ] Узнайте о клинических испытаниях ( Национальный институт рака ), [ 157 ] Поиск клинических испытаний (Национальный институт рака), [ 158 ] Clinicaltrials.gov (Национальные институты здравоохранения). [ 159 ] [ 93 ] Клинические испытания также проводятся в Канаде. [ 160 ]
Ссылки
[ редактировать ]- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж «Лечение рака эпителия яичников» . НИС . 12 мая 2014 года. Архивировано с оригинала 5 июля 2014 года . Получено 1 июля 2014 года .
- ^ Jump up to: а беременный «Каковы факторы риска рака яичников?» Полем www.cancer.org . 4 февраля 2016 года. Архивировано с оригинала 17 мая 2016 года . Получено 18 мая 2016 года .
- ^ Jump up to: а беременный в Žilovič D, Chiurlienė R, Sabaliauskaitė R, Jarmalaitė S (июль 2021 г.). Будущие перспективы скрининга на рак яичников . Рак . 13 (15): 3840. DOI : 10.3390/CANCERS13153840 . PMC 8345180 . PMID 34359740 .
- ^ Jump up to: а беременный в «Профилактика рака яичников» . НИС . 6 декабря 2013 года. Архивировано с оригинала 6 июля 2014 года . Получено 1 июля 2014 года .
- ^ Jump up to: а беременный в дюймовый и фон глин час я World Cancer Report 2014 . Всемирная организация здравоохранения. 2014. Глава 5.12. ISBN 978-92-832-0429-9 Полем Архивировано с оригинала 19 сентября 2016 года.
- ^ Jump up to: а беременный в «Профилактика рака яичников» . НИС . 20 июня 2014 года. Архивировано с оригинала 6 июля 2014 года . Получено 1 июля 2014 года .
- ^ Jump up to: а беременный «Провидеры SEER Stat Facts: рак яичника» . НИС . Архивировано из оригинала 6 июля 2014 года . Получено 18 июня 2014 года .
- ^ GBD 2015 заболевания и заболеваемость и распространенность Collaborators (октябрь 2016 г.). «Глобальная, региональная и национальная заболеваемость, распространенность и годы жили с инвалидностью для 310 заболеваний и травм, 1990-2015 гг.: Систематический анализ для исследования глобального бремени заболевания 2015 года» . Лансет . 388 (10053): 1545–1602. doi : 10.1016/s0140-6736 (16) 31678-6 . PMC 5055577 . PMID 27733282 .
- ^ GBD 2015 Смертность и причины смерти сотрудники (октябрь 2016 г.). «Глобальная, региональная и национальная ожидаемая продолжительность жизни, смертность от всех причин и конкретная смертность по причине 249 причин смерти, 1980-2015 гг.: Систематический анализ глобального исследования болезни 2015 года» . Лансет . 388 (10053): 1459–1544. doi : 10.1016/s0140-6736 (16) 31012-1 . PMC 5388903 . PMID 27733281 .
- ^ Классификация редакционной совета опухолей, изд. (2020). «1. Опухоли яичника: введение». Женские генитальные опухоли: ВОЗ классификации опухолей . Тол. 4 (5 -е изд.). Лион (Франция): Международное агентство по исследованиям рака. С. 32–35. ISBN 978-92-832-4504-9 .
- ^ «Основная информация о раке яичников» . Центры для контроля и профилактики заболеваний. 24 октября 2023 года. Архивировано с оригинала 12 августа 2024 года . Получено 12 августа 2024 года .
- ^ Jump up to: а беременный «Что такое рак яичников | опухоли яичников и кисты» . www.cancer.org . Получено 2 ноября 2022 года .
- ^ «Определение рака» . Национальный институт рака . 17 сентября 2007 года. Архивировано с оригинала 25 июня 2014 года . Получено 10 июня 2014 года .
- ^ Jump up to: а беременный Ebell MH, Culp MB, Radke TJ (март 2016 г.). «Систематический обзор симптомов диагностики рака яичников». Американский журнал профилактической медицины . 50 (3): 384–394. doi : 10.1016/j.amepre.2015.09.023 . PMID 26541098 .
- ^ Ruddon RW (2007). Биология рака (4 -е изд.). Издательство Оксфордского университета. п. 223. ISBN 978-0-19-517543-1 Полем Архивировано с оригинала 15 сентября 2015 года.
- ^ Jump up to: а беременный «Факторы риска рака яичников» . www.cancer.org . Получено 2 ноября 2022 года .
- ^ Армстронг Д.К. (2020). «189. Гинаэкологический рак: рак яичников» . В Goldman L, Schafer Ai (Eds.). Голдман-эфил медицина . Тол. 1 (26 -е изд.). Филадельфия: Elsevier. С. 1332–5. ISBN 978-0-323-55087-1 .
- ^ Maos A, Matsuo K, Ciccone MA, Matsuzaki S, Klar M, Roman Ld, et al. (Май 2020). «Молекулярные пути и целевые терапии для злокачественных опухолей зародышевых клеток яичников и половых пусковых опухолей: современный обзор» . Рак . 12 (6): 1398. DOI : 10.3390/раковые кабины12061398 . PMC 7353025 . PMID 32485873 .
- ^ Jump up to: а беременный Гроссман Д.К., Карри С.Дж., Оуэнс Д.К., Барри М.Дж., Дэвидсон К.В., Дубени К.А. и др. (Февраль 2018 г.). «Скрининг на рак яичников: Заявление о профилактических службах США» . Джама . 319 (6): 588–594. doi : 10.1001/Jama.2017.21926 . PMID 29450531 .
- ^ Jump up to: а беременный в Гибсон С.Дж., Флеминг Г.Ф., Темкин С.М., Чейз Д.М. (2016). «Применение и исход стандартного лечения ухода у пожилых женщин с раком яичников: обзор литературы за последние 10 лет» . Границы в онкологии . 6 : 63. DOI : 10.3389/fonc.2016.00063 . PMC 4805611 . PMID 27047797 .
- ^ «Статистика рака яичников» . Всемирный фонд исследований рака Международный . Получено 2 ноября 2022 года .
- ^ Jump up to: а беременный «Визуализация данных USCS» . gis.cdc.gov . Архивировано с оригинала 25 января 2019 года . Получено 3 ноября 2022 года .
- ^ Jump up to: а беременный Zhou Z, Wang X, Ren X, Zhou L, Wang N, Kang H (2021). «Бремя заболевания и связанные с ней факторы риска рака яичников с 1990 по 2017 год: результаты глобального исследования болезни 2017 года» . Фронт общественного здравоохранения . 9 : 619581. DOI : 10.3389/fpubh.2021.619581 . PMC 8484795 . PMID 34604147 .
- ^ «Статистика рака яичников | CDC» . www.cdc.gov . 18 мая 2022 года . Получено 2 ноября 2022 года .
- ^ «Статистика рака яичников | Насколько распространен рак яичников» . www.cancer.org . Получено 2 ноября 2022 года .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж k л м не а п Q. ведущий с Т в v В х и С аа Аб и объявление Но из в нравиться это к и ал являюсь анонца в доступа вод с как в В из W. топор Ай а нет б.Б. до н.э. бд Seiden MV (2012). «Гинекологические злокачественные новообразования». В Longo DL, Kasper DL, Jameson JL, Fauci AS, Hauser SL, Loscalzo J (Eds.). Принципы внутренней медицины Харрисона (18 -е изд.). МакГроу-Хилл. ISBN 978-0-07-174889-6 .
- ^ Jump up to: а беременный в дюймовый «Рак яичников, внутренние знания, получают факты о гинекологическом раке» (PDF) . Центры для контроля и профилактики заболеваний. Сентябрь 2016 года. Архивировал (PDF) из оригинала 16 июня 2017 года . Получено 17 июня 2017 года .
 Эта статья включает в себя материал общественного достояния с веб -сайтов или документов Центров по контролю и профилактике заболеваний .
Эта статья включает в себя материал общественного достояния с веб -сайтов или документов Центров по контролю и профилактике заболеваний .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж k л м не а п Q. ведущий с Т в v В х и С аа Аб и объявление Но из в нравиться это к и ал являюсь анонца в доступа вод с как в В из W. топор Ай а нет б.Б. до н.э. бд быть бр Jayson GC, Kohn EC, Kitchener HC, Ledermann JA (октябрь 2014). «Рак яичников». Лансет . 384 (9951): 1376–88. doi : 10.1016/s0140-6736 (13) 62146-7 . PMID 24767708 . S2CID 205971030 .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж k л м не а п Q. ведущий с Т в v В х и С аа Аб и объявление Но из в нравиться это к и ал являюсь анонца в доступа вод с как в В из W. топор Ай а нет б.Б. до н.э. бд быть бр б. BH с бидж бенк с БМ мгновенный боевой б. бк бренд BS Хоффман Б.Л., Шордж Джо, Шаффер Джи, Халворсон Л.М., Брэдшоу К.Д., Каннингем Ф.Г. (2012). «Эпителиальный рак яичников». Williams Gynecology (2 -е изд.). McGraw Hill Medical. С. 853–878. ISBN 978-0-07-171672-7 .
- ^ «Симптомы рака яичников» . www.cancerresearchuk.org . Архивировано из оригинала 12 мая 2015 года . Получено 16 мая 2015 года .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж k л м не а п Q. ведущий с Т в v В х и С аа Аб и объявление Но из в нравиться это к и ал являюсь анонца в доступа вод с как в В из W. топор Ай а нет б.Б. до н.э. бд быть бр б. BH с бидж бенк с БМ мгновенный боевой б. «Рак яичников» . Dynamed. 18 июня 2015 года. Архивировано с оригинала 21 июня 2015 года.
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж k л м не а п Q. ведущий с Т в v В х и С аа Аб и объявление Но из в нравиться это к и ал являюсь анонца Williams Gynecology 2012
- ^ Jump up to: а беременный в дюймовый и фон глин Decherney A, Nathan L, Goodwin TM, Laufer N, Roman A (2012). «Педиатрическая и подростка гинекология». Текущий диагноз и лечение акушерство и гинекология (11 -е изд.). McGraw Hill Professional. ISBN 978-0-07-163856-2 .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж k л м не а п «Риск и причины рака яичников» . Рак исследований Великобритания. 15 января 2014 года. Архивировано с оригинала 21 февраля 2015 года . Получено 29 января 2015 года .
- ^ Jump up to: а беременный Gong TT, Wu QJ, Vogtmann E, Lin B, Wang YL (июнь 2013 г.). «Возраст в менархе и риск рака яичников: мета-анализ эпидемиологических исследований» . Международный журнал рака . 132 (12): 2894–2900. doi : 10.1002/ijc.27952 . PMC 3806278 . PMID 23175139 .
- ^ Manson JE, Bassuk SS (2012). «Переход менопаузы и гормональная терапия в постменопаузе». В Longo DL, Kasper DL, Jameson JL, Fauci AS, Hauser SL, Loscalzo J (Eds.). Принципы внутренней медицины Харрисона (18 -е изд.). МакГроу-Хилл. ISBN 978-0-07-174889-6 .
- ^ «Профилактика рака яичников (PDQ®)» . Национальный институт рака . 2013. Архивировано с оригинала 31 декабря 2013 года . Получено 30 декабря 2013 года .
- ^ Kyriakidis I, Papaioannidou P (июнь 2016 г.). «Бета -версия рецептора эстрогена и рак яичников: ключ к патогенезу и реакции на терапию». Архивы гинекологии и акушерства . 293 (6): 1161–8. doi : 10.1007/s00404-016-4027-8 . PMID 26861465 . S2CID 25627227 .
- ^ Норквист Б.М., Харрелл М.И., Брэди М.Ф., Уолш Т., Ли М.К., Гулсунер С. и др. (Апрель 2016 г.). «Унаследованные мутации у женщин с карциномой яичников» . Джама Онкология . 2 (4): 482–490. doi : 10.1001/Jamaoncol.2015.5495 . PMC 4845939 . PMID 26720728 .
- ^ Kuusisto KM, Bebel A, Vihinen M, Schleutker J, Sallinen SL (февраль 2011 г.). «Скрининг на мутации BRCA1, BRCA2, CHEK2, PALB2, BRIP1, RAD50 и CDH1 у финских финских финских людей BRCA1/2-факторов, негативных молочной железы и/или яичника» . Исследование рака молочной железы . 13 (1): R20. doi : 10.1186/bcr2832 . PMC 3109589 . PMID 21356067 .
- ^ Hjartåker A, Meo MS, Weiderpass E (январь 2010 г.). «Алкоголь и гинекологический рак: обзор». Европейский журнал по предотвращению рака . 19 (1): 1–10. doi : 10.1097/cej.0b013e328333fb3a . PMID 19926999 . S2CID 27570587 .
- ^ "Факторы риска рака яичников" . Cancer.org. Получено 2 января 2021 года.
- ^ Qiu W, Lu H, Qi Y, Wang X (июнь 2016 г.). «Диетический потребление жира и риск рака яичников: метаанализ эпидемиологических исследований» . Oncotarget . 7 (24): 37390–406. doi : 10.18632/oncotarget.8940 . PMC 5095084 . PMID 27119509 .
- ^ Tanha K, Mottaghi A, Nojomi M, Moradi M, Rajabzadeh R, Lotfi S, et al. (Ноябрь 2021 г.). «Исследование факторов, связанных с раком яичников: обзор зонтика систематического обзора и мета-анализа» . Журнал исследований яичников . 14 (1): 153. doi : 10.1186/s13048-021-00911-z . PMC 8582179 . PMID 34758846 .
- ^ Jump up to: а беременный Liao MQ, Gao XP, Yu XX, Zeng YF, Li SN, Naicker N, et al. (Ноябрь 2020 г.). «Влияние молочных продуктов, кальция и витамина D на риск рака яичников: метаанализ двадцати девяти эпидемиологических исследований». Британский журнал питания . 124 (10): 1001–12. doi : 10.1017/s0007114520001075 . PMID 32189606 . S2CID 213181277 .
- ^ Sun H, Gong TT, Xia Y, Wen ZY, Zhao LG, Zhao YH, et al. (Апрель 2021 г.). «Диета и риск рака яичников: общий обзор систематических обзоров и метаанализов когортных исследований». Клиническое питание . 40 (4): 1682–90. doi : 10.1016/j.clnu.2020.11.032 . PMID 33308841 . S2CID 229175041 .
- ^ Salehi F, Dunfield L, Phillips KP, Krewski D, Vanderhyden BC (март 2008 г.). «Факторы риска рака яичников: обзор с акцентом на гормональные факторы». Журнал токсикологии и здоровья окружающей среды Часть B: критические обзоры . 11 (3–4): 301–321. Bibcode : 2008jtehb..11..301s . doi : 10.1080/10937400701876095 . PMID 18368558 . S2CID 5589506 .
- ^ "Знаем ли мы, что вызывает рак яичников?" Полем www.cancer.org . Архивировано с оригинала 10 ноября 2016 года.
- ^ Zhang X, Nicosia SV, Bai W (май 2006 г.). «Рецептор витамина D является новой лекарственной мишенью для лечения рака яичников». Современные раковые препараты . 6 (3): 229–244. doi : 10.2174/156800906776842939 . PMID 16712459 .
- ^ Бисвас А., О Пи, Фолкнер Г.Е., Баджадж Р.Р., Сильвер М.А., Митчелл М.С. и др. (Январь 2015). «Время сидячих и его связь с риском заболеваемости, смертности и госпитализации у взрослых: систематический обзор и метаанализ». Анналы внутренней медицины . 162 (2): 123–132. doi : 10.7326/m14-1651 . PMID 25599350 . S2CID 7256176 .
- ^ «Аспирин снижает агрессивную форму рака яичников» . Международный бизнес времени Великобритания . 11 октября 2012 года.
- ^ Zheng G, Faber MT, Wang J, Baandrup L, Hertzum-Larsen R, Sundsröm K, et al. (Май 2024). «Использование аспирина с низкими дозами и риск рака яичников: комбинированный анализ двух общенациональных исследований в Дании и Швеции». Br J Cancer . 130 (8): 1279–1285. doi : 10.1038/s41416-024-02609-7 . PMC 11014981. PMID 38347096 .
- ^ Zheng B, Shen H, Han H, Han T, Цинь Y (октябрь 2018). «Потребление пищевых волокон и снижение риска рака яичников: метаанализ» . Журнал питания . 17 (1): 99. DOI : 10.1186/S12937-018-0407-1 . PMC 6208085 . PMID 30376840 .
- ^ Ходаванди, Ализаде и Разис 2021
- ^ Jump up to: а беременный Кунле О., Пежович Т., Андерсон М.Л. (2011). «Молекулярная биология гинекологического рака». Девита, Хеллман и Рак Розенберга: принципы и практика онкологии (9 -е изд.). Wolters Kluwer/Lippincott Williams & Wilkins. С. 1302–10. ISBN 978-1-4511-0545-2 Полем OCLC 703790514 .
- ^ «Генетика рака молочной железы и яичников (PDQ®)» . Национальный институт рака. 2 октября 2014 года. Архивировано с оригинала 22 октября 2014 года . Получено 27 октября 2014 года .
- ^ "Можно ли найти рак яичников рано?" Полем Американское онкологическое общество.
- ^ Rossing MA, Wicklund KG, Cushing-Haugen KL, Weiss NS (февраль 2010 г.). «Прогнозирующая ценность симптомов раннего выявления рака яичников» . Журнал Национального института рака . 102 (4): 222–9. doi : 10.1093/jnci/djp500 . PMC 2826180 . PMID 20110551 .
- ^ Jump up to: а беременный в Miller RW, Ueland FR (март 2012 г.). «Риск злокачественности в сонографически подтвержденных опухолях яичников». Клиническое акушерство и гинекология . 55 (1): 52–64. doi : 10.1097/grf.0b013e31824970cf . PMID 22343229 .
- ^ «Испытания на рак яичников» . www.cancerresearchuk.org . Архивировано из оригинала 18 мая 2015 года . Получено 16 мая 2015 года .
- ^ Jump up to: а беременный «FDA одобряет новое лекарство для визуализации, чтобы помочь выявить поражения рака яичников» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс -релиз). 29 ноября 2021 года . Получено 30 ноября 2021 года .
 Эта статья включает текст из этого источника, который находится в общественном доступе .
Эта статья включает текст из этого источника, который находится в общественном доступе .
- ^ «Руководство CG122. Рак яичников: распознавание и первоначальное лечение рака яичников, Приложение D: риск индекса злокачественных новообразований (RMI I)» . Хорошие клинические рекомендации . Апрель 2011. Архивировано с оригинала 22 сентября 2013 года.
- ^ Geomini P, Kruitwagen R, Bremer GL, Cnossen J, Mol BW (февраль 2009 г.). «Точность показателей риска в прогнозировании злокачественных новообразований яичников: систематический обзор». Акушерство и гинекология . 113 (2 pt 1): 384–394. doi : 10.1097/aog.0b013e318195ad17 . PMID 19155910 . S2CID 24585101 .
- ^ Kaijser J, Bourne T, De Rijdt S, Van Holsbeke C, Sayasneh A, Valentin L, et al. (Август 2012 г.). «Основные результаты исследования международного анализа опухоли яичников (IOTA): подход к оптимальной характеристике ультразвукового на основе ультразвукового на основе патологии аднекса» . Австралийский журнал ультразвука в медицине . 15 (3): 82–86. doi : 10.1002/j.2205-0140.2012.tb00011.x . PMC 5025098 . PMID 28191150 .
- ^ «Калькулятор O'Rads и генератор отчетов (США и МРТ)» . Рад под рукой . Получено 25 июля 2024 года .
- ^ Jump up to: а беременный Kosary CL (2007). «Глава 16: Рак яичника» (PDF) . В Baguio RN, Young JL, Keel GE, Eisner MP, Lin YD, Horner MJ (Eds.). Монография выживания провидцев: выживание рака среди взрослых: программа США, 1988–2001 годы, характеристики пациента и опухоли . Тол. NIH Pub. № 07-6215. Bethesda, MD: Национальный институт рака. С. 133–144. Архивировано с оригинала 10 октября 2013 года.
- ^ Jump up to: а беременный Desai A, Xu J, Aysola K, Qin Y, Okoli C, Happred R, T al. (Апрель 2014). "Обзор " Journal Medicine World 3 (1): 1–8 doi : 10.5528/ wjtm.i1 PMC 4267287 . PMID 25525571 . 19391874S2CID
- ^ «Эпителиальный рак яичников | Рак исследований в Великобритании» . www.cancerresearchuk.org . Получено 8 ноября 2022 года .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Lheureux S, Gourley C, Vergote I, Oza Am (март 2019 г.). «Эпителиальный рак яичников» (PDF) . Лансет . 393 (10177): 1240–53. doi : 10.1016/s0140-6736 (18) 32552-2 . HDL : 20.500.11820/b4f4b3bf-bf1b-4074-8c62-7d30f1c8fb70 . PMID 30910306 . S2CID 84846601 .
- ^ Jump up to: а беременный в дюймовый и фон глин час «Типы рака яичников» . www.cancerresearchuk.org . Архивировано из оригинала 18 мая 2015 года . Получено 16 мая 2015 года .
- ^ Велле А., Песенти С., Грасси Т, Бельтрам Л., Мартини П., Джейкони М. и др. (Май 2023). «Комплексное исследование гистотиповой микроРНК и их вариантов при раке эпителиальных яичников I стадии» . Международный журнал рака . 152 (9): 1989–2001. doi : 10.1002/ijc.34408 . HDL : 11577/3478062 . PMID 36541726 . S2CID 255034585 .
- ^ Jump up to: а беременный в Nucci MR (3 февраля 2020 г.). Гинекологическая патология: объем в серийных основаниях в диагностической патологии (второе изд.). Elsevier. п. 946. ISBN 978-0-323-35909-2 .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж k л м не Korivi BR, Javadi S, Faria S, Sagebiel T, Garg N, Patnana M, et al. (Сентябрь 2018 г.). «Маленькая клеточная карцинома яичника, гиперкальемический тип: клинический обзор и обзор визуализации». Текущие проблемы в диагностической радиологии . 47 (5): 333–339. doi : 10.1067/j.cpradiol.2017.08.004 . PMID 28943050 . S2CID 41153959 .
- ^ Jump up to: а беременный в Lu B, Shi H (2019). «Глубокий взгляд на мелкую клеточную карциному яичника, гиперкальциемический тип (SCCOHT): клинические последствия от недавних молекулярных результатов» . Журнал рака . 10 (1): 223–237. doi : 10.7150/jca.26978 . PMC 6329856 . PMID 30662543 .
- ^ Jump up to: а беременный Tischkowitz M, Huang S, Banerjee S, Hague J, Hendricks WP, Huntsman DG, et al. (Август 2020). «Маленькая клетка карцинома яичника, гиперкальциемические генетики типа, новые цели лечения и текущие руководящие принципы управления» . Клиническое исследование рака . 26 (15): 3908–3917. doi : 10.1158/1078-0432.ccr-19-3797 . PMC 7415570 . PMID 32156746 .
- ^ «Первичная брюшная карцинома» . www.cancerresearchuk.org . Архивировано из оригинала 20 мая 2015 года . Получено 16 мая 2015 года .
- ^ Jump up to: а беременный в дюймовый и фон глин Gadducci A, Multinu F, Cosio S, Carinelli S, Ghioni M, Aletti GD (сентябрь 2021 г.). «Чистая клеточная карцинома яичника: эпидемиология, патологические и биологические особенности, варианты лечения и клинические результаты». Гинекологическая онкология . 162 (3): 741–750. doi : 10.1016/j.ygyno.2021.06.033 . PMID 34247767 .
- ^ Jump up to: а беременный в дюймовый Iida Y, Okamoto A, Hollis RL, Gourley C, Herrington CS (апрель 2021 г.). «Чистая клеточная карцинома яичника: клиническая и молекулярная перспектива» . Международный журнал гинекологического рака . 31 (4): 605–616. doi : 10.1136/ijgc-2020-001656 . HDL : 20.500.11820/0E23C421-D2CF-4858-AC50-021C64DE747D . PMID 32948640 . S2CID 221796329 .
- ^ Jump up to: а беременный в дюймовый и фон Fadare O, Parkash V (июнь 2019 г.). «Патология эндометриоидной и чистой клеточной карциномы яичника». Хирургические патологические клиники . 12 (2): 529–564. doi : 10.1016/j.path.2019.01.009 . PMID 31097114 . S2CID 157056883 .
- ^ Lee SJ, Bae JH, Lee AW, Tong Sy, Park YG, Park JS (февраль 2009 г.). «Клинические характеристики метастатических опухолей в яичники» . Журнал корейской медицинской науки . 24 (1): 114–9. doi : 10.3346/jkms.2009.24.1.114 . PMC 2650975 . PMID 19270823 .
- ^ Levy G, Purcell K (2013). «Прендовые и злокачественные расстройства яичников и яйцеклеток». В Decherney AH, Nathan L, Laufer N, Roman As (Eds.). Текущий диагноз и лечение: акушерство и гинекология (11 -е изд.). МакГроу-Хилл. ISBN 978-0-07-163856-2 Полем Архивировано с оригинала 10 сентября 2017 года.
- ^ Jump up to: а беременный «Постановка рака яичников» (PDF) . Общество гинекологической онкологии. 1 января 2014 года. Архивировал (PDF) с оригинала 5 ноября 2014 года.
- ^ "Как поставляется рак яичников?" Полем Американское онкологическое общество. Архивировано с оригинала 24 ноября 2016 года . Получено 17 июня 2017 года .
- ^ «Стадии рака яичников» . www.cancerresearchuk.org . Архивировано из оригинала 18 мая 2015 года . Получено 16 мая 2015 года .
- ^ Jump up to: а беременный в Croswell JM, Brawley OW, Kramer BS (2012). «Профилактика и раннее обнаружение рака». В Longo DL, Kasper DL, Jameson JL, Fauci AS, Hauser SL, Loscalzo J (Eds.). Принципы внутренней медицины Харрисона (18 -е изд.). МакГроу-Хилл. ISBN 978-0-07-174889-6 .
- ^ Zadabedini Masouleh T, Etchegary H, Hodgkinson K, Wilson BJ, Dawson L (ноябрь 2023 г.). «Помимо стерилизации: всесторонний обзор безопасности и эффективности оппортунистической сальпингэктомии как профилактической стратегии рака яичников» . Curr Oncol . 30 (12): 10152–65. doi : 10.3390/curroncol30120739 . PMC 10742942 . PMID 38132373 .
Недавние исследования показывают, что фимбриальная дистальная фаллопиевая трубка является наиболее вероятным происхождением HGSC. Это привело к разработке плана профилактики для населения в целом: оппортунистическая сальпинговая, удаление обеих маточных труб. ... Оппортунистическая сальпингэктомия обещает снизить риск ОС и может быть безопасно реализована в большинстве практик акушерства. Постоянные исследования и долгосрочные последующие исследования необходимы для полного понимания его влияния на заболеваемость OC и оптимизировать его реализацию в клинической практике.
- ^ Саламон М (21 апреля 2023 г.). «Предотвращение рака яичников: должны ли женщины подумать о том, чтобы удалить маточные трубки?» Полем Harvard Health News . Гарвардский Health Publishing и Гарвардский колледж . Получено 30 июня 2024 года .
- ^ Хэнли Дж (18 мая 2023 г.). «Оппортунистическая сальпингэктомия: безопасный и эффективный выбор противозачаточных средств, который предотвращает рак яичников» (PDF) . BC Рак . Получено 30 июня 2024 года .
- ^ Cibula D, Widstch Weeddter M, Májek или (2010). Полем воспроизведения человека Обновление 17 (1): 55–67. doi : 10.1093/ dmuld/ dmq0 PMID 20634209 .
- ^ Jump up to: а беременный Нэш З, Менон У (май 2020). «Скрининг рака яичников: текущий статус и будущие направления» . Лучшая практика и исследования. Клиническое акушерство и гинекология . 65 : 32–45. doi : 10.1016/j.bpobgyn.2020.02.010 . PMID 32273169 . S2CID 215726814 .
- ^ Гупта К.К., Гупта В.К., Науманн Р.В. (январь 2019 г.). «Рак яичников: скрининг и будущие направления» . Международный журнал гинекологического рака . 29 (1): 195–200. doi : 10.1136/ijgc-2018-00000016 . ISSN 1525-1438 . PMID 30640704 . S2CID 58626560 .
- ^ «Рак яичников: неудача в качестве основного испытания скрининга не может спасти жизни» . BBC News . 12 мая 2021 года.
- ^ Jump up to: а беременный "Как лечится рак яичников?" Полем Центры для контроля и профилактики заболеваний. 13 февраля 2017 года. Архивировано с оригинала 16 июня 2017 года . Получено 17 июня 2017 года .
 Эта статья включает в себя материал общественного достояния с веб -сайтов или документов Центров по контролю и профилактике заболеваний .
Эта статья включает в себя материал общественного достояния с веб -сайтов или документов Центров по контролю и профилактике заболеваний .
- ^ Marchetti C, Pisano C, Facchini G, Bruni GS, Magazzino FP, Losito S, et al. (Январь 2010). «Лечение первой линии развитого рака яичников: текущие исследования и перспективы». Экспертный обзор противоопухолевой терапии . 10 (1): 47–60. doi : 10.1586/era.09.167 . PMID 20014885 . S2CID 40586650 .
- ^ Jump up to: а беременный в дюймовый и «Типы лечения рака яичников» . www.cancerresearchuk.org . Архивировано из оригинала 12 мая 2015 года . Получено 16 мая 2015 года .
- ^ Jump up to: а беременный в дюймовый «Лечение рака яичников» . Канадское онкологическое общество. Архивировано с оригинала 26 октября 2016 года . Получено 17 июня 2017 года .
- ^ «Более ранние решения по хирургии молочной железы и яичников снижают рак у женщин с высоким риском» . Доказательства NIHR (РЕЗЮМЕ ИНГЛИЯ). Национальный институт исследований здравоохранения и ухода. 7 декабря 2021 года. DOI : 10.3310/alert_48318 . S2CID 263487127 .
- ^ Marcinkute R, Woodward ER, Gandhi A, Howell S, Crosbie EJ, Wissely J, et al. (Февраль 2022 г.). «Поглощение и эффективность двустороннего риска снижения хирургии у несменных женщин BRCA1 и BRCA2 » . Журнал медицинской генетики . 59 (2): 133–140. doi : 10.1136/jmedgenet-2020-107356 . PMID 33568438 . S2CID 231876899 .
- ^ Elattar A, Bryant A, Winter-Roach BA, Hatem M, Naik R (август 2011 г.). «Оптимальное первичное хирургическое лечение при распространенном раке эпителиальных яичников» . Кокрановская база данных систематических обзоров . 2011 (8): CD007565. doi : 10.1002/14651858.cd007565.pub2 . PMC 6457688 . PMID 21833960 .
- ^ Harter P, Sehouli J, Vergote I, Ferron G, Reuss A, Meier W, et al. (Декабрь 2021 г.). «Рандомизированное исследование циторедуктивной хирургии при рецидивирующем раке яичников» . Новая Англия Журнал медицины . 385 (23): 2123–31. doi : 10.1056/nejmoa2103294 . PMID 34874631 . S2CID 244922453 .
- ^ Roze JF, Hoogendam JP, Van De Wetringering FT, Spijker R, Verleye L, Vlayen J, et al. (Октябрь 2018). «Позитронная эмиссионная томография (ПЭТ) и магнитно -резонансная томография (МРТ) для оценки резекточности опухоли в прогрессирующем эпителиальном яичнике/паллопии/первичном перитонеальном раке» . Кокрановская база данных систематических обзоров . 2018 (10): CD012567. doi : 10.1002/14651858.cd012567.pub2 . PMC 6517226 . PMID 30298516 .
- ^ Reuss A, Du Bois A, Harter P, Fotopoulou C, Sehouli J, Aletti G, et al. (Октябрь 2019). «Доверие: испытание радикальной авансовой хирургической терапии при прогрессирующем раке яичников (Engot OV33/AGO-OVAR OP7)». Международный журнал гинекологического рака . 29 (8): 1327–31. doi : 10.1136/ijgc-2019-000682 . PMID 31420412 . S2CID 201042286 .
- ^ Harter P, Sehouli J, Lorusso D, Reuss A, Vergote I, Marth C, et al. (28 февраля 2019 г.). «Рандомизированное исследование лимфаденэктомии у пациентов с усовершенствованными яичниками» . Новая Англия Журнал медицины . 380 (9): 822–832. doi : 10.1056/nejmoa1808424 . HDL : 2434/765566 . ISSN 0028-4793 . PMID 30811909 .
- ^ Montero-Macías R, Segura-Sampedro JJ, Rigolet P, Leurauru F, Craus-Miguel A, Castillo-Tuñón JM (январь 2024 г.). «Роль системной лимфаденекомии при низкоклассном раке яичников: систематический обзор и мета-анализ » Рак 16 (5): 955. DOI : 10.3390/ CANCERS16050955 ISSN 2072-6 PMC 10931268 PMID 38473315
- ^ Segura-Sampedro JJ, Morales-Soriano R, Arjona-Sánchez A, Cascales-Campos P (май 2020). «Вторичная хирургическая циторедукция должна быть оценена с учетом хирургической техники, полноты циторедукции и степени заболевания» . Мировой журнал хирургической онкологии . 18 (1): 92. DOI : 10.1186/S12957-020-01853-4 . PMC 7216587 . PMID 32393274 .
- ^ Al Rawahi T, Lopes AD, Bristow Re, Bryant A, Elattar A, Chattopadhyay S, et al. (Февраль 2013 г.). «Хирургическая циторедукция для рецидивирующего эпителиального рака яичников» . Кокрановская база данных систематических обзоров . 2013 (2): CD008765. doi : 10.1002/14651858.cd008765.pub3 . PMC 6457850 . PMID 23450588 .
- ^ «Хирургия при раке яичников» . www.cancerresearchuk.org . Архивировано из оригинала 18 мая 2015 года . Получено 16 мая 2015 года .
- ^ Фалсетта Ф.С., Лори Т.А., Медейрос Л.Р., Да Роса М.И., Эдельвейс М.И., Стейн А.Т. и др. (Октябрь 2016). «Лапароскопия против лапаротомии для рака яичников I -стадии FIGO» . Кокрановская база данных систематических обзоров . 10 (10): CD005344. doi : 10.1002/14651858.cd005344.pub4 . PMC 6464147 . PMID 27737492 .
- ^ Лори Т.А., Винтер-Руач Б.А., Хеус П, Китченер ХК (декабрь 2015 г.). «Адъювантная (после операция) химиотерапия для ранней стадии эпителиального рака яичников» . Кокрановская база данных систематических обзоров . 2015 (12): CD004706. doi : 10.1002/14651858.cd004706.pub5 . PMC 6457737 . PMID 26676202 .
- ^ Pesando JM, Come Se, Stark J, Parker LM, Griffiths CT, Canellos GP (1980). «Цис-диамминеллихлороплатиновая (II) терапия при распространенном раке яичников». Отчеты о лечении рака . 64 (10–11): 1147–8. PMID 7193089 .
- ^ Стюарт Л (25 января 1999 г.). «Химиотерапия для развитого рака яичников. Кокрановская база данных систематических обзоров (2): CD001418. doi : 10.1002/14651858.cd001418 . PMID 10796788 .
- ^ Lihua P, Chen Xy, Wu TX (апрель 2008 г.). «Топотекан для рака яичников» . Кокрановская база данных систематических обзоров . 2008 (2): CD005589. doi : 10.1002/14651858.cd005589.pub2 . PMC 6905487 . PMID 18425923 .
- ^ Jump up to: а беременный «Препараты, используемые для рака яичников» . www.cancerresearchuk.org . Архивировано из оригинала 18 мая 2015 года . Получено 16 мая 2015 года .
- ^ Yao S (19 декабря 2014 г.). «FDA одобряет Lynparza для лечения современного рака яичников: первый диагностический тест Companion LDT также одобрил для выявления подходящих пациентов» . Управление по контролю за продуктами и лекарствами США. Архивировано из оригинала 14 сентября 2015 года.
- ^ «Инновационное лечение гинекологического рака, одобренное для фонда раковых лекарств» . Архивировано из оригинала 14 августа 2019 года . Получено 14 августа 2019 года .
- ^ Gaitskell K, Rogozińska E, Platt S, Chen Y, Abd El Aziz M, Tattersall A, et al. (Апрель 2023 г.). «Ингибиторы ангиогенеза для лечения эпителиального рака яичников» . Кокрановская база данных систематических обзоров . 2023 (4): CD007930. doi : 10.1002/14651858.cd007930.pub3 . PMC 10111509 . PMID 37185961 .
- ^ Jump up to: а беременный «Лучевая терапия при раке яичников» . www.cancerresearchuk.org . Архивировано из оригинала 18 мая 2015 года . Получено 16 мая 2015 года .
- ^ Уильямс С., Симера I, Брайант А (март 2010 г.). «Тамоксифен для рецидива рака яичников» . Кокрановская база данных систематических обзоров . 2010 (3): CD001034. doi : 10.1002/14651858.cd001034.pub2 . PMC 4235755 . PMID 20238312 .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж k л «Исследование рака яичников» . www.cancerresearchuk.org . Архивировано из оригинала 9 мая 2015 года . Получено 16 мая 2015 года .
- ^ «Последующее наблюдение за раком яичников» . Рак исследований Великобритания. 30 августа 2017 года. Архивировано с оригинала 29 августа 2014 года.
- ^ Jump up to: а беременный Последующая помощь архивировала 25 декабря 2013 года на машине Wayback от Американского общества рака . Последний медицинский обзор: 21 марта 2013 года. Последнее пересмотрение: 2 июня 2014 г.
- ^ Jump up to: а беременный в Общество гинекологической онкологии (февраль 2014 г.), «Пять вещей, которые врачи и пациенты должны подвергать сомнению» , выбирая мудрое : инициатива Фонда Абим , Общество гинекологической онкологии, архивировав в оригинале 1 декабря 2013 года , извлеченные февраля 2013 19
- Bhosale P, Peungjesada S, Wei W, Levenback CF, Schmeler K, Rohren E, et al. (Август 2010 г.). «Клиническая полезность позитронной эмиссионной томографии/компьютерной томографии при оценке предполагаемого рецидивирующего рака яичников в условиях нормальных уровней CA-125». Международный журнал гинекологического рака . 20 (6): 936–944. doi : 10.1111/igc.0b013e3181e82a7f . PMID 20683399 . S2CID 13542187 .
- ^ «Химиотерапия при раке яичников» . www.cancerresearchuk.org . Архивировано из оригинала 18 мая 2015 года . Получено 16 мая 2015 года .
- ^ «ASCO Временное клиническое мнение: интеграция паллиативной помощи в стандартную онкологическую помощь» . АСКО. Архивировано из оригинала 21 августа 2014 года . Получено 20 августа 2014 года .
- ^ «Лечение распространенного рака яичников» . www.cancerresearchuk.org . Архивировано из оригинала 19 мая 2015 года . Получено 16 мая 2015 года .
- ^ Jump up to: а беременный в дюймовый и Роланд К.Б., Родригес Дж.Л., Паттерсон -младший, Триверс К.Ф. (ноябрь 2013). «Литература обзор социальных и психологических потребностей выживших рака яичников» . Психоконкология . 22 (11): 2408–18. doi : 10.1002/pon.3322 . PMC 11299102 . PMID 23760742 . S2CID 30648891 .
- ^ Уоттс С., Прескотт П., Мейсон Дж., Маклеод Н., Левит Дж (ноябрь 2015). «Депрессия и беспокойство при раке яичников: систематический обзор и метаанализ показателей распространенности» . BMJ Open . 5 (11): E007618. doi : 10.1136/bmjopen-2015-007618 . PMC 4679843 . PMID 26621509 .
- ^ Билсон Х.А., Холланд С., Курвелл Дж., Дэйви В.Л., Кинси Л., Лоутон Л.Дж. и др. (Сентябрь 2013 г.). «Периоперационные мероприятия по питанию для женщин с раком яичников» . Кокрановская база данных систематических обзоров . 2013 (9): CD009884. doi : 10.1002/14651858.cd009884.pub2 . PMC 8730356 . PMID 24027084 .
- ^ Jump up to: а беременный «Показатели выживаемости при раке яичников, на стадии» . Американское онкологическое общество . Архивировано с оригинала 29 октября 2014 года . Получено 29 октября 2014 года .
- ^ «Статистика и перспективы для рака яичников» . www.cancerresearchuk.org . Архивировано из оригинала 18 мая 2015 года . Получено 16 мая 2015 года .
- ^ Jump up to: а беременный Уровень выживаемости на основе статистики заболеваемости SEER и смертности от NCHS, как цитируется Национальным институтом рака в яичника платежах SEER Stat - рак архивирования 6 июля 2014 года на машине Wayback
- ^ Gucalp R, Dutcher J (2012). «Онкологические чрезвычайные ситуации». В Longo DL, Kasper DL, Jameson JL, Fauci AS, Hauser SL, Loscalzo J (Eds.). Принципы внутренней медицины Харрисона (18 -е изд.). МакГроу-Хилл. ISBN 978-0-07-174889-6 .
- ^ «Оценки страны и травмы, которые оценивают» . Всемирная организация здравоохранения . 2009 Получено 15 июня 2017 года . Статистика с 2004 года. Эта Weblink открывается с автоматической загрузкой файла Excel
- ^ Vaidya S, Sharma P, KC S, Vaidya SA (2014). «Спектр опухолей яичников в реферальной больнице в Непале» . Журнал патологии Непала . 4 (7): 539–543. doi : 10.3126/jpn.v4i7.10295 . ISSN 2091-0908 .
- Незначительная корректировка зрелых кистозных тератомы (от 0,17 до 2% риска рака яичников): Мандал С., Бадхе Б.А. (2012). «Злокачественная трансформация при зрелой тератоме с метастатическими отложениями в Omentum: отчет о случае» . Отчеты о патологии . 2012 : 568062. DOI : 10.1155/2012/568062 . PMC 3469088 . PMID 23082264 . - ^ Jump up to: а беременный в Gaona-Luvian P, Medina-Gaona La La, Magaña-Pérez K (август 2020 г.). «Эпидемиология рака яичников » Китайская клиническая онкология 9 (4): 47. doi : 10.21037/cco- 20-3 PMID 32648444 S2CID 220465461
- ^ Лозано Р., Нагхави М., Форман К., Лим С., Шибуя К., Абоянс В. и др. (Декабрь 2012 г.). «Глобальная и региональная смертность от 235 причин смерти для 20 возрастных групп в 1990 и 2010 годах: систематический анализ глобального исследования болезней 2010 года» . Лансет . 380 (9859): 2095–2128. doi : 10.1016/s0140-6736 (12) 61728-0 . HDL : 10536/dro/du: 30050819 . PMC 10790329 . PMID 23245604 . S2CID 1541253 .
- ^ Локли М., Стоунхэм С.Дж., Олсон Т.А. (2019). «Рак яичников у подростков и молодых людей». Педиатр Рак крови . 66 (3): E27512. doi : 10.1002/pbc.27512 . PMID 30350916 . S2CID 53040039 .
- ^ «Факты и статистика рака» . Американское онкологическое общество . Получено 18 ноября 2022 года .
- ^ Jump up to: а беременный «Факты по статистике рака: рак яичника» . SEER: Программа наблюдения, эпидемиология и конечные результаты . Национальный институт рака NIH.
- ^ Ramirez PT, Gershenson DM (сентябрь 2013 г.). «Рак яичников» . Руководство Merck для медицинских работников .

- ^ «Статистика рака яичников» . Рак исследований Великобритания . Архивировано с оригинала 6 октября 2014 года . Получено 28 октября 2014 года .
- ^ Jump up to: а беременный Гиббонс К (22 февраля 2022 г.). «Женщины без необходимости умирают после того, как GPS пропускают ранние признаки рака яичников» . Время .
- ^ Hennessy BT, Suh GK, Markman M (2011). «Рак яичников». В Кантарджиане HM, Wolff RA, Koller CA (Eds.). MD Anderson Manual of Medical Oncology (2 -е изд.). МакГроу-Хилл. ISBN 978-0-07-170106-8 Полем Архивировано с оригинала 10 сентября 2017 года.
- ^ Catone G, Marino G, Mancuso R, Zanghì A (апрель 2004 г.). «Клинико -патологические особенности тератомы яичников лошадей». Воспроизведение у домашних животных = Zuchthygiene . 39 (2): 65–69. doi : 10.1111/j.1439-0531.2003.00476.x . HDL : 11581/112802 . PMID 15065985 .
- ^ Lefebvre R, Theoret C, Doré M, Girard C, Laverty S, Vaillancourt D (ноябрь 2005 г.). «Тератома яичника и эндометрит в кобыле» . Канадский ветеринарный журнал . 46 (11): 1029–33. PMC 1259148 . PMID 16363331 .
- ^ Son YS, Lee CS, Jeong WI, Hong IH, Park SJ, Kim TH, et al. (Май 2005 г.). «Цистаденокарцинома в яичнике чистокровной кобылы». Австралийский ветеринарный журнал . 83 (5): 283–4. doi : 10.1111/j.1751-0813.2005.tb12740.x . PMID 15957389 .
- ^ LM, Gerard MP, CRTO CR, Gradil CM (2007). Аравийская кобыла " Канадский ветеринарный журнал 48 (5): 502–5 PMC 1852596 . PMID 17542368 .
- ^ Hoque S, Derar RI, Osawa T, Taya K, Watanabe G, Miyake Y (июнь 2003 г.). «Спонтанное восстановление атрофического контралатерального яичника без овариээктомии в случае опухоли клетки гранулеза Theca (GTCT) повлияла на кобылу» . Журнал ветеринарной медицинской науки . 65 (6): 749–751. doi : 10.1292/jvms.65.749 . PMID 12867740 .
- ^ Sedrish SA, McClure JR, Pinto C, Oliver J, Burba DJ (ноябрь 1997 г.). «Прушка яичника, связанная с опухолью клеток гранулеза-тека в кобыле». Журнал Американской ветеринарной медицинской ассоциации . 211 (9): 1152–4. doi : 10.2460/javma.1997.211.09.1152 . PMID 9364230 .
- ^ Молл Х.Д., Слоун Д.Е., Джузвиак Дж.С., Гарретт П.Д. (1987). «Диагональный парамедианский подход для удаления опухолей яичников в кобыле» . Ветеринарная хирургия . 16 (6): 456–8. doi : 10.1111/j.1532-950x.1987.tb00987.x . PMID 3507181 . Архивировано с оригинала 10 октября 2012 года.
- ^ Доран Р., Аллен Д., Гордон Б. (январь 1988 г.). «Использование сшивающих инструментов для помощи в удалении опухолей яичников в кобылах». Ветеринарный журнал лошадей . 20 (1): 37–40. doi : 10.1111/j.2042-3306.1988.tb01450.x . PMID 2835223 .
- ^ Gizzo S, Noventa M, Ciaranta M, Vitagliano A, Saccardi C, Litta P, et al. (Февраль 2017 г.). «Новый гистероскопический подход для скрининга рака яичников/ранней диагностики» . Онкологические письма . 13 (2): 549–553. doi : 10.3892/ol.2016.5493 . PMC 5351187 . PMID 28356928 . требуется подписка
- ^ Джейкобс И.Дж., Менон У, Райан А., Джентри-Махарадж А., Бернелл М., Калси Дж.К. и др. (Март 2016 г.). «Скрининг и смертность от рака яичников в британском совместном исследовании скрининга рака яичников (UKCTOC): рандомизированное контролируемое исследование» . Лансет . 387 (10022): 945–956. doi : 10.1016/s0140-6736 (15) 01224-6 . PMC 4779792 . PMID 26707054 .
- ^ Paijens St, Leffers N, Daemen T, Helfrich W, Boezen HM, Cohlen BJ, et al. (Сентябрь 2018 г.). «Антиген-специфическая активная иммунотерапия при раке яичников» . Кокрановская база данных систематических обзоров . 2018 (9): CD007287. doi : 10.1002/14651858.cd007287.pub4 . PMC 6513204 . PMID 30199097 .
- ^ Ингерлев К., Хогдалл Е., Шнак Т. Т., Сковридер-Румински В., Хогдалл С., Блаакаер Дж. (2017). «Потенциальная роль инфекционных агентов и воспалительных заболеваний таза в канцерогенезе яичников» . Заразительные агенты и рак . 12 (1): 25. doi : 10.1186/s13027-017-0134-9 . PMC 5437405 . PMID 28529540 .
- ^ «NIH клинические исследования и вы» . Архивировано с оригинала 8 июня 2017 года . Получено 17 июня 2017 года .
- ^ «Информация о клинических испытаниях для пациентов и лиц, осуществляющих уход» . Национальный институт рака . Май 2015. Архивировано с оригинала 16 июня 2017 года . Получено 17 июня 2017 года .
- ^ «Найдите клинические испытания, поддерживаемые NCI» . Национальный институт рака . 23 июня 2016 года. Архивировано с оригинала 1 июля 2017 года . Получено 17 июня 2017 года .
- ^ «Дом - Clinicaltrials.gov» . www.clinicaltrials.gov . Архивировано из оригинала 16 июня 2017 года . Получено 17 июня 2017 года .
- ^ «Дом - канадские испытания рака» . www.canadiancancertrials.ca . Архивировано с оригинала 26 июня 2017 года . Получено 17 июня 2017 года .
Дальнейшее чтение
[ редактировать ]- Cannistra (декабрь 2004 г.). "Рак яичника" Новый английский журнал медицины 351 (24): 2519–29. doi : 10.1056/ nejmra0 PMID 1590954 .
- Ходаванди А., Ализаде Ф., Разис А.Ф. (июнь 2021 г.). «Связь между потреблением питания и риском рака яичников: систематический обзор и метаанализ». Eur J Nutr . 60 (4): 1707–36. doi : 10.1007/s00394-020-023332-y . PMID 32661683 . S2CID 220505663 .
- Петруцелли Н., Дейли М.Б., Фельдман Г.Л. (2013). «Наследственные наследственные и ассоциированные с BRCA2 рак молочной железы и яичников» . GenereViews . Университет Вашингтона, Сиэтл. PMID 20301425 . NBK1247.
Внешние ссылки
[ редактировать ]- «Яичники, фаллопиевая трубка и первичный брюшной рак - версия пациента» . Национальный институт рака . Получено 30 марта 2017 года .
- Что такое инфографика рака яичников, информация о раке яичников - больница горы Синай, Нью -Йорк



