Колоректальный рак
| Колоректальный рак | |
|---|---|
| Другие имена |
|
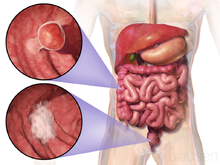 | |
| Расположение и внешний вид двух примеров колоректальных опухолей | |
| Специальность | Гастроэнтерология Общая хирургия Онкология |
| Симптомы |
|
| Causes | |
| Risk factors |
|
| Diagnostic method | Tissue biopsy during a sigmoidoscopy or colonoscopy[1] |
| Prevention | Screening from age of 45 to 75 |
| Treatment | |
| Prognosis | Five-year survival rate 65% (US)[6] |
| Frequency | 9.4 million (2015)[7] |
| Deaths | 551,000 (2018)[8] |
Колоректальный рак КРР ) , также известный как рак кишечника , рак толстой кишки или рак прямой кишки , представляет собой развитие рака толстой ( или прямой кишки (частей толстой кишки ). [5] Признаки и симптомы могут включать кровь в стуле , изменение стула , потерю веса, боль в животе и усталость. [9] Большинство случаев колоректального рака обусловлено старостью и факторами образа жизни, и лишь небольшое количество случаев связано с генетическими нарушениями . [2] [3] Факторы риска включают диету, ожирение , курение и отсутствие физической активности . [2] Диетические факторы, повышающие риск, включают красное мясо , обработанное мясо и алкоголь . [2] [4] Другим фактором риска являются воспалительные заболевания кишечника , в том числе болезнь Крона и язвенный колит . [2] Некоторые из наследственных генетических нарушений, которые могут вызвать колоректальный рак, включают семейный аденоматозный полипоз и наследственный неполипозный рак толстой кишки ; однако это составляет менее 5% случаев. [2] [3] Обычно оно начинается как доброкачественная опухоль , часто в форме полипа , который со временем становится раковым . [2]
Colorectal cancer may be diagnosed by obtaining a sample of the colon during a sigmoidoscopy or colonoscopy.[1] This is then followed by medical imaging to determine whether the disease has spread.[5] Screening is effective for preventing and decreasing deaths from colorectal cancer.[10] Screening, by one of a number of methods, is recommended starting from the age of 45 to 75. It was recommended starting at age 50 but it was changed to 45 due to increasing amount of colon cancers.[10][11] During colonoscopy, small polyps may be removed if found.[2] If a large polyp or tumor is found, a biopsy may be performed to check if it is cancerous. Aspirin and other non-steroidal anti-inflammatory drugs decrease the risk of pain during polyp excision.[2][12] Their general use is not recommended for this purpose, however, due to side effects.[13]
Treatments used for colorectal cancer may include some combination of surgery, radiation therapy, chemotherapy, and targeted therapy.[5] Cancers that are confined within the wall of the colon may be curable with surgery, while cancer that has spread widely is usually not curable, with management being directed towards improving quality of life and symptoms.[5] The five-year survival rate in the United States was around 65% in 2014.[6] The individual likelihood of survival depends on how advanced the cancer is, whether or not all the cancer can be removed with surgery, and the person's overall health.[1] Globally, colorectal cancer is the third most common type of cancer, making up about 10% of all cases.[14] In 2018, there were 1.09 million new cases and 551,000 deaths from the disease.[8] It is more common in developed countries, where more than 65% of cases are found.[2] It is less common in women than men.[2]
Signs and symptoms
[edit]The signs and symptoms of colorectal cancer depend on the location of the tumor in the bowel, and whether it has spread elsewhere in the body (metastasis). The classic warning signs include: worsening constipation, blood in the stool, decrease in stool caliber (thickness), loss of appetite, loss of weight, and nausea or vomiting in someone over 50 years old.[15] Around 50% of people who have colorectal cancer do not report any symptoms.[16]
Rectal bleeding or anemia are high-risk symptoms in people over the age of 50.[17] Weight loss and changes in a person's bowel habit are typically only concerning if they are associated with rectal bleeding.[17][18]
Cause
[edit]75–95% of colorectal cancer cases occur in people with little or no genetic risk.[19][20] Risk factors include older age, male sex,[20] high intake of fat, sugar, alcohol, red meat, processed meats, obesity, smoking, and a lack of physical exercise.[19][21] The Rectal Cancer Survival Calculator developed by the MD Anderson Cancer Center additionally considers race to be a risk factor; however, there are equity issues concerning whether this might lead to inequity in clinical decision making.[22][23] Approximately 10% of cases are linked to insufficient activity.[24] The risk from alcohol appears to increase at greater than one drink per day.[25] Drinking five glasses of water a day is linked to a decrease in the risk of colorectal cancer and adenomatous polyps.[26] Streptococcus gallolyticus is associated with colorectal cancer.[27] Some strains of Streptococcus bovis/Streptococcus equinus complex are consumed by millions of people daily and thus may be safe.[28] 25 to 80% of people with Streptococcus bovis/gallolyticus bacteremia have concomitant colorectal tumors.[29] Seroprevalence of Streptococcus bovis/gallolyticus is considered as a candidate practical marker for the early prediction of an underlying bowel lesion at high risk population.[29] It has been suggested that the presence of antibodies to Streptococcus bovis/gallolyticus antigens or the antigens themselves in the bloodstream may act as markers for the carcinogenesis in the colon.[29]
Pathogenic Escherichia coli may increase the risk of colorectal cancer by producing the genotoxic metabolite, colibactin.[30]
Inflammatory bowel disease
[edit]People with inflammatory bowel disease (ulcerative colitis and Crohn's disease) are at increased risk of colon cancer.[31][32] The risk increases the longer a person has the disease, and the worse the severity of inflammation.[33] In these high risk groups, both prevention with aspirin and regular colonoscopies are recommended.[34] Endoscopic surveillance in this high-risk population may reduce the development of colorectal cancer through early diagnosis and may also reduce the chances of dying from colon cancer.[34] People with inflammatory bowel disease account for less than 2% of colon cancer cases yearly.[33] In those with Crohn's disease, 2% get colorectal cancer after 10 years, 8% after 20 years, and 18% after 30 years.[33] In people who have ulcerative colitis, approximately 16% develop either a cancer precursor or cancer of the colon over 30 years.[33]
Genetics
[edit]Those with a family history in two or more first-degree relatives (such as a parent or sibling) have a two to threefold greater risk of disease, and this group accounts for about 20% of all cases. A number of genetic syndromes are also associated with higher rates of colorectal cancer. The most common of these is hereditary nonpolyposis colorectal cancer (HNPCC, or Lynch syndrome) which is present in about 3% of people with colorectal cancer.[20] Other syndromes that are strongly associated with colorectal cancer include Gardner syndrome and familial adenomatous polyposis (FAP).[35] For people with these syndromes, cancer almost always occurs and makes up 1% of the cancer cases.[36] A total proctocolectomy may be recommended for people with FAP as a preventive measure due to the high risk of malignancy. Colectomy, removal of the colon, may not suffice as a preventive measure because of the high risk of rectal cancer if the rectum remains.[37] The most common polyposis syndrome affecting the colon is serrated polyposis syndrome,[38] which is associated with a 25-40% risk of CRC.[39]
Mutations in the pair of genes (POLE and POLD1) have been associated with familial colon cancer.[40]
Most deaths due to colon cancer are associated with metastatic disease. A gene that appears to contribute to the potential for metastatic disease, metastasis associated in colon cancer 1 (MACC1), has been isolated.[41] It is a transcriptional factor that influences the expression of hepatocyte growth factor. This gene is associated with the proliferation, invasion, and scattering of colon cancer cells in cell culture, and tumor growth and metastasis in mice. MACC1 may be a potential target for cancer intervention, but this possibility needs to be confirmed with clinical studies.[42]
Epigenetic factors, such as abnormal DNA methylation of tumor suppressor promoters, play a role in the development of colorectal cancer.[43]
Ashkenazi Jews have a 6% higher risk rate of getting adenomas and then colon cancer due to mutations in the APC gene being more common.[44]
Pathogenesis
[edit]Colorectal cancer is a disease originating from the epithelial cells lining the colon or rectum of the gastrointestinal tract, most frequently as a result of genetic mutations in the Wnt signaling pathway that increases signaling activity.[45] The Wnt signaling pathway normally plays an important role for normal function of these cells including maintaining this lining. Mutations can be inherited or acquired, and most probably occur in the intestinal crypt stem cell.[46][47][48] The most commonly mutated gene in all colorectal cancer is the APC gene, which produces the APC protein.[45] The APC protein prevents the accumulation of β-catenin protein. Without APC, β-catenin accumulates to high levels and translocates (moves) into the nucleus, binds to DNA, and activates the transcription of proto-oncogenes. These genes are normally important for stem cell renewal and differentiation, but when inappropriately expressed at high levels, they can cause cancer.[45] While APC is mutated in most colon cancers, some cancers have increased β-catenin because of mutations in β-catenin (CTNNB1) that block its own breakdown, or have mutations in other genes with function similar to APC such as AXIN1, AXIN2, TCF7L2, or NKD1.[49]
Beyond the defects in the Wnt signaling pathway, other mutations must occur for the cell to become cancerous. The p53 protein, produced by the TP53 gene, normally monitors cell division and induces their programmed death if they have Wnt pathway defects. Eventually, a cell line acquires a mutation in the TP53 gene and transforms the tissue from a benign epithelial tumor into an invasive epithelial cell cancer. Sometimes the gene encoding p53 is not mutated, but another protective protein named BAX is mutated instead.[49]
Other proteins responsible for programmed cell death that are commonly deactivated in colorectal cancers are TGF-β and DCC (Deleted in Colorectal Cancer). TGF-β has a deactivating mutation in at least half of colorectal cancers. Sometimes TGF-β is not deactivated, but a downstream protein named SMAD is deactivated.[49] DCC commonly has a deleted segment of a chromosome in colorectal cancer.[50]
Approximately 70% of all human genes are expressed in colorectal cancer, with just over 1% of having increased expression in colorectal cancer compared to other forms of cancer.[51] Some genes are oncogenes: they are overexpressed in colorectal cancer. For example, genes encoding the proteins KRAS, RAF, and PI3K, which normally stimulate the cell to divide in response to growth factors, can acquire mutations that result in over-activation of cell proliferation. The chronological order of mutations is sometimes important. If a previous APC mutation occurred, a primary KRAS mutation often progresses to cancer rather than a self-limiting hyperplastic or borderline lesion.[52] PTEN, a tumor suppressor, normally inhibits PI3K, but can sometimes become mutated and deactivated.[49]
Comprehensive, genome-scale analysis has revealed that colorectal carcinomas can be categorized into hypermutated and non-hypermutated tumor types.[53] In addition to the oncogenic and inactivating mutations described for the genes above, non-hypermutated samples also contain mutated CTNNB1, FAM123B, SOX9, ATM, and ARID1A. Progressing through a distinct set of genetic events, hypermutated tumors display mutated forms of ACVR2A, TGFBR2, MSH3, MSH6, SLC9A9, TCF7L2, and BRAF. The common theme among these genes, across both tumor types, is their involvement in Wnt and TGF-β signaling pathways, which results in increased activity of MYC, a central player in colorectal cancer.[53]
Mismatch repair (MMR) deficient tumours are characterized by a relatively high amount of poly-nucleotide tandem repeats.[54] This is caused by a deficiency in MMR proteins – which are typically caused by epigenetic silencing and or inherited mutations (e.g., Lynch syndrome).[55] 15 to 18 percent of colorectal cancer tumours have MMR deficiencies, with 3 percent developing due to Lynch syndrome.[56] The role of the mismatch repair system is to protect the integrity of the genetic material within cells (i.e., error detecting and correcting).[55] Consequently, a deficiency in MMR proteins may lead to an inability to detect and repair genetic damage, allowing for further cancer-causing mutations to occur and colorectal cancer to progress.[55]
The polyp to cancer progression sequence is the classical model of colorectal cancer pathogenesis.[57] In this adenoma-carcinoma sequence,[58] normal epithelial cells progress to dysplastic cells such as adenomas, and then to carcinoma, by a process of progressive genetic mutation.[59] Central to the polyp to CRC sequence are gene mutations, epigenetic alterations, and local inflammatory changes.[57] The polyp to CRC sequence can be used as an underlying framework to illustrate how specific molecular changes lead to various cancer subtypes.[57]
Field defects
[edit]
The term "field cancerization" was first used in 1953 to describe an area or "field" of epithelium that has been preconditioned (by what were largely unknown processes at the time) to predispose it towards development of cancer.[60] Since then, the terms "field cancerization", "field carcinogenesis", "field defect", and "field effect" have been used to describe pre-malignant or pre-neoplastic tissue in which new cancers are likely to arise.[61]
Field defects are important in progression to colon cancer.[62][63]
However, as pointed out by Rubin, "The vast majority of studies in cancer research has been done on well-defined tumors in vivo, or on discrete neoplastic foci in vitro. Yet there is evidence that more than 80% of the somatic mutations found in mutator phenotype human colorectal tumors occur before the onset of terminal clonal expansion."[64][65] Similarly, Vogelstein et al.[66] pointed out that more than half of somatic mutations identified in tumors occurred in a pre-neoplastic phase (in a field defect), during growth of apparently normal cells. Likewise, epigenetic alterations present in tumors may have occurred in pre-neoplastic field defects.[67]
An expanded view of field effect has been termed "etiologic field effect", which encompasses not only molecular and pathologic changes in pre-neoplastic cells but also influences of exogenous environmental factors and molecular changes in the local microenvironment on neoplastic evolution from tumor initiation to death.[68]
Epigenetics
[edit]Epigenetic alterations are much more frequent in colon cancer than genetic (mutational) alterations. As described by Vogelstein et al.,[66] an average cancer of the colon has only 1 or 2 oncogene mutations and 1 to 5 tumor suppressor mutations (together designated "driver mutations"), with about 60 further "passenger" mutations. The oncogenes and tumor suppressor genes are well studied and are described above under Pathogenesis.[69][70]
In addition to epigenetic alteration of expression of miRNAs, other common types of epigenetic alterations in cancers that change gene expression levels include direct hypermethylation or hypomethylation of CpG islands of protein-encoding genes and alterations in histones and chromosomal architecture that influence gene expression.[71] As an example, 147 hypermethylations and 27 hypomethylations of protein coding genes were frequently associated with colorectal cancers. Of the hypermethylated genes, 10 were hypermethylated in 100% of colon cancers, and many others were hypermethylated in more than 50% of colon cancers.[72] In addition, 11 hypermethylations and 96 hypomethylations of miRNAs were also associated with colorectal cancers.[72] Abnormal (aberrant) methylation occurs as a normal consequence of normal aging and the risk of colorectal cancer increases as a person gets older.[73] The source and trigger of this age-related methylation is unknown.[73][74] Approximately half of the genes that show age-related methylation changes are the same genes that have been identified to be involved in the development of colorectal cancer.[73] These findings may suggest a reason for age being associated with the increased risk of developing colorectal cancer.[73]
Epigenetic reductions of DNA repair enzyme expression may likely lead to the genomic and epigenomic instability characteristic of cancer.[75][76][67] As summarized in the articles Carcinogenesis and Neoplasm, for sporadic cancers in general, a deficiency in DNA repair is occasionally due to a mutation in a DNA repair gene, but is much more frequently due to epigenetic alterations that reduce or silence expression of DNA repair genes.[77]
Epigenetic alterations involved in the development of colorectal cancer may affect a person's response to chemotherapy.[78]
Genomics and epigenomics
[edit]Consensus molecular subtypes (CMS) classification of colorectal cancer was first introduced in 2015. CMS classification so far has been considered the most robust classification system available for CRC that has a clear biological interpretability and the basis for future clinical stratification and subtype-based targeted interventions.[79]
A novel Epigenome-based Classification (EpiC) of colorectal cancer was proposed in 2021 introducing 4 enhancer subtypes in people with CRC. Chromatin states using 6 histone marks are characterized to identify EpiC subtypes. A combinatorial therapeutic approach based on the previously introduced consensus molecular subtypes (CMSs) and EpiCs could significantly enhance current treatment strategies.[80]
Diagnosis
[edit]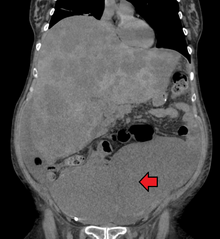
Colorectal cancer diagnosis is performed by sampling of areas of the colon suspicious for possible tumor development, typically during colonoscopy or sigmoidoscopy, depending on the location of the lesion.[20]
Medical imaging
[edit]A colorectal cancer is sometimes initially discovered on CT scan.[81]
Presence of metastases is determined by a CT scan of the chest, abdomen and pelvis.[20] Other potential imaging tests such as PET and MRI may be used in certain cases.[20] MRI is particularly useful to determine local stage of the tumor and to plan the optimal surgical approach.[81]
MRI is also performed after completion of neoadjuvant chemoradiotherapy to identify patients who achieve complete response. Patients with complete response on both MRI and endoscopy may not require surgical resection and can avoid unnecessary surgical morbidity and complications.[82] Patients selected for non-surgical treatment of rectal cancer should have periodic MRI scans, receive physical examinations, and undergo endoscopy procedures to detect any tumor re-growth which can occur in a minority of these patients. When local recurrence occurs, periodic follow up can detect it when it is still small and curable with salvage surgery. In addition, MRI tumor regression grades can be assigned after chemoradiotherapy which correlate with patients' long-term survival outcomes.[83]
Histopathology
[edit]

The histopathologic characteristics of the tumor are reported from the analysis of tissue taken from a biopsy or surgery. A pathology report contains a description of the microscopical characteristics of the tumor tissue, including both tumor cells and how the tumor invades into healthy tissues and finally if the tumor appears to be completely removed. The most common form of colon cancer is adenocarcinoma, constituting between 95%[85] and 98%[86] of all cases of colorectal cancer. Other, rarer types include lymphoma, adenosquamous and squamous cell carcinoma. Some subtypes are more aggressive.[87] Immunohistochemistry may be used in uncertain cases.[88]
Staging
[edit]Staging of the cancer is based on both radiological and pathological findings. As with most other forms of cancer, tumor staging is based on the TNM system which considers how much the initial tumor has spread and the presence of metastases in lymph nodes and more distant organs.[20] The AJCC 8th edition was published in 2018.[89]
Prevention
[edit]It has been estimated that about half of colorectal cancer cases are due to lifestyle factors, and about a quarter of all cases are preventable.[90] Increasing surveillance, engaging in physical activity, consuming a diet high in fiber, quitting smoking and limiting alcohol consumption decrease the risk.[91][92]
Lifestyle
[edit]Lifestyle risk factors with strong evidence include lack of exercise, cigarette smoking, alcohol, and obesity.[93][94][95] The risk of colon cancer can be reduced by maintaining a normal body weight through a combination of sufficient exercise and eating a healthy diet.[96]
Current research consistently links eating more red meat and processed meat to a higher risk of the disease.[97] Starting in the 1970s, dietary recommendations to prevent colorectal cancer often included increasing the consumption of whole grains, fruits and vegetables, and reducing the intake of red meat and processed meats. This was based on animal studies and retrospective observational studies. However, large scale prospective studies have failed to demonstrate a significant protective effect, and due to the multiple causes of cancer and the complexity of studying correlations between diet and health, it is uncertain whether any specific dietary interventions will have significant protective effects.[98]: 432–433 [99]: 125–126 In 2018 the National Cancer Institute stated that "There is no reliable evidence that a diet started in adulthood that is low in fat and meat and high in fiber, fruits, and vegetables reduces the risk of CRC by a clinically important degree."[93][100]
Consuming alcoholic drinks and consuming processed meat both increase the risk of colorectal cancer.[101]
The 2014 World Health Organization cancer report noted that it has been hypothesized that dietary fiber might help prevent colorectal cancer, but that most studies at the time had not yet studied the correlation.[99] A 2019 review, however, found evidence of benefit from dietary fiber and whole grains.[102] The World Cancer Research Fund listed the benefit of fiber for prevention of colorectal cancer as "probable" as of 2017.[103] A 2022 umbrella review says there is "convincing evidence" for that association.[104]
Higher physical activity is recommended.[21][105] Physical exercise is associated with a modest reduction in colon but not rectal cancer risk.[106][107] High levels of physical activity reduce the risk of colon cancer by about 21%.[108] Sitting regularly for prolonged periods is associated with higher mortality from colon cancer. Regular exercise does not negate the risk but does lower it.[109]
Medication and supplements
[edit]Aspirin and celecoxib appear to decrease the risk of colorectal cancer in those at high risk.[110][111] Aspirin is recommended in those who are 50 to 60 years old, do not have an increased risk of bleeding, and are at risk for cardiovascular disease to prevent colorectal cancer.[112] It is not recommended in those at average risk.[113]
There is tentative evidence for calcium supplementation, but it is not sufficient to make a recommendation.[114] Vitamin D intake and blood levels are associated with a lower risk of colon cancer.[115][116]
Screening
[edit]As more than 80% of colorectal cancers arise from adenomatous polyps, screening for this cancer is effective for both early detection and for prevention.[20][117] Diagnosis of cases of colorectal cancer through screening tends to occur 2–3 years before diagnosis of cases with symptoms.[20] Any polyps that are detected can be removed, usually by colonoscopy or sigmoidoscopy, and thus prevent them from turning into cancer. Screening has the potential to reduce colorectal cancer deaths by 60%.[118]
The three main screening tests are colonoscopy, fecal occult blood testing, and flexible sigmoidoscopy. Of the three, only sigmoidoscopy cannot screen the right side of the colon where 42% of cancers are found.[119] Flexible sigmoidoscopy, however, has the best evidence for decreasing the risk of death from any cause.[120]
Fecal occult blood testing (FOBT) of the stool is typically recommended every two years and can be either guaiac-based or immunochemical.[20] If abnormal FOBT results are found, participants are typically referred for a follow-up colonoscopy examination. When done once every 1–2 years, FOBT screening reduces colorectal cancer deaths by 16% and among those participating in screening, colorectal cancer deaths can be reduced up to 23%, although it has not been proven to reduce all-cause mortality.[121] Immunochemical tests are accurate and do not require dietary or medication changes before testing.[122] However, research in the UK has found that for these immunochemical tests, the threshold for further investigation is set at a point that may miss more than half of bowel cancer cases. The research suggests that the NHS England's Bowel Cancer Screening Programme could make better use of the test's ability to provide the exact concentration of blood in faeces (rather than only whether it is above or below a cutoff level).[123][124]
Other options include virtual colonoscopy and stool DNA screening testing (FIT-DNA). Virtual colonoscopy via a CT scan appears as good as standard colonoscopy for detecting cancers and large adenomas but is expensive, associated with radiation exposure, and cannot remove any detected abnormal growths as standard colonoscopy can.[20] Stool DNA screening test looks for biomarkers associated with colorectal cancer and precancerous lesions, including altered DNA and blood hemoglobin. A positive result should be followed by colonoscopy. FIT-DNA has more false positives than FIT and thus results in more adverse effects.[10] Further study is required as of 2016 to determine whether a three-year screening interval is correct.[10]
Recommendations
[edit]In the United States, screening is typically recommended between ages 50 and 75 years.[10][125] The American Cancer Society recommends starting at the age of 45.[126] For those between 76 and 85 years old, the decision to screen should be individualized.[10] For those at high risk, screenings usually begin at around 40.[20][127]
Several screening methods are recommended including stool-based tests every 2 years, sigmoidoscopy every 10 years with fecal immunochemical testing every two years, and colonoscopy every 10 years.[125] It is unclear which of these two methods is better.[128] Colonoscopy may find more cancers in the first part of the colon, but is associated with greater cost and more complications.[128] For people with average risk who have had a high-quality colonoscopy with normal results, the American Gastroenterological Association does not recommend any type of screening in the 10 years following the colonoscopy.[129][130] For people over 75 or those with a life expectancy of less than 10 years, screening is not recommended.[131] It takes about 10 years after screening for one out of a 1000 people to benefit.[132] The USPSTF list seven potential strategies for screening, with the most important thing being that at least one of these strategies is appropriately used.[10]
In Canada, among those 50 to 75 years old at normal risk, fecal immunochemical testing or FOBT is recommended every two years or sigmoidoscopy every 10 years.[133] Colonoscopy is less preferred.[133]
Some countries have national colorectal screening programs which offer FOBT screening for all adults within a certain age group, typically starting between ages 50 and 60. Examples of countries with organised screening include the United Kingdom,[134] Australia,[135] the Netherlands,[136] Hong Kong, and Taiwan.[137]
The UK Bowel Cancer Screening Programme aims to find warning signs in people aged 60 to 74, by recommending a faecal immunochemical test (FIT) every two years. FIT measures blood in faeces, and people with levels above a certain threshold may have bowel tissue examined for signs of cancer. Growths having cancerous potential are removed.[138][124]
Treatment
[edit]The treatment of colorectal cancer can be aimed at cure or palliation. The decision on which aim to adopt depends on various factors, including the person's health and preferences, as well as the stage of the tumor.[139] Assessment in multidisciplinary teams is a critical part of determining whether the patient is suitable for surgery or not.[140] When colorectal cancer is caught early, surgery can be curative. However, when it is detected at later stages (for which metastases are present), this is less likely and treatment is often directed at palliation, to relieve symptoms caused by the tumour and keep the person as comfortable as possible.[20]
Surgery
[edit]
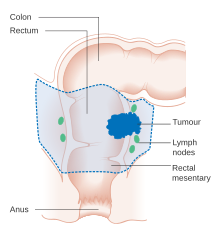

At an early stage, colorectal cancer may be removed during a colonoscopy using one of several techniques, including endoscopic mucosal resection or endoscopic submucosal dissection.[5] Endoscopic resection is possible if there is low possibility of lymph node metastasis and the size and location of the tumor make en bloc resection possible.[141] For people with localized cancer, the preferred treatment is complete surgical removal with adequate margins, with the attempt of achieving a cure. The procedure of choice is a partial colectomy (or proctocolectomy for rectal lesions) where the affected part of the colon or rectum is removed along with parts of its mesocolon and blood supply to facilitate removal of draining lymph nodes. This can be done either by an open laparotomy or laparoscopically, depending on factors related to the individual person and lesion factors.[20] The colon may then be reconnected or a person may have a colostomy.[5]
If there are only a few metastases in the liver or lungs, these may also be removed. Chemotherapy may be used before surgery to shrink the cancer before attempting to remove it. The two most common sites of recurrence of colorectal cancer are the liver and lungs.[20] For peritoneal carcinomatosis cytoreductive surgery, sometimes in combination with HIPEC can be used in an attempt to remove the cancer.[142]
Chemotherapy
[edit]In both cancer of the colon and rectum, chemotherapy may be used in addition to surgery in certain cases. The decision to add chemotherapy in management of colon and rectal cancer depends on the stage of the disease.[143]
In Stage I colon cancer, no chemotherapy is offered, and surgery is the definitive treatment. The role of chemotherapy in Stage II colon cancer is debatable, and is usually not offered unless risk factors such as T4 tumor, undifferentiated tumor, vascular and perineural invasion or inadequate lymph node sampling is identified.[144] It is also known that the people who carry abnormalities of the mismatch repair genes do not benefit from chemotherapy. For Stage III and Stage IV colon cancer, chemotherapy is an integral part of treatment.[20]
If cancer has spread to the lymph nodes or distant organs, which is the case with Stage III and Stage IV colon cancer respectively, adding chemotherapy agents fluorouracil, capecitabine or oxaliplatin increases life expectancy. If the lymph nodes do not contain cancer, the benefits of chemotherapy are controversial. If the cancer is widely metastatic or unresectable, treatment is then palliative. Typically in this setting, a number of different chemotherapy medications may be used.[20] Chemotherapy drugs for this condition may include capecitabine, fluorouracil, irinotecan, oxaliplatin and UFT.[145] The drugs capecitabine and fluorouracil are interchangeable, with capecitabine being an oral medication and fluorouracil being an intravenous medicine. Some specific regimens used for CRC are CAPOX, FOLFOX, FOLFOXIRI, and FOLFIRI.[146] Antiangiogenic drugs such as bevacizumab are often added in first line therapy.[147] Another class of drugs used in the second line setting are epidermal growth factor receptor inhibitors, of which the three FDA approved ones are aflibercept, cetuximab and panitumumab.[148][149]
The primary difference in the approach to low stage rectal cancer is the incorporation of radiation therapy. Often, it is used in conjunction with chemotherapy in a neoadjuvant fashion to enable surgical resection, so that ultimately a colostomy is not required. However, it may not be possible in low lying tumors, in which case, a permanent colostomy may be required. Stage IV rectal cancer is treated similar to Stage IV colon cancer.
Stage IV colorectal cancer due to peritoneal carcinomatosis can be treated using HIPEC combined with cytoreductive surgery, in some people.[150][151][152] Also, T4 colorectal cancer can be treated with HIPEC to avoid future relapses.[153]
Radiation therapy
[edit]While a combination of radiation and chemotherapy may be useful for rectal cancer,[20] for some people requiring treatment, chemoradiotherapy can increase acute treatment-related toxicity, and has not been shown to improve survival rates compared to radiotherapy alone, although it is associated with less local recurrence.[142] The use of radiotherapy in colon cancer is not routine due to the sensitivity of the bowels to radiation.[154] As with chemotherapy, radiotherapy can be used as a neoadjuvant for clinical stages T3 and T4 for rectal cancer.[155] This results in downsizing or downstaging of the tumour, preparing it for surgical resection, and also decreases local recurrence rates.[155] For locally advanced rectal cancer, neoadjuvant chemoradiotherapy has become the standard treatment.[156] Additionally, when surgery is not possible radiation therapy has been suggested to be an effective treatment against CRC pulmonary metastases, which are developed by 10-15% of people with CRC.[157]
Immunotherapy
[edit]Immunotherapy with immune checkpoint inhibitors has been found to be useful for a type of colorectal cancer with mismatch repair deficiency and microsatellite instability.[158][159][160] Pembrolizumab is approved for advanced CRC tumours that are MMR deficient and have failed usual treatments.[161] Most people who do improve, however, still worsen after months or years.[159]
On the other hand, in a prospective phase 2 study published in June 2022 in The New England Journal of Medicine, 12 patients with Deficient Mismatch Repair (dMMR) stage II or III rectal adenocarcinoma were administered single-agent dostarlimab, an anti–PD-1 monoclonal antibody, every three weeks for six months. After a median follow-up of 12 months (range, 6 to 25 months), all 12 patients had a complete clinical response with no evidence of tumor on MRI, 18F-fluorodeoxyglucose–positron-emission tomography, endoscopic evaluation, digital rectal examination, or biopsy. Moreover, no patient in the trial needed chemoradiotherapy or surgery, and no patient reported adverse events of grade 3 or higher. However, although the results of this study are promising, the study is small and has uncertainties about long-term outcomes.[162]
Palliative care
[edit]Palliative care is recommended for any person who has advanced colon cancer or who has significant symptoms.[163][164]
Involvement of palliative care may be beneficial to improve the quality of life for both the person and his or her family, by improving symptoms, anxiety and preventing admissions to the hospital.[165]
In people with incurable colorectal cancer, palliative care can consist of procedures that relieve symptoms or complications from the cancer but do not attempt to cure the underlying cancer, thereby improving quality of life. Surgical options may include non-curative surgical removal of some of the cancer tissue, bypassing part of the intestines, or stent placement. These procedures can be considered to improve symptoms and reduce complications such as bleeding from the tumor, abdominal pain and intestinal obstruction.[166] Non-operative methods of symptomatic treatment include radiation therapy to decrease tumor size as well as pain medications.[167]
Psychosocial Intervention
[edit]In addition to medical intervention, a variety of psychosocial interventions have been implemented to address psychosocial concerns in the context of colorectal cancer.[168] Depression and anxiety are highly prevalent in patients diagnosed with CRC, therefore psychosocial interventions can be helpful for alleviating psychological distress.[169][170] Many patients continue to experience symptoms of anxiety and depression following treatment, regardless of treatment outcome.[169][171] Societal stigmas associated with colorectal cancer present further psychosocial challenges for CRC patients and their families.[172][173]
Depression and Anxiety
[edit]Colorectal cancer patients have a 51% higher risk of experiencing depression than individuals without the disease.[170] Additionally, CRC patients are at high risk of experiencing severe anxiety, low self-esteem, poor self-concept, and social anxiety.[169][174]
Post-Treatment Distress
[edit]Regardless of treatment outcome, many CRC patients experience ongoing symptoms of anxiety, depression, and distress.[169]
Survivorship of CRC can involve significant lifestyle adjustments.[173] Postoperative afflictions may include stomas, bowel issues, incontinence, odor, and changes to sexual functioning.[173][174] These changes can result in distorted body image, social anxiety, depression, and distress—all of which contribute to a poorer quality of life.[173][175]
Colorectal cancer is the second leading cause of cancer-related death worldwide.[176] Transitioning into palliative care and contending with mortality can be a deeply distressing experience for a CRC patient and their loved ones.
Stigma
[edit]Colorectal cancer is highly stigmatized and can elicit feelings of disgust from patients, healthcare professionals, family, intimate partners, and the general public.[172] Patients with stomas are especially vulnerable to stigmatization due to unavoidable odors, gas, and unpleasant noises from stoma bags.[172] Additionally, associated CRC risk factors like poor diet, alcohol consumption, and lack of physical activity prompt negative assumptions of blame and personal responsibility onto CRC patients.[173] Judgement from others along with internalized self-blame and embarrassment can negatively affect self-esteem, sociability, and quality of life.[173]
Methods of Intervention
[edit]Face-to-face interventions such as clinician-patient talk therapy, body-mind-spirit practices, and support group sessions have been identified as most effective in reducing anxiety and depression in CRC patients.[168] Additionally, journaling exercises and over-the-phone talk therapy sessions have been implemented.[168] Though deemed less effective, these non-face-to-face interventions are economically inclusive and have been found to reduce both depression and anxiety in CRC patients.[168]
Follow-up
[edit]The U.S. National Comprehensive Cancer Network and American Society of Clinical Oncology provide guidelines for the follow-up of colon cancer.[177][178] A medical history and physical examination are recommended every 3 to 6 months for 2 years, then every 6 months for 5 years. Carcinoembryonic antigen blood level measurements follow the same timing, but are only advised for people with T2 or greater lesions who are candidates for intervention. A CT-scan of the chest, abdomen and pelvis can be considered annually for the first 3 years for people who are at high risk of recurrence (for example, those who had poorly differentiated tumors or venous or lymphatic invasion) and are candidates for curative surgery (with the aim to cure). A colonoscopy can be done after 1 year, except if it could not be done during the initial staging because of an obstructing mass, in which case it should be performed after 3 to 6 months. If a villous polyp, a polyp >1 centimeter or high-grade dysplasia is found, it can be repeated after 3 years, then every 5 years. For other abnormalities, the colonoscopy can be repeated after 1 year.[143]
Routine PET or ultrasound scanning, chest X-rays, complete blood count or liver function tests are not recommended.[177][178]
For people who have undergone curative surgery or adjuvant therapy (or both) to treat non-metastatic colorectal cancer, intense surveillance and close follow-up have not been shown to provide additional survival benefits.[179]
Exercise
[edit]Exercise may be recommended in the future as secondary therapy to cancer survivors. In epidemiological studies, exercise may decrease colorectal cancer-specific mortality and all-cause mortality. Results for the specific amounts of exercise needed to observe a benefit were conflicting. These differences may reflect differences in tumour biology and the expression of biomarkers. People with tumors that lacked CTNNB1 expression (β-catenin), involved in Wnt signalling pathway, required more than 18 Metabolic equivalent (MET) hours per week, a measure of exercise, to observe a reduction in colorectal cancer mortality. The mechanism of how exercise benefits survival may be involved in immune surveillance and inflammation pathways. In clinical studies, a pro-inflammatory response was found in people with stage II-III colorectal cancer who underwent 2 weeks of moderate exercise after completing their primary therapy. Oxidative balance may be another possible mechanism for benefits observed. A significant decrease in 8-oxo-dG was found in the urine of people who underwent 2 weeks of moderate exercise after primary therapy. Other possible mechanisms may involve metabolic hormone and sex-steroid hormones, although these pathways may be involved in other types of cancers.[180][181]
Another potential biomarker may be p27. Survivors with tumors that expressed p27 and performed greater and equal to 18 MET hours per week were found to have reduced colorectal cancer mortality survival compared to those with less than 18 MET hours per week. Survivors without p27 expression who exercised were shown to have worse outcomes. The constitutive activation of PI3K/AKT/mTOR pathway may explain the loss of p27 and excess energy balance may up-regulate p27 to stop cancer cells from dividing.[181]
Physical activity provides benefits to people with non-advanced colorectal cancer. Improvements in aerobic fitness, cancer-related fatigue and health-related quality of life have been reported in the short term.[182] However, these improvements were not observed at the level of disease-related mental health, such as anxiety and depression.[182]
Prognosis
[edit]Fewer than 600 genes are linked to outcomes in colorectal cancer.[51] These include both unfavorable genes, where high expression is related to poor outcome, for example the heat shock 70 kDa protein 1 (HSPA1A), and favorable genes where high expression is associated with better survival, for example the putative RNA-binding protein 3 (RBM3).[51] The prognosis is also correlated with a poor fidelity of the pre-mRNA splicing apparatus, and thus a high number of deviating alternative splicing.[183]
Recurrence rates
[edit]The average five-year recurrence rate in people with colon cancer where surgery is successful is 5% for stage I cancers, 12% in stage II and 33% in stage III. However, depending on the number of risk factors it ranges from 9–22% in stage II and 17–44% in stage III.[184] The average five-year recurrence rate in people with rectal cancer where surgery is successful is 9% for stage 0 (after pre-treatment) cancers, 8% for stage I cancers, 18% in stage II and 34% in stage III. Depending on the number of risk factors (0-2) the risk for distant metastasis in rectal cancer ranges from 4-11% in stage 0, 6-12% in stage I, 11-28% in stage II and 15-43% in stage III.[185]
The recurrence rates have decreased over the past decades as a result of improvements in the colorectal cancer management.[186] The risk of recurrence after five years of surveillance remain very low.[187]
Survival rates
[edit]In Europe the five-year survival rate for colorectal cancer is less than 60%. In the developed world about a third of people who get the disease die from it.[20]
Survival is directly related to detection and the type of cancer involved, but overall is poor for symptomatic cancers, as they are typically quite advanced. Survival rates for early stage detection are about five times that of late stage cancers. People with a tumor that has not breached the muscularis mucosa (TNM stage Tis, N0, M0) have a five-year survival rate of 100%, while those with invasive cancer of T1 (within the submucosal layer) or T2 (within the muscular layer) have an average five-year survival rate of approximately 90%. Those with a more invasive tumor yet without node involvement (T3-4, N0, M0) have an average five-year survival rate of approximately 70%. People with positive regional lymph nodes (any T, N1-3, M0) have an average five-year survival rate of approximately 40%, while those with distant metastases (any T, any N, M1) have a poor prognosis and the five year survival ranges from <5 percent to 31 percent.[188][189][190][191][192]
Five-year overall survival (OS) in rectal cancer after modern preoperative treatment and surgery was 90% for stage 0, 86% for stage I, 78% for stage II, and 67% for stage III according to a nationwide, population-based study.[185]
Whilst the impact of colorectal cancer on those who survive varies greatly there will often be a need to adapt to both physical and psychological outcomes of the illness and its treatment.[193] For example, it is common for people to experience incontinence,[194] sexual dysfunction,[195] problems with stoma care[196] and fear of cancer recurrence[197] after primary treatment has concluded.
A qualitative systematic review published in 2021 highlighted that there are three main factors influencing adaptation to living with and beyond colorectal cancer: support mechanisms, severity of late effects of treatment and psychosocial adjustment. Therefore, it is essential that people are offered appropriate support to help them better adapt to life following treatment.[198]
Epidemiology
[edit]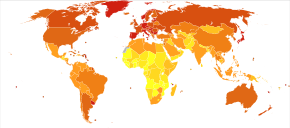
Globally more than 1 million people get colorectal cancer every year[20] resulting in about 715,000 deaths as of 2010 up from 490,000 in 1990.[199]
As of 2012[update], it is the second most common cause of cancer in women (9.2% of diagnoses) and the third most common in men (10.0%)[14]: 16 with it being the fourth most common cause of cancer death after lung, stomach, and liver cancer.[200] It is more common in developed than developing countries.[201] Global incidence varies 10-fold, with highest rates in Australia, New Zealand, Europe and the US and lowest rates in Africa and South-Central Asia.[202]
United States
[edit]Ожидается, что в 2022 году заболеваемость колоректальным раком в США составит около 151 000 взрослых, включая более 106 000 новых случаев рака толстой кишки (около 54 000 мужчин и 52 000 женщин) и около 45 000 новых случаев рака прямой кишки. [203] Since the 1980s, the incidence of colorectal cancer decreased, dropping by about 2% annually from 2014 to 2018 in adults aged 50 and older, due mainly to improved screening.[203] However, incidence of colorectal cancer has increased in individuals aged 25 to 50. In early 2023, the American Cancer Society (ACS) reported that 20% of diagnoses (of colon cancer) in 2019 were in patients under age 55, which is about double the rate in 1995, and rates of advanced disease increased by about 3% annually in people younger than 50. It predicted that, in 2023, an estimated 19,550 diagnoses and 3,750 deaths would be in people younger than 50.[204] Колоректальный рак также непропорционально поражает чернокожее сообщество, где уровень заболеваемости является самым высоким среди всех расовых/этнических групп в США. Афроамериканцы примерно на 20% чаще заболевают колоректальным раком и примерно на 40% чаще умирают от него, чем представители большинства других групп. Чернокожие американцы часто сталкиваются с более серьезными препятствиями на пути профилактики, выявления, лечения и выживания рака, включая системные расовые различия, которые являются сложными и выходят за рамки очевидной связи с раком.
Великобритания
[ редактировать ]В Великобритании около 41 000 человек в год заболевают раком толстой кишки, что делает его четвертым наиболее распространенным типом. [205]
Австралия
[ редактировать ]У одного из 19 мужчин и одной из 28 женщин в Австралии колоректальный рак заболеет в возрасте до 75 лет; к 85 годам он разовьется у одного из 10 мужчин и одной из 15 женщин. [206]
Папуа-Новая Гвинея
[ редактировать ]В развивающихся странах, таких как Папуа-Новая Гвинея и других островных государствах Тихого океана, включая Соломоновы Острова, колоректальный рак является очень редким раком среди населения, который встречается реже всего по сравнению с раком легких, желудка, печени или молочной железы. По оценкам, по крайней мере, у 8 из 100 000 людей ежегодно чаще всего развивается колоректальный рак, в отличие от рака легких или молочной железы, где только последний рак встречается у 24 из 100 000 женщин. [207]
Колоректальный рак с ранним началом (EOCC)
[ редактировать ]Диагноз колоректального рака у пациентов в возрасте до 50 лет называется колоректальным раком с ранним началом (EOCC). [176] [208] За последнее десятилетие число случаев EOCC увеличилось, особенно среди пациентов в возрасте от 20 до 40 лет в Северной Америке, Европе, Австралии и Китае. [208] [209]
Заболеваемость по возрасту
[ редактировать ]Заболеваемость колоректальным раком среди более молодого населения увеличилась за последнее десятилетие. [176] [208] [209] Хотя достижения в диагностических процедурах могут иметь определенное влияние, снижение вероятности скрининга среди этих групп населения позволяет предположить, что систематическая ошибка выявления не является основным фактором, способствующим этой тенденции. Более вероятно, что этому способствуют когортные эффекты. [209]
Наибольший рост случаев EOCC составляют мужчины и женщины в возрасте от 20 до 29 лет, при этом заболеваемость увеличивалась на 7,9% в год в период с 2004 по 2016 год. [209] Аналогичным образом, хотя и менее серьезно, у мужчин и женщин в возрасте от 30 до 39 лет наблюдался рост случаев заболевания на 3,4% в год в течение того же периода времени. Несмотря на это увеличение, уровень смертности от колоректального рака остался прежним. [209]
Факторы риска
[ редактировать ]Факторы риска, связанные с EOCC, аналогичны факторам риска всех случаев колоректального рака. [208] Наблюдаемые когортные эффекты, вероятно, являются результатом смены поколений в образе жизни и факторах окружающей среды. [176] [208]
Профилактический осмотр
[ редактировать ]В 2018 году Американское онкологическое общество изменило свои предыдущие рекомендации по скринингу колоректального рака с 50 до 45 лет после признания увеличения случаев EOCC. [209] Лица в возрасте до 60 лет были признаны наиболее подверженными неучастию в скрининге колоректального рака. [210]
История
[ редактировать ]Этот раздел нуждается в расширении . Вы можете помочь, добавив к нему . ( январь 2024 г. ) |
Рак прямой кишки был диагностирован у древнеегипетской мумии , которая жила в оазисе Дахле в период Птолемеев . [211]
Общество и культура
[ редактировать ]В США март — месяц осведомленности о колоректальном раке . [118]
Исследовать
[ редактировать ]Этот раздел необходимо обновить . Причина: все источники старше 5 лет. ( январь 2024 г. ) |
Предварительные in vitro данные позволяют предположить, что молочнокислые бактерии (например, лактобактерии , стрептококки или лактококки ) могут защищать от развития и прогрессирования колоректального рака посредством нескольких механизмов, таких как антиоксидантная активность, иммуномодуляция , содействие запрограммированной гибели клеток , антипролиферативный эффект и эпигенетическая модификация. раковых клеток. [212]
- Атлас генома рака [53]
- Был разработан Атлас колоректального рака, объединяющий геномные и протеомные данные, относящиеся к тканям и клеточным линиям колоректального рака. [213]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д «Общая информация о раке толстой кишки» . НЦИ . 12 мая 2014 года. Архивировано из оригинала 4 июля 2014 года . Проверено 29 июня 2014 г.
- ^ Перейти обратно: а б с д и ж г час я дж к л Босман FT (2014). «Глава 5.5: Колоректальный рак» . В Стюарте Б.В., Wild CP (ред.). Всемирный доклад о раке . Международное агентство по исследованию рака, Всемирная организация здравоохранения. стр. 392–402. ISBN 978-92-832-0443-5 .
- ^ Перейти обратно: а б с «Профилактика колоректального рака (PDQ®)» . Национальный институт рака . 27 февраля 2014. Архивировано из оригинала 5 июля 2014 года . Проверено 29 июня 2014 г.
- ^ Перейти обратно: а б Теодорату Э, Тимофеева М, Ли Х, Мэн Х, Иоаннидис Дж. П. (август 2017 г.). «Природа, воспитание и риски рака: генетический и пищевой вклад в развитие рака» . Ежегодный обзор питания (обзор). 37 : 293–320. doi : 10.1146/annurev-nutr-071715-051004 . ПМК 6143166 . ПМИД 28826375 .
- ^ Перейти обратно: а б с д и ж г «Лечение рака толстой кишки (PDQ®)» . НЦИ . 12 мая 2014. Архивировано из оригинала 5 июля 2014 года . Проверено 29 июня 2014 г.
- ^ Перейти обратно: а б «Информационные бюллетени SEER: рак толстой и прямой кишки» . НЦИ . Архивировано из оригинала 24 июня 2014 года . Проверено 18 июня 2014 г.
- ^ Вос Т., Барбер Р.М., Белл Б., Бертоцци-Вилла А., Бирюков С., Боллигер И. и др. (Сотрудники ГББ, 2015 г. по заболеваемости и распространенности заболеваний и травм) (октябрь 2016 г.). «Глобальная, региональная и национальная заболеваемость, распространенность и продолжительность жизни с инвалидностью по 310 заболеваниям и травмам, 1990–2015 гг.: систематический анализ для исследования глобального бремени болезней, 2015 г.» . Ланцет . 388 (10053): 1545–1602. дои : 10.1016/S0140-6736(16)31678-6 . ПМК 5055577 . ПМИД 27733282 .
- ^ Перейти обратно: а б Брэй Ф., Ферлей Дж., Сурджоматарам И., Сигел Р.Л., Торре Л.А., Джемал А. (ноябрь 2018 г.). «Глобальная статистика рака за 2018 год: оценки GLOBOCAN заболеваемости и смертности во всем мире от 36 видов рака в 185 странах» . CA: Журнал рака для врачей . 68 (6): 394–424. дои : 10.3322/caac.21492 . ПМИД 30207593 . S2CID 52188256 .
- ^ «Признаки и симптомы колоректального рака | Признаки колоректального рака» . www.cancer.org . Проверено 8 февраля 2023 г.
- ^ Перейти обратно: а б с д и ж г Биббинс-Доминго К., Гроссман Д.С., Карри С.Дж., Дэвидсон К.В., Эплинг Дж.В., Гарсиа Ф.А. и др. (июнь 2016 г.). «Скрининг колоректального рака: Рекомендации Целевой группы профилактической службы США» . ДЖАМА . 315 (23): 2564–2575. дои : 10.1001/jama.2016.5989 . ПМИД 27304597 .
- ^ «Первая колоноскопия теперь рекомендуется в возрасте 45 лет» . ТедаКэр . Проверено 30 декабря 2022 г.
- ^ Торат М.А., Кузик Дж. (декабрь 2013 г.). «Роль аспирина в профилактике рака» . Текущие отчеты по онкологии . 15 (6): 533–540. дои : 10.1007/s11912-013-0351-3 . ПМИД 24114189 . S2CID 40187047 .
- ^ «Рутинный прием аспирина или нестероидных противовоспалительных препаратов для первичной профилактики колоректального рака: рекомендации» . Американский семейный врач . 76 (1): 109–113. Июль 2007 г. PMID 17668849 . Архивировано из оригинала 14 июля 2014 года.
- ^ Перейти обратно: а б Форман Д., Ферлей Дж. (2014). «Глава 1.1: Глобальное и региональное бремя рака» . В Стюарте Б.В., Wild CP (ред.). Всемирный доклад о раке . Международное агентство по исследованию рака, Всемирная организация здравоохранения. стр. 16–53. ISBN 978-92-832-0443-5 .
- ^ Альперс Д.Х., Каллоо А.Н., Капловиц Н., Оуян С., Пауэлл Д.В. (2008). Ямада Т. (ред.). Основы клинической гастроэнтерологии . Чичестер, Западный Суссекс: Уайли-Блэквелл. п. 381. ИСБН 978-1-4051-6910-3 . Архивировано из оригинала 28 сентября 2015 года.
- ^ Юул Дж.С., Хорнунг Н., Андерсен Б., Лаурберг С., Олесен Ф., Ведстед П. (август 2018 г.). «Ценность использования фекального иммунохимического теста в общей практике у пациентов с не тревожными симптомами колоректального рака» . Британский журнал рака . 119 (4): 471–479. дои : 10.1038/s41416-018-0178-7 . ПМК 6133998 . ПМИД 30065255 .
- ^ Перейти обратно: а б Эстин М., Гриффин Т., Нил Р.Д., Роуз П., Гамильтон В. (май 2011 г.). «Диагностическая ценность симптомов колоректального рака в первичной медико-санитарной помощи: систематический обзор» . Британский журнал общей практики . 61 (586): с231–е243. дои : 10.3399/bjgp11X572427 . ПМК 3080228 . ПМИД 21619747 .
- ^ Адельштейн Б.А., Макаскилл П., Чан С.Ф., Кателарис П.Х., Ирвиг Л. (май 2011 г.). «Большинство симптомов рака кишечника не указывают на колоректальный рак и полипы: систематический обзор» . БМК Гастроэнтерология . 11:65 . дои : 10.1186/1471-230X-11-65 . ПМК 3120795 . ПМИД 21624112 .
- ^ Перейти обратно: а б Уотсон Эй Джей, Коллинз П. Д. (2011). «Рак толстой кишки: цивилизационное расстройство» . Пищеварительные заболевания . 29 (2): 222–228. дои : 10.1159/000323926 . ПМИД 21734388 . S2CID 7640363 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т Каннингем Д., Аткин В., Ленц Х.Дж., Линч Х.Т., Мински Б., Нордлингер Б. и др. (март 2010 г.). «Колоректальный рак». Ланцет . 375 (9719): 1030–1047. дои : 10.1016/S0140-6736(10)60353-4 . ПМИД 20304247 . S2CID 25299272 .
- ^ Перейти обратно: а б «Отчет о колоректальном раке за 2011 год: пища, питание, физическая активность и профилактика колоректального рака» (PDF) . Всемирный фонд исследования рака и Американский институт исследований рака. 2011. Архивировано (PDF) из оригинала 9 сентября 2016 года.
- ^ Вьяс Д.А., Эйзенштейн Л.Г., Джонс Д.С. (27 августа 2020 г.). Малина Д. (ред.). «Скрыто на виду — пересмотр использования расовой коррекции в клинических алгоритмах» . Медицинский журнал Новой Англии . 383 (9): 874–882. дои : 10.1056/NEJMms2004740 . ISSN 0028-4793 . ПМИД 32853499 . S2CID 221359557 .
- ^ Боулз Т.Л., Ху С.И., Ю Нью-Йорк, Скиббер Дж.М., Родригес-Бигас М.А., Чанг Г.Дж. (май 2013 г.). «Индивидуальный калькулятор условной выживаемости для пациентов с раком прямой кишки» . Заболевания толстой и прямой кишки . 56 (5): 551–559. дои : 10.1097/DCR.0b013e31827bd287 . ISSN 0012-3706 . ПМЦ 3673550 . ПМИД 23575393 .
- ^ Ли И.М., Широма Э.Дж., Лобело Ф., Пушка П., Блэр С.Н., Кацмарзик П.Т. (июль 2012 г.). «Влияние отсутствия физической активности на основные неинфекционные заболевания во всем мире: анализ бремени болезней и ожидаемой продолжительности жизни» . Ланцет . 380 (9838): 219–229. дои : 10.1016/S0140-6736(12)61031-9 . ПМЦ 3645500 . ПМИД 22818936 .
- ^ Федирко В., Трамасере И., Багнарди В., Рота М., Скотти Л., Ислами Ф. и др. (сентябрь 2011 г.). «Употребление алкоголя и риск колоректального рака: общий метаанализ опубликованных исследований и реакция на дозу» . Анналы онкологии . 22 (9): 1958–1972. дои : 10.1093/annonc/mdq653 . ПМИД 21307158 .
- ^ Валтин Х. (ноябрь 2002 г.). « Пейте не менее восьми стаканов воды в день». Правда? Есть ли научные доказательства «8 х 8»?». Американский журнал физиологии. Регуляторная, интегративная и сравнительная физиология . 283 (5): Р993–1004. дои : 10.1152/ajpregu.00365.2002 . ПМИД 12376390 . S2CID 2256436 .
- ^ Болей А., ван Гелдер М.М., Свинкелс Д.В., Тьялсма Х. (ноябрь 2011 г.). «Клиническое значение инфекции Streptococcus Gallolyticus среди больных колоректальным раком: систематический обзор и метаанализ» . Клинические инфекционные болезни . 53 (9): 870–878. дои : 10.1093/cid/cir609 . ПМИД 21960713 .
- ^ Янс С., Мейле Л., Лакруа С., Стивенс М.Дж. (июль 2015 г.). «Геномика, эволюция и молекулярная эпидемиология комплекса Streptococcus bovis/Streptococcus equinus (SBSEC)». Инфекция, генетика и эволюция . 33 : 419–436. Бибкод : 2015InfGE..33..419J . дои : 10.1016/j.meegid.2014.09.017 . ПМИД 25233845 .
- ^ Перейти обратно: а б с Абдуламир А.С., Хафид Р.Р., Абу Бакар Ф. (январь 2011 г.). «Ассоциация Streptococcus bovis/gallolyticus с колоректальными опухолями: природа и механизмы ее этиологической роли» . Журнал экспериментальных и клинических исследований рака . 30 (1): 11. дои : 10.1186/1756-9966-30-11 . ПМК 3032743 . ПМИД 21247505 .
 В эту статью включен текст Ахмеда С. Абдуламира, Ранда Р. Хафида и Фатимы Абу Бакар, доступный по лицензии CC BY 2.0 .
В эту статью включен текст Ахмеда С. Абдуламира, Ранда Р. Хафида и Фатимы Абу Бакар, доступный по лицензии CC BY 2.0 . - ^ Артур Джей Си (июнь 2020 г.). «Микробиота и колоректальный рак: колибактин оставляет свой след». Обзоры природы. Гастроэнтерология и гепатология . 17 (6): 317–318. дои : 10.1038/s41575-020-0303-y . ПМИД 32317778 . S2CID 216033220 .
- ^ Джавад Н., Дирекзе Н., Лидхэм С.Дж. (2011). «Воспалительные заболевания кишечника и рак толстой кишки». Воспаление и рак желудочно-кишечного тракта . Последние результаты исследований рака. Том. 185. стр. 99–115. дои : 10.1007/978-3-642-03503-6_6 . ISBN 978-3-642-03502-9 . ПМИД 21822822 .
- ^ Ху Т, Ли ЛФ, Шен Дж, Чжан Л, Чо Ч (2015). «Хроническое воспаление и колоректальный рак: роль фактора роста эндотелия сосудов». Текущий фармацевтический дизайн . 21 (21): 2960–2967. дои : 10.2174/1381612821666150514104244 . ПМИД 26004415 .
- ^ Перейти обратно: а б с д Триантафиллидис Дж.К., Насиулас Г., Космидис П.А. (июль 2009 г.). «Колоректальный рак и воспалительные заболевания кишечника: эпидемиология, факторы риска, механизмы канцерогенеза и стратегии профилактики». Противораковые исследования . 29 (7): 2727–2737. ПМИД 19596953 .
- ^ Перейти обратно: а б Пока, В.А., Нгуен Т.М., Паркер С.Э., Джайрат В., Ист Дж.Э. (сентябрь 2017 г.). «Стратегии выявления рака толстой кишки у пациентов с воспалительными заболеваниями кишечника» . Кокрановская база данных систематических обзоров . 2017 (9): CD000279. дои : 10.1002/14651858.cd000279.pub4 . ПМК 6483622 . ПМИД 28922695 .
- ^ Джун Э, Хачемун А (2010). «Синдром Гарднера: кожные проявления, дифференциальный диагноз и лечение». Американский журнал клинической дерматологии . 11 (2): 117–122. дои : 10.2165/11311180-000000000-00000 . ПМИД 20141232 . S2CID 36836169 .
- ^ Хаф Э, Беркович Д, Розен П (октябрь 2009 г.). «Семейный аденоматозный полипоз» . Сиротский журнал редких заболеваний . 4:22 . дои : 10.1186/1750-1172-4-22 . ПМЦ 2772987 . ПМИД 19822006 .
- ^ Мёслейн Г., Писториус С., Сагер Х.Д., Шакерт Х.К. (март 2003 г.). «Профилактическая хирургия рака толстой кишки при семейном аденоматозном полипозе и синдроме наследственного неполипозного колоректального рака». Архив хирургии Лангенбека . 388 (1): 9–16. дои : 10.1007/s00423-003-0364-8 . ПМИД 12690475 . S2CID 21385340 .
- ^ Манкени Дж., Руфаэль С., Берк, Калифорния (апрель 2020 г.). «Синдром зубчатого полипоза» . Клиническая гастроэнтерология и гепатология . 18 (4): 777–779. дои : 10.1016/j.cgh.2019.09.006 . ПМИД 31520728 .
- ^ Фан С., Юнис А., Букхаут CE, Крокетт С.Д. (март 2018 г.). «Лечение зубчатых полипов толстой кишки» . Современные варианты лечения в гастроэнтерологии . 16 (1): 182–202. дои : 10.1007/s11938-018-0176-0 . ПМК 6284520 . ПМИД 29445907 .
- ^ Бурдэ Р., Руссо Б., Пухальс А., Буссион Х., Жоли С., Гиймен А. и др. (май 2017 г.). «Мутации домена корректировки полимеразы: новые возможности иммунотерапии при гипермутированном колоректальном раке, помимо дефицита MMR». Критические обзоры по онкологии/гематологии . 113 : 242–248. дои : 10.1016/j.critrevonc.2017.03.027 . ПМИД 28427513 .
- ^ Штейн У., Вальтер В., Арльт Ф., Швабе Х., Смит Дж., Фихтнер И. и др. (январь 2009 г.). «MACC1, недавно идентифицированный ключевой регулятор передачи сигналов HGF-MET, предсказывает метастазы рака толстой кишки». Природная медицина . 15 (1): 59–67. дои : 10.1038/нм.1889 . ПМИД 19098908 . S2CID 8854895 .
- ^ Stein U (2013) MACC1 – новая мишень для солидного рака. Мнения экспертов
- ^ Шубель К.Е., Чен В., Коуп Л., Глёкнер С.С., Сузуки Х., Йи Дж.М. и др. (сентябрь 2007 г.). «Сравнение гиперметилома ДНК с генными мутациями при колоректальном раке человека» . ПЛОС Генетика . 3 (9): 1709–1723. дои : 10.1371/journal.pgen.0030157 . ЧВК 1988850 . ПМИД 17892325 .
- ^ «Какова связь между евреями-ашкенази и колоректальным раком?» . ВебМД . Проверено 17 октября 2019 г.
- ^ Перейти обратно: а б с Табибзаде А., Тамешкель Ф.С., Моради Й., Солтани С., Моради-Лаке М., Ашрафи Г.Х. и др. (30 октября 2020 г.). «Мутации пути сигнальной трансдукции при раке желудочно-кишечного тракта (ЖКТ): систематический обзор и метаанализ» . Научные отчеты . 10 (1): 18713. Бибкод : 2020NatSR..1018713T . дои : 10.1038/s41598-020-73770-1 . ISSN 2045-2322 . ПМЦ 7599243 . ПМИД 33127962 .
- ^ Ионов Ю., Пейнадо М.А., Малхосян С., Шибата Д., Перучо М. (июнь 1993 г.). «Повсеместные соматические мутации в простых повторяющихся последовательностях открывают новый механизм канцерогенеза толстой кишки». Природа . 363 (6429): 558–561. Бибкод : 1993Natur.363..558I . дои : 10.1038/363558a0 . ПМИД 8505985 . S2CID 4254940 .
- ^ Чакраварти С., Кришнан Б., Мадхаван М. (1999). «Апоптоз и экспрессия р53 при колоректальных новообразованиях». Индийский Дж. Мед. Рез . 86 (7): 95–102.
- ^ Абдул Халек Ф.Дж., Галликано Дж.И., Мишра Л. (ноябрь 2010 г.). «Стволовые клетки рака толстой кишки» . Исследования рака желудочно-кишечного тракта (Приложение 1): S16–S23. ПМК 3047031 . ПМИД 21472043 .
- ^ Перейти обратно: а б с д Марковиц С.Д., Бертаньолли М.М. (декабрь 2009 г.). «Молекулярное происхождение рака: Молекулярная основа колоректального рака» . Медицинский журнал Новой Англии . 361 (25): 2449–2460. дои : 10.1056/NEJMra0804588 . ПМЦ 2843693 . ПМИД 20018966 .
- ^ Мелен П., Фирон Э.Р. (август 2004 г.). «Роль рецептора зависимости DCC в патогенезе колоректального рака». Журнал клинической онкологии . 22 (16): 3420–3428. дои : 10.1200/JCO.2004.02.019 . ПМИД 15310786 .
- ^ Перейти обратно: а б с Улен М., Чжан С., Ли С., Сьёстедт Е., Фагерберг Л., Бидхори Г. и др. (август 2017 г.). «Атлас патологии транскриптома рака человека» . Наука . 357 (6352): eaan2507. дои : 10.1126/science.aan2507 . ПМИД 28818916 .
- ^ Фогельштейн Б., Кинцлер К.В. (август 2004 г.). «Гены рака и пути, которыми они управляют». Природная медицина . 10 (8): 789–799. дои : 10.1038/nm1087 . PMID 15286780 . S2CID 205383514 .
- ^ Перейти обратно: а б с Музни Д.М., Бейнбридж М.Н., Чанг К., Динь Х.Х., Драммонд Дж.А., Фаулер Г. и др. (Сеть атласов генома рака) (июль 2012 г.). «Комплексная молекулярная характеристика рака толстой и прямой кишки человека» . Природа . 487 (7407): 330–337. Бибкод : 2012Natur.487..330T . дои : 10.1038/nature11252 . ПМК 3401966 . ПМИД 22810696 .
- ^ Гаталика З., Вранич С., Сю Дж., Свенсен Дж., Редди С. (июль 2016 г.). «Колоректальный рак с высокой микросателлитной нестабильностью (MSI-H): краткий обзор прогностических биомаркеров в эпоху персонализированной медицины» . Семейный рак . 15 (3): 405–412. дои : 10.1007/s10689-016-9884-6 . ПМЦ 4901118 . ПМИД 26875156 .
- ^ Перейти обратно: а б с Райан Э., Шихан К., Кревин Б., Мохан Х.М., Винтер, округ Колумбия (август 2017 г.). «Текущая ценность определения статуса репарации несоответствия при колоректальном раке: обоснование рутинного тестирования». Критические обзоры по онкологии/гематологии . 116 : 38–57. doi : 10.1016/j.critrevonc.2017.05.006 . ПМИД 28693799 .
- ^ Хиссонг Э., Кроу Э.П., Янтисс Р.К., Чен Ю.Т. (ноябрь 2018 г.). «Оценка статуса восстановления несоответствия колоректального рака в современную эпоху: обзор текущей практики и переоценка роли тестирования микросателлитной нестабильности» . Современная патология . 31 (11): 1756–1766. дои : 10.1038/s41379-018-0094-7 . ПМИД 29955148 .
- ^ Перейти обратно: а б с Грейди В.М., Марковиц С.Д. (март 2015 г.). «Молекулярный патогенез колоректального рака и его потенциальное применение для скрининга колоректального рака» . Пищеварительные заболевания и науки . 60 (3): 762–772. дои : 10.1007/s10620-014-3444-4 . ПМЦ 4779895 . ПМИД 25492499 .
- ^ Лесли А., Кэри Ф.А., Пратт Н.Р., Стил Р.Дж. (июль 2002 г.). «Последовательность колоректальной аденомы-карциномы» . Британский журнал хирургии . 89 (7): 845–860. дои : 10.1046/j.1365-2168.2002.02120.x . ISSN 0007-1323 . ПМИД 12081733 . S2CID 36456541 .
- ^ Нгуен Л.Х., Гоэль А., Чунг, округ Колумбия (январь 2020 г.). «Пути колоректального канцерогенеза» . Гастроэнтерология . 158 (2): 291–302. дои : 10.1053/j.gastro.2019.08.059 . ISSN 0016-5085 . ПМК 6981255 . ПМИД 31622622 .
- ^ Слотер ДП, Саутвик HW, Смейкал В (сентябрь 1953 г.). «Полевая канцеризация многослойного плоского эпителия полости рта; клинические последствия мультицентрического происхождения» . Рак . 6 (5): 963–968. doi : 10.1002/1097-0142(195309)6:5<963::AID-CNCR2820060515>3.0.CO;2-Q . ПМИД 13094644 . S2CID 6736946 .
- ^ Джованнуччи Э., Огино С. (сентябрь 2005 г.). «Метилирование ДНК, полевые эффекты и колоректальный рак» . Журнал Национального института рака . 97 (18): 1317–1319. дои : 10.1093/jnci/dji305 . ПМИД 16174847 .
- ^ Бернштейн С., Бернштейн Х., Пейн С.М., Дворжак К., Гаревал Х. (февраль 2008 г.). «Полевые дефекты при прогрессировании рака желудочно-кишечного тракта» . Письма о раке . 260 (1–2): 1–10. дои : 10.1016/j.canlet.2007.11.027 . ПМЦ 2744582 . ПМИД 18164807 .
- ^ Нгуен Х., Лустаунау С., Фациста А., Рэмси Л., Хассуна Н., Тейлор Х. и др. (июль 2010 г.). «Дефицит Pms2, ERCC1, Ku86, CcOI в дефектах поля во время прогрессирования рака толстой кишки» . Журнал визуализированных экспериментов (41): 1931. doi : 10.3791/1931 . ПМК 3149991 . ПМИД 20689513 . 28-минутное видео
- ^ Рубин Х (март 2011 г.). «Поля и канцеризация полей: предопухолевые источники рака: бессимптомные гиперпластические поля являются предшественниками неоплазии, и их прогрессирование в опухоли можно отследить по плотности насыщения в культуре». Биоэссе . 33 (3): 224–231. doi : 10.1002/bies.201000067 . ПМИД 21254148 . S2CID 44981539 .
- ^ Цао Дж.Л., Ятабе Ю., Саловаара Р., Ярвинен Х.Дж., Меклин Дж.П., Аалтонен Л.А. и др. (февраль 2000 г.). «Генетическая реконструкция историй отдельных колоректальных опухолей» . Труды Национальной академии наук Соединенных Штатов Америки . 97 (3): 1236–1241. Бибкод : 2000PNAS...97.1236T . дои : 10.1073/pnas.97.3.1236 . ПМК 15581 . ПМИД 10655514 .
- ^ Перейти обратно: а б Фогельштейн Б., Пападопулос Н., Велкулеску В.Е., Чжоу С., Диас Л.А., Кинцлер К.В. (март 2013 г.). «Пейзажи генома рака» . Наука . 339 (6127): 1546–1558. Бибкод : 2013Sci...339.1546V . дои : 10.1126/science.1235122 . ПМК 3749880 . ПМИД 23539594 .
- ^ Перейти обратно: а б Бернштейн С., Нфонсам В., Прасад А.Р., Бернштейн Х. (март 2013 г.). «Дефекты эпигенетического поля при прогрессировании рака» . Всемирный журнал желудочно-кишечной онкологии . 5 (3): 43–49. дои : 10.4251/wjgo.v5.i3.43 . ПМЦ 3648662 . ПМИД 23671730 .
- ^ Локхед П., Чан А.Т., Нишихара Р., Фукс К.С., Бек А.Х., Джованнуччи Е. и др. (январь 2015 г.). «Этиологический полевой эффект: переоценка концепции полевого эффекта в предрасположенности и прогрессировании рака» . Современная патология . 28 (1): 14–29. дои : 10.1038/modpathol.2014.81 . ПМК 4265316 . ПМИД 24925058 .
- ^ Уилбур Б., изд. (2009). Мир клетки (7-е изд.). Сан-Франциско, К.
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Страницы биологии Кимбалла. Архивировано 31 декабря 2017 года в Wayback Machine "Онкогены". Полный текст бесплатно.
- ^ Канвал Р., Гупта С. (апрель 2012 г.). «Эпигенетические модификации рака» . Клиническая генетика . 81 (4): 303–311. дои : 10.1111/j.1399-0004.2011.01809.x . ПМК 3590802 . ПМИД 22082348 .
- ^ Перейти обратно: а б Шнекенбургер М., Дидерих М. (март 2012 г.). «Эпигенетика открывает новые горизонты в профилактике колоректального рака» . Текущие отчеты о колоректальном раке . 8 (1): 66–81. дои : 10.1007/s11888-011-0116-z . ПМК 3277709 . ПМИД 22389639 .
- ^ Перейти обратно: а б с д Лао В.В., Грейди В.М. (октябрь 2011 г.). «Эпигенетика и колоректальный рак» . Обзоры природы. Гастроэнтерология и гепатология . 8 (12): 686–700. дои : 10.1038/nrgastro.2011.173 . ПМЦ 3391545 . ПМИД 22009203 .
- ^ Клутштейн М., Нейман Д., Гринфилд Р., Сидар Х. (июнь 2016 г.). «Метилирование ДНК при раке и старении» . Исследования рака . 76 (12): 3446–3450. дои : 10.1158/0008-5472.CAN-15-3278 . ПМИД 27256564 .
- ^ Хасинто Ф.В., Эстеллер М. (июль 2007 г.). «Мутаторные пути, вызванные эпигенетическим молчанием при раке человека» . Мутагенез . 22 (4): 247–253. дои : 10.1093/mutage/gem009 . ПМИД 17412712 .
- ^ Латц К., Пфайфер GP (февраль 2011 г.). «Эпигенетические изменения генов репарации ДНК при раке» . Журнал молекулярно-клеточной биологии . 3 (1): 51–58. дои : 10.1093/jmcb/mjq053 . ПМК 3030973 . ПМИД 21278452 .
- ^ «Колоректальный рак» . Библиотека медицинских концепций Lecturio . Проверено 22 июля 2021 г.
- ^ Коппеде Ф, Лопомо А, Списни Р, Мильоре Л (январь 2014 г.). «Генетические и эпигенетические биомаркеры для диагностики, прогноза и лечения колоректального рака» . Всемирный журнал гастроэнтерологии . 20 (4): 943–956. дои : 10.3748/wjg.v20.i4.943 . ПМЦ 3921546 . ПМИД 24574767 .
- ^ Гинни Дж., Динстманн Р., Ван Х., де Рейньес А., Шликер А., Сонесон С. и др. (ноябрь 2015 г.). «Консенсусные молекулярные подтипы колоректального рака» . Природная медицина . 21 (11): 1350–1356. дои : 10.1038/нм.3967 . ПМЦ 4636487 . ПМИД 26457759 .
- ^ Оруджи Э., Раман А.Т., Сингх А.К., Сорокин А., Арслан Э., Гош А.К. и др. (май 2021 г.). «Динамика состояния хроматина определяет конкретные терапевтические стратегии при энхансерных подтипах колоректального рака» . Гут . 71 (5): 938–949. doi : 10.1136/gutjnl-2020-322835 . ПМЦ 8745382 . ПМИД 34059508 . S2CID 235269540 .
- ^ Перейти обратно: а б «Колоректальный рак» . Библиотека медицинских концепций Lecturio . Проверено 10 июля 2021 г.
- ^ Авиви М.О., Каур Х., Эрнст Р., Раух Г.М., Морани А.С., Станицкий Н. и др. (2023). «Восстановление МРТ аденокарциномы прямой кишки после неоадъювантной химиолучевой терапии: результаты визуализации и потенциальные опасности». Рентгенография . 43 (4): e220135. дои : 10.1148/rg.220135 . ПМИД 36927125 . S2CID 257583845 .
- ^ Авиви М.О., Каур Х., Эрнст Р., Раух Г.М., Морани А.С., Станицкий Н. и др. (апрель 2023 г.). «Восстановление МРТ аденокарциномы прямой кишки после неоадъювантной химиолучевой терапии: результаты визуализации и потенциальные опасности». Рентгенография . 43 (4): e220135. дои : 10.1148/rg.220135 . ПМИД 36927125 . S2CID 257583845 .
- ^ Канг Х, О'Коннелл Дж.Б., Леонарди М.Дж., Маггард М.А., МакГори М.Л., Ко С.И. (февраль 2007 г.). «Редкие опухоли толстой и прямой кишки: национальный обзор». Международный журнал колоректальных заболеваний . 22 (2): 183–189. дои : 10.1007/s00384-006-0145-2 . ПМИД 16845516 . S2CID 34693873 .
- ^ «Эквивалентные термины и определения для толстой, ректосигмовидной и прямой кишки C180-C189, C199, C209 (исключая лимфому и лейкоз M9590 – M9992 и саркому Капоши M9140) – Правила для солидных опухолей толстой кишки 2018. Обновление за июль 2019 года» (PDF) . Национальный институт рака . Архивировано (PDF) из оригинала 16 января 2020 г.
- ^ «Виды колоректального рака» . Центры лечения рака Америки . 4 октября 2018 г. Проверено 16 января 2020 г.
- ^ Ди Комо Х.А., Махендрарадж К., Лау К.С., Чемберлен Р.С. (октябрь 2015 г.). «Аденосквамозная карцинома ободочной и прямой кишки: популяционное исследование клинических исходов с участием 578 пациентов из базы данных эпидемиологии и конечных результатов (SEER) (1973–2010)». Журнал Американского колледжа хирургов . 221 (4): 56. doi : 10.1016/j.jamcollsurg.2015.08.044 .
- ^ Уайтсайд Дж., Мунглани Р. (сентябрь 1998 г.). «TUNEL, Hoechst и тройная маркировка иммуногистохимии: улучшенный метод обнаружения апоптоза в срезах тканей - обновление». Исследования мозга. Протоколы исследования мозга . 3 (1): 52–53. дои : 10.1016/s1385-299x(98)00020-8 . ПМИД 9767106 .
- ^ «Стадирование колоректального рака по TNM (8-е издание AJCC)» . www.pathologyoutlines.com . Проверено 24 февраля 2019 г.
- ^ Паркин Д.М., Бойд Л., Уокер Л.С. (декабрь 2011 г.). «16. Доля рака, обусловленная образом жизни и факторами окружающей среды в Великобритании в 2010 году» . Британский журнал рака . 105 (С2): С77–С81. дои : 10.1038/bjc.2011.489 . ПМК 3252065 . ПМИД 22158327 .
- ^ Сирк Д. (2006). Эпидемиология и профилактика рака (3-е изд.). Издательство Оксфордского университета. п. 809. ИСБН 978-0-19-974797-9 . Архивировано из оригинала 28 сентября 2015 года.
- ^ Реннерт Г (2007). Профилактика рака . Спрингер. п. 179. ИСБН 978-3-540-37696-5 . Архивировано из оригинала 3 октября 2015 года.
- ^ Перейти обратно: а б «Обзор профилактики колоректального рака» . Национальный институт рака . 1 марта 2018 года . Проверено 26 октября 2018 г.
- ^ «Профилактика рака» . Всемирная организация здравоохранения . Проверено 27 октября 2018 г.
- ^ Чаплин А., Родригес Р.М., Сегура-Сампедро Х.Дж., Очогавиа-Сеги А., Ромагера Д., Барсело-Коблин Г. (октябрь 2022 г.). «Идея взаимосвязи между колоректальным раком и ожирением: является ли висцеральная жировая ткань недостающим звеном?» . Международный журнал молекулярных наук . 23 (21): 13128. doi : 10.3390/ijms232113128 . ПМЦ 9655590 . ПМИД 36361914 .
- ^ Лауби-Секретан Б, Скоччианти С, Лумис Д, Гросс Й, Бьянкини Ф, Страйф К (август 2016 г.). «Ожирение и рак – точка зрения рабочей группы IARC» . Медицинский журнал Новой Англии . 375 (8): 794–798. дои : 10.1056/nejmsr1606602 . ПМК 6754861 . ПМИД 27557308 .
- ^ «Колоректальный рак – факторы риска и профилактика» . 25 июня 2012 г.
- ^ Уиллетт У.К. (2014). «Диета, питание и рак: что дальше в области общественного здравоохранения?» . В Стюарте Б.В., Wild CP (ред.). Всемирный доклад о раке . Международное агентство по исследованию рака, Всемирная организация здравоохранения. стр. 432–435. ISBN 978-92-832-0443-5 .
- ^ Перейти обратно: а б Уиллетт У.К., Ки Т., Ромье I (2014). «Глава 2.6: Диета, ожирение и физическая активность» . В Стюарте Б.В., Wild CP (ред.). Всемирный доклад о раке . Международное агентство по исследованию рака, Всемирная организация здравоохранения. стр. 124–133. ISBN 978-92-832-0443-5 .
Несколько крупных проспективных когортных исследований пищевых волокон и риска развития рака толстой кишки не подтвердили наличие связи, хотя обратная связь наблюдалась в крупном исследовании Европейского проспективного исследования рака и питания (EPIC) и недавнем метаанализе. Необходимо лучше понять различия в результатах проспективных исследований; Пищевые волокна сложны и неоднородны, и связь с колоректальным раком может различаться в зависимости от источника питания. (стр. 127)
- ^ «Описание фактических данных по профилактике колоректального рака» . Национальный институт рака . 1 марта 2018 года . Проверено 26 октября 2018 г.
- ^ Туан Дж, Чен YX (18 декабря 2015 г.). «Факторы питания и образа жизни, связанные с риском колоректального рака, и взаимодействие с микробиотой: клетчатка, красное или обработанное мясо и алкогольные напитки» . Желудочно-кишечные опухоли . 3 (1). С. Каргер АГ: 17–24. дои : 10.1159/000442831 . ISSN 2296-3774 . ПМК 5040877 . ПМИД 27722153 .
- ^ Рейнольдс А., Манн Дж., Каммингс Дж., Винтер Н., Мете Э., Те Моренга Л. (февраль 2019 г.). «Качество углеводов и здоровье человека: серия систематических обзоров и метаанализов» . Ланцет . 393 (10170): 434–445. дои : 10.1016/S0140-6736(18)31809-9 . ПМИД 30638909 . S2CID 58632705 .
- ^ Сон М, Чан А.Т. (январь 2019 г.). «Факторы окружающей среды, кишечная микробиота и профилактика колоректального рака» . Клиническая гастроэнтерология и гепатология . 17 (2): 275–289. дои : 10.1016/j.cgh.2018.07.012 . ПМК 6314893 . ПМИД 30031175 .
Несмотря на давнюю гипотезу о том, что диета с высоким содержанием клетчатки может защитить от колоректального рака... эпидемиологические исследования, связывающие потребление пищевых волокон с последующим риском колоректального рака, дали противоречивые результаты... Тем не менее, основываясь на существующих данных, самый последний экспертный отчет от Всемирный фонд исследования рака и Американский институт исследований рака в 2017 году пришли к выводу, что существуют вероятные доказательства
- ^ Джаббари М., Пурморадян С., Эйни-Зинаб Х., Мошаркеш Э., Хоссейни Балам Ф., Ягмаи Ю. и др. (ноябрь 2022 г.). «Уровни доказательств связи между потреблением различных групп продуктов питания / предметов и риском возникновения различных локализаций рака: общий обзор». Международный журнал пищевых наук и питания . 73 (7): 861–874. дои : 10.1080/09637486.2022.2103523 . ПМИД 35920747 . S2CID 251280745 .
- ^ Перес-Куэто Ф.Д., Вербеке В. (апрель 2012 г.). «Потребительские последствия постоянных обновлений WCRF о колоректальном раке». Мясная наука . 90 (4): 977–978. дои : 10.1016/j.meatsci.2011.11.032 . ПМИД 22196090 .
- ^ Харрисс Дж., Аткинсон Дж., Баттерхэм А., Джордж К., Кейбл НТ, Рейли Т. и др. (сентябрь 2009 г.). «Факторы образа жизни и риск колоректального рака (2): систематический обзор и метаанализ связей с физической активностью в свободное время». Колоректальное заболевание . 11 (7): 689–701. дои : 10.1111/j.1463-1318.2009.01767.x . ПМИД 19207713 . S2CID 8026021 .
- ^ Робсам Т.Э., Агнес Б., Хьяртокер А., Лангсет Х., Брэй Ф.И., Ларсен И.К. (ноябрь 2013 г.). «Индекс массы тела, физическая активность и колоректальный рак по анатомическим участкам: систематический обзор и метаанализ когортных исследований». Европейский журнал профилактики рака . 22 (6): 492–505. дои : 10.1097/CEJ.0b013e328360f434 . ПМИД 23591454 . S2CID 24764995 .
- ^ Кю Х.Х., Бахман В.Ф., Александр Л.Т., Мамфорд Дж.Е., Афшин А., Эстеп К. и др. (август 2016 г.). «Физическая активность и риск развития рака молочной железы, рака толстой кишки, диабета, ишемической болезни сердца и ишемического инсульта: систематический обзор и метаанализ зависимости доза-эффект для исследования глобального бремени болезней 2013» . БМЖ . 354 : i3857. дои : 10.1136/bmj.i3857 . ПМЦ 4979358 . ПМИД 27510511 .
- ^ Бисвас А., О П.И., Фолкнер Г.Е., Баджадж Р.Р., Сильвер М.А., Митчелл М.С. и др. (январь 2015 г.). «Сидячий образ жизни и его связь с риском заболеваемости, смертности и госпитализации у взрослых: систематический обзор и метаанализ». Анналы внутренней медицины . 162 (2): 123–132. дои : 10.7326/M14-1651 . ПМИД 25599350 . S2CID 7256176 .
- ^ Купер К., Сквайрс Х., Кэрролл С., Папайоанну Д., Бут А., Логан Р.Ф. и др. (июнь 2010 г.). «Химиопрофилактика колоректального рака: систематический обзор и экономическая оценка» . Оценка технологий здравоохранения . 14 (32): 1–206. дои : 10.3310/hta14320 . ПМИД 20594533 .
- ^ Эмильссон Л., Холм О., Бреттауэр М., Кук Н.Р., Беринг Дж.Э., Лёберг М. и др. (январь 2017 г.). «Систематический обзор с мета-анализом: сравнительная эффективность аспирина и скрининга для профилактики колоректального рака» . Алиментарная фармакология и терапия . 45 (2): 193–204. дои : 10.1111/кв.13857 . ПМИД 27859394 .
- ^ Биббинс-Доминго К. (июнь 2016 г.). «Использование аспирина для первичной профилактики сердечно-сосудистых заболеваний и колоректального рака: рекомендательное заявление Целевой группы профилактических служб США» . Анналы внутренней медицины . 164 (12): 836–845. дои : 10.7326/M16-0577 . ПМИД 27064677 .
- ^ Агентство медицинских исследований и качества. «Аспирин или нестероидные противовоспалительные препараты для первичной профилактики колоректального рака» . Министерство здравоохранения и социальных служб США. Архивировано из оригинала 5 января 2016 г.
2010/2011.
- ^ Вайнгартен М.А., Залманович А., Яфе Дж. (январь 2008 г.). «Диетические добавки кальция для профилактики колоректального рака и аденоматозных полипов» . Кокрановская база данных систематических обзоров . 2010 (1): CD003548. дои : 10.1002/14651858.CD003548.pub4 . ПМЦ 8719254 . ПМИД 18254022 .
- ^ Ма Ю, Чжан П, Ван Ф, Ян Дж, Лю Цз, Цинь Х (октябрь 2011 г.). «Связь между витамином D и риском колоректального рака: систематический обзор проспективных исследований» . Журнал клинической онкологии . 29 (28): 3775–3782. дои : 10.1200/JCO.2011.35.7566 . ПМИД 21876081 .
- ^ Инь Л., Гранди Н., Раум Э., Хауг У., Арндт В., Бреннер Х. (2011). «Метаанализ: сывороточный витамин D и риск колоректальной аденомы». Профилактическая медицина . 53 (1–2): 10–16. дои : 10.1016/j.ypmed.2011.05.013 . ПМИД 21672549 .
- ^ «Что я могу сделать, чтобы снизить риск развития колоректального рака?» . Центры по контролю и профилактике заболеваний . 2 апреля 2014. Архивировано из оригинала 26 февраля 2015 года . Проверено 5 марта 2015 г.
- ^ Перейти обратно: а б Он Дж, Эфрон Дж. Э. (2011). «Скрининг колоректального рака». Достижения хирургии . 45 : 31–44. дои : 10.1016/j.yasu.2011.03.006 . hdl : 2328/11906 . ПМИД 21954677 .
- ^ Сигел Р.Л., Уорд Э.М., Джемал А. (март 2012 г.). «Тенденции заболеваемости колоректальным раком в США по локализации и стадии опухоли, 1992–2008 гг.» . Эпидемиология рака, биомаркеры и профилактика . 21 (3): 411–416. дои : 10.1158/1055-9965.EPI-11-1020 . ПМИД 22219318 .
- ^ Шварц А.В., Эберт Дж.М., Джози М.Дж., Страйер С.М. (октябрь 2017 г.). «Повторный анализ смертности от всех причин в докладе Целевой группы профилактических служб США о скрининге колоректального рака за 2016 год» . Анналы внутренней медицины . 167 (8): 602–603. дои : 10.7326/M17-0859 . ПМК 5823607 . ПМИД 28828493 .
- ^ Хьюитсон П., Гласиу П., Уотсон Э., Таулер Б., Ирвиг Л. (июнь 2008 г.). «Кокрейновский систематический обзор скрининга колоректального рака с использованием анализа кала на скрытую кровь (гемоккультизм): обновленная информация». Американский журнал гастроэнтерологии . 103 (6): 1541–1549. дои : 10.1111/j.1572-0241.2008.01875.x . ПМИД 18479499 . S2CID 26338156 .
- ^ Ли Дж.К., Лайлз Э.Г., Бент С., Левин Т.Р., Корли Д.А. (февраль 2014 г.). «Точность фекальных иммунохимических тестов на колоректальный рак: систематический обзор и метаанализ» . Анналы внутренней медицины . 160 (3): 171. дои : 10.7326/M13-1484 . ПМК 4189821 . ПМИД 24658694 .
- ^ «Новые пути могут улучшить скрининг рака кишечника» . Доказательства НИХР . 13 сентября 2021 г. doi : 10.3310/alert_47581 . S2CID 239113610 . Проверено 5 августа 2022 г.
- ^ Перейти обратно: а б Ли С.Дж., Шарплс Л.Д., Бентон С.К., Блюсс О., Мэтьюз С., Сасиени П. и др. (сентябрь 2021 г.). «Фекальное иммунохимическое тестирование при скрининге рака кишечника: оценка результатов различных диагностических стратегий» . Журнал медицинского скрининга . 28 (3): 277–285. дои : 10.1177/0969141320980501 . ПМЦ 8366184 . ПМИД 33342370 .
- ^ Перейти обратно: а б Касим А., Крэндалл С.Дж., Мустафа Р.А., Хикс Л.А., Уилт Т.Дж., Форсиа М.А. и др. (ноябрь 2019 г.). «Скрининг колоректального рака у бессимптомных взрослых со средним риском: рекомендации Американского колледжа врачей» . Анналы внутренней медицины . 171 (9): 643–654. дои : 10.7326/M19-0642 . ПМК 8152103 . ПМИД 31683290 .
- ^ Вольф А.М., Фонтам Э.Т., Черч Т.Р., Флауэрс С.Р., Герра С.Э., Ламонте С.Дж. и др. (июль 2018 г.). «Скрининг колоректального рака у взрослых со средним риском: обновление рекомендаций Американского онкологического общества на 2018 год» . CA: Журнал рака для врачей . 68 (4): 250–281. дои : 10.3322/caac.21457 . ПМИД 29846947 .
- ^ «Скрининг колоректального рака» . Рабочая группа США по профилактическим услугам . 2008. Архивировано из оригинала 7 февраля 2015 года . Проверено 19 декабря 2011 г.
- ^ Перейти обратно: а б Бреннер Х., Сток С., Хоффмайстер М. (апрель 2014 г.). «Влияние скрининговой ректороманоскопии и скрининговой колоноскопии на заболеваемость и смертность от колоректального рака: систематический обзор и метаанализ рандомизированных контролируемых исследований и обсервационных исследований» . БМЖ . 348 (1 апреля 2009 г.): g2467. дои : 10.1136/bmj.g2467 . ПМЦ 3980789 . ПМИД 24922745 .
- ^ «Пять вопросов, которые должны задать врачи и пациенты» (PDF) . Выбираем мудро: инициатива Фонда ABIM . Американская Гастроэнтерологическая Ассоциация . Архивировано из оригинала (PDF) 9 августа 2012 года . Проверено 17 августа 2012 г.
- ^ Винавер С., Флетчер Р., Рекс Д., Бонд Дж., Берт Р., Ферруччи Дж. и др. (февраль 2003 г.). «Скрининг и эпиднадзор за колоректальным раком: клинические рекомендации и обоснование. Обновление на основе новых данных» . Гастроэнтерология . 124 (2): 544–560. дои : 10.1053/gast.2003.50044 . ПМИД 12557158 . S2CID 29354772 .
- ^ Касим А., Денберг Т.Д., Хопкинс Р.Х., Хамфри Л.Л., Левин Дж., Свит Д.Е. и др. (март 2012 г.). «Скрининг колоректального рака: рекомендации Американского колледжа врачей» . Анналы внутренней медицины . 156 (5): 378–386. дои : 10.7326/0003-4819-156-5-201203060-00010 . ПМИД 22393133 .
- ^ Тан В., Боскардин В.Дж., Стиячич-Цензер И., Ли С.Дж. (апрель 2015 г.). «Время извлечь выгоду из скрининга колоректального рака: метаанализ выживаемости гибких ректороманоскопических исследований» . БМЖ . 350 : h1662. дои : 10.1136/bmj.h1662 . ПМК 4399600 . ПМИД 25881903 .
- ^ Перейти обратно: а б Бахус С.М., Данфилд Л., Горбер С.К., Холмс Н.М., Бертвистл Р., Дикинсон Дж.А. и др. (март 2016 г.). «Рекомендации по скринингу колоректального рака в учреждениях первичной медико-санитарной помощи» . CMAJ . 188 (5): 340–348. дои : 10.1503/cmaj.151125 . ПМЦ 4786388 . ПМИД 26903355 .
- ^ «Программа скрининга рака кишечника Национальной службы здравоохранения» . www.cancerscreening.nhs.uk . Архивировано из оригинала 29 ноября 2014 года.
- ^ «Дом – рак кишечника, Австралия» . www.boelcanceraustralia.org . Архивировано из оригинала 24 декабря 2014 года.
- ^ «Обследование населения по раку кишечника» . rivm.nl. Архивировано из оригинала 17 декабря 2014 года.
- ^ Тепус М., Яу ТО (июль 2020 г.). «Неинвазивный скрининг колоректального рака: обзор» . Желудочно-кишечные опухоли . 7 (3): 62–73. дои : 10.1159/000507701 . ПМЦ 7445682 . ПМИД 32903904 .
- ^ «Новые пути могут улучшить скрининг рака кишечника» . Доказательства НИХР . 13 сентября 2021 г. doi : 10.3310/alert_47581 . S2CID 239113610 .
- ^ Штейн А, Атанакович Д, Бокемейер С (сентябрь 2011 г.). «Современные стандарты и новые тенденции в первичном лечении колоректального рака». Европейский журнал рака . 47 (Приложение 3): S312–S314. дои : 10.1016/S0959-8049(11)70183-6 . ПМИД 21943995 .
- ^ Чиореан Э.Г., Нандакумар Г., Фаделу Т., Темин С., Аларкон-Розас А.Е., Бехарано С. и др. (март 2020 г.). «Лечение пациентов с поздней стадией колоректального рака: Руководство ASCO по стратификации ресурсов» . JCO Глобальная онкология . 6 (6): 414–438. дои : 10.1200/JGO.19.00367 . ПМК 7124947 . ПМИД 32150483 .
- ^ Ямасита К., Ока С., Танака С., Нагата С., Кувай Т., Фурудой А. и др. (1 марта 2019 г.). «Долгосрочный прогноз после лечения рака Т1 с латерально распространяющимися опухолями: многоцентровое ретроспективное исследование» . Международный журнал колоректальных заболеваний . 34 (3): 481–490. дои : 10.1007/s00384-018-3203-7 . ISSN 1432-1262 . ПМИД 30607579 . S2CID 57427824 .
- ^ Перейти обратно: а б Маккарти К., Пирсон К., Фултон Р., Хьюитт Дж. и др. (Кокрейновская группа по колоректальному раку) (декабрь 2012 г.). «Предоперационная химиолучевая терапия при неметастатическом местно-распространенном раке прямой кишки». Кокрановская база данных систематических обзоров . 12 : CD008368. дои : 10.1002/14651858.CD008368.pub2 . ПМИД 23235660 .
- ^ Перейти обратно: а б «Колоректальный рак» . Кливлендская клиника . Проверено 9 июля 2021 г.
- ^ Бёкельман С., Энгельманн Б.Е., Каприо Т., Хансен Т.Ф., Глимелиус Б. (январь 2015 г.). «Риск рецидива у пациентов с раком толстой кишки II и III стадии: систематический обзор и метаанализ современной литературы» . Акта Онкологика . 54 (1): 5–16. дои : 10.3109/0284186x.2014.975839 . ПМИД 25430983 .
- ^ «Химиотерапия метастатического колоректального рака». Пресрайр Интернэшнл . 19 (109): 219–224. Октябрь 2010 г. PMID 21180382 .
- ^ Факих М.Г. (июнь 2015 г.). «Метастатический колоректальный рак: современное состояние и будущие направления» . Журнал клинической онкологии . 33 (16): 1809–1824. дои : 10.1200/JCO.2014.59.7633 . ПМИД 25918280 .
- ^ Бенделл Дж. (14 марта 2024 г.). «Антиангиогенные агенты в терапии первой и второй линии при распространенном колоректальном раке» . Исследования рака желудочно-кишечного тракта . 1 (4 Приложение 2). Международное общество желудочно-кишечной онкологии: S22-8. ПМК 2666834 . ПМИД 19365574 .
- ^ Шаиб В., Махаджан Р., Эль-Райес Б. (сентябрь 2013 г.). «Маркеры резистентности к терапии анти-EGFR при колоректальном раке» . Журнал желудочно-кишечной онкологии . 4 (3): 308–318. дои : 10.3978/j.issn.2078-6891.2013.029 . ПМЦ 3712296 . ПМИД 23997942 .
- ^ Яу ТО (октябрь 2019 г.). «Точное лечение колоректального рака: настоящее и будущее» . JGH Открыть . 3 (5): 361–369. дои : 10.1002/jgh3.12153 . ПМЦ 6788378 . ПМИД 31633039 .
- ^ Шугарбейкер П.Х., Ван дер Спитен К. (февраль 2016 г.). «Хирургическая технология и фармакология гипертермической периоперационной химиотерапии» . Журнал желудочно-кишечной онкологии . 7 (1): 29–44. дои : 10.3978/j.issn.2078-6891.2015.105 . ПМЦ 4754302 . ПМИД 26941982 .
- ^ Сегура-Сампедро Дж. Джей, Моралес-Сориано Р. (август 2020 г.). «Профилактическое применение HIPEC с оксалиплатином может быть полезным при Т4 и перфоративном раке толстой кишки: еще одна возможная интерпретация результатов COLOPEC» . Revista Espanola de Enfermedades Digestivas . 112 (8): 666. дои : 10.17235/reed.2020.6755/2019 . hdl : 20.500.13003/12309 . ПМИД 32686435 .
- ^ Эскивель Дж., Стикка Р., Шугарбейкер П., Левин Э., Ян Т.Д., Александр Р. и др. (январь 2007 г.). «Циторедуктивная хирургия и гипертермическая внутрибрюшинная химиотерапия в лечении злокачественных новообразований поверхности брюшины толстой кишки: консенсусное заявление. Общество хирургической онкологии». Анналы хирургической онкологии . 14 (1): 128–133. дои : 10.1245/s10434-006-9185-7 . ПМИД 17072675 . S2CID 21282326 .
- ^ Архона-Санчес А., Эспиноза-Редондо Е., Гутьеррес-Балд А., Сейф-Сампедро Дж.Дж., Перес-Олд Е., Консепсьон-Мартин В. и др. (апрель 2023 г.). «Эффективность и безопасность интраоперационной гипертермической внутрибрюшинной химиотерапии при местно-распространенном раке толстой кишки: рандомизированное клиническое исследование фазы 3» . ДЖАМА Хирургия 158 (7): 683–691. дои : 10.1001/jamasurg.2023.0662 . ПМЦ 10134040 . ПМИД 37099280 .
- ^ ДеВита В.Т., Лоуренс Т.С., Розенберг С.А. (2008). Рак ДеВиты, Хеллмана и Розенберга: принципы и практика онкологии . Липпинкотт Уильямс и Уилкинс. стр. 1258–. ISBN 978-0-7817-7207-5 .
- ^ Перейти обратно: а б Фини Дж., Сегал Р., Шихан М., Хоган А., Риган М., Джойс М. и др. (сентябрь 2019 г.). «Неоадъювантная лучевая терапия в лечении рака прямой кишки» . Всемирный журнал гастроэнтерологии . 25 (33): 4850–4869. дои : 10.3748/wjg.v25.i33.4850 . ПМЦ 6737323 . ПМИД 31543678 .
- ^ Ли Ю, Ван Дж, Ма Х, Тан Л, Ян Ю, Сюэ С и др. (2016). «Обзор неоадъювантной химиолучевой терапии местно-распространенного рака прямой кишки» . Международный журнал биологических наук . 12 (8): 1022–1031. дои : 10.7150/ijbs.15438 . ПМЦ 4971740 . ПМИД 27489505 .
- ^ Цао С., Ван Д., Тянь Д.Х., Уилсон-Смит А., Хуан Дж., Римнер А. (декабрь 2019 г.). «Систематический обзор и метаанализ стереотаксической лучевой терапии тела при колоректальных метастазах в легких» . Журнал торакальных заболеваний . 11 (12): 5187–5198. дои : 10.21037/jtd.2019.12.12 . ПМК 6988072 . ПМИД 32030236 .
- ^ Боланд П.М., Ма В.В. (май 2017 г.). «Иммунотерапия колоректального рака» . Раки . 9 (5): 50. дои : 10.3390/cancers9050050 . ПМК 5447960 . ПМИД 28492495 .
- ^ Перейти обратно: а б Син Н.Л., Тенг М.В., Мок Т.С., Су Р.А. (декабрь 2017 г.). «De-novo и приобретенная устойчивость к нацеливанию на иммунные контрольные точки». «Ланцет». Онкология . 18 (12): е731–е741. дои : 10.1016/s1470-2045(17)30607-1 . ПМИД 29208439 .
- ^ Боррас Д.М., Вербандт С., Ауссерхофер М. и др. (ноябрь 2023 г.). «Динамика специфичности опухоли в сравнении с активностью свидетеля в CD8+ Т-клетках определяет разнообразные иммунные ландшафты при колоректальном раке» . Открытие клеток . 9 (114): 114. дои : 10.1038/s41421-023-00605-4 . ПМК 10652011 . ПМИД 37968259 .
- ^ «FDA предоставляет ускоренное одобрение пембролизумабу для первых показаний, не зависящих от ткани/места» . Управление по контролю за продуктами и лекарствами США . 9 февраля 2019 г.
- ^ Черчек А., Лумиш М., Синополи Дж., Вайс Дж., Шайа Дж., Ламендола-Эссель М. и др. (июнь 2022 г.). «Блокада PD-1 при дефектном восстановлении несоответствия, местно-распространенном раке прямой кишки» . Медицинский журнал Новой Англии . 386 (25): 2363–2376. дои : 10.1056/NEJMoa2201445 . ПМЦ 9492301 . ПМИД 35660797 . S2CID 249395846 .
- ^ «Паллиативная или поддерживающая помощь» . Американское онкологическое общество. Архивировано из оригинала 21 августа 2014 года . Проверено 20 августа 2014 г.
- ^ «Предварительное клиническое заключение ASCO: интеграция паллиативной помощи в стандартную онкологическую помощь» . АСКО. Архивировано из оригинала 21 августа 2014 года . Проверено 20 августа 2014 г.
- ^ Хиггинсон И.Дж., Эванс С.Дж. (сентябрь – октябрь 2010 г.). «Какие доказательства того, что команды паллиативной помощи улучшают результаты лечения онкологических больных и их семей?» . Раковый журнал . 16 (5): 423–435. дои : 10.1097/PPO.0b013e3181f684e5 . ПМИД 20890138 . S2CID 39881122 .
- ^ Вассерберг Н., Кауфман Х.С. (декабрь 2007 г.). «Паллиативная терапия колоректального рака». Хирургическая онкология . 16 (4): 299–310. дои : 10.1016/j.suronc.2007.08.008 . ПМИД 17913495 .
- ^ Амерси Ф, Стамос МД, Ко С.И. (июль 2004 г.). «Паллиативная помощь при колоректальном раке». Клиники хирургической онкологии Северной Америки . 13 (3): 467–477. дои : 10.1016/j.soc.2004.03.002 . ПМИД 15236729 .
- ^ Перейти обратно: а б с д Сон Х, Сон YJ, Ким Х, Ли Ю (8 июня 2018 г.). «Влияние психосоциальных вмешательств на качество жизни пациентов с колоректальным раком: систематический обзор и метаанализ» . Результаты по здоровью и качеству жизни . 16 (1): 119. дои : 10.1186/s12955-018-0943-6 . ISSN 1477-7525 . ПМК 5994008 . ПМИД 29884182 .
- ^ Перейти обратно: а б с д Пэн Юнь, Хуан МЛ, Као Ч. (31 января 2019 г.). «Распространенность депрессии и тревоги у больных колоректальным раком: обзор литературы» . Международный журнал экологических исследований и общественного здравоохранения . 16 (3): 411. doi : 10.3390/ijerph16030411 . ISSN 1660-4601 . ПМЦ 6388369 . ПМИД 30709020 .
- ^ Перейти обратно: а б Ченг В., Овейси Н., МакТаггарт-Коуэн Х., Лори Дж.М., Мерфи Р.А., Де Вера Массачусетс (2022). «Колоректальный рак и начало тревоги и депрессии: систематический обзор и метаанализ» . Современная онкология . 29 (11): 8751–8766. doi : 10.3390/curroncol29110689 . ISSN 1718-7729 . ПМЦ 9689519 . ПМИД 36421342 .
- ^ Мошер CE, Вингер Дж.Г., Гивен BA, Helft PR, О'Нил Б.Х. (2016). «Результаты психического здоровья при выживании при колоректальном раке: обзор литературы: Психическое здоровье при выживании при колоректальном раке» . Психоонкология . 25 (11): 1261–1270. дои : 10.1002/пон.3954 . ПМЦ 4894828 . ПМИД 26315692 .
- ^ Перейти обратно: а б с Рейнольдс Л.М., Конседин Н.С., Писарро Д.А., Биссетт И.П. (2013). «Отвращение и поведенческое избегание при скрининге и лечении колоректального рака: систематический обзор и программа исследований» . Уход за раком . 36 (2): 122–130. дои : 10.1097/NCC.0b013e31826a4b1b . ISSN 0162-220X . ПМИД 23047793 .
- ^ Перейти обратно: а б с д и ж Фелан С.М., Гриффин Дж.М., Джексон Г.Л., Зафар С.Ю., Хеллерстедт В., Старе М. и др. (2013). «Стигма, воспринимаемая вина, самообвинение и депрессивные симптомы у мужчин с колоректальным раком» . Психоонкология . 22 (1): 65–73. дои : 10.1002/пон.2048 . ISSN 1057-9249 . ПМК 6000725 . ПМИД 21954081 .
- ^ Перейти обратно: а б Хун Л.С., Чи Салли CW, Хонг-Гу Х (2013). «Влияние психосоциальных вмешательств на исходы пациентов с колоректальным раком: обзор литературы» . Европейский журнал сестринского дела в онкологии . 17 (6): 883–891. дои : 10.1016/j.ejon.2013.05.001 . ISSN 1462-3889 . ПМИД 23759360 .
- ^ Мэн X, Ван X, Донг Z (1 октября 2021 г.). «Влияние нефармакологических вмешательств на качество жизни, показатели тревоги и депрессии у пациентов с колоректальным раком: систематический обзор и метаанализ рандомизированных контролируемых исследований» . Поддерживающая терапия при раке . 29 (10): 5635–5652. дои : 10.1007/s00520-021-06185-x . ISSN 1433-7339 . ПМИД 33786669 .
- ^ Перейти обратно: а б с д Хуа Х, Цзян Ц, Сунь П, Сюй Сюй (5 мая 2023 г.). «Факторы риска колоректального рака с ранним началом: систематический обзор и метаанализ» . Границы онкологии . 13 . дои : 10.3389/fonc.2023.1132306 . ISSN 2234-943X . ПМЦ 10196487 . ПМИД 37213277 .
- ^ Перейти обратно: а б «Национальная комплексная онкологическая сеть» (PDF) . nccn.org . Архивировано (PDF) из оригинала 25 марта 2009 г.
- ^ Перейти обратно: а б Деш С.Э., Бенсон А.Б., Сомерфилд М.Р., Флинн П.Дж., Краузе С., Лопринци С.Л. и др. (ноябрь 2005 г.). «Эпиднадзор за колоректальным раком: обновление практического руководства Американского общества клинической онкологии, 2005 г.» . Журнал клинической онкологии . 23 (33): 8512–8519. дои : 10.1200/JCO.2005.04.0063 . ПМИД 16260687 .
- ^ Джеффри М., Хики Б.Е., Хидер П.Н. (сентябрь 2019 г.). «Стратегии последующего наблюдения за пациентами, лечившимися от неметастатического колоректального рака» . Кокрановская база данных систематических обзоров . 2019 (9): CD002200. дои : 10.1002/14651858.CD002200.pub4 . ПМК 6726414 . ПМИД 31483854 .
- ^ Бетоф А.С., Дьюхерст М.В., Джонс Л.В. (март 2013 г.). «Влияние и потенциальные механизмы физических упражнений на прогрессирование рака: трансляционная перспектива» . Мозг, поведение и иммунитет . 30 (Дополнение): S75–S87. дои : 10.1016/j.bbi.2012.05.001 . ПМЦ 3638811 . ПМИД 22610066 .
- ^ Перейти обратно: а б Баллард-Барбаш Р., Фриденрайх К.М., Курнея К.С., Сиддики С.М., Мактирнан А., Альфано К.М. (июнь 2012 г.). «Физическая активность, биомаркеры и исходы заболеваний у выживших после рака: систематический обзор» . Журнал Национального института рака . 104 (11): 815–840. дои : 10.1093/jnci/djs207 . ПМЦ 3465697 . ПМИД 22570317 .
- ^ Перейти обратно: а б МакГеттиган М., Кардвелл Ч.Р., Кэнтуэлл М.М., Талли М.А. (май 2020 г.). «Вмешательства в области физической активности для улучшения физического и психического здоровья, связанного с заболеванием, во время и после лечения у людей с не запущенным колоректальным раком» . Кокрановская база данных систематических обзоров . 2020 (5): CD012864. дои : 10.1002/14651858.cd012864.pub2 . ПМЦ 7196359 . ПМИД 32361988 .
- ^ Стрёмме Дж. М., Йоханнессен Б., Скотхайм Р.И. (2023 г.). «Отклоняющийся альтернативный сплайсинг как молекулярный подтип микросателлитно-стабильного колоректального рака» . JCO Клиническая информатика рака . 7 (7): e2200159. дои : 10.1200/CCI.22.00159 . hdl : 10852/108838 . ПМИД 36821799 .
- ^ Остерман Э., Глимелиус Б (сентябрь 2018 г.). «Риск рецидива после современных стадий, операций и патологий рака толстой кишки: анализ всего населения Швеции» . Заболевания толстой и прямой кишки . 61 (9): 1016–1025. doi : 10.1097/dcr.0000000000001158 . ПМИД 30086050 . S2CID 51934598 .
- ^ Перейти обратно: а б Дорудян С., Остерман Э., Глимелиус Б. (9 июня 2024 г.). «Факторы риска рецидива после операции по поводу рака прямой кишки в современной общенациональной популяционной когорте» . Анналы хирургической онкологии . дои : 10.1245/s10434-024-15552-x . ISSN 1068-9265 . ПМИД 38853216 .
- ^ Норс Дж., Иверсен Л.Х., Эриксен Р., Готшальк К.А., Андерсен К.Л. (1 января 2024 г.). «Частота рецидивов и время до рецидива на стадиях I–III колоректального рака: общенациональное датское когортное исследование» . JAMA Онкология . 10 (1): 54–62. дои : 10.1001/jamaoncol.2023.5098 . ISSN 2374-2437 . ПМЦ 10654928 . ПМИД 37971197 .
- ^ Норс Дж., Готшалк К.А., Эриксен Р., Андерсен К.Л. (1 июня 2024 г.). «Частота позднего рецидива и второго первичного рака через 5-10 лет после неметастатического колоректального рака» . Международный журнал рака . 154 (11): 1890–1899. дои : 10.1002/ijc.34871 . ПМИД 38323453 .
- ^ Захаракис М., Ксинос И.Д., Лазарис А., Смаро Т., Космас С., Доку А. и др. (февраль 2010 г.). «Предикторы выживаемости при метастатическом колоректальном раке IV стадии» . Противораковые исследования . 30 (2): 653–660. ПМИД 20332485 .
- ^ Агабеги ЭД, Агабеги С.С. (2008). Шаг вперед к медицине (серия «Шаг вперед») . Хагерствон, доктор медицины: Липпинкотт Уильямс и Уилкинс. ISBN 978-0-7817-7153-5 .
- ^ Хун Ю (30 июня 2020 г.). «Клиническое исследование операции при колоректальном раке: анализ выживаемости» . Корейский журнал клинической онкологии 2020 . 16 (1): 3–8. дои : 10.14216/kjco.20002 . ПМЦ 9942716 . ПМИД 36945303 .
- ^ «Пятилетняя выживаемость» . Национальный институт рака . Проверено 9 мая 2021 г.
- ^ Сюй З., Бесерра А.З., Флеминг Ф.Дж., Аквина К.Т., Долан Дж.Г., Монсон Дж.Р. и др. (октябрь 2019 г.). «Лечение рака толстой кишки IV стадии и общая выживаемость». Журнал хирургических исследований . 242 : 47–54. дои : 10.1016/j.jss.2019.04.034 . ПМИД 31071604 . S2CID 149443256 .
- ^ Drageset S, Lindstrøm TC, Underlid K (апрель 2016 г.). « Мне просто нужно двигаться дальше»: опыт женщин и их размышления после первого года после первичной операции по поводу рака молочной железы». Европейский журнал сестринского дела в онкологии . 21 : 205–211. дои : 10.1016/j.ejon.2015.10.005 . ПМИД 26521054 .
- ^ Рестиво А., Зорколо Л., Д'Алия Г., Кокко Ф., Коссу А., Сцинту Ф. и др. (февраль 2016 г.). «Риск осложнений и долгосрочных функциональных изменений после местного иссечения опухолей прямой кишки с помощью трансанальной эндоскопической микрохирургии (ТЭМ)». Международный журнал колоректальных заболеваний . 31 (2): 257–266. дои : 10.1007/s00384-015-2371-y . ПМИД 26298182 . S2CID 29087556 .
- ^ Брегендал С., Эммерцен К.Дж., Линдегаард Дж.К., Лаурберг С. (январь 2015 г.). «Мочевая и сексуальная дисфункция у женщин после резекции с предоперационной лучевой терапией и без нее при раке прямой кишки: популяционное поперечное исследование». Колоректальное заболевание . 17 (1): 26–37. дои : 10.1111/codi.12758 . ПМИД 25156386 . S2CID 42069306 .
- ^ Рамирес М., Макмаллен С., Грант М., Альтшулер А., Хорнбрук М.С., Крауз Р.С. (декабрь 2009 г.). «Выяснение пола в измененном теле: опыт женщин, переживших колоректальный рак, со стомой» . Женщины и здоровье . 49 (8): 608–624. дои : 10.1080/03630240903496093 . ПМЦ 2836795 . ПМИД 20183104 .
- ^ Стил Н., Хей Р., Ноулз Г., Макин М. (сентябрь 2007 г.). «Тестирование карциноэмбрионального антигена (СЕА) при наблюдении за колоректальным раком: что думают пациенты?» . Последипломный медицинский журнал . 83 (983): 612–614. дои : 10.1136/pgmj.2007.059634 . ПМК 2600007 . ПМИД 17823231 .
- ^ Макгичан Г.Дж., Бирнс К., Кэмпбелл М., Карти Н., Эберхардт Дж., Патон В. и др. (январь 2021 г.). «Систематический обзор и качественный синтез опыта жизни с колоректальным раком как хроническим заболеванием» . Психология и здоровье . 37 (3): 350–374. дои : 10.1080/08870446.2020.1867137 . ПМИД 33499649 . S2CID 231771176 .
- ^ Лозано Р., Нагави М., Форман К., Лим С., Сибуя К., Абоянс В. и др. (декабрь 2012 г.). «Глобальная и региональная смертность от 235 причин смерти в 20 возрастных группах в 1990 и 2010 годах: систематический анализ для исследования глобального бремени болезней 2010 года» . Ланцет . 380 (9859): 2095–2128. дои : 10.1016/S0140-6736(12)61728-0 . hdl : 10536/DRO/DU:30050819 . ПМЦ 10790329 . ПМИД 23245604 . S2CID 1541253 .
- ^ ВОЗ (февраль 2010 г.). "Рак" . Всемирная организация здравоохранения. Архивировано из оригинала 29 декабря 2010 года . Проверено 5 января 2011 г.
- ^ Мерика Э., Саиф М.В., Кац А., Сиригос К., Сиригос С., Морс М. (2010). «Обзор. Вакцины против рака толстой кишки: обновленная информация». В Виво . 24 (5): 607–628. ПМИД 20952724 .
- ^ Ферли Дж., Шин Х.Р., Брей Ф., Форман Д., Мазерс С., Паркин Д.М. (2010). «Заболеваемость, смертность и распространенность колоректального рака во всем мире в 2008 г. – Резюме» . Архивировано из оригинала 17 октября 2012 года . ; «GLOBOCAN 2008 v2.0, Заболеваемость раком и смертность во всем мире: IARC CancerBase № 10» . Лион, Франция: Международное агентство по исследованию рака. Архивировано из оригинала 8 мая 2011 года.
- ^ Перейти обратно: а б «Колоректальный рак: Статистика» . Cancer.net, Американское общество клинической онкологии. февраль 2022 года . Проверено 13 мая 2022 г.
- ^ Кателла К. «Колоректальный рак: что нужно знать миллениалам и поколению Z» . Йельская медицина .
- ^ «Рак кишечника | О раке кишечника | Исследования рака в Великобритании» . www.cancerresearchuk.org . Архивировано из оригинала 9 марта 2017 года . Проверено 12 мая 2017 г.
- ^ Рак в Австралии: обзор, 2014. Серия «Рак» № 90. Кат. № CAN 88 . Канберра: Австралийский институт здравоохранения и социального обеспечения. 2014. ISBN 978-1-74249-677-1 .
- ^ Рак в Папуа-Новой Гвинее: обзор, 2016. Серия «Рак» № 176. Кат. № CAN 88 . Департамент здравоохранения Папуа-Новой Гвинеи. 2016.
- ^ Перейти обратно: а б с д и Пуццоно М., Мануччи А., Гранно С., Зуппардо Р.А., Галли А., Данезе С. и др. (2021). «Роль диеты и образа жизни при раннем начале колоректального рака: систематический обзор» . Раки . 13 (23): 5933. doi : 10.3390/cancers13235933 . ISSN 2072-6694 . ПМЦ 8657307 . ПМИД 34885046 .
- ^ Перейти обратно: а б с д и ж Вуик Ф.Е., Ньювенбург С.А., Барду М., Лансдорп-Фогелаар И., Динис-Рибейро М., Бенто М.Дж. и др. (2019). «Рост заболеваемости колоректальным раком среди молодых людей в Европе за последние 25 лет» . Гут . 68 (10): 1820–1826. дои : 10.1136/gutjnl-2018-317592 . ISSN 0017-5749 . ПМК 6839794 . ПМИД 31097539 .
- ^ Унануэ-Арса С., Солис-Ибинагойтия М., Диас-Сеоан М., Москера-Меткалф I, Идигорас I, Бильбао I и др. (12 декабря 2020 г.). «Неравенство и факторы риска, связанные с неучастием в программах скрининга колоректального рака: систематический обзор» . Европейский журнал общественного здравоохранения . 31 (2): 346–355. дои : 10.1093/eurpub/ckaa203 . ISSN 1101-1262 . ПМЦ 8071594 . ПМИД 33313657 .
- ^ Рехемтулла А (декабрь 2010 г.). «Динозавры и древние цивилизации: размышления о лечении рака» . Неоплазия . 12 (12): 957–968. дои : 10.1593/neo.101588 . ПМК 3003131 . ПМИД 21170260 .
- ^ Чжун Л., Чжан Х., Коваса М. (июнь 2014 г.). «Новая роль молочнокислых бактерий в защите от колоректального рака» . Всемирный журнал гастроэнтерологии . 20 (24): 7878–7886. дои : 10.3748/wjg.v20.i24.7878 . ПМК 4069315 . ПМИД 24976724 .
- ^ «Атлас колоректального рака» . Архивировано из оригинала 13 января 2016 года.