Рак поджелудочной железы
| Рак поджелудочной железы | |
|---|---|
 | |
| Схема, показывающая положение поджелудочной железы позади желудка (на этой схеме он прозрачен). | |
| Специальность | |
| Симптомы |
|
| Usual onset | 40+ years of age[2] |
| Risk factors |
|
| Diagnostic method |
|
| Prevention | Not smoking, low alcohol intake, maintaining a healthy weight, low red meat diet[5] |
| Treatment | |
| Prognosis | Five year survival rate 13%[6] |
| Frequency | 393,800 (2015)[7] |
| Deaths | 411,600 (2015)[8] |
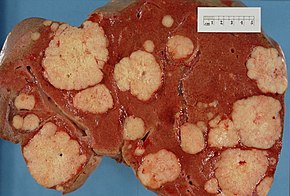
Рак поджелудочной железы возникает, когда клетки поджелудочной железы , железистого органа, расположенного за желудком , начинают бесконтрольно размножаться и образовывать массу . Эти раковые клетки способны проникать в другие части тела. [9] Известно несколько типов рака поджелудочной железы. [10]
Наиболее распространенная аденокарцинома поджелудочной железы составляет около 90% случаев. [11] и термин «рак поджелудочной железы» иногда используется только для обозначения этого типа. [10] Эти аденокарциномы возникают в той части поджелудочной железы, которая вырабатывает пищеварительные ферменты . [10] Некоторые другие типы рака, которые в совокупности представляют собой большинство неаденокарцином, также могут возникать из этих клеток. [10]
Около 1–2% случаев рака поджелудочной железы составляют нейроэндокринные опухоли , возникающие из гормонпродуцирующих клеток поджелудочной железы. [10] Они, как правило, менее агрессивны, чем аденокарцинома поджелудочной железы. [10]
Признаки и симптомы наиболее распространенной формы рака поджелудочной железы могут включать пожелтение кожи , в животе или боли спине , необъяснимую потерю веса , светлый стул , темную мочу и потерю аппетита . [1] Usually, no symptoms are seen in the disease's early stages, and symptoms that are specific enough to suggest pancreatic cancer typically do not develop until the disease has reached an advanced stage.[1][2] By the time of diagnosis, pancreatic cancer has often spread to other parts of the body.[10][12]
Pancreatic cancer rarely occurs before the age of 40, and more than half of cases of pancreatic adenocarcinoma occur in those over 70.[2] Risk factors for pancreatic cancer include tobacco smoking, obesity, diabetes, and certain rare genetic conditions.[2] About 25% of cases are linked to smoking,[3] and 5–10% are linked to inherited genes.[2]
Pancreatic cancer is usually diagnosed by a combination of medical imaging techniques such as ultrasound or computed tomography, blood tests, and examination of tissue samples (biopsy).[3][4] The disease is divided into stages, from early (stage I) to late (stage IV).[12] Screening the general population has not been found to be effective.[13]
The risk of developing pancreatic cancer is lower among non-smokers, and people who maintain a healthy weight and limit their consumption of red or processed meat;[5] however, the risk is greater for men, especially at very high levels of red meat consumption.[14] However, this is in debate, as a study performed by the International Journal of Cancer in 2013 did not find any statistically significant relationship between red meat consumption and pancreatic cancer, finding instead no male connection and only finding positive association of red meat consumption with pancreatic cancer risk in women after restriction to microscopically confirmed cases.[15] Smokers' risk of developing the disease decreases immediately upon quitting, and almost returns to that of the rest of the population after 20 years.[10] Pancreatic cancer can be treated with surgery, radiotherapy, chemotherapy, palliative care, or a combination of these.[1] Treatment options are partly based on the cancer stage.[1] Surgery is the only treatment that can cure pancreatic adenocarcinoma,[12] and may also be done to improve quality of life without the potential for cure.[1][12] Pain management and medications to improve digestion are sometimes needed.[12] Early palliative care is recommended even for those receiving treatment that aims for a cure.[16]
Pancreatic cancer is among the most deadly forms of cancer globally, with one of the lowest survival rates. In 2015, pancreatic cancers of all types resulted in 411,600 deaths globally.[8] Pancreatic cancer is the fifth-most-common cause of death from cancer in the United Kingdom,[17] and the third most-common in the United States.[18] The disease occurs most often in the developed world, where about 70% of the new cases in 2012 originated.[10] Pancreatic adenocarcinoma typically has a very poor prognosis; after diagnosis, 25% of people survive one year and 12% live for five years.[6][10] For cancers diagnosed early, the five-year survival rate rises to about 20%.[19] Neuroendocrine cancers have better outcomes; at five years from diagnosis, 65% of those diagnosed are living, though survival considerably varies depending on the type of tumor.[10]
Types[edit]


The many types of pancreatic cancer can be divided into two general groups. The vast majority of cases (about 95%) occur in the part of the pancreas that produces digestive enzymes, known as the exocrine component. Several subtypes of exocrine pancreatic cancers are described, but their diagnosis and treatment have much in common.
The small minority of cancers that arise in the hormone-producing (endocrine) tissue of the pancreas have different clinical characteristics and are called pancreatic neuroendocrine tumors, sometimes abbreviated as "PanNETs". Both groups occur mainly (but not exclusively) in people over 40, and are slightly more common in men, but some rare subtypes mainly occur in women or children.[21][22]
Exocrine cancers[edit]
The exocrine group is dominated by pancreatic adenocarcinoma (variations of this name may add "invasive" and "ductal"), which is by far the most common type, representing about 85% of all pancreatic cancers.[2] Nearly all these start in the ducts of the pancreas, as pancreatic ductal adenocarcinoma (PDAC).[23] This is despite the fact that the tissue from which it arises – the pancreatic ductal epithelium – represents less than 10% of the pancreas by cell volume, because it constitutes only the ducts (an extensive but capillary-like duct-system fanning out) within the pancreas.[24] This cancer originates in the ducts that carry secretions (such as enzymes and bicarbonate) away from the pancreas. About 60–70% of adenocarcinomas occur in the head of the pancreas.[2]
The next-most common type, acinar cell carcinoma of the pancreas, arises in the clusters of cells that produce these enzymes, and represents 5% of exocrine pancreas cancers.[25] Like the 'functioning' endocrine cancers described below, acinar cell carcinomas may cause over-production of certain molecules, in this case digestive enzymes, which may cause symptoms such as skin rashes and joint pain.
Cystadenocarcinomas account for 1% of pancreatic cancers, and they have a better prognosis than the other exocrine types.[25]
Pancreatoblastoma is a rare form, mostly occurring in childhood, and with a relatively good prognosis. Other exocrine cancers include adenosquamous carcinomas, signet ring cell carcinomas, hepatoid carcinomas, colloid carcinomas, undifferentiated carcinomas, and undifferentiated carcinomas with osteoclast-like giant cells. Solid pseudopapillary tumor is a rare low-grade neoplasm that mainly affects younger women, and generally has a very good prognosis.[2][26]
Pancreatic mucinous cystic neoplasms are a broad group of pancreas tumors that have varying malignant potential. They are being detected at a greatly increased rate as CT scans become more powerful and common, and discussion continues as how best to assess and treat them, given that many are benign.[27]
Neuroendocrine[edit]
The small minority of tumors that arise elsewhere in the pancreas are mainly pancreatic neuroendocrine tumors (PanNETs).[28] Neuroendocrine tumors (NETs) are a diverse group of benign or malignant tumors that arise from the body's neuroendocrine cells, which are responsible for integrating the nervous and endocrine systems. NETs can start in most organs of the body, including the pancreas, where the various malignant types are all considered to be rare. PanNETs are grouped into 'functioning' and 'nonfunctioning' types, depending on the degree to which they produce hormones. The functioning types secrete hormones such as insulin, gastrin, and glucagon into the bloodstream, often in large quantities, giving rise to serious symptoms such as low blood sugar, but also favoring relatively early detection. The most common functioning PanNETs are insulinomas and gastrinomas, named after the hormones they secrete. The nonfunctioning types do not secrete hormones in a sufficient quantity to give rise to overt clinical symptoms, so nonfunctioning PanNETs are often diagnosed only after the cancer has spread to other parts of the body.[29]
As with other neuroendocrine tumors, the history of the terminology and classification of PanNETs is complex.[28] PanNETs are sometimes called "islet cell cancers",[30] though they are now known to not actually arise from islet cells as previously thought.[29]
Signs and symptoms[edit]

Since pancreatic cancer usually does not cause recognizable symptoms in its early stages, the disease is typically not diagnosed until it has spread beyond the pancreas itself.[4] This is one of the main reasons for the generally poor survival rates. Exceptions to this are the functioning PanNETs, where over-production of various active hormones can give rise to symptoms (which depend on the type of hormone).[31]
Common presenting symptoms of pancreatic adenocarcinoma include:
- Pain in the upper abdomen or back, often spreading from around the stomach to the back. The location of the pain can indicate the part of the pancreas where a tumor is located. The pain may be worse at night and may increase over time to become severe and unremitting.[25] It may be slightly relieved by bending forward. In the UK, about half of new cases of pancreatic cancer are diagnosed following a visit to a hospital emergency department for pain or jaundice. In up to two-thirds of people, abdominal pain is the main symptom, for 46% of the total accompanied by jaundice, with 13% having jaundice without pain.[12]
- Jaundice, a yellow tint to the whites of the eyes or skin, with or without pain, and possibly in combination with darkened urine, results when a cancer in the head of the pancreas obstructs the common bile duct as it runs through the pancreas.[32]
- Unexplained weight loss, either from loss of appetite, or loss of exocrine function resulting in poor digestion.[12]
- The tumor may compress neighboring organs, disrupting digestive processes and making it difficult for the stomach to empty, which may cause nausea and a feeling of fullness. The undigested fat leads to foul-smelling, fatty feces that are difficult to flush away.[12] Constipation is also common.[33]
- At least 50% of people with pancreatic adenocarcinoma have diabetes at the time of diagnosis.[2] While long-standing diabetes is a known risk factor for pancreatic cancer (see Risk factors), the cancer can itself cause diabetes, in which case recent onset of diabetes could be considered an early sign of the disease.[34] People over 50 who develop diabetes have eight times the usual risk of developing pancreatic adenocarcinoma within three years, after which the relative risk declines.[12]
Other findings[edit]
- Trousseau's syndrome – in which blood clots form spontaneously in the portal blood vessels (portal vein thrombosis), the deep veins of the extremities (deep vein thrombosis), or the superficial veins (superficial vein thrombosis) anywhere on the body – may be associated with pancreatic cancer, and is found in about 10% of cases.[3]
- Clinical depression has been reported in association with pancreatic cancer in some 10–20% of cases, and can be a hindrance to optimal management. The depression sometimes appears before the diagnosis of cancer, suggesting that it may be brought on by the biology of the disease.[3]
Other common manifestations of the disease include weakness and tiring easily, dry mouth, sleep problems, and a palpable abdominal mass.[33]
Symptoms of spread[edit]
The spread of pancreatic cancer to other organs (metastasis) may also cause symptoms. Typically, pancreatic adenocarcinoma first spreads to nearby lymph nodes, and later to the liver or to the peritoneal cavity, large intestine, or lungs.[3] Uncommonly, it spreads to the bones or brain.[35]
Cancers in the pancreas may also be secondary cancers that have spread from other parts of the body. This is uncommon, found in only about 2% of cases of pancreatic cancer. Kidney cancer is by far the most common cancer to spread to the pancreas, followed by colorectal cancer, and then cancers of the skin, breast, and lung. Surgery may be performed on the pancreas in such cases, whether in hope of a cure or to alleviate symptoms.[36]
Risk factors[edit]
Risk factors for pancreatic adenocarcinoma include:[2][10][12][37][38][excessive citations]
- Age, sex, and ethnicity – the risk of developing pancreatic cancer increases with age. Most cases occur after age 65,[10] while cases before age 40 are uncommon. The disease is slightly more common in men than in women.[10] In the United States, it is over 1.5 times more common in African Americans, though incidence in Africa is low.[10]
- Cigarette smoking is the best-established avoidable risk factor for pancreatic cancer, approximately doubling risk among long-term smokers, the risk increasing with the number of cigarettes smoked and the years of smoking. The risk declines slowly after smoking cessation, taking some 20 years to return to almost that of nonsmokers.[39]
- Obesity – a body mass index greater than 35 increases relative risk by about half.[12][40]
- Family history – 5–10% of pancreatic cancer cases have an inherited component, where people have a family history of pancreatic cancer.[2][41] The risk escalates greatly if more than one first-degree relative had the disease, and more modestly if they developed it before the age of 50.[4] Most of the genes involved have not been identified.[2][42] Hereditary pancreatitis gives a greatly increased lifetime risk of pancreatic cancer of 30–40% to the age of 70.[3] Screening for early pancreatic cancer may be offered to individuals with hereditary pancreatitis on a research basis.[43] Some people may choose to have their pancreas surgically removed to prevent cancer from developing in the future.[3]
- Pancreatic cancer has been associated with these other rare hereditary syndromes: Peutz–Jeghers syndrome due to mutations in the STK11 tumor suppressor gene (very rare, but a very strong risk factor); dysplastic nevus syndrome (or familial atypical multiple mole and melanoma syndrome, FAMMM-PC) due to mutations in the CDKN2A tumor suppressor gene; autosomal recessive ataxia-telangiectasia and autosomal dominantly inherited mutations in the BRCA2 and PALB2 genes; hereditary non-polyposis colon cancer (Lynch syndrome); and familial adenomatous polyposis. PanNETs have been associated with multiple endocrine neoplasia type 1 (MEN1) and von Hippel Lindau syndromes.[2][3][4]
- Chronic pancreatitis appears to almost triple risk, and as with diabetes, new-onset pancreatitis may be a symptom of a tumor.[3] The risk of pancreatic cancer in individuals with familial pancreatitis is particularly high.[3][42]
- Diabetes mellitus is a risk factor for pancreatic cancer and (as noted in the Signs and symptoms section) new-onset diabetes may also be an early sign of the disease. People who have been diagnosed with type 2 diabetes for longer than 10 years may have a 50% increased risk, as compared with individuals without diabetes.[3] In 2021, Venturi reported that the pancreas is able to absorb in great quantity radioactive cesium (Cs-134 and Cs-137) causing chronic pancreatitis and probably pancreatic cancer with damage of pancreatic islands, causing type 3c (pancreatogenic) diabetes.[44] Chronic pancreatitis, pancreatic cancer and diabetes mellitus increased in contaminated populations, particularly children and adolescents, after Fukushima and Chernobyl nuclear incidents. At the same time, worldwide pancreatic diseases, diabetes and environmental radiocesium are increasing.
- Specific types of food (as distinct from obesity) have not been clearly shown to increase the risk of pancreatic cancer.[2][45] Dietary factors for which some evidence shows slightly increased risk include processed meat, red meat, and meat cooked at very high temperatures (e.g. by frying, broiling, or grilling).[45][46]
Alcohol[edit]
Drinking alcohol excessively is a major cause of chronic pancreatitis, which in turn predisposes to pancreatic cancer, but considerable research has failed to firmly establish alcohol consumption as a direct risk factor for pancreatic cancer. Overall, the association is consistently weak and the majority of studies have found no association, with smoking a strong confounding factor. The evidence is stronger for a link with heavy drinking, of at least six drinks per day.[3][47]
Pathophysiology[edit]

Precancer[edit]


Exocrine cancers are thought to arise from several types of precancerous lesions within the pancreas, but these lesions do not always progress to cancer, and the increased numbers detected as a byproduct of the increasing use of CT scans for other reasons are not all treated.[3] Apart from pancreatic serous cystadenomas, which are almost always benign, four types of precancerous lesion are recognized.
The first is pancreatic intraepithelial neoplasia (PanIN). These lesions are microscopic abnormalities in the pancreas and are often found in autopsies of people with no diagnosed cancer. These lesions may progress from low to high grade and then to a tumor. More than 90% of cases at all grades carry a faulty KRAS gene, while in grades 2 and 3, damage to three further genes – CDKN2A (p16), p53, and SMAD4 – are increasingly often found.[2]
A second type is the intraductal papillary mucinous neoplasm (IPMN). These are macroscopic lesions, which are found in about 2% of all adults. This rate rises to about 10% by age 70. These lesions have about a 25% risk of developing into invasive cancer. They may have KRAS gene mutations (40–65% of cases) and in the GNAS Gs alpha subunit and RNF43, affecting the Wnt signaling pathway.[2] Even if removed surgically, a considerably increased risk remains of pancreatic cancer developing subsequently.[3]
The third type, pancreatic mucinous cystic neoplasm (MCN), mainly occurs in women, and may remain benign or progress to cancer.[49] If these lesions become large, cause symptoms, or have suspicious features, they can usually be successfully removed by surgery.[3]
A fourth type of cancer that arises in the pancreas is the intraductal tubulopapillary neoplasm. This type was recognised by the WHO in 2010 and constitutes about 1–3% of all pancreatic neoplasms. Mean age at diagnosis is 61 years (range 35–78 years). About 50% of these lesions become invasive. Diagnosis depends on histology, as these lesions are very difficult to differentiate from other lesions on either clinical or radiological grounds.[50]
Invasive cancer[edit]
The genetic events found in ductal adenocarcinoma have been well characterized, and complete exome sequencing has been done for the common types of tumor. Four genes have each been found to be mutated in the majority of adenocarcinomas: KRAS (in 95% of cases), CDKN2A (also in 95%), TP53 (75%), and SMAD4 (55%). The last of these is especially associated with a poor prognosis.[3] SWI/SNF mutations/deletions occur in about 10–15% of the adenocarcinomas.[2] The genetic alterations in several other types of pancreatic cancer and precancerous lesions have also been researched.[3] Transcriptomics analyses and mRNA sequencing for the common forms of pancreatic cancer have found that 75% of human genes are expressed in the tumors, with some 200 genes more specifically expressed in pancreatic cancer as compared to other tumor types.[51][52]
PanNETs[edit]
The genes often found mutated in pancreatic neuroendocrine tumors (PanNETs) are different from those in exocrine pancreatic cancer.[53] For example, KRAS mutation is normally absent. Instead, hereditary MEN1 gene mutations give risk to MEN1 syndrome, in which primary tumors occur in two or more endocrine glands. About 40–70% of people born with a MEN1 mutation eventually develop a PanNet.[54] Other genes that are frequently mutated include DAXX, mTOR, and ATRX.[29]
Diagnosis[edit]
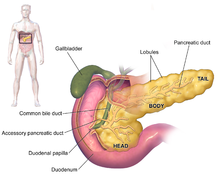

The symptoms of pancreatic adenocarcinoma do not usually appear in the disease's early stages, and they are not individually distinctive to the disease.[3][12][32] The symptoms at diagnosis vary according to the location of the cancer in the pancreas, which anatomists divide (from left to right on most diagrams) into the thick head, the neck, and the tapering body, ending in the tail.
Regardless of a tumor's location, the most common symptom is unexplained weight loss, which may be considerable. A large minority (between 35% and 47%) of people diagnosed with the disease will have had nausea, vomiting, or a feeling of weakness. Tumors in the head of the pancreas typically also cause jaundice, pain, loss of appetite, dark urine, and light-colored stools. Tumors in the body and tail typically also cause pain.[32]
People sometimes have recent onset of atypical type 2 diabetes that is difficult to control, a history of recent but unexplained blood vessel inflammation caused by blood clots (thrombophlebitis) known as Trousseau sign, or a previous attack of pancreatitis.[32] A doctor may suspect pancreatic cancer when the onset of diabetes in someone over 50 years old is accompanied by typical symptoms such as unexplained weight loss, persistent abdominal or back pain, indigestion, vomiting, or fatty feces.[12] Jaundice accompanied by a painlessly swollen gallbladder (known as Courvoisier's sign) may also raise suspicion, and can help differentiate pancreatic cancer from gallstones.[55]
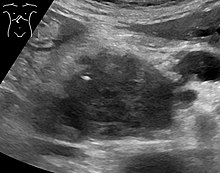
Medical imaging techniques, such as computed tomography (CT scan) and endoscopic ultrasound (EUS) are used both to confirm the diagnosis and to help decide whether the tumor can be surgically removed (its "resectability").[12] On contrast CT scan, pancreatic cancer typically shows a gradually increasing radiocontrast uptake, rather than a fast washout as seen in a normal pancreas or a delayed washout as seen in chronic pancreatitis.[56] Magnetic resonance imaging and positron emission tomography may also be used,[2] and magnetic resonance cholangiopancreatography may be useful in some cases.[32] Abdominal ultrasound is less sensitive and will miss small tumors, but can identify cancers that have spread to the liver and build-up of fluid in the peritoneal cavity (ascites).[12] It may be used for a quick and cheap first examination before other techniques.[57]

A biopsy by fine needle aspiration, often guided by endoscopic ultrasound, may be used where there is uncertainty over the diagnosis, but a histologic diagnosis is not usually required for removal of the tumor by surgery to go ahead.[12]
Liver function tests can show a combination of results indicative of bile duct obstruction (raised conjugated bilirubin, γ-glutamyl transpeptidase and alkaline phosphatase levels). CA19-9 (carbohydrate antigen 19.9) is a tumor marker that is frequently elevated in pancreatic cancer. However, it lacks sensitivity and specificity, not least because 5% of people lack the Lewis (a) antigen and cannot produce CA19-9. It has a sensitivity of 80% and specificity of 73% in detecting pancreatic adenocarcinoma, and is used for following known cases rather than diagnosis.[2][12]
Histopathology[edit]
The most common form of pancreatic cancer (adenocarcinoma) is typically characterized by moderately to poorly differentiated glandular structures on microscopic examination. There is typically considerable desmoplasia or formation of a dense fibrous stroma or structural tissue consisting of a range of cell types (including myofibroblasts, macrophages, lymphocytes and mast cells) and deposited material (such as type I collagen and hyaluronic acid). This creates a tumor microenvironment that is short of blood vessels (hypovascular) and so of oxygen (tumor hypoxia).[2] It is thought that this prevents many chemotherapy drugs from reaching the tumor, as one factor making the cancer especially hard to treat.[2][3]
| Cancer type | Relative incidence[11] | Microscopy findings[11] | Micrograph | Immunohistochemistry markers[11] | Genetic alterations[11] |
|---|---|---|---|---|---|
| Pancreatic ductal adenocarcinoma (PDAC) | 90% | Glands and desmoplasia | 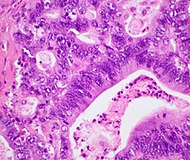 | ||
| Pancreatic acinar cell carcinoma (ACC) | 1% to 2% | Granular appearance | 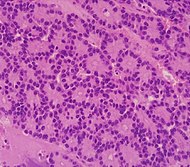 | ||
| Solid pseudopapillary tumor | Discohesive tumor nests surrounded by thin fibrous bands. |  Low and high magnification[58] | |||
| Adenosquamous carcinoma | 1% to 4%[59] | Combination of gland-like cells and squamous epithelial cells. |  | Positive for: Negative for: | |
| Pancreatic neuroendocrine tumor | 5% | Multiple nests of tumor cells | 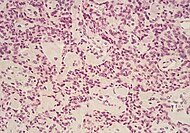 | ||
| Pre-cancer below for comparison: | |||||
| Precancer: Intraductal papillary mucinous neoplasm (IPMN) | 3% | Mucinous epithelial cells.[60] Growth within the pancreatic ducts.[61] | 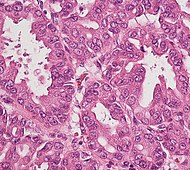 | ||
Staging[edit]
Exocrine cancers[edit]
Pancreatic cancer is usually staged following a CT scan.[32] The most widely used cancer staging system for pancreatic cancer is the one formulated by the American Joint Committee on Cancer (AJCC) together with the Union for International Cancer Control (UICC). The AJCC-UICC staging system designates four main overall stages, ranging from early to advanced disease, based on TNM classification of Tumor size, spread to lymph Nodes, and Metastasis.[62]
To help decide treatment, the tumors are also divided into three broader categories based on whether surgical removal seems possible: in this way, tumors are judged to be "resectable", "borderline resectable", or "unresectable".[63] When the disease is still in an early stage (AJCC-UICC stages I and II), without spread to large blood vessels or distant organs such as the liver or lungs, surgical resection of the tumor can normally be performed, if the patient is willing to undergo this major operation and is thought to be sufficiently fit.[12]
The AJCC-UICC staging system allows distinction between stage III tumors that are judged to be "borderline resectable" (where surgery is technically feasible because the celiac axis and superior mesenteric artery are still free) and those that are "unresectable" (due to more locally advanced disease); in terms of the more detailed TNM classification, these two groups correspond to T3 and T4 respectively.[3]
- Pancreatic cancer staging (TNM classification)
- Stage T1 pancreatic cancer
- Stage T2 pancreatic cancer
- Stage T3 pancreatic cancer
- Stage T4 pancreatic cancer
- Pancreatic cancer in nearby lymph nodes – Stage N1

Locally advanced adenocarcinomas have spread into neighboring organs, which may be any of the following (in roughly decreasing order of frequency): the duodenum, stomach, transverse colon, spleen, adrenal gland, or kidney. Very often they also spread to the important blood or lymphatic vessels and nerves that run close to the pancreas, making surgery far more difficult. Typical sites for metastatic spread (stage IV disease) are the liver, peritoneal cavity and lungs, all of which occur in 50% or more of fully advanced cases.[64]
PanNETs[edit]
The 2010 WHO classification of tumors of the digestive system grades all the pancreatic neuroendocrine tumors (PanNETs) into three categories, based on their degree of cellular differentiation (from "NET G1" through to the poorly differentiated "NET G3").[22] The U.S. National Comprehensive Cancer Network recommends use of the same AJCC-UICC staging system as pancreatic adenocarcinoma.[65]: 52 Using this scheme, the stage-by-stage outcomes for PanNETs are dissimilar to those of the exocrine cancers.[66] A different TNM system for PanNETs has been proposed by the European Neuroendocrine Tumor Society.[22]
Prevention and screening[edit]
Apart from not smoking, the American Cancer Society recommends keeping a healthy weight, and increasing consumption of fruits, vegetables, and whole grains, while decreasing consumption of red and processed meat, although there is no consistent evidence this will prevent or reduce pancreatic cancer specifically.[67] A 2014 review of research concluded that there was evidence that consumption of citrus fruits and curcumin reduced risk of pancreatic cancer, while there was possibly a beneficial effect from whole grains, folate, selenium, and non-fried fish.[47]
In the general population, screening of large groups is not considered effective and may be harmful as of 2019,[68] although newer techniques, and the screening of tightly targeted groups, are being evaluated.[69][70] Nevertheless, regular screening with endoscopic ultrasound and MRI/CT imaging is recommended for those at high risk from inherited genetics.[4][57][70][71]
A 2019 meta-analysis found that use of aspirin might be negatively associated with the incidence risk of pancreatic cancer, but found no significant relationship with pancreatic cancer mortality.[72]
Management[edit]
Exocrine cancer[edit]
A key assessment that is made after diagnosis is whether surgical removal of the tumor is possible (see Staging), as this is the only cure for this cancer. Whether or not surgical resection can be offered depends on how much the cancer has spread. The exact location of the tumor is also a significant factor, and CT can show how it relates to the major blood vessels passing close to the pancreas. The general health of the person must also be assessed, though age in itself is not an obstacle to surgery.[3]
Chemotherapy and, to a lesser extent, radiotherapy are likely to be offered to most people, whether or not surgery is possible. Specialists advise that the management of pancreatic cancer should be in the hands of a multidisciplinary team including specialists in several aspects of oncology, and is, therefore, best conducted in larger centers.[2][3]
Surgery[edit]

Surgery with the intention of a cure is only possible in around one-fifth (20%) of new cases.[12] Although CT scans help, in practice it can be difficult to determine whether the tumor can be fully removed (its "resectability"), and it may only become apparent during surgery that it is not possible to successfully remove the tumor without damaging other vital tissues. Whether or not surgical resection can be offered depends on various factors, including the precise extent of local anatomical adjacency to, or involvement of, the venous or arterial blood vessels,[2] as well as surgical expertise and a careful consideration of projected post-operative recovery.[73][74] The age of the person is not in itself a reason not to operate, but their general performance status needs to be adequate for a major operation.[12]
Одной из особенностей, которая оценивается, является обнадеживающее наличие или обескураживающее отсутствие прозрачного слоя или плоскости жира, создающего барьер между опухолью и сосудами. [3] Традиционно оценивают близость опухоли к крупным венозным или артериальным сосудам с точки зрения «прилегания» (определяется как опухоль, касающаяся не более половины окружности кровеносного сосуда без жировой оболочки, разделяющей ее), «оболочки» (когда опухоль охватывает большую часть окружности сосуда) или полное поражение сосуда. [75] : 22 В некоторых случаях возможна резекция, включающая покрытые оболочкой участки кровеносных сосудов. [76] [77] особенно если предварительная неоадъювантная терапия , возможна [78] [79] [80] с помощью химиотерапии [74] [75] : 36 [81] и/или лучевая терапия. [75] : 29–30
Даже если операция кажется успешной, раковые клетки часто обнаруживаются по краям (« краям ») удаленной ткани, когда патологоанатом исследует их под микроскопом (это всегда будет сделано), что указывает на то, что рак не был полностью удален. . [2] Более того, раковые стволовые клетки обычно не обнаруживаются под микроскопом, а если они и присутствуют, то могут продолжать развиваться и распространяться. [82] [83] Поэтому может быть выполнена исследовательская лапароскопия (небольшая хирургическая процедура под контролем камеры), чтобы получить более четкое представление о результате полноценной операции. [84]

При раке головки поджелудочной железы операция Уиппла является наиболее распространенным методом радикального хирургического лечения. Это серьезная операция, которая включает совместное удаление головки поджелудочной железы и изгиба двенадцатиперстной кишки («панкреатодуоденэктомия»), создание обходного пути для поступления пищи из желудка в тощую кишку («гастроеюностомия») и наложение петли тощей кишки. в пузырный проток для оттока желчи («холецисто-еюностомия»). Его можно выполнить только в том случае, если человек с большой вероятностью переживет серьезную операцию и если рак локализован, не прорастая в местные структуры и не метастазируя. Поэтому его можно выполнить лишь в меньшинстве случаев. Рак хвоста поджелудочной железы можно удалить с помощью процедуры, известной как дистальная панкреатэктомия , которая часто также влечет за собой удаление селезенки . [2] [3] Сегодня это часто можно сделать с помощью малоинвазивной хирургии . [2] [3]
Хотя лечебная хирургия больше не вызывает столь высоких показателей смертности, как это было до 1980-х годов, значительная часть людей (около 30–45%) по-прежнему нуждается в лечении от послеоперационных заболеваний, не вызванных самим раком. Наиболее частым осложнением операции является затруднение опорожнения желудка. [3] Для облегчения симптомов также можно использовать некоторые более ограниченные хирургические процедуры (см. Паллиативная помощь ): например, если рак прорастает или сдавливает двенадцатиперстную или толстую кишку . В таких случаях шунтирование может преодолеть обструкцию и улучшить качество жизни, но не предназначено для лечения. [12]
Химиотерапия [ править ]
После операции может быть предложена адъювантная химиотерапия гемцитабином или 5-ФУ , если человек достаточно здоров , после периода восстановления продолжительностью от одного до двух месяцев. [4] [57] У людей, не подходящих для радикальной хирургии, химиотерапия может использоваться для продления жизни или улучшения ее качества . [3] Перед операцией ), можно использовать неоадъювантную химиотерапию или химиолучевую терапию в случаях, которые считаются «пограничными резектабельными» (см. Стадирование , чтобы снизить рак до уровня, при котором хирургическое вмешательство может оказаться полезным. В других случаях неоадъювантная терапия остается спорной, поскольку откладывает хирургическое вмешательство. [3] [4] [85]
США Гемцитабин был одобрен Управлением по контролю за продуктами и лекарствами (FDA) в 1997 году после того, как клинические испытания показали улучшение качества жизни и пятинедельное улучшение средней продолжительности жизни у людей с распространенным раком поджелудочной железы. [86] Это был первый химиотерапевтический препарат, одобренный FDA в первую очередь для конечной точки клинического исследования, не связанной с выживанием. [87] Химиотерапия с использованием только гемцитабина была стандартом в течение примерно десяти лет, поскольку ряд испытаний, в которых тестировалась его комбинация с другими препаратами, не продемонстрировали значительно лучших результатов. Однако было обнаружено, что комбинация гемцитабина с эрлотинибом незначительно увеличивает выживаемость, и в 2005 году FDA лицензировало эрлотиниб для применения при раке поджелудочной железы. [88]
Схема FOLFIRINOX химиотерапии с использованием четырех препаратов оказалась более эффективной, чем гемцитабин, но с существенными побочными эффектами и поэтому подходит только для людей с хорошим физическим состоянием. Это также относится к связанному с белком паклитакселу (наб-паклитакселу), который был лицензирован FDA в 2013 году для использования с гемцитабином при раке поджелудочной железы. [89] К концу 2013 года и FOLFIRINOX, и наб-паклитаксел с гемцитабином считались хорошим выбором для тех, кто способен переносить побочные эффекты, а гемцитабин оставался эффективным вариантом для тех, кто этого не делал. Ожидается прямое испытание двух новых вариантов, а испытания по изучению других вариантов продолжаются. Однако изменения последних нескольких лет увеличили время выживания лишь на несколько месяцев. [86] Клинические испытания часто проводятся для новых адъювантных методов лечения. [4]
терапия Лучевая
Роль лучевой терапии как вспомогательного (адъювантного) лечения после потенциально излечивающего хирургического вмешательства вызывает споры с 1980-х годов. [3] В начале 2000-х годов Европейская исследовательская группа по исследованию рака поджелудочной железы ( ESPAC ) продемонстрировала прогностическое превосходство адъювантной химиотерапии над химиолучевой терапией. [90] [91] [4] Европейское общество медицинской онкологии рекомендует использовать адъювантную лучевую терапию только для людей, участвующих в клинических исследованиях. [57] Тем не менее, сохраняется тенденция к тому, что врачи в США более готовы использовать адъювантную лучевую терапию, чем врачи в Европе. Многие клинические испытания, начиная с 1980-х годов, проверяли различные комбинации лечения, но не смогли окончательно решить этот вопрос. [3] [4]
Лучевая терапия может стать частью лечения, направленного на уменьшение опухоли до резектабельного состояния, но ее использование при неоперабельных опухолях остается спорным, поскольку существуют противоречивые результаты клинических испытаний. Предварительные результаты одного исследования, представленные в 2013 году, «заметно снизили энтузиазм» по поводу его использования при местно-распространенных опухолях. [2]
Пансети [ править ]
Лечение PanNET, включая менее распространенные злокачественные типы, может включать ряд подходов. [65] [92] [93] [94] Некоторые небольшие опухоли размером менее 1 см. которые идентифицируются случайно, например, при компьютерной томографии, выполненной для других целей, может сопровождаться бдительным ожиданием . [65] Это зависит от предполагаемого риска хирургического вмешательства, на который влияет расположение опухоли и наличие других медицинских проблем . [65] Опухоли только в поджелудочной железе (локализованные опухоли) или с ограниченными метастазами, например в печень, могут быть удалены хирургическим путем. Тип операции зависит от локализации опухоли и степени распространения на лимфатические узлы. [22]
Для локализованных опухолей хирургическая процедура может быть гораздо менее обширной, чем виды хирургического вмешательства, используемые для лечения аденокарциномы поджелудочной железы, описанные выше, но в остальном хирургические процедуры аналогичны таковым для экзокринных опухолей. Диапазон возможных результатов сильно различается; некоторые типы имеют очень высокую выживаемость после операции, в то время как другие имеют плохой прогноз. Поскольку все эти группы встречаются редко, в руководствах подчеркивается, что лечение должно проводиться в специализированном центре. [22] [29] Использование трансплантации печени может быть рассмотрено в некоторых случаях метастазирования в печень. [95]
При функционирующих опухолях препараты класса аналогов соматостатина , такие как октреотид , могут снизить чрезмерную выработку гормонов. [22] Ланреотид может замедлить рост опухоли. [96] Если опухоль не поддается хирургическому удалению и вызывает симптомы, таргетная терапия эверолимусом сунитинибом или может уменьшить симптомы и замедлить прогрессирование заболевания. [29] [97] [98] Стандартная цитотоксическая химиотерапия, как правило, не очень эффективна при PanNET, но может использоваться, когда другие медикаментозные методы лечения не могут предотвратить прогрессирование заболевания. [29] или при низкодифференцированном раке PanNET. [99]
Лучевая терапия иногда используется, если возникает боль из-за анатомического расширения, например, метастазов в кости. Некоторые PanNET поглощают определенные пептиды или гормоны, и эти PanNET могут реагировать на ядерной медициной терапию с помощью радиоактивно меченных пептидов или гормонов, таких как иобенгуан (йод-131-MIBG). [100] [101] [102] [103] радиочастотная абляция (РЧА), криоабляция и эмболизация печеночной артерии . Также могут использоваться [104] [105]
Паллиативная помощь [ править ]
Паллиативная помощь – это медицинская помощь, направленная на лечение симптомов серьезных заболеваний, таких как рак, и улучшение качества жизни. [106] Поскольку аденокарцинома поджелудочной железы обычно диагностируется после того, как она достигла поздней стадии, паллиативная помощь как лечение симптомов часто является единственным возможным лечением. [107]
Паллиативная помощь направлена не на лечение основного рака, а на лечение таких симптомов, как боль или тошнота, и может помочь в принятии решений, в том числе о том, когда и ли хосписная помощь полезной. будет [108] Боль можно контролировать с помощью лекарств, таких как опиоиды , или путем процедурного вмешательства путем блокады нерва чревного сплетения (CPB). Это изменяет или, в зависимости от используемой техники, разрушает нервы, передающие боль из живота. CPB — безопасный и эффективный способ уменьшить боль, который обычно снижает необходимость использования опиоидных обезболивающих, которые имеют значительные негативные побочные эффекты. [3] [109]
Другими симптомами или осложнениями, которые можно лечить с помощью паллиативной хирургии, являются обструкция опухолью кишечника или желчных протоков . небольшую металлическую трубку, называемую стентом можно вставить В последнем случае, который встречается более чем в половине случаев, с помощью эндоскопа , чтобы обеспечить дренирование протоков. [32] Паллиативная помощь также может помочь в лечении депрессии, которая часто сопровождается диагнозом рака поджелудочной железы. [3]
Как хирургическое вмешательство, так и распространенные неоперабельные опухоли часто приводят к расстройствам пищеварительной системы из-за недостатка экзокринных продуктов поджелудочной железы (экзокринная недостаточность). Их можно лечить, принимая панкреатин , который содержит произведенные ферменты поджелудочной железы, и его лучше всего принимать во время еды. [12] Затруднение опорожнения желудка (задержка опорожнения желудка) встречается часто и может стать серьезной проблемой, требующей госпитализации. Лечение может включать в себя различные подходы, включая дренирование желудка путем назогастральной аспирации и применение препаратов, называемых ингибиторами протонной помпы или H 2 антагонистами , которые снижают выработку желудочной кислоты . [12] такие лекарства, как метоклопрамид Для очистки содержимого желудка также можно использовать .
Результаты [ править ]
| Клиническая стадия | Пятилетняя выживаемость в США (%) для диагнозов 1992–1998 гг. | |
|---|---|---|
| Экзокринный рак поджелудочной железы | Нейроэндокринное лечение хирургическим путем | |
| ИТ/Я | 14 | 61 |
| ИБ | 12 | |
| II | 7 | 52 |
| МИБ | 5 | |
| III | 3 | 41 |
| IV | 1 | 16 |
Аденокарцинома поджелудочной железы и другие менее распространенные экзокринные виды рака имеют очень плохой прогноз , поскольку они обычно диагностируются на поздней стадии, когда рак уже локально распространен или распространился на другие части тела. [2] Результаты PanNET намного лучше: многие из них доброкачественные и полностью лишены клинических симптомов, и даже в тех случаях, которые не поддаются хирургическому лечению, средняя пятилетняя выживаемость составляет 16%. [63] хотя внешний вид значительно варьируется в зависимости от типа. [31]
Для местно-распространенной и метастатической аденокарциномы поджелудочной железы, которые в совокупности составляют более 80% случаев, многочисленные исследования, сравнивающие режимы химиотерапии, показали увеличение времени выживаемости, но не более одного года. [2] [86] Общая пятилетняя выживаемость при раке поджелудочной железы в США улучшилась с 2% в случаях, диагностированных в 1975–1977 годах, и 4% в случаях диагнозов 1987–1989 годов, до 6% в 2003–2009 годах. [110] В менее чем 20% случаев аденокарциномы поджелудочной железы с диагнозом локализованного и небольшого ракового образования (менее 2 см на стадии Т1) около 20% американцев доживают до пяти лет. [19]
Около 1500 генов связаны с исходами аденокарциномы поджелудочной железы. К ним относятся как неблагоприятные гены, высокая экспрессия которых связана с плохим исходом, например C-Met и MUC-1 , так и благоприятные гены, высокая экспрессия которых связана с лучшей выживаемостью, например фактор транскрипции PELP1 . [51] [52]
Распространение [ править ]

В 2015 году рак поджелудочной железы всех типов стал причиной 411 600 смертей во всем мире. [8] Ожидается, что в 2014 году примерно у 46 000 человек в США будет диагностирован рак поджелудочной железы и 40 000 умрут от него. [2] Хотя на него приходится лишь 2,5% новых случаев, рак поджелудочной железы является причиной 6% смертей от рака каждый год. [111] Это седьмая по значимости причина смертности от рака в мире. [10] Рак поджелудочной железы является пятой по распространенности причиной смерти от рака в Соединенном Королевстве. [17] и третий по распространенности в Соединенных Штатах. [18]
В мировом масштабе рак поджелудочной железы занимает 11-е место среди наиболее распространенных видов рака у женщин и 12-е место среди мужчин. [10] Большинство зарегистрированных случаев приходится на развитые страны . [10] Жители США имеют средний риск развития этого заболевания в течение жизни примерно 1 из 67 (или 1,5%). [112] немного выше, чем показатель для Великобритании. [113] Заболевание чаще встречается у мужчин, чем у женщин, [2] [10] хотя за последние десятилетия разница в показателях сократилась, что, вероятно, отражает более ранний рост курения среди женщин. В Соединенных Штатах риск для афроамериканцев более чем на 50% выше, чем для белых , но показатели в Африке и Восточной Азии намного ниже, чем в Северной Америке или Европе. в США, Центральной и Восточной Европе, а также в Аргентине и Уругвае . Высокие показатели наблюдаются [10]
Пансети [ править ]
Ежегодная заболеваемость клинически распознаваемыми нейроэндокринными опухолями поджелудочной железы (ПанНЭО) невелика (около 5 на миллион человеко-лет) и преобладают нефункционирующие типы. [26] Считается, что где-то от 45% до 90% сетей PanNET относятся к нефункциональным типам. [22] [29] Исследования аутопсии довольно часто выявляли распространенность небольшие PanNET, что позволяет предположить, что опухолей , которые остаются инертными и бессимптомными, может быть относительно высокой. [29] Считается, что в целом PanNET составляют от 1 до 2% всех опухолей поджелудочной железы. [26] Определение и классификация PanNET со временем изменились, что повлияло на то, что известно об их эпидемиологии и клинической значимости. [53]
История [ править ]
Распознавание и диагностика [ править ]
Самое раннее признание рака поджелудочной железы приписывают итальянскому ученому XVIII века Джованни Баттисте Морганьи , историческому отцу современной анатомической патологии , который утверждал, что обнаружил несколько случаев рака поджелудочной железы. Многие врачи 18 и 19 веков скептически относились к существованию этого заболевания, учитывая схожесть панкреатита. Некоторые сообщения о случаях заболевания были опубликованы в 1820-х и 1830-х годах, а подлинный гистопатологический диагноз в конечном итоге был зафиксирован американским клиницистом Джейкобом Мендесом Да Костой , который также усомнился в достоверности интерпретаций Морганьи. К началу 20 века рак головки поджелудочной железы стал общепринятым диагнозом. [114]
Что касается распознавания PanNET, то возможность рака островковых клеток была первоначально предложена в 1888 году. Первый случай гиперинсулинизма из-за опухоли этого типа был зарегистрирован в 1927 году. Распознавание неинсулинсекретирующего типа PanNET обычно приписывается американским хирургам Р. М. Золлингеру и Э. Х. Эллисону, которые дали свои имена синдрому Золлингера-Эллисона , после постулирования существования гастрин-секретирующей опухоли поджелудочной железы в сообщении о двух случаях необычно тяжелых пептических язв, опубликованном в 1955 году. [114] В 2010 году ВОЗ рекомендовала называть PanNETs «нейроэндокринными», а не «эндокринными» опухолями. [28]
Небольшие предраковые новообразования при многих видах рака поджелудочной железы выявляются с гораздо большей частотой с помощью современной медицинской визуализации. Один тип, внутрипротоковое папиллярное муцинозное новообразование (ВПМН), был впервые описан японскими исследователями в 1982 году. В 2010 году было отмечено, что: «В течение следующего десятилетия этому сообщению уделялось мало внимания; однако в течение последующих 15 лет появились произошел настоящий взрыв в признании этой опухоли». [64]
Хирургия [ править ]
Первая зарегистрированная частичная панкреатодуоденэктомия была выполнена итальянским хирургом Алессандро Кодивиллой в 1898 году, но пациент прожил всего 18 дней, прежде чем скончался от осложнений. Ранние операции были скомпрометированы отчасти из-за ошибочного убеждения, что люди умрут, если удалить двенадцатиперстную кишку, а также, поначалу, если прекратится отток панкреатического сока. Позже считалось (также ошибочно), что проток поджелудочной железы можно просто перевязать без серьезных побочных эффектов; на самом деле, позже он очень часто будет протекать. В 1907–1908 годах, после еще нескольких неудачных операций других хирургов, французские хирурги опробовали экспериментальные процедуры на трупах. [115]
В 1912 году немецкий хирург Вальтер Кауш первым удалил большие части двенадцатиперстной кишки и поджелудочной железы вместе ( en bloc ). Это было в Бреслау, ныне Вроцлаве , в Польше. В 1918 году при операциях на собаках было продемонстрировано, что можно выжить даже после полного удаления двенадцатиперстной кишки, но в хирургии человека о таком результате не сообщалось до 1935 года, когда американский хирург Аллен Олдфатер Уиппл опубликовал результаты серии исследований. трех операций в пресвитерианской больнице Колумбии в Нью-Йорке. Только одному из пациентов полностью удалили двенадцатиперстную кишку, но он прожил два года, прежде чем умер от метастазов в печень.
Первая операция была незапланированной, так как рак обнаружили только в операционной. Успех Уиппла указал путь в будущее, но операция оставалась сложной и опасной до последних десятилетий. Он опубликовал несколько усовершенствований своей процедуры, в том числе первое полное удаление двенадцатиперстной кишки в 1940 году, но всего он выполнил всего 37 операций. [115]
Открытие в конце 1930-х годов того, что витамин К предотвращает кровотечение при желтухе , а также развитие переливания крови как повседневного процесса улучшили послеоперационную выживаемость. [115] но около 25% людей никогда не покидали больницу живыми даже в 1970-х годах. [116] В 1970-х годах группа американских хирургов написала письмо, в котором убеждала, что процедура слишком опасна и от нее следует отказаться. С тех пор результаты в более крупных центрах значительно улучшились, а смертность от операции часто составляет менее 4%. [24]
В 2006 году был опубликован отчет о серии из 1000 последовательных панкреатико-дуоденэктомий, выполненных одним хирургом из больницы Джонса Хопкинса в период с 1969 по 2003 год. Частота этих операций неуклонно росла за этот период, причем только три из них были проведены до 1980 года, и среднее время работы сократилось с 8,8 часов в 1970-х годах до 5,5 часов в 2000-х, а смертность в течение 30 дней или в больнице составила всего 1%. [115] [116] Другая серия из 2050 операций в Массачусетской больнице общего профиля в период с 1941 по 2011 год продемонстрировала аналогичную картину улучшения. [117]
Направления исследований [ править ]
Этот раздел необходимо обновить . ( май 2023 г. ) |
Исследования на ранней стадии рака поджелудочной железы включают изучение генетики и раннего выявления, лечения на различных стадиях рака, хирургических стратегий и таргетной терапии , такой как ингибирование факторов роста , иммунная терапия и вакцины . [42] [118] [119] [120] [121] Желчные кислоты могут играть роль в канцерогенезе рака поджелудочной железы. [122]
Ключевой вопрос заключается в сроках развития и прогрессирования заболевания, особенно в роли диабета . [118] [34] и как и когда распространяется болезнь. [123] Знание того, что новое начало диабета может быть ранним признаком заболевания, может способствовать своевременной диагностике и профилактике, если будет разработана работоспособная стратегия скрининга. [118] [34] [124] Исследование Европейского регистра наследственного панкреатита и семейного рака поджелудочной железы (EUROPAC) направлено на то, чтобы определить, подходит ли регулярный скрининг людям с семейным анамнезом этого заболевания. [125]
хирургия замочной скважины ( лапароскопия ), а не процедура Уиппла , особенно с точки зрения времени восстановления. Оценивается [126] Необратимая электропорация — относительно новый метод абляции , способный снизить стадию и продлить выживаемость у людей с местно-распространенным заболеванием, особенно при опухолях, расположенных вблизи перипанкреатических сосудов, без риска сосудистой травмы. [127] [128]
В настоящее время предпринимаются усилия по разработке новых лекарств, в том числе воздействующих на молекулярные механизмы возникновения рака. [129] [130] стволовые клетки , [83] и пролиферация клеток . [130] [131] Дальнейший подход предполагает использование иммунотерапии , например, онколитических вирусов . [132] Галектинспецифические механизмы микроокружения опухоли находятся в стадии изучения. [133]
Наночастицы способствуют устойчивому и целенаправленному высвобождению лекарственного препарата к участкам, специфичным для рака/опухоли, а не затрагивают здоровые клетки, что приводит к незначительной токсичности или ее отсутствию. [134]
См. также [ править ]
- Рак желудочно-кишечного тракта
- Сеть действий по борьбе с раком поджелудочной железы (организация в США)
- Фонд Люстгартена по исследованию рака поджелудочной железы (организация в США)
- Список людей с диагнозом рак поджелудочной железы
Ссылки [ править ]
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г «Версия для пациентов при лечении рака поджелудочной железы (PDQ®)» . Национальный институт рака. Национальные институты здравоохранения. 17 апреля 2014 года. Архивировано из оригинала 5 июля 2014 года . Проверено 8 июня 2014 г.
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в v В х и С аа аб и объявление но из Райан Д.П., Хонг Т.С., Бардиси Н. (сентябрь 2014 г.). «Аденокарцинома поджелудочной железы». Медицинский журнал Новой Англии . 371 (11): 1039–49. дои : 10.1056/NEJMra1404198 . ПМИД 25207767 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в v В х и С аа аб и объявление но из в Вольфганг К.Л., Герман Дж.М., Лахеру Д.А., Кляйн А.П., Эрдек М.А., Фишман Е.К., Хрубан Р.Х. (сентябрь 2013 г.). «Недавние успехи в лечении рака поджелудочной железы» . CA: Журнал рака для врачей . 63 (5): 318–48. дои : 10.3322/caac.21190 . ПМЦ 3769458 . ПМИД 23856911 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я дж к Винсент А., Герман Дж., Шулик Р., Хрубан Р.Х., Гоггинс М. (август 2011 г.). «Рак поджелудочной железы» (PDF) . Ланцет . 378 (9791): 607–20. дои : 10.1016/S0140-6736(10)62307-0 . ПМК 3062508 . ПМИД 21620466 . Архивировано из оригинала (PDF) 12 января 2015 года.
- ↑ Перейти обратно: Перейти обратно: а б «Можно ли предотвратить рак поджелудочной железы?» . Американское онкологическое общество. 11 июня 2014 года. Архивировано из оригинала 13 ноября 2014 года . Проверено 13 ноября 2014 г.
- ↑ Перейти обратно: Перейти обратно: а б «Пятилетняя выживаемость при раке поджелудочной железы увеличивается до 12%» . ПАНКАН . 2023. Архивировано из оригинала 4 марта 2023 года . Проверено 3 марта 2023 г.
- ^ Вос Т., Аллен С., Арора М., Барбер Р.М., Бхутта З.А., Браун А. и др. (Сотрудники ГББ 2015 г. по заболеваемости и распространенности заболеваний и травм) (октябрь 2016 г.). «Глобальная, региональная и национальная заболеваемость, распространенность и количество лет жизни с инвалидностью по 310 заболеваниям и травмам, 1990–2015 гг.: систематический анализ для исследования глобального бремени болезней 2015 г.» . Ланцет . 388 (10053): 1545–1602. дои : 10.1016/S0140-6736(16)31678-6 . ПМК 5055577 . ПМИД 27733282 .
- ↑ Перейти обратно: Перейти обратно: а б с Ван Х., Нагави М., Аллен С., Барбер Р.М., Бхутта З.А., Картер А. и др. (GBD 2015 Смертность и причины смерти, сотрудники) (октябрь 2016 г.). «Глобальная, региональная и национальная продолжительность жизни, смертность от всех причин и смертность от конкретных причин по 249 причинам смерти, 1980–2015 гг.: систематический анализ для исследования глобального бремени болезней, 2015 г.» . Ланцет . 388 (10053): 1459–1544. дои : 10.1016/s0140-6736(16)31012-1 . ПМЦ 5388903 . ПМИД 27733281 .
- ^ «Что такое рак? Определение рака» . Национальный институт рака, Национальные институты здравоохранения. 7 марта 2014 года. Архивировано из оригинала 25 июня 2014 года . Проверено 5 декабря 2014 г.
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т Всемирный доклад о раке . Всемирная организация здравоохранения. 2014. Глава 5.7. ISBN 978-92-832-0429-9 .
- ↑ Перейти обратно: Перейти обратно: а б с д и Если иное не указано в графах, ссылка следующая: Пишвайан М.Ю., Броуди-младший (март 2017 г.). «Терапевтическое значение молекулярного подтипирования рака поджелудочной железы» . Онкология . 31 (3): 159–66, 168. PMID 28299752 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в v В Бонд-Смит Дж., Банга Н., Хаммонд Т.М., Имбер СиДжей (май 2012 г.). «Аденокарцинома поджелудочной железы». БМЖ . 344 (16 мая): e2476. дои : 10.1136/bmj.e2476 . ПМИД 22592847 . S2CID 206894869 .
- ^ «Проект рекомендации: Рак поджелудочной железы: скрининг» . Рабочая группа США по профилактическим услугам . Проверено 11 февраля 2019 г.
- ^ Ларссон, Южная Каролина; Волк, А. (2012). «Потребление красного и обработанного мяса и риск рака поджелудочной железы: метаанализ проспективных исследований» . Британский журнал рака . 106 (3): 603–607. дои : 10.1038/bjc.2011.585 . ПМЦ 3273353 . ПМИД 22240790 .
- ^ Рорманн, Сабина; и др. (2013). «Потребление мяса и рыбы и риск рака поджелудочной железы: результаты Европейского проспективного исследования рака и питания» . Международный журнал рака . 132 (3): 617–624. дои : 10.1002/ijc.27637 . ПМИД 22610753 . S2CID 2613568 .
- ^ Барду М., Ле Рэй I (декабрь 2013 г.). «Лечение рака поджелудочной железы: описательный обзор исследований экономической эффективности». Передовая практика и исследования в области клинической гастроэнтерологии . 27 (6): 881–92. дои : 10.1016/j.bpg.2013.09.006 . ПМИД 24182608 .
- ↑ Перейти обратно: Перейти обратно: а б «Факты и цифры о раке – Почему мы существуем» . Фонд исследования рака поджелудочной железы . Проверено 5 апреля 2019 г.
- ↑ Перейти обратно: Перейти обратно: а б «Рак поджелудочной железы – факты о статистике рака» . ПРОИДЧИК . Проверено 4 апреля 2019 г.
- ↑ Перейти обратно: Перейти обратно: а б «Лечение рака поджелудочной железы (PDQ®) Профессиональная версия» . Национальный институт рака. Национальные институты здравоохранения. 21 февраля 2014 года. Архивировано из оригинала 22 октября 2014 года . Проверено 24 ноября 2014 г. «Наивысший показатель излечения наблюдается, если опухоль действительно локализована в поджелудочной железе; однако на эту стадию заболевания приходится менее 20% случаев. В случаях с локализованным заболеванием и небольшими раковыми образованиями (<2 см) без метастазов в лимфатические узлы и отсутствие распространения за пределы капсулы поджелудочной железы, полная хирургическая резекция по-прежнему связана с низкой актуарной пятилетней выживаемостью — от 18% до 24%».
- ^ Ван Ю, Миллер Ф.Х., Чен Зе, Меррик Л., Мортеле К.Дж., Хофф Ф.Л.; и др. (2011). «Диффузионно-взвешенная МРТ солидных и кистозных поражений поджелудочной железы» . Рентгенография . 31 (3): Е47-64. дои : 10.1148/rg.313105174 . ПМИД 21721197 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) . Диаграмма Микаэля Хэггстрема, доктора медицинских наук. - ^ Харрис Р.Э. (2013). «Эпидемиология рака поджелудочной железы» . Эпидемиология хронических болезней . Джонс и Бартлетт. стр. 181–190. ISBN 978-0-7637-8047-0 . Архивировано из оригинала 24 июня 2016 года.
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г Оберг, К; Книгге, У; Квеккебум, Д; Перрен, А; и др. (Рабочая группа по рекомендациям ESMO) (октябрь 2012 г.). «Нейроэндокринные гастроэнтеропанкреатические опухоли: Клинические рекомендации ESMO по диагностике, лечению и наблюдению» . Анналы онкологии . 23 Приложение 7 (приложение 7): vii124-30. дои : 10.1093/annonc/mds295 . ПМИД 22997445 . ( В Таблице 5 представлена предлагаемая промежуточная система TNM для сетей PanNET.)
- ^ Справочник по раку поджелудочной железы . Нью-Йорк: Спрингер. 2009. с. 288. ИСБН 978-0-387-77497-8 . Архивировано из оригинала 10 сентября 2017 года . Проверено 12 июня 2016 г.
- ↑ Перейти обратно: Перейти обратно: а б Говиндан Р. (2011). Рак ДеВиты, Хеллмана и Розенберга: Рак: принципы и практика онкологии (9-е изд.). Липпинкотт Уильямс и Уилкинс. Глава 35: Рак поджелудочной железы: хирургическое лечение. ISBN 978-1-4511-0545-2 . Интернет-издание с обновлениями до 2014 г.
- ↑ Перейти обратно: Перейти обратно: а б с Тобиас Дж.С., Хоххаузер Д. (2014). Рак и его лечение (7-е изд.). Джон Уайли и сыновья. п. 297. ИСБН 978-1-118-46871-5 .
- ↑ Перейти обратно: Перейти обратно: а б с «Виды опухолей поджелудочной железы» . Исследовательский центр рака поджелудочной железы Сола Голдмана . Медицина Джонса Хопкинса. 2012. Архивировано из оригинала 8 октября 2014 года . Проверено 18 ноября 2014 г.
- ^ Фаррелл Джей Джей, Фернандес-дель Кастильо С (июнь 2013 г.). «Кистозные новообразования поджелудочной железы: лечение и вопросы без ответа». Гастроэнтерология . 144 (6): 1303–15. дои : 10.1053/j.gastro.2013.01.073 . ПМИД 23622140 .
- ↑ Перейти обратно: Перейти обратно: а б с Обозначение PanNET соответствует рекомендациям ВОЗ по классификации опухолей пищеварительной системы. «Классификация ВОЗ опухолей пищеварительной системы – Каталог NLM – NCBI» . Архивировано из оригинала 9 сентября 2017 года . Проверено 7 сентября 2017 г. опубликовано в 2010 году. Исторически PanNET также обозначались различными терминами, и их до сих пор обычно называют «эндокринными опухолями поджелудочной железы». Видеть: Климстра Д.С., Модлин И.Р., Коппола Д., Ллойд Р.В., Састер С. (август 2010 г.). «Патологическая классификация нейроэндокринных опухолей: обзор номенклатуры, классификации и систем стадирования» . Поджелудочная железа . 39 (6): 707–12. дои : 10.1097/MPA.0b013e3181ec124e . ПМИД 20664470 . S2CID 3735444 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час Бернс В.Р., Эдил Б.Х. (март 2012 г.). «Нейроэндокринные опухоли поджелудочной железы: рекомендации по лечению и обновлению». Современные возможности лечения онкологии . 13 (1): 24–34. дои : 10.1007/s11864-011-0172-2 . ПМИД 22198808 . S2CID 7329783 .
- ^ Система индексации медицинских предметных рубрик относится к «карциноме островковых клеток», которая подразделяется на гастриному, глюкагоному , соматостатиному и випому . См.: Дерево MeSH 2014 г. в разделе «Новообразования поджелудочной железы [C04.588.322.475]». Архивировано 19 марта 2016 г. в Wayback Machine 16 октября 2014 г.
- ↑ Перейти обратно: Перейти обратно: а б «Опухоли островковых клеток поджелудочной железы / Эндокринные новообразования поджелудочной железы» . Исследовательский центр рака поджелудочной железы Сола Голдмана . Медицина Джонса Хопкинса. 2012. Архивировано из оригинала 5 января 2015 года . Проверено 5 января 2015 г.
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г Де Ла Круз М.С., Янг А.П., Раффин М.Т. (апрель 2014 г.). «Диагностика и лечение рака поджелудочной железы». Американский семейный врач . 89 (8): 626–32. ПМИД 24784121 .
- ↑ Перейти обратно: Перейти обратно: а б Альбертс С.Р., Голдберг Р.М. (2009). «Глава 9: Рак желудочно-кишечного тракта» . В Casciato DA, Territo MC (ред.). Руководство по клинической онкологии . Липпинкотт Уильямс и Уилкинс. стр. 188–236 . ISBN 978-0-7817-6884-9 .
- ↑ Перейти обратно: Перейти обратно: а б с Паннала Р., Басу А., Петерсен ГМ, Чари С.Т. (январь 2009 г.). «Новый диабет: потенциальный ключ к ранней диагностике рака поджелудочной железы» . «Ланцет». Онкология . 10 (1): 88–95. дои : 10.1016/S1470-2045(08)70337-1 . ПМК 2795483 . ПМИД 19111249 .
- ^ «Глава 15. Поджелудочная железа» (PDF) . Руководство по стадированию рака (2-е изд.). Американский объединенный комитет по раку. стр. 95–98. Архивировано (PDF) оригинала 29 ноября 2014 г. См. стр. 95 за цитату о «... меньшей степени поражения костей, мозга и других анатомических участков».
- ^ Сперти С, Молетта Л, Патане Дж (октябрь 2014 г.). «Метастатические опухоли поджелудочной железы: роль хирургии» . Всемирный журнал желудочно-кишечной онкологии . 6 (10): 381–92. дои : 10.4251/wjgo.v6.i10.381 . ПМЦ 4197429 . ПМИД 25320654 .
- ^ «Причины рака поджелудочной железы» . Выбор Национальной службы здравоохранения . Национальная служба здравоохранения Англии. 7 октября 2014 года. Архивировано из оригинала 6 ноября 2014 года . Проверено 5 декабря 2014 г.
- ^ Андерсон, Лаура Н.; Коттерчио, Мишель; Галлинджер, Стивен (5 февраля 2009 г.). «Факторы образа жизни, питания и истории болезни, связанные с риском рака поджелудочной железы в Онтарио, Канада» . Причины рака и борьба с ним . 20 (6): 825–34. дои : 10.1007/s10552-009-9303-5 . ISSN 0957-5243 . ПМК 3907069 . ПМИД 19194662 .
- ^ Бозетти С., Лусентефорте Е., Сильверман Д.Т., Петерсен Г., Браччи П.М., Джи Б.Т. и др. (июль 2012 г.). «Курение сигарет и рак поджелудочной железы: анализ Международного консорциума по контролю случаев рака поджелудочной железы (Panc4)» . Анналы онкологии . 23 (7): 1880–88. дои : 10.1093/annonc/mdr541 . ПМЦ 3387822 . ПМИД 22104574 .
- ^ Де Рубейс, Ванесса; Коттерчио, Мишель; Смит, Брендан Т.; Гриффит, Лорен Э.; Боргида, Айелет; Галлинджер, Стивен; Клири, Шон; Андерсон, Лаура Н. (1 сентября 2019 г.). «Траектории индекса массы тела от подросткового возраста до старшего взрослого возраста и риск рака поджелудочной железы; популяционное исследование случай-контроль в Онтарио, Канада» . Причины рака и борьба с ним . 30 (9): 955–66. дои : 10.1007/s10552-019-01197-9 . ISSN 1573-7225 . ПМК 6685923 . ПМИД 31230151 .
- ^ Петерс М.Л., Ценг Дж.Ф., Миксад Р.А. (июль 2016 г.). «Генетическое тестирование аденокарциномы протоков поджелудочной железы: значение для профилактики и лечения» . Клиническая терапия . 38 (7): 1622–35. doi : 10.1016/j.clinthera.2016.03.006 . ПМИД 27041411 .
- ↑ Перейти обратно: Перейти обратно: а б с Резник Р., Хендифар А.Е., Тули Р. (2014). «Генетические детерминанты и потенциальные терапевтические мишени аденокарциномы поджелудочной железы» . Границы в физиологии . 5 : 87. doi : 10.3389/fphys.2014.00087 . ПМЦ 3939680 . ПМИД 24624093 .
- ^ Гринхалф В., Грокок С., Харкус М., Неоптолемос Дж. (май 2009 г.). «Скрининг семей высокого риска по раку поджелудочной железы». Панкреатология . 9 (3): 215–22. дои : 10.1159/000210262 . ПМИД 19349734 . S2CID 29100310 .
- ^ Вентури, Себастьяно (январь 2021 г.). «Цезий в биологии, рак поджелудочной железы и противоречия в отношении ущерба от высокого и низкого радиационного воздействия — научные, экологические, геополитические и экономические аспекты» . Международный журнал экологических исследований и общественного здравоохранения . 18 (17): 8934. doi : 10.3390/ijerph18178934 . ПМЦ 8431133 . ПМИД 34501532 .
 Текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
Текст был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 . - ↑ Перейти обратно: Перейти обратно: а б «Факты и цифры о раке, 2014 г.» (PDF) . Американское онкологическое общество . Архивировано (PDF) из оригинала 18 декабря 2014 года . Проверено 5 января 2015 г. , с. 19: «Хотя доказательства все еще накапливаются, потребление красного или обработанного мяса, а также мяса, приготовленного при очень высоких температурах, может немного увеличить риск».
- ^ Ларссон СК, Волк А (январь 2012 г.). «Потребление красного и обработанного мяса и риск рака поджелудочной железы: метаанализ проспективных исследований» . Британский журнал рака . 106 (3): 603–07. дои : 10.1038/bjc.2011.585 . ПМЦ 3273353 . ПМИД 22240790 .
- ↑ Перейти обратно: Перейти обратно: а б Периклеус М., Росси Р.Э., Мандаир Д., Уайанд Т., Кэплин М.Е. (январь 2014 г.). «Питание и рак поджелудочной железы». Противораковые исследования . 34 (1): 9–21. ПМИД 24403441 .
- ^ Хакенг В.М., Хрубан Р.Х., Офферхаус Г.Дж., Бросенс Л.А. (2016). «Хирургическая и молекулярная патология новообразований поджелудочной железы» . Диагностика Патол . 11 (1): 47. дои : 10.1186/s13000-016-0497-z . ПМЦ 4897815 . ПМИД 27267993 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) (распространяется на условиях международной лицензии Creative Commons Attribution 4.0 ( http://creativecommons.org/licenses/by/4.0/ )), название изображения и оптимизация: Микаэль Хэггстрем , доктор медицинских наук - ^ Дельпу Ю., Ханун Н., Лулка Х., Сикард Ф., Селвес Дж., Бускейл Л. и др. (март 2011 г.). «Генетические и эпигенетические изменения в канцерогенезе поджелудочной железы» . Современная геномика . 12 (1): 15–24. дои : 10.2174/138920211794520132 . ПМК 3129039 . ПМИД 21886451 .
- ^ Руни С.Л., Ши Дж. (октябрь 2016 г.). «Внутрипротоковая тубулопапиллярная опухоль поджелудочной железы: обновленная информация с точки зрения патологоанатома» . Архивы патологии и лабораторной медицины . 140 (10): 1068–73. дои : 10.5858/arpa.2016-0207-RA . ПМИД 27684978 .
- ↑ Перейти обратно: Перейти обратно: а б «Протеом патологии человека при раке поджелудочной железы - Атлас белков человека» . www.proteinatlas.org . Проверено 28 сентября 2017 г.
- ↑ Перейти обратно: Перейти обратно: а б Улен М., Чжан С., Ли С., Сьёстедт Е., Фагерберг Л., Бидхори Г. и др. (август 2017 г.). «Атлас патологии транскриптома рака человека» . Наука . 357 (6352): eaan2507. дои : 10.1126/science.aan2507 . ПМИД 28818916 .
- ↑ Перейти обратно: Перейти обратно: а б Льюис М.А., Яо Дж.К. (февраль 2014 г.). «Молекулярная патология и генетика нейроэндокринных опухолей желудочно-кишечного тракта». Современное мнение в эндокринологии, диабете и ожирении . 21 (1): 22–27. doi : 10.1097/MED.0000000000000033 . ПМИД 24310147 . S2CID 31094880 .
- ^ Таккер Р.В., Ньюи П.Дж., Уоллс Г.В., Билезикян Дж., Дралле Х., Эбелинг П.Р. и др. (сентябрь 2012 г.). «Клинические рекомендации по множественным эндокринным неоплазиям 1 типа (МЭН1)» . Журнал клинической эндокринологии и метаболизма . 97 (9): 2990–3011. дои : 10.1210/jc.2012-1230 . ПМИД 22723327 .
- ^ Фицджеральд Дж. Э., Уайт М. Дж., Лобо Д. Н. (апрель 2009 г.). «Желчный пузырь Курвуазье: закон или знак?». Всемирный журнал хирургии . 33 (4): 886–91. дои : 10.1007/s00268-008-9908-y . ПМИД 19190960 . S2CID 21799234 .
- ^ Пирака С., Шейман Дж. М. (сентябрь 2011 г.). «Новые методы диагностической визуализации заболеваний поджелудочной железы». Современное мнение в гастроэнтерологии . 27 (5): 475–80. дои : 10.1097/MOG.0b013e328349e30c . ПМИД 21743318 . S2CID 38963685 .
- ↑ Перейти обратно: Перейти обратно: а б с д Сойферляйн Т., Баше Дж.Б., Ван Катсем Э., Ружье П. (октябрь 2012 г.). «Аденокарцинома поджелудочной железы: Клинические практические рекомендации ESMO-ESDO по диагностике, лечению и наблюдению» . Анналы онкологии . 23 (Приложение 7): vii33–40. дои : 10.1093/annonc/mds224 . ПМИД 22997452 .
- ↑ Перейти обратно: Перейти обратно: а б с д Изображение Микаэля Хэггстрема, доктора медицинских наук.
Ссылка на функции: Пуджа Навале, доктор медицинских наук, Омид Савари, доктор медицинских наук, Джозеф Ф. Томашефски-младший, доктор медицинских наук, Моника Вьяс, доктор медицинских наук «Солидное псевдопапиллярное новообразование» .{{cite web}}: CS1 maint: несколько имен: список авторов ( ссылка ) Последнее обновление автора: 4 марта 2022 г. - ^ Скафида Е., Грамматоглу Х., Глава С., Зиссис Д., Паскалидис Н., Кацамагку Е. и др. (февраль 2010 г.). «Аденосквамозный рак поджелудочной железы: клинический случай» . Журнал дел . 3 (1): 41. дои : 10.1186/1757-1626-3-41 . ПМЦ 2825199 . ПМИД 20205828 .
- ^ Диана Агостини-Вулай. «Поджелудочная железа – Экзокринные опухоли/карциномы – Внутрипротоковое папиллярное муцинозное новообразование (ВПМН)» . Очертания патологии . Тема завершена: 1 июля 2018 г. Отредактирована: 9 марта 2020 г.
- ^ Адсай В., Мино-Кенудсон М., Фурукава Т., Бастурк О., Замбони Г., Марчегиани Г. и др. (январь 2016 г.). «Патологическая оценка и отчетность о внутрипротоковых папиллярных муцинозных новообразованиях поджелудочной железы и других опухолевых интраэпителиальных новообразованиях панкреатобилиарного тракта: рекомендации Веронского консенсусного совещания» . Анналы хирургии . 263 (1): 162–77. doi : 10.1097/SLA.0000000000001173 . ПМЦ 4568174 . ПМИД 25775066 .
- ^ Касцину С., Фалькони М., Валентини В., Джелич С. (май 2010 г.). «Рак поджелудочной железы: Клинические практические рекомендации ESMO по диагностике, лечению и наблюдению» . Анналы онкологии . 21 Приложение 5 (Приложение 5): v55–58. дои : 10.1093/annonc/mdq165 . ПМИД 20555103 .
- ↑ Перейти обратно: Перейти обратно: а б с «Стадирование рака поджелудочной железы» . Американское онкологическое общество . 11 июня 2014 г. Архивировано из оригинала 10 августа 2020 г. . Проверено 29 сентября 2014 г.
- ↑ Перейти обратно: Перейти обратно: а б Жиромски, Нью-Джерси, Накиб А., Лиллемо К.Д. (2010). Зильберман Х., Зильберман А.В. (ред.). Принципы и практика хирургической онкологии: междисциплинарный подход к сложным проблемам (онлайн-изд.). Филадельфия: Уолтерс Клювер/Липпинкотт Уильямс и Уилкинс. Глава 35. ISBN 978-0-7817-6546-6 . Архивировано из оригинала 6 февраля 2015 года . Проверено 3 ноября 2014 г.
- ↑ Перейти обратно: Перейти обратно: а б с д «Нейроэндокринные опухоли, Рекомендации NCCN, версия 1.2015» (PDF) . Национальная комплексная онкологическая сеть, Inc. (NCCN). 11 ноября 2014 года . Проверено 25 декабря 2014 г.
- ^ Национальный институт рака. Лечение нейроэндокринных опухолей поджелудочной железы (опухолей островковых клеток) (PDQ®) Заболеваемость и смертность «Лечение нейроэндокринных опухолей поджелудочной железы (опухолей островковых клеток) (PDQ®) – версия для медицинских работников» . Архивировано из оригинала 4 января 2015 года . Проверено 29 декабря 2014 г.
- ^ «Диета и факторы активности, влияющие на риск развития некоторых видов рака: раздел рака поджелудочной железы» . Американское онкологическое общество . 20 августа 2012 года. Архивировано из оригинала 4 ноября 2014 года . Проверено 4 ноября 2014 г.
- ^ Оуэнс Д.К., Дэвидсон К.В., Крист А.Х., Барри М.Дж., Кабана М., Коги А.Б. и др. (август 2019 г.). «Скрининг рака поджелудочной железы: подтверждение рекомендаций Целевой группы профилактических служб США» . ДЖАМА . 322 (5): 438–44. дои : 10.1001/jama.2019.10232 . ПМИД 31386141 .
- ^ Хэ XY, Юань YZ (август 2014 г.). «Достижения в области исследований рака поджелудочной железы: движение к раннему выявлению» . Всемирный журнал гастроэнтерологии . 20 (32): 11241–48. дои : 10.3748/wjg.v20.i32.11241 . ПМЦ 4145762 . ПМИД 25170208 .
- ↑ Перейти обратно: Перейти обратно: а б Окано К., Сузуки Ю. (август 2014 г.). «Стратегии раннего выявления резектабельного рака поджелудочной железы» . Всемирный журнал гастроэнтерологии . 20 (32): 11230–40. дои : 10.3748/wjg.v20.i32.11230 . ПМЦ 4145761 . ПМИД 25170207 .
- ^ Гоггинс М., Овербик К.А., Брэнд Р., Сингал С., Дель Кьяро М., Барч Д.К. и др. (январь 2020 г.). «Ведение пациентов с повышенным риском семейного рака поджелудочной железы: обновленные рекомендации Международного консорциума по скринингу рака поджелудочной железы (CAPS)» . Гут . 69 (1): 7–17. дои : 10.1136/gutjnl-2019-319352 . ПМК 7295005 . ПМИД 31672839 .
- ^ Сан, Дж.; Ли, Ю.; Лю, Л.; Цзян, З.; Лю, Г. (2019). «Употребление аспирина и риск рака поджелудочной железы: систематический обзор наблюдательных исследований - PubMed» . Лекарство . 98 (51): e18033. дои : 10.1097/MD.0000000000018033 . ПМК 6940047 . ПМИД 31860953 .
- ^ Гурусами К.С., Кумар С., Дэвидсон Б.Р., Фусай Г. (февраль 2014 г.). «Резекция по сравнению с другими методами лечения местно-распространенного рака поджелудочной железы» . Кокрановская база данных систематических обзоров . 2 (2): CD010244. дои : 10.1002/14651858.CD010244.pub2 . ПМЦ 11095847 . ПМИД 24578248 .
- ↑ Перейти обратно: Перейти обратно: а б Моллберг Н., Рахбари Н.Н., Кох М., Хартвиг В., Хегер Ю., Бюхлер М.В., Вайц Дж. (декабрь 2011 г.). «Артериальная резекция во время панкреатэктомии при раке поджелудочной железы: систематический обзор и метаанализ». Анналы хирургии . 254 (6): 882–93. дои : 10.1097/SLA.0b013e31823ac299 . ПМИД 22064622 . S2CID 42685174 .
- ↑ Перейти обратно: Перейти обратно: а б с «Аденокарцинома поджелудочной железы. Рекомендации NCCN, версия 1.2015» (PDF) . Рекомендации NCCN . Национальная комплексная онкологическая сеть, Inc., 4 декабря 2014 г. Проверено 26 декабря 2014 г.
- ^ Аламо Х.М., Марин Л.М., Суарес Г., Берналь С., Серрано Дж., Баррера Л. и др. (октябрь 2014 г.). «Улучшение результатов лечения рака поджелудочной железы: ключевые моменты периоперационного ведения» . Всемирный журнал гастроэнтерологии . 20 (39): 14237–45. дои : 10.3748/wjg.v20.i39.14237 . ПМК 4202352 . ПМИД 25339810 .
- ^ Лопес Н.Е., Прендергаст К., Лоуи А.М. (август 2014 г.). «Пограничный резектабельный рак поджелудочной железы: определения и лечение» . Всемирный журнал гастроэнтерологии . 20 (31): 10740–51. дои : 10.3748/wjg.v20.i31.10740 . ПМК 4138454 . ПМИД 25152577 .
- ^ Полистина Ф, Ди Натале Дж, Бончарелли Дж, Амбросино Дж, Фрего М (июль 2014 г.). «Неоадъювантные стратегии лечения рака поджелудочной железы» . Всемирный журнал гастроэнтерологии . 20 (28): 9374–83. doi : 10.3748/wjg.v20.i28.9374 (неактивен 31 января 2024 г.). ПМК 4110569 . ПМИД 25071332 .
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на январь 2024 г. ( ссылка ) - ^ Гиллен С., Шустер Т., Мейер Цум Бюшенфельде С., Фрисс Х., Клефф Дж. (апрель 2010 г.). «Предоперационная/неоадъювантная терапия при раке поджелудочной железы: систематический обзор и метаанализ ответа и процентов резекции» . ПЛОС Медицина . 7 (4): e1000267. дои : 10.1371/journal.pmed.1000267 . ПМЦ 2857873 . ПМИД 20422030 .
- ^ Христиане К.К., Эванс Д.Б. (июнь 2015 г.). «Дополнительная поддержка неоадъювантной терапии при лечении рака поджелудочной железы» . Анналы хирургической онкологии . 22 (6): 1755–58. дои : 10.1245/s10434-014-4307-0 . ПМИД 25519932 .
- ^ Цветкова Е.В., Асмис Т.Р. (август 2014 г.). «Роль неоадъювантной терапии в лечении рака поджелудочной железы: наступила ли эра терапии, направленной на биомаркеры?» . Современная онкология . 21 (4): e650–7. дои : 10.3747/co.21.2006 . ПМК 4117630 . ПМИД 25089113 .
- ^ Чжан Х.С., Сюй Ю.В., Ву Д., Чжан Т.П., Ху С.Ю. (февраль 2015 г.). «Стволовые клетки рака поджелудочной железы: новый взгляд на упорную болезнь». Письма о раке . 357 (2): 429–37. дои : 10.1016/j.canlet.2014.12.004 . ПМИД 25499079 .
- ↑ Перейти обратно: Перейти обратно: а б Танасе С.П., Неагу А.И., Некула Л.Г., Мамбет С., Энчиу А.М., Каленик Б. и др. (август 2014 г.). «Раковые стволовые клетки: участие в патогенезе рака поджелудочной железы и перспективы лечения рака» . Всемирный журнал гастроэнтерологии . 20 (31): 10790–801. дои : 10.3748/wjg.v20.i31.10790 . ПМЦ 4138459 . ПМИД 25152582 .
- ^ Аллен В.Б., Гурусами К.С., Таквоинги Й., Калия А., Дэвидсон Б.Р. (июль 2016 г.). «Диагностическая точность лапароскопии после компьютерной томографии (КТ) для оценки резектабельности с лечебной целью при раке поджелудочной железы и периампулярном раке» . Кокрановская база данных систематических обзоров . 2016 (7): CD009323. дои : 10.1002/14651858.CD009323.pub3 . ПМК 6458011 . ПМИД 27383694 .
- ^ Хайнеманн В., Хаас М., Бек С. (октябрь 2013 г.). «Неоадъювантное лечение пограничного резектабельного и неоперабельного рака поджелудочной железы» . Анналы онкологии . 24 (10): 2484–92. дои : 10.1093/annonc/mdt239 . ПМИД 23852311 .
- ↑ Перейти обратно: Перейти обратно: а б с Тота Р., Пауф Дж. М., Берлин Дж. Д. (январь 2014 г.). «Лечение метастатической аденокарциномы поджелудочной железы: обзор». Онкология . 28 (1): 70–74. ПМИД 24683721 .
- ^ Райан Д.П. (8 июля 2014 г.). «Химиотерапия распространенного экзокринного рака поджелудочной железы: тема 2475, версия 46.0» (требуется подписка) . До настоящего времени . Уолтерс Клювер Здоровье . Архивировано из оригинала 8 декабря 2014 года . Проверено 18 ноября 2014 г.
- ^ «Информация о противораковых препаратах: одобрение FDA эрлотиниба гидрохлорида» . Национальный институт рака . Национальные институты здравоохранения. 3 июля 2013 года. Архивировано из оригинала 29 ноября 2014 года . Проверено 5 декабря 2014 г.
- ^ Боразанчи Э., Фон Хофф Д.Д. (сентябрь 2014 г.). «Наб-паклитаксел и гемцитабин для лечения больных метастатическим раком поджелудочной железы». Экспертный обзор гастроэнтерологии и гепатологии . 8 (7): 739–47. дои : 10.1586/17474124.2014.925799 . ПМИД 24882381 . S2CID 31633898 .
- ^ Неоптолемос, Дж. П.; Данн, Джа; Стокен, доктор медицинских наук; Алмонд, Дж; Линк, К; Бегер, Х; Басси, К; Фалькони, М; Педерзоли, П; Дервенис, К; Фернандес-Крус, L (ноябрь 2001 г.). «Адъювантная химиолучевая терапия и химиотерапия при резектабельном раке поджелудочной железы: рандомизированное контролируемое исследование» . Ланцет . 358 (9293): 1576–1585. дои : 10.1016/S0140-6736(01)06651-X . ПМИД 11716884 . S2CID 23803289 .
- ^ Неоптолемос, Джон П.; Стокен, Дебора Д.; Фрисс, Хельмут; Басси, Клаудио; Данн, Джанет А.; Хикки, Хелен; Бегер, Ганс; Фернандес-Крус, Лауреано; Дервенис, Христос; Лакэн, Франсуа; Фалькони, Массимо (18 марта 2004 г.). «Рандомизированное исследование химиолучевой терапии и химиотерапии после резекции рака поджелудочной железы» . Медицинский журнал Новой Англии . 350 (12): 1200–1210. doi : 10.1056/NEJMoa032295 . ISSN 0028-4793 . ПМИД 15028824 .
- ^ Фалькони М., Барч Д.К., Эрикссон Б., Клёппель Г., Лопес Дж.М., О'Коннор Дж.М. и др. (2012). «Консенсусные рекомендации ENETS по ведению пациентов с нейроэндокринными новообразованиями пищеварительной системы: высокодифференцированные нефункционирующие опухоли поджелудочной железы». Нейроэндокринология . 95 (2): 120–34. дои : 10.1159/000335587 . ПМИД 22261872 . S2CID 6985904 .
- ^ Дженсен Р.Т., Кадиот Дж., Брэнди М.Л., де Гердер В.В., Кальцас Г., Комминот П. и др. (2012). «Консенсусные рекомендации ENETS по ведению пациентов с нейроэндокринными новообразованиями пищеварительной системы: синдромы функциональных эндокринных опухолей поджелудочной железы» . Нейроэндокринология . 95 (2): 98–119. дои : 10.1159/000335591 . ПМК 3701449 . ПМИД 22261919 .
- ^ Павел М., Боден Э., Кувелард А., Креннинг Э., Оберг К., Штайнмюллер Т. и др. (2012). «Консенсусные рекомендации ENETS по ведению пациентов с печенью и другими отдаленными метастазами нейроэндокринных новообразований передней, средней и задней кишки и неизвестных первичных». Нейроэндокринология . 95 (2): 157–76. дои : 10.1159/000335597 . ПМИД 22262022 . S2CID 2097604 .
- ^ Росси Р.Э., Массирони С., Конте Д., Перакки М. (январь 2014 г.). «Терапия метастатических нейроэндокринных опухолей поджелудочной железы» . Анналы трансляционной медицины . 2 (1): 8. doi : 10.3978/j.issn.2305-5839.2013.03.01 . ПМК 4200651 . ПМИД 25332984 .
- ^ Ник Малкахи (17 декабря 2014 г.). «FDA одобрило ланреотид для лечения нейроэндокринных опухолей» . Медицинские новости Medscape . ООО «ВебМД». Архивировано из оригинала 18 января 2015 года . Проверено 25 декабря 2014 г.
- ^ Эверолимус одобрен для лечения нейроэндокринных опухолей поджелудочной железы. Архивировано 16 июля 2016 г. в Wayback Machine, The ASCO Post . 15 мая 2011, Том 2, Выпуск 8
- ^ Национальный институт рака. Информация о лекарствах от рака. Одобрение FDA для сунитиниба малата. Архивировано 5 января 2015 г. в Wayback Machine . Нейроэндокринные опухоли поджелудочной железы
- ^ Текст доступен в электронном виде (но может потребоваться бесплатная регистрация). См.: Бенсон А.Б., Майерсон Р.Дж., Сассон А.Р. (2010). Рак поджелудочной железы, нейроэндокринный рак желудочно-кишечного тракта и надпочечников. Лечение рака: междисциплинарный подход (13-е изд.). УБМ Медика. ISBN 978-0-615-41824-7 . Архивировано из оригинала 15 мая 2011 года.
- ^ Гуленчин К.Ю., Яо X, Аса С.Л., Сингх С., Лоу С. (май 2012 г.). «Радионуклидная терапия нейроэндокринных опухолей: систематический обзор». Клиническая онкология . 24 (4): 294–308. дои : 10.1016/j.clon.2011.12.003 . ПМИД 22221516 .
- ^ Виник А.И. (ноябрь 2014 г.). «Достижения в диагностике и лечении нейроэндокринных опухолей поджелудочной железы». Эндокринная практика . 20 (11): 1222–30. дои : 10.4158/EP14373.RA . ПМИД 25297671 .
- ^ Квеккебум DJ, де Хердер В.В., ван Эйк CH, Кам Б.Л., ван Эссен М., Теуниссен Дж.Дж., Креннинг EP (март 2010 г.). «Пептидно-рецепторная радионуклидная терапия у больных гастроэнтеропанкреатическими нейроэндокринными опухолями» . Семинары по ядерной медицине . 40 (2): 78–88. doi : 10.1053/j.semnuclmed.2009.10.004 . ПМИД 20113677 .
- ^ Бодей Л., Кремонези М., Кидд М., Грана С.М., Севери С., Модлин И.М., Паганелли Г. (август 2014 г.). «Пептидно-рецепторная радионуклидная терапия при распространенных нейроэндокринных опухолях». Клиники торакальной хирургии . 24 (3): 333–49. doi : 10.1016/j.thorsurg.2014.04.005 . HDL : 11392/2378236 . ПМИД 25065935 .
- ^ Кастеллано Д., Гранде Э., Валле Дж., Капдевила Дж., Рейди-Лагунес Д., О'Коннор Дж. М., Раймонд Э. (июнь 2015 г.). «Экспертный консенсус по лечению распространенных или метастатических нейроэндокринных и карциноидных опухолей поджелудочной железы». Химиотерапия и фармакология рака . 75 (6): 1099–114. дои : 10.1007/s00280-014-2642-2 . ПМИД 25480314 . S2CID 39434924 .
- ^ Сингх С., Дей С., Кеннеке Х., Коча В., Марун Дж., Метракос П. и др. (август 2015 г.). «Консенсусные рекомендации по диагностике и лечению нейроэндокринных опухолей поджелудочной железы: рекомендации Канадской национальной экспертной группы». Анналы хирургической онкологии . 22 (8): 2685–99. дои : 10.1245/s10434-014-4145-0 . ПМИД 25366583 . S2CID 8129133 .
- ^ «Паллиативная или поддерживающая помощь» . Американское онкологическое общество. 2014. Архивировано из оригинала 21 августа 2014 года . Проверено 20 августа 2014 г.
- ^ Буанес Т.А. (август 2014 г.). «Улучшение лечения рака поджелудочной железы достижимо» . Всемирный журнал гастроэнтерологии . 20 (30): 10405–18. дои : 10.3748/wjg.v20.i30.10405 . ПМК 4130847 . ПМИД 25132756 .
- ^ «Если лечение рака поджелудочной железы перестанет работать» . Американское онкологическое общество. 11 июня 2014 года. Архивировано из оригинала 22 октября 2014 года . Проверено 20 августа 2014 г.
- ^ Арчидиаконо П.Г., Калори Дж., Каррара С., Макникол Э.Д., Тестони П.А. (март 2011 г.). Арчидиаконо PG (ред.). «Блокада чревного сплетения при боли при раке поджелудочной железы у взрослых» . Кокрановская база данных систематических обзоров . 2019 (3): CD007519. дои : 10.1002/14651858.CD007519.pub2 . ПМК 6464722 . ПМИД 21412903 .
- ^ «Факты и цифры о раке, 2014 г.» (PDF) . Американское онкологическое общество . Архивировано (PDF) из оригинала 18 декабря 2014 года . Проверено 5 января 2015 г. , Таблица, с. 18 лет, ставки скорректированы с учетом нормальной продолжительности жизни
- ^ Джемал А., Сигел Р., Уорд Э., Мюррей Т., Сюй Дж., Тун М.Дж. (2007). «Раковая статистика, 2007» . CA: Журнал рака для врачей . 57 (1): 43–66. дои : 10.3322/canjclin.57.1.43 . ПМИД 17237035 . S2CID 22305510 .
- ^ «Каковы основные статистические данные о раке поджелудочной железы?» . Американское онкологическое общество . 11 июня 2014 года. Архивировано из оригинала 11 ноября 2014 года . Проверено 11 ноября 2014 г.
- ^ «Статистика рака поджелудочной железы» . Исследования рака Великобритании . Архивировано из оригинала 18 декабря 2014 года . Проверено 18 декабря 2014 г. ; «В 2010 году в Великобритании риск развития рака поджелудочной железы в течение жизни составлял 1 из 73 для мужчин и 1 из 74 для женщин», отмечая, что «риск в течение жизни... был рассчитан... с использованием метода «Текущей вероятности». «Этот метод отличается от метода, используемого в большинстве других онкологических мест, поскольку вероятность получения более одного диагноза рака поджелудочной железы в течение жизни очень мала».
- ↑ Перейти обратно: Перейти обратно: а б Буснардо AC, ДиДио LJ, Тидрик RT, Томфорд NR (ноябрь 1983 г.). «История поджелудочной железы» . Американский журнал хирургии . 146 (5): 539–50. дои : 10.1016/0002-9610(83)90286-6 . ПМИД 6356946 .
- ↑ Перейти обратно: Перейти обратно: а б с д Аэр С, Дхир М, Равипати Л (июнь 2011 г.). «История панкреатодуоденэктомии: ранние заблуждения, начальные вехи и пионеры» . Е.П.Б. 13 (6): 377–84. дои : 10.1111/j.1477-2574.2011.00305.x . ПМК 3103093 . ПМИД 21609369 .
- ↑ Перейти обратно: Перейти обратно: а б Кэмерон Дж.Л., Риалл Т.С., Коулман Дж., Белчер К.А. (июль 2006 г.). «Тысяча последовательных панкреатодуоденэктомий» . Анналы хирургии . 244 (1): 10–5. doi : 10.1097/01.sla.0000217673.04165.ea . ПМК 1570590 . ПМИД 16794383 .
- ^ Фернандес-дель Кастильо С., Моралес-Оярвиде В., МакГрат Д., Варго Х.А., Ферроне С.Р., Тайер С.П. и др. (сентябрь 2012 г.). «Эволюция процедуры Уиппла в больнице общего профиля Массачусетса» . Операция . 152 (3 Приложение 1): С56-63. дои : 10.1016/j.surg.2012.05.022 . ПМК 3806095 . ПМИД 22770961 .
- ↑ Перейти обратно: Перейти обратно: а б с «Что нового в исследованиях и лечении рака поджелудочной железы?» . Американское онкологическое общество . 2019 . Проверено 2 мая 2019 г.
- ^ «Исследование рака поджелудочной железы» . Исследования рака Великобритании . Архивировано из оригинала 18 февраля 2014 года . Проверено 17 июля 2014 г.
- ^ «Австралийская инициатива по геному поджелудочной железы» . Гарванский институт. Архивировано из оригинала 26 июля 2014 года . Проверено 17 июля 2014 г.
- ^ Бьянкин А.В., Уодделл Н., Кассан К.С., Гинграс М.К., Мутусвами Л.Б., Джонс А.Л. и др. (ноябрь 2012 г.). «Геномы рака поджелудочной железы обнаруживают аберрации в генах пути наведения аксонов» . Природа . 491 (7424): 399–405. Бибкод : 2012Natur.491..399. . дои : 10.1038/nature11547 . ПМЦ 3530898 . ПМИД 23103869 .
- ^ Фэн, Хуэй-И; Чен, Ян-Чао (7 сентября 2016 г.). «Роль желчных кислот в канцерогенезе рака поджелудочной железы: старая тема с новой перспективой» . Всемирный журнал гастроэнтерологии . 22 (33): 7463–7477. дои : 10.3748/wjg.v22.i33.7463 . ISSN 1007-9327 . ПМК 5011662 . ПМИД 27672269 .
- ^ Грэм Дж.С., Джеймисон Н.Б., Рулах Р., Гриммонд С.М., Чанг Д.К., Бьянкин А.В. (сентябрь 2015 г.). «Геномика рака поджелудочной железы: куда может нас привести наука?». Клиническая генетика . 88 (3): 213–9. дои : 10.1111/cge.12536 . ПМИД 25388820 . S2CID 26414866 .
- ^ Брюндерман Э.Х., Мартин Р.К. (март 2015 г.). «Популяция высокого риска при спорадической аденокарциноме поджелудочной железы: рекомендации по скринингу» . Журнал хирургических исследований . 194 (1): 212–9. дои : 10.1016/j.jss.2014.06.046 . ПМЦ 4559279 . ПМИД 25479908 .
- ^ «О ЕВРОПАК» . Европейский регистр наследственного панкреатита и семейного рака поджелудочной железы (EUROPAC) . Университет Ливерпуля. Архивировано из оригинала 26 июля 2014 года . Проверено 17 июля 2014 г.
- ^ Субар Д., Гобардхан П.Д., Гайет Б. (февраль 2014 г.). «Лапароскопическая хирургия поджелудочной железы: обзор литературы и опыта одного центра». Лучшие практики и исследования. Клиническая гастроэнтерология . 28 (1): 123–32. дои : 10.1016/j.bpg.2013.11.011 . ПМИД 24485260 .
- ^ Вайс М.Ю., Вольфганг К.Л. (2013). «Необратимая электропорация: новая терапия рака поджелудочной железы». Текущие проблемы рака . 37 (5): 262–5. doi : 10.1016/j.currproblcancer.2013.10.002 . ПМИД 24331180 . S2CID 3137300 .
- ^ Мойр Дж., Уайт С.А., Френч Дж.Дж., Литтлер П., Манас Д.М. (декабрь 2014 г.). «Систематический обзор необратимой электропорации при лечении распространенного рака поджелудочной железы». Европейский журнал хирургической онкологии . 40 (12): 1598–604. дои : 10.1016/j.ejso.2014.08.480 . ПМИД 25307210 .
- ^ Клегер А., Перхофер Л., Зойферляйн Т. (июль 2014 г.). «Появляются более умные лекарства для лечения рака поджелудочной железы» . Анналы онкологии . 25 (7): 1260–1270. дои : 10.1093/annonc/mdu013 . ПМИД 24631947 .
- ↑ Перейти обратно: Перейти обратно: а б Тан С.К., Чен Ю.К. (август 2014 г.). «Новые терапевтические мишени для лечения рака поджелудочной железы» . Всемирный журнал гастроэнтерологии . 20 (31): 10825–44. дои : 10.3748/wjg.v20.i31.10825 . ПМК 4138462 . ПМИД 25152585 .
- ^ Росси М.Л., Рехман А.А., Гонди CS (август 2014 г.). «Терапевтические возможности лечения рака поджелудочной железы» . Всемирный журнал гастроэнтерологии . 20 (32): 11142–59. дои : 10.3748/wjg.v20.i32.11142 . ПМК 4145755 . ПМИД 25170201 .
- ^ Ади Дж.В., Хеффнер Дж., Кляйн Э., Фонг Ю. (2014). «Онколитическая вирусная терапия рака поджелудочной железы: текущие исследования и будущие направления» . Онколитическая виротерапия . 3 : 35–46. дои : 10.2147/OV.S53858 . ПМЦ 4918362 . ПМИД 27512661 .
- ^ Рен Б, Цуй М, Ян Г, Ван Х, Фэн М, Ю Л, Чжао Ю (июль 2018 г.). «Микроокружение опухоли участвует в метастазировании рака поджелудочной железы» . Молекулярный рак . 17 (1): 108. дои : 10.1186/s12943-018-0858-1 . ПМК 6065152 . ПМИД 30060755 .
- ^ Сачи Дас, Сабья; Кумар Дубей, Амит; Сингх, Ниру; Ранджан, Прия; Верма, Прасад; Кумар Сингх, Шубханкар; Кумар Сингх, Сандип (9 января 2023 г.). «Лечение рака поджелудочной железы с использованием тераностических наночастиц» . Механизмы рака, связанные с гормонами, и наномедицины . стр. 149–168. дои : 10.1007/978-981-19-5558-7_8 . ISBN 978-981-19-5557-0 .




