Нейробластома
| Нейробластома | |
|---|---|
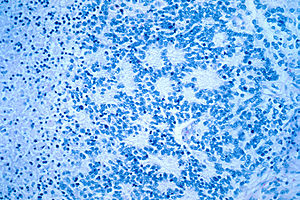 | |
| Микроскопический вид типичной нейробластомы с розетки. образованием | |
| Специальность | Нейроонкология |
| Симптомы | Боль в костях, шишки [1] |
| Обычное начало | До 5 лет [1] |
| Причины | Генетическая мутация [1] |
| Метод диагностики | Биопсия ткани [1] |
| Уход | Наблюдение, хирургия, лучевая терапия , химиотерапия , трансплантация стволовых клеток [1] |
| Прогноз | в США Пятилетняя выживаемость ~ 95% (<1 года), 68% (1–14 лет) [2] |
| Частота | 1 из 7000 детей [2] |
| Летальные исходы | 15% смертей от рака у детей [3] |
Нейробластома ( НБ ) – это тип рака , который образуется в определенных типах нервной ткани . [1] Чаще всего он начинается с одного из надпочечников , но может также развиться в голове , шее , груди , животе или позвоночнике . [1] Симптомы могут включать боль в костях , уплотнение в животе, шее или груди или безболезненное синюшное образование под кожей. [1]
Обычно нейробластома возникает из-за генетической мутации, возникающей в первом триместре беременности. [4] [5] мутацией В редких случаях это может быть связано с наследственной . [1] Влияние факторов окружающей среды не обнаружено. [2] Диагностика основывается на биопсии ткани . [1] Иногда его можно обнаружить у ребенка с помощью УЗИ во время беременности . [1] На момент постановки диагноза рак обычно уже распространился . [1] Рак делится на группы низкого, среднего и высокого риска в зависимости от возраста ребенка, стадии рака и внешнего вида рака. [1]
Лечение и результаты зависят от группы риска, в которой находится человек. [1] [5] Лечение может включать наблюдение, хирургическое вмешательство, лучевую терапию , химиотерапию или трансплантацию стволовых клеток . [1] Заболевания низкого риска у младенцев обычно имеют хороший исход при хирургическом вмешательстве или простом наблюдении. [5] Однако при заболевании высокого риска шансы на долгосрочное выживание составляют менее 40%, несмотря на агрессивное лечение. [5]
Нейробластома является наиболее распространенным раком у младенцев и третьим по распространенности раком у детей после лейкемии и рака головного мозга . [5] Примерно один из каждых 7000 детей в какой-то момент страдает от этого заболевания. [2] Около 90% случаев встречается у детей до 5 лет, у взрослых встречается редко. [2] [3] Около 15% случаев смерти от рака у детей вызваны нейробластомой. [3] Впервые заболевание было описано в 1800-х годах. [6]
Признаки и симптомы
[ редактировать ]Первые симптомы нейробластомы часто неясны, что затрудняет диагностику. Часто наблюдаются утомляемость , потеря аппетита , лихорадка и боли в суставах. Симптомы зависят от локализации первичной опухоли и наличия метастазов: [7]
- В брюшной полости опухоль может вызывать вздутие живота и запоры .
- Опухоль в грудной клетке может вызвать проблемы с дыханием .
- Опухоль, давящая на спинной мозг , может вызвать слабость и, следовательно, неспособность стоять, ползать или ходить.
- Поражения костей ног и бедер могут вызывать боль и хромоту.
- Опухоль в костях вокруг глаз или орбит может вызвать отчетливые синяки и отеки.
- Инфильтрация костного мозга может вызвать бледность вследствие анемии .
Нейробластома часто распространяется на другие части тела до появления каких-либо симптомов, и от 50 до 60% всех случаев нейробластомы имеют метастазы . [8]
Наиболее частым местом возникновения нейробластомы (т. е. первичной опухоли) являются надпочечники. Это происходит в 40% локализованных опухолей и в 60% случаев распространенного заболевания. Нейробластома также может развиваться в любом месте цепи симпатической нервной системы от шеи до таза. Частота локализации в различных местах включает: шею (1%), грудь (19%), живот (30% вне надпочечников) или таз (1%). В редких случаях первичную опухоль не удается различить. [9]
Редкие, но характерные проявления включают поперечную миелопатию (опухоль сдавления спинного мозга, 5% случаев), резистентную к лечению диарею (опухоль вазоактивной секреции кишечных пептидов , 4% случаев), синдром Горнера (опухоль шейки матки, 2,4% случаев), опсоклонус, миоклонус. синдром [10] атаксия паранеопластическую (подозрение на причину , 1,3% случаев) и гипертензия ( секреция катехоламинов или сдавление почечной артерии, 1,3% случаев). [11]
Причина
[ редактировать ]Причина нейробластомы до конца не изучена. Подавляющее большинство случаев носит спорадический и несемейный характер. Около 1–2% случаев передаются в семьях и связаны со специфическими генными мутациями. Семейная нейробластома в некоторых случаях вызвана редкими мутациями зародышевой линии в гене киназы анапластической лимфомы ( ALK ). [12] Зародышевые мутации гена PHOX2B или KIF1B также связаны с семейной нейробластомой. Нейробластома также является признаком нейрофиброматоза 1 типа и синдрома Беквита-Видемана .
MYCN Амплификация онкогена в опухоли является частой находкой при нейробластоме. Степень амплификации имеет бимодальное распределение: либо в 3–10 раз, либо в 100–300 раз. Наличие этой мутации тесно связано с поздними стадиями заболевания. [13]
Было показано , что дуплицированные сегменты гена LMO1 в опухолевых клетках нейробластомы увеличивают риск развития агрессивной формы рака. [14]
Другие гены могут иметь прогностическую роль при нейробластоме. Биоинформатическое исследование , опубликованное в 2023 году, показало, что AHCY , DPYSL3 и NME1 гены могут играть прогностическую роль при этом заболевании. [15]
Нейробластома связана с изменением числа копий в гене NBPF10 , что приводит к синдрому делеции 1q21.1 или синдрому дупликации 1q21.1 . [16]
Одно исследование убедительно показывает, что микроРНК, которые чрезмерно экспрессируются в клетках нейробластомы с делецией 1p , в отличие от других генетических подгрупп нейробластомы, потенциально могут нарушать регуляцию генов, связанных с дифференцировкой нейронов, тем самым способствуя патогенезу нейробластомы. Более того, было отмечено, что миР-495 в первую очередь нацелена на большинство мРНК, которые участвуют в дифференцировке нейронов. [17]
Было предложено несколько факторов риска, которые являются предметом продолжающихся исследований. Из-за характерного раннего начала многие исследования были сосредоточены на родительских факторах во время зачатия и во время беременности . Исследуемые факторы включали род занятий (т.е. воздействие химических веществ в конкретных отраслях промышленности), курение, употребление алкоголя, употребление медицинских препаратов во время беременности и факторы рождения; однако результаты оказались неубедительными. [18]
Другие исследования изучали возможные связи с атопией и воздействием инфекции в раннем возрасте. [19] использование гормонов и препаратов от бесплодия, [20] и использование краски для волос матерью. [21] [22]
Диагностика
[ редактировать ]
Диагноз обычно подтверждается патологоанатомом -хирургом с учетом клинической картины, результатов микроскопии и других лабораторных исследований. Оно может возникнуть из любого нервного гребня элемента симпатической нервной системы (СНС).
Считается, что эстезионейробластома , также известная как обонятельная нейробластома, возникает из обонятельного эпителия , и ее классификация остается спорной. Однако, поскольку это не злокачественное новообразование симпатической нервной системы, эстезионейробластома представляет собой отдельную клиническую единицу, и ее не следует путать с нейробластомой. [23] [24]
Биохимия
[ редактировать ]Примерно в 90% случаев нейробластомы повышенные уровни катехоламинов в моче или крови обнаруживаются или их метаболитов. Катехоламины и их метаболиты включают дофамин , гомованилиновую кислоту (ГВА) и/или ванилилминдальную кислоту (ВМА). [25]
Визуализация
[ редактировать ]Другим способом обнаружения нейробластомы является сканирование мета-йодбензилгуанидином , которое используется в 90–95% всех нейробластом, часто называемых «mIBG-зависимыми». [26] Механизм заключается в том, что mIBG поглощается симпатическими нейронами и является функциональным аналогом нейромедиатора норадреналина . Когда он радиойодирован I-131 или I-123 (радиоактивными изотопами йода ), он является очень хорошим радиофармпрепаратом для диагностики и мониторинга реакции на лечение этого заболевания. I-123 с периодом полураспада 13 часов является предпочтительным изотопом с точки зрения чувствительности и качества визуализации. Период полувыведения I-131 составляет 8 дней, и в более высоких дозах он является эффективной терапией в качестве таргетного облучения против рецидивирующей и рефрактерной нейробластомы. [27] Поскольку mIBG не всегда поглощается нейробластомами, исследователи изучали у детей с нейробластомой, может ли быть полезен другой тип ядерной визуализации, фтордезоксиглюкозно-позитронно-эмиссионная томография, часто называемая «F-FDG-PET». [28] Имеющиеся данные свидетельствуют о том, что это может быть целесообразно использовать у детей с нейробластомой, для которых MIBG не работает, но в этой области необходимы дополнительные исследования. [28]
Гистология
[ редактировать ]
При микроскопии опухолевые клетки обычно описываются как маленькие, круглые и синие, и в виде розеток узоры ( псевдорозетки Гомера Райта можно увидеть ). Псевдорозетки Гомера Райта — это опухолевые клетки вокруг нейропиля , не путать с настоящими розетками, которые представляют собой опухолевые клетки вокруг пустого просвета. [29] Они также отличаются от псевдорозеток эпендимомы, которые состоят из опухолевых клеток с глиальными фибриллярными кислыми белками (GFAP)-положительными отростками, сужающимися к кровеносному сосуду (таким образом, комбинация этих двух). [30] Патологоанатомы используют различные иммуногистохимические окраски, чтобы отличить нейробластомы от гистологических имитаций, таких как рабдомиосаркома , саркома Юинга , лимфома и опухоль Вильмса . [31]
Нейробластома является одной из периферических нейробластических опухолей (пНТ), которые имеют сходное происхождение и демонстрируют широкий характер дифференцировки, начиная от доброкачественной ганглионевромы и стромой богатой ганглионейробластомы с перемешанными нейробластическими клетками или в узлах и заканчивая высокозлокачественной нейробластомой. Такое различие в опухолевой патологии до лечения является важным прогностическим фактором, наряду с возрастом и митозом - индексом кариорексиса (МКИ). Эта система классификации патологий (система Шимады) описывает «благоприятные» и «неблагоприятные» опухоли Международного комитета патологии нейробластомы (INPC), который был создан в 1999 году и пересмотрен в 2003 году. [32]
Постановка
[ редактировать ]«Международная система стадирования нейробластомы» (INSS), созданная в 1986 году и пересмотренная в 1988 году, классифицирует нейробластому в соответствии с ее анатомическим наличием на момент постановки диагноза: [33] [34] [35]
- Стадия 1: Локализованная опухоль, ограниченная областью происхождения.
- Стадия 2А: Односторонняя опухоль с неполной грубой резекцией; идентифицируемые ипсилатеральные и контралатеральные лимфатические узлы, отрицательные на опухоль.
- Стадия 2Б: Односторонняя опухоль с полной или неполной грубой резекцией; с ипсилатеральным лимфатическим узлом, положительным на опухоль; идентифицируемый контралатеральный лимфатический узел отрицательный на опухоль.
- Стадия 3: инфильтрация опухоли по средней линии с поражением регионарных лимфатических узлов или без него; или односторонняя опухоль с поражением контралатеральных лимфатических узлов; или срединная опухоль с двусторонним поражением лимфатических узлов.
- Стадия 4: Распространение опухоли на отдаленные лимфатические узлы, костный мозг, кости, печень или другие органы, за исключением случаев, определенных для стадии 4S.
- Стадия 4S: возраст <1 года с локализованной первичной опухолью, как определено на стадии 1 или 2, с диссеминацией, ограниченной печенью, кожей или костным мозгом (менее 10 процентов ядросодержащих клеток костного мозга являются опухолями).
Хотя использовалось международное соглашение о стадировании (INSS), также была признана необходимость международного консенсуса по распределению рисков для сравнения аналогичных когорт по результатам исследований. Начиная с 2005 года представители крупнейших кооперативных групп педиатрической онкологии встретились для рассмотрения данных о 8800 людях с нейробластомой, пролеченных в Европе, Японии, США, Канаде и Австралии в период с 1990 по 2002 год. Эта целевая группа предложила создать Международную группу риска нейробластомы (Международную группу риска нейробластомы). INRG) система классификации. Ретроспективные исследования выявили высокую выживаемость в возрастной группе 12–18 месяцев, ранее отнесенной к группе высокого риска, и побудили принять решение о реклассификации детей в возрасте 12–18 месяцев без N- myc (также обычно называемого MYCN амплификации ). к средней категории риска. [36]
Новое распределение рисков INRG будет классифицировать нейробластому при постановке диагноза на основе новой Международной системы стадирования групп риска нейробластомы (INRGSS):
- Стадия L1: Локализованное заболевание без определенных на снимке факторов риска.
- Стадия L2: Локализованное заболевание с факторами риска, определяемыми на снимке.
- Стадия М: Метастатическое заболевание.
- Стадия рассеянного склероза: «особая» метастатическая болезнь, при которой рассеянный склероз эквивалентен стадии 4S.
Новая стратификация риска будет основана на новой системе стадирования INRGSS, возрасте (дихотомизированном через 18 месяцев), степени опухоли, амплификации N-myc , несбалансированной аберрации 11q и плоидности на четыре группы риска перед лечением: очень низкий, низкий и промежуточный. , и высокий риск. [5] [37]
Скрининг
[ редактировать ]в моче Уровень катехоламинов может быть повышен при доклинической стадии нейробластомы. Скрининг бессимптомных младенцев в возрасте трех недель, шести месяцев и одного года проводится в Японии, Канаде, Австрии и Германии с 1980-х годов. [38] [39] Япония начала скрининг шестимесячных детей на нейробластому путем анализа уровней гомованилиновой и ванилиминдальной кислот в 1984 году. Скрининг был прекращен в 2004 году после того, как исследования в Канаде и Германии не показали снижения смертности от нейробластомы, а скорее вызвали увеличение смертности от нейробластомы. диагнозы, которые исчезли бы без лечения, подвергая этих детей ненужному хирургическому вмешательству и химиотерапии. [40] [41] [42]
Уход
[ редактировать ]Если поражение локализовано, оно, как правило, излечимо. Однако долгосрочная выживаемость детей с запущенным заболеванием старше 18 месяцев низкая, несмотря на агрессивную мультимодальную терапию (интенсивная химиотерапия , хирургическое вмешательство , лучевая терапия , трансплантация стволовых клеток , дифференцировки агент изотретиноин, также называемый 13- цис -ретиноевой кислотой, и часто иммунотерапия [43] при против GD2 терапии моноклональными антителами – динутуксимабом ).
Выявлены биологические и генетические характеристики, которые в сочетании с классической клинической стадией позволили отнести к группам риска для планирования интенсивности лечения. [44] Эти критерии включают возраст человека, степень распространения заболевания, микроскопический вид и генетические особенности, включая плоидность ДНК и N-myc онкогена амплификацию (N-myc регулирует микроРНК). [45] ), на заболевания низкого, среднего и высокого риска. В недавнем биологическом исследовании (COG ANBL00B1) было проанализировано 2687 человек с нейробластомой, и был определен спектр распределения риска: 37% случаев нейробластомы относятся к низкому риску, 18% - к среднему риску и 45% - к высокому риску. [46] (Есть некоторые свидетельства того, что типы высокого и низкого риска вызываются разными механизмами, а не просто представляют собой две разные степени выраженности одного и того же механизма.) [47]
Терапия для этих разных категорий риска очень различна.
- Заболевание низкого риска часто можно наблюдать вообще без какого-либо лечения или излечить только хирургическим путем. [48]
- Заболевание промежуточного риска лечат хирургическим путем и химиотерапией . [49]
- Нейробластому высокого риска лечат с помощью интенсивной химиотерапии, хирургического вмешательства , лучевой терапии , трансплантации костного мозга / кроветворных стволовых клеток . [50] биологическая терапия 13- цис -ретиноевой кислотой ( изотретиноин или аккутан) [51] и терапию антителами, обычно вводимую с цитокинами GM-CSF и IL-2 . [52] Мета-анализ обнаружил доказательства того, что у детей с нейробластомой высокого риска лечение миелоаблативной терапией улучшает бессобытийную выживаемость, но может увеличить риск побочных эффектов, таких как проблемы с почками, по сравнению с традиционной химиотерапией. [53]
Люди с заболеванием низкого и среднего риска имеют отличный прогноз: показатели излечения превышают 90% для низкого риска и 70–90% для среднего риска. Напротив, терапия нейробластомы высокого риска за последние два десятилетия [ когда? ] приводило к излечению лишь в 30% случаев. [54] Добавление терапии антителами значительно повысило показатели выживаемости при заболеваниях высокого риска. В марте 2009 года ранний анализ исследования Детской онкологической группы (COG) с участием 226 человек из группы высокого риска показал, что через два года после трансплантации стволовых клеток 66% группы были рандомизированы для получения антитела ch14.18 с GM-CSF и IL. -2 были живы и здоровы по сравнению с 46% в группе, которая не получала антитела. Рандомизация была остановлена, чтобы все люди, принявшие участие в исследовании, получили терапию антителами. [55]
Было обнаружено, что химиотерапевтические агенты, используемые в комбинации, эффективны против нейробластомы. Агентами, обычно используемыми при индукции и кондиционировании трансплантата стволовых клеток, являются соединения платины ( цисплатин , карбоплатин ), алкилирующие агенты ( циклофосфамид , ифосфамид , мелфалан ), ингибитор топоизомеразы II ( этопозид ), антрациклиновые антибиотики ( доксорубицин ) и алкалоиды барвинка ( винкристин ). Некоторые новые схемы включают в индукцию ингибиторы топоизомеразы I ( топотекан и иринотекан ), которые оказались эффективными против рецидивов заболевания. Хотя необходимы дальнейшие исследования, вмешательства, которые в настоящее время проходят доклинические исследования, включают эпигенетические методы лечения, такие как ингибирование SWI/SNF , [56] которые могут дополнять существующие методы лечения ретиноидами.
В ноябре 2020 года накситамаб был одобрен для медицинского применения в США в сочетании с гранулоцитарно-макрофагальным колониестимулирующим фактором (GM-CSF) для лечения людей в возрасте одного года и старше с нейробластомой высокого риска в кости или костном мозге, у которой опухоль не ответил на предыдущее лечение или вернулся после него и продемонстрировал частичный ответ, незначительный ответ или стабилизацию заболевания на предыдущую терапию. [57] [58]
Прогноз
[ редактировать ]По данным Англии , общая 5-летняя выживаемость при нейробластоме составляет 67%. [59] От 20% до 50% случаев высокого риска не реагируют адекватно на индукционную высокодозную химиотерапию и являются прогрессирующими или рефрактерными. [60] [61] Рецидив после завершения первой линии терапии также является частым явлением. Дальнейшее лечение доступно в рамках клинических исследований фазы I и II, в которых тестируются новые агенты и комбинации агентов против нейробластомы, но результат остается очень плохим для рецидивирующего заболевания высокого риска. [62]
Большинство выживших сегодня пациентов с длительным сроком выживания имели заболевание низкого или среднего риска и более мягкие курсы лечения по сравнению с заболеваниями высокого риска. У большинства выживших наблюдаются долгосрочные последствия лечения. Выжившие после лечения промежуточного и высокого риска часто страдают потерей слуха, замедлением роста, нарушениями функции щитовидной железы, трудностями в обучении и повышенным риском вторичного рака у тех, кто перенес заболевание высокого риска. [63] [64] По оценкам, у двоих из трех человек, перенесших детский рак, в конечном итоге разовьется по крайней мере одно хроническое, а иногда и опасное для жизни заболевание, в течение 20–30 лет после постановки диагноза рака. [65] [66] [67]
Цитогенетические профили
[ редактировать ]На основании серии из 493 образцов нейробластомы было сообщено, что общий геномный паттерн, проверенный с помощью кариотипирования на основе массивов , является предиктором исхода нейробластомы: [68]
- Опухоли, демонстрирующие исключительно изменения числа копий всей хромосомы, были связаны с отличной выживаемостью.
- Опухоли с любыми изменениями числа копий сегментарных хромосом были связаны с высоким риском рецидива.
- В опухолях, демонстрирующих сегментарные изменения, дополнительными независимыми предикторами снижения общей выживаемости были амплификация N-myc , делеции 1p и 11q и прирост 1q.
В более ранних публикациях нейробластомы были разделены на три основных подтипа на основе цитогенетического профиля: [69] [70]
- Подтип 1: благоприятная нейробластома с почти триплоидией и преобладанием численных приростов и потерь, в основном представляющая неметастатические стадии 1, 2 и 4S НБ.
- Подтипы 2А и 2В: встречаются при неблагоприятной распространенной нейробластоме, стадии 3 и 4, с потерей 11q и усилением 17q без амплификации N-myc (подтип 2А) или с амплификацией N-myc, часто вместе с делецией 1p и усилением 17q (подтип 2В).
Виртуальное кариотипирование можно проводить на свежих или залитых в парафин опухолях, чтобы оценить количество копий в этих локусах. Виртуальное кариотипирование с использованием массива SNP предпочтительнее для образцов опухолей, включая нейробластомы, поскольку оно может обнаружить копийно-нейтральную потерю гетерозиготности (приобретенную однородительскую дисомию). Копи-нейтральный LOH может быть биологически эквивалентен делеции и был обнаружен в ключевых локусах нейробластомы. [71] ArrayCGH, FISH или традиционные цитогенетические методы не могут обнаружить копировально-нейтральный LOH.
Эпидемиология
[ редактировать ]
Нейробластома составляет 6–10% всех случаев рака у детей и 15% случаев смерти от рака у детей. Ежегодный уровень смертности составляет 10 на миллион детей в возрастной группе от 0 до 4 лет и 4 на миллион в возрастной группе от 4 до 9 лет. [73]
Наибольшее количество случаев приходится на первый год жизни, некоторые случаи являются врожденными . Возрастной диапазон широк, включая детей старшего возраста и взрослых, [74] но только 10% случаев встречаются у людей старше 5 лет. [26] Крупное европейское исследование показало, что менее 2% из более чем 4000 случаев нейробластомы были старше 18 лет. [75]
История
[ редактировать ]
В 1864 году немецкий врач Рудольф Вирхов первым описал опухоль брюшной полости у ребенка как «глиому». Характеристики опухолей симпатической нервной системы и мозгового вещества надпочечников были отмечены в 1891 году немецким патологом Феликсом Маршаном . [76] [77] В 1901 году Уильям Пеппер описал характерную картину стадии 4S у младенцев (метастазы в печени, но без метастазов в костях). В 1910 году Джеймс Гомер Райт понял, что опухоль возникает из примитивных нервных клеток, и назвал ее нейробластомой. Он также отметил круглые скопления клеток в образцах костного мозга, которые теперь называются «розетками Гомера Райта». Следует отметить, что слово «Гомер-Райт» через дефис грамматически неверно, поскольку эпоним относится только к доктору Райту. [78]
Научные исследования
[ редактировать ]
Доклинические модели
[ редактировать ]с нейробластомой, Ксенотрансплантаты опухолей (PDX), полученные от пациентов были созданы путем ортотопической имплантации образцов опухоли мышам с иммунодефицитом. [79] Модели PDX имеют ряд преимуществ перед традиционными линиями раковых клеток (CCL) . [80] PDX нейробластомы сохраняют генетические признаки соответствующих опухолей, а PDX демонстрируют инфильтративный рост и метастазирование в отдаленные органы. [79] Модели PDX более прогнозируют клинический результат по сравнению с обычными ксенотрансплантатами линий раковых клеток. [81] Таким образом, PDX нейробластомы могут служить клинически значимыми моделями для выявления эффективных соединений против нейробластомы. [79]
Лечение
[ редактировать ]В последнее время основное внимание уделяется сокращению терапии нейробластомы низкого и среднего риска при сохранении уровня выживаемости на уровне 90%. [82] Исследование 467 человек с промежуточным риском, включенных в программу A3961 с 1997 по 2005 год, подтвердило гипотезу о том, что терапию можно успешно снизить для этой группы риска. Пациенты с благоприятными характеристиками (степень опухоли и ответ) получили четыре цикла химиотерапии, а пациенты с неблагоприятными характеристиками получили восемь циклов с трехлетней выживаемостью без событий и общей выживаемостью, стабильной на уровне 90% для всей группы. В планах на будущее – усиление лечения людей с аберрациями хромосом 1p36 или 11q23, а также тех, у кого нет раннего ответа на лечение. [83] [84]
Напротив, последние 20 лет или более основное внимание уделялось интенсификации лечения нейробластомы высокого риска. Продолжается изучение вариантов индукции химиотерапии, сроков операции, схем трансплантации стволовых клеток, различных схем доставки радиации, а также использования моноклональных антител и ретиноидов для лечения минимальной остаточной болезни. фазы III Недавние клинические исследования с рандомизацией были проведены, чтобы ответить на эти вопросы и улучшить выживаемость при заболеваниях высокого риска:
Рефрактерная и рецидивирующая нейробластома
[ редактировать ]Химиотерапия топотеканом и циклофосфамидом часто используется в рефрактерных условиях и после рецидива. [85]
Трансплантация гаплоидентичных стволовых клеток , то есть донорских клеток, полученных от родителей, изучается у пациентов с рефрактерной или рецидивирующей нейробластомой, поскольку стволовые клетки самого человека бесполезны. [86]
Показано, что нейробластома демонстрирует высокую экспрессию рецепторов соматостатина. [87] [88] [89] и это делает возможной терапию с использованием 177Lu-DOTA-TATE , типа радионуклидной терапии , которая специфически нацелена на рецепторы соматостатина. Несколько ранних клинических исследований с использованием 177 Lu-DOTA-TATE для лечения рефрактерной/рецидивирующей нейробластомы высокого риска была проведена с многообещающими результатами. [90] [91] [92]
Данные электронных медицинских карт
[ редактировать ]Недавно было запущено несколько международных инициатив по обмену данными электронных медицинских карт пациентов с нейробластомой: эти данные фактически можно проанализировать с помощью моделей машинного обучения и статистики , чтобы получить новые знания об этом заболевании.С этой целью Международная группа по риску нейробластомы (INRG) недавно опубликовала данные INRG Data Commons, [93] в то время как Чикагский университет запустил Commons Data Cancer Data Commons. [94] Эти два хранилища содержат данные электронных медицинских карт тысяч пациентов, которые доступны для научных исследований с предварительного разрешения.В 2022 году исследователи выпустили новое хранилище данных электронных медицинских карт под названием « Открытое хранилище данных электронных медицинских записей нейробластомы» , где данные можно загружать свободно и без каких-либо ограничений. [95]
Организации
[ редактировать ]Ассоциация исследований нейробластомы (ANRA) является высшим органом исследователей в области биологии, диагностики, прогноза и терапии нейробластомы и каждые два года проводит встречи для обмена информацией между ними. [96]
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г час я дж к л м н тот «Лечение нейробластомы» . Национальный институт рака . 20 января 2016 г. Архивировано из оригинала 10 ноября 2016 г. Проверено 9 ноября 2016 г.
- ^ Jump up to: а б с д и «Лечение нейробластомы» . Национальный институт рака . 25 августа 2016 года. Архивировано из оригинала 10 ноября 2016 года . Проверено 10 ноября 2016 г. .
- ^ Jump up to: а б с Всемирный доклад о раке, 2014 год . Всемирная организация здравоохранения. 2014. Глава 5.16. ISBN 978-92-832-0429-9 . Архивировано из оригинала 19 сентября 2016 г. Проверено 10 ноября 2016 г.
- ^ Кёрбер В., Штайнчик С.А., Курилов Р., Генрих К.О., Герой Б., Брорс Б., Вестерманн Ф., Хёфер Т. (апрель 2023 г.). «Нейробластома возникает на ранних стадиях развития плода, и ее эволюционная продолжительность предсказывает исход» . Природная генетика . 55 (4): 619–630. дои : 10.1038/s41588-023-01332-y . ISSN 1546-1718 . ПМК 10101850 . ПМИД 36973454 .
- ^ Jump up to: а б с д и ж Марис Дж.М., Хогарти, доктор медицинских наук, Багатель Р., Кон С.Л. (июнь 2007 г.). "Нейробластома". Ланцет . 369 (9579): 2106–2120. дои : 10.1016/S0140-6736(07)60983-0 . ПМИД 17586306 . S2CID 208790138 .
- ^ Олсон Дж.С. (1989). История рака: аннотированная библиография . АВС-КЛИО. п. 177. ИСБН 978-0-313-25889-3 . Архивировано из оригинала 10 сентября 2017 г.
- ^ Уиллер К. (1 января 2013 г.). «Нейробластома у детей» . Макмиллан. Архивировано из оригинала 5 октября 2015 года.
- ^ «Нейробластома: детский рак: профессиональное руководство Merck» . Архивировано из оригинала 18 декабря 2007 г. Проверено 1 января 2008 г.
- ^ Фридман Г.К., Каслберри Р.П. (декабрь 2007 г.). «Изменение тенденций исследований и лечения детской нейробластомы». Детская кровь и рак . 49 (7 дополнений): 1060–1065. дои : 10.1002/pbc.21354 . ПМИД 17943963 . S2CID 37657305 .
- ^ Ротенберг А.Б., Бердон В.Е., Д'Анжио Г.Дж., Ямасиро Д.Д., Коулз Р.А. (июль 2009 г.). «Связь между нейробластомой и синдромом опсоклонус-миоклонус: исторический обзор». Детская радиология . 39 (7): 723–726. дои : 10.1007/s00247-009-1282-x . ПМИД 19430769 . S2CID 24523263 .
- ^ Чунг НК (2005). Нейробластома . Спрингер-Верлаг . стр. 66–7. ISBN 978-3-540-40841-3 .
- ^ Моссе Ю.П., Лауденслагер М., Лонго Л., Коул К.А., Вуд А., Аттия Э.Ф. и др. (октябрь 2008 г.). «Идентификация ALK как основного гена семейной предрасположенности нейробластомы» . Природа . 455 (7215): 930–935. Бибкод : 2008Natur.455..930M . дои : 10.1038/nature07261 . ПМК 2672043 . ПМИД 18724359 .
- ^ Бродер Г.М., Сигер Р.К., Шваб М., Вармус Х.Э., Бишоп Дж.М. (июнь 1984 г.). «Амплификация N-myc в нелеченых нейробластомах человека коррелирует с поздней стадией заболевания». Наука . 224 (4653): 1121–1124. Бибкод : 1984Sci...224.1121B . дои : 10.1126/science.6719137 . ПМИД 6719137 .
- ^ Ван К., Дискин С.Дж., Чжан Х., Аттие Э.Ф., Винтер С., Хоу С. и др. (январь 2011 г.). «Интегративная геномика идентифицирует LMO1 как онкоген нейробластомы» . Природа . 469 (7329): 216–220. Бибкод : 2011Natur.469..216W . дои : 10.1038/nature09609 . ПМК 3320515 . ПМИД 21124317 .
- ^ Дискин С.Дж., Хоу С., Глесснер Дж.Т., Аттие Э.Ф., Лауденслагер М., Боссе К. и др. (июнь 2009 г.). «Изменение числа копий на участке 1q21.1, связанное с нейробластомой» . Природа . 459 (7249): 987–991. Бибкод : 2009Natur.459..987D . дои : 10.1038/nature08035 . ПМЦ 2755253 . ПМИД 19536264 .
- ^ Алтунгоз О, Таймер, Багчи (17 февраля 2023 г.). «Статус хромосомы 1p при нейробластоме коррелирует с более высокими уровнями экспрессии микроРНК, нацеленных на путь дифференцировки нейронов» . In Vitro Cell.Dev.Biol.-Animal . 59 (2): 100–108. дои : 10.1007/s11626-023-00750-w . PMID 36800078 – через Springer.
- ^ Ольшан А.Ф., Бунин Г.Р. (2000). «Эпидемиология нейробластомы». Бродер Г.М., Савада Т., Цучида Ю., Воут П.П. (ред.). Нейробластома . Амстердам: Эльзевир. стр. 33–9. ISBN 978-0-444-50222-3 .
- ^ Менего Ф., Ольшан А.Ф., Нелья Дж.П., Поллок Б.Х., Бонди М.Л. (май 2004 г.). «Детский уход, детские инфекции и риск нейробластомы» . Американский журнал эпидемиологии . 159 (9): 843–851. дои : 10.1093/aje/kwh111 . ПМК 2080646 . ПМИД 15105177 .
- ^ Олшан А.Ф., Смит Дж., Кук М.Н., Груфферман С., Поллок Б.Х., Стрэм Д.О. и др. (ноябрь 1999 г.). «Употребление гормонов и препаратов для лечения бесплодия и риск нейробластомы: отчет Детской онкологической группы и Детской онкологической группы» . Американский журнал эпидемиологии . 150 (9): 930–938. doi : 10.1093/oxfordjournals.aje.a010101 . ПМИД 10547138 .
- ^ МакКолл Э.Э., Олшан А.Ф., Дэниелс Дж.Л. (август 2005 г.). «Использование краски для волос матери и риск нейробластомы у потомства». Причины рака и борьба с ним . 16 (6): 743–748. дои : 10.1007/s10552-005-1229-y . ПМИД 16049813 . S2CID 24323871 .
- ^ Черт возьми, Ритц Б., Хунг Р.Дж., Хашибе М., Боффетта П. (март 2009 г.). «Эпидемиология нейробластомы: обзор». Детская и перинатальная эпидемиология . 23 (2): 125–143. дои : 10.1111/j.1365-3016.2008.00983.x . ПМИД 19159399 .
- ^ Эстезионейробластома в eMedicine
- ^ Чунг НК (2005). Нейробластома . Спрингер-Верлаг . п. 73. ИСБН 978-3-540-40841-3 .
- ^ Стренгер В., Кербл Р., Дорнбуш Х.Дж., Ладенштайн Р., Амброс П.Ф., Амброс И.М., Урбан С. (май 2007 г.). «Диагностическое и прогностическое влияние катехоламинов мочи на пациентов с нейробластомой». Детская кровь и рак . 48 (5): 504–509. дои : 10.1002/pbc.20888 . ПМИД 16732582 . S2CID 34838939 .
- ^ Jump up to: а б Хоуман-Джайлз Р., Шоу П.Дж., Урен Р.Ф., Чанг Д.К. (июль 2007 г.). «Нейробластома и другие нейроэндокринные опухоли». Семинары по ядерной медицине . 37 (4): 286–302. doi : 10.1053/j.semnuclmed.2007.02.009 . ПМИД 17544628 .
- ^ Пашанкар Ф.Д., О'Дорисио М.С., Менда Ю. (январь 2005 г.). «МИБГ и аналоги рецепторов соматостатина у детей: современные концепции диагностического и терапевтического использования» . Журнал ядерной медицины . 46 (Приложение 1): 55С–61С. ПМИД 15653652 .
- ^ Jump up to: а б Бликер Г., Титгат Г.А., Адам Дж.А., Кэрон Х.Н., Кремер Л.К., Хоофт Л., ван Дален ЕС (сентябрь 2015 г.). «Сцинтиграфия 123I-MIBG и ПЭТ-визуализация 18F-ФДГ для диагностики нейробластомы» . Кокрановская база данных систематических обзоров . 2015 (9): CD009263. дои : 10.1002/14651858.cd009263.pub2 . ПМК 4621955 . ПМИД 26417712 .
- ^ Патологические основы болезней Роббинса и Котрана (9-е изд.). Эльзевир. 2015. ISBN 978-1-4557-2613-4 .
- ^ Эпендимома в eMedicine
- ^ Картер Р.Л., Аль-Самс С.З., Корбетт Р.П., Клинтон С. (май 1990 г.). «Сравнительное исследование иммуногистохимического окрашивания на нейрон-специфическую енолазу, белок-генный продукт 9.5 и белок S-100 при нейробластоме, саркоме Юинга и других круглоклеточных опухолях у детей». Гистопатология . 16 (5): 461–467. дои : 10.1111/j.1365-2559.1990.tb01545.x . ПМИД 2163356 . S2CID 6461880 .
- ^ Пешмаур М., д'Амор Э.С., Джоши В.В., Хата Дж., Роальд Б., Денер Л.П. и др. (ноябрь 2003 г.). «Пересмотр Международной классификации патологии нейробластомы: подтверждение благоприятных и неблагоприятных прогностических подгрупп узловой ганглионейробластомы» . Рак . 98 (10): 2274–2281. дои : 10.1002/cncr.11773 . ПМИД 14601099 . S2CID 27081822 .
- ^ «Лечение нейробластомы — Национальный институт рака» . 1 января 1980 г. Архивировано из оригинала 2 октября 2008 г. Проверено 30 июля 2008 г.
- ^ Бродер Г.М., Сигер Р.К., Барретт А., Бертольд Ф., Каслберри Р.П., Д'Анжио Дж. и др. (декабрь 1988 г.). «Международные критерии диагностики, стадии и реакции на лечение пациентов с нейробластомой». Журнал клинической онкологии . 6 (12): 1874–1881. дои : 10.1200/JCO.1988.6.12.1874 . ПМИД 3199170 .
- ^ Бродер Г.М., Причард Дж., Бертольд Ф., Карлсен Н.Л., Кастель В., Кастельберри Р.П. и др. (август 1993 г.). «Пересмотр международных критериев диагностики нейробластомы, стадии и реакции на лечение». Журнал клинической онкологии . 11 (8): 1466–1477. дои : 10.1200/JCO.1993.11.8.1466 . ПМИД 8336186 .
- ^ Шмидт М.Л., Лал А., Сигер Р.К., Марис Дж.М., Шимада Х., О'Лири М. и др. (сентябрь 2005 г.). «Благоприятный прогноз для пациентов в возрасте от 12 до 18 месяцев с неамплифицированной нейробластомой MYCN 4 стадии: исследование группы детского рака» . Журнал клинической онкологии . 23 (27): 6474–6480. дои : 10.1200/JCO.2005.05.183 . ПМИД 16116154 .
- ^ Кон С.Л., Лондон ВБ, Монклер Т., Маттей К.К., Амброс П.Ф., Пирсон А.Д. (2007). «Обновленная информация о разработке международной классификационной схемы групп риска нейробластомы (INRG)» . Журнал клинической онкологии . 25 (18 дополнений): 9503. doi : 10.1200/jco.2007.25.18_suppl.9503 . Архивировано из оригинала 10 января 2016 г.
- ^ Вудс В.Г., Гао Р.Н., Шустер Дж.Дж., Робисон Л.Л., Бернштейн М., Вайцман С. и др. (апрель 2002 г.). «Скрининг младенцев и смертность от нейробластомы» . Медицинский журнал Новой Англии . 346 (14): 1041–1046. doi : 10.1056/NEJMoa012387 . ПМИД 11932470 .
- ^ Шиллинг Ф.Х., Спикс С., Бертольд Ф., Эрттманн Р., Сандер Дж., Тройнер Дж., Михаэлис Дж. (июль 2003 г.). «Детям может не помочь скрининг нейробластомы в возрасте 1 года. Обновленные результаты популяционного контролируемого исследования в Германии». Письма о раке . 197 (1–2): 19–28. дои : 10.1016/S0304-3835(03)00077-6 . ПМИД 12880955 .
- ^ Цубоно Ю., Хисамити С. (май 2004 г.). «Прекращение скрининга нейробластомы в Японии» . Медицинский журнал Новой Англии . 350 (19): 2010–2011. дои : 10.1056/NEJM200405063501922 . ПМИД 15128908 .
- ^ «Скрининг нейробластомы» . Национальный институт рака. 1 января 1980 г. Архивировано из оригинала 1 октября 2008 г. Проверено 30 июля 2008 г.
- ↑ Даршак Сангхави, «Экранное оповещение: как унция профилактики RX может вызвать фунт боли». Архивировано 1 декабря 2006 г. в Wayback Machine , журнал Slate , 28 ноября 2006 г.
- ^ Джонсон Э., Дин С.М., Сондел П.М. (декабрь 2007 г.). «Иммунотерапия на основе антител при нейробластоме высокого риска». Обзоры экспертов в области молекулярной медицины . 9 (34): 1–21. дои : 10.1017/S1462399407000518 . ПМИД 18081947 . S2CID 32358612 .
- ^ Бродер GM (март 2003 г.). «Нейробластома: биологическое понимание клинической загадки». Обзоры природы. Рак . 3 (3): 203–216. дои : 10.1038/nrc1014 . ПМИД 12612655 . S2CID 6447457 .
- ^ Шульте Дж.Х., Хорн С., Отто Т., Саманс Б., Хойкамп Л.С., Эйлерс Калифорнийский университет и др. (февраль 2008 г.). «MYCN регулирует онкогенные микроРНК при нейробластоме» . Международный журнал рака . 122 (3): 699–704. дои : 10.1002/ijc.23153 . ПМИД 17943719 .
- ^ «Перенос геномики нейробластомы в клинику - презентация Дж. Мариса ASCO 2007» . Архивировано из оригинала 2 января 2009 г. Проверено 13 января 2008 г.
- ^ Гиссельссон Д., Лундберг Г., Ора И., Хёглунд М. (сентябрь 2007 г.). «Отличные эволюционные механизмы геномного дисбаланса при нейробластомах высокого и низкого риска» . Журнал канцерогенеза . 6:15 . дои : 10.1186/1477-3163-6-15 . ПМК 2042979 . ПМИД 17897457 .
- ^ «Лечение нейробластомы» . Национальный институт рака. 1 января 1980 г. Архивировано из оригинала 3 мая 2008 г. Проверено 2 февраля 2008 г.
- ^ Хаасе ГМ, Перес К., Аткинсон Дж.Б. (март 1999 г.). «Современные аспекты биологии, оценки риска и лечения нейробластомы». Семинары по хирургической онкологии . 16 (2): 91–104. doi : 10.1002/(SICI)1098-2388(199903)16:2<91::AID-SSU3>3.0.CO;2-1 . ПМИД 9988866 .
- ^ Fish JD, Grupp SA (январь 2008 г.). «Трансплантация стволовых клеток при нейробластоме» . Трансплантация костного мозга . 41 (2): 159–165. дои : 10.1038/sj.bmt.1705929 . ПМЦ 2892221 . ПМИД 18037943 .
- ^ Маттай К.К., Виллабланка Дж.Г., Сигер Р.К., Страм Д.О., Харрис Р.Э., Рамзи Н.К. и др. (октябрь 1999 г.). «Лечение нейробластомы высокого риска с помощью интенсивной химиотерапии, лучевой терапии, аутологичной трансплантации костного мозга и 13-цис-ретиноевой кислоты. Детская онкологическая группа» . Медицинский журнал Новой Англии . 341 (16): 1165–1173. дои : 10.1056/NEJM199910143411601 . ПМИД 10519894 .
- ^ Ю А.Л., Гилман А.Л., Озкайнак М.Ф., Лондон В.Б., Крейссман С.Г., Чен Х.Х. и др. (сентябрь 2010 г.). «Антитело к GD2 с GM-CSF, интерлейкином-2 и изотретиноином при нейробластоме» . Медицинский журнал Новой Англии . 363 (14): 1324–1334. дои : 10.1056/NEJMoa0911123 . ПМК 3086629 . ПМИД 20879881 .
- ^ Ялчин Б., Кремер Л.К., ван Дален Э.К. (октябрь 2015 г.). «Высокодозная химиотерапия и спасение аутологичных гемопоэтических стволовых клеток у детей с нейробластомой высокого риска» . Кокрановская база данных систематических обзоров . 2015 (10): CD006301. дои : 10.1002/14651858.cd006301.pub4 . ПМЦ 8783746 . ПМИД 26436598 .
- ^ «Лечение нейробластомы» . Национальный институт рака. 1 января 1980 г. Архивировано из оригинала 2 октября 2008 г. Проверено 30 июля 2008 г.
- ^ Ю А.Л., Гилман М.Ф., Озкайнак В.Б., Лондон С., Крайссман Х.Х., Чен К.К., Маттай С.Л., Кон Дж.М., Марис Дж.М., Сондел П.М. (2009). «Рандомизированное исследование фазы III химерного антитела против GD2 ch14.18 с GM-CSF и IL2 в качестве иммунотерапии после интенсивной химиотерапии нейробластомы высокого риска: исследование Детской онкологической группы (COG) ANBL0032» . Журнал клинической онкологии . 27 (15 доп.): 10067z. Архивировано из оригинала 10 января 2016 г. Проверено 10 сентября 2015 г.
- ^ Чермакова К., Тао Л., Деймек М., Сала М., Монтьерт М.Д., Чан Ю.С., Патель И., Чемберс С., Лоэза Кабрера М., Хоффман Д., Парчем Р.Дж., Ван В., Ненка Р., Барбьери Э., Ходжес ХК (2023-11- 23). «Реактивация ландшафта энхансеров G1 лежит в основе зависимости основных схем от SWI/SNF» . Исследования нуклеиновых кислот . 52 (1): 4–21. дои : 10.1093/nar/gkad1081 . ISSN 1362-4962 . ПМЦ 10783513 . ПМИД 37993417 .
- ^ «Снимок испытаний наркотиков: Даниэлза» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 25 ноября 2020 г. Проверено 25 декабря 2020 г. .
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ «Пакет одобрения лекарств: Даниэлза» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 22 декабря 2020 г. Проверено 25 декабря 2020 г. .
- ^ «Обзор нейробластомы» . Дети, больные раком, Великобритания . Проверено 01 июля 2020 г.
- ^ Кушнер Б.Х., Крамер К., ЛаКвалья М.П., Модак С., Ятаген К., Чунг Н.К. (декабрь 2004 г.). «Сокращение с семи до пяти циклов интенсивной индукционной химиотерапии у детей с нейробластомой высокого риска». Журнал клинической онкологии . 22 (24): 4888–4892. дои : 10.1200/JCO.2004.02.101 . ПМИД 15611504 .
- ^ Крейсман С.Г., Виллабланка Дж.Г., Диллер Л., Лондон В.Б., Марис Дж.М., Парк Дж.Р., Рейнольдс С.П., фон Аллмен Д., Кон С.Л., Маттей К.К. (2007). «Реакция и токсичность на режим индукционной химиотерапии с интенсивными дозами при нейробластоме высокого риска (HR-NB): исследование детской онкологической группы (COG A3973)» . Журнал клинической онкологии . 25 (18 дополнений): 9505. doi : 10.1200/jco.2007.25.18_suppl.9505 . Архивировано из оригинала 10 января 2016 г.
- ^ Чешель С., Казотто В., Вальсекки М.Г., Тамаро П., Янкович М., Ханау Г. и др. (октябрь 2006 г.). «Выживаемость после рецидива у детей с солидными опухолями: последующее исследование из итальянского регистра отсутствия терапии». Детская кровь и рак . 47 (5): 560–566. дои : 10.1002/pbc.20726 . ПМИД 16395684 . S2CID 31490896 .
- ^ Герни Дж.Г., Терсак Дж.М., Несс К.К., Ландье В., Маттей К.К., Шмидт М.Л. (ноябрь 2007 г.). «Потеря слуха, качество жизни и академические проблемы у долговременно выживших нейробластомы: отчет группы детской онкологии». Педиатрия . 120 (5): е1229–е1236. дои : 10.1542/пед.2007-0178 . ПМИД 17974716 . S2CID 10606999 .
- ^ Трэхейр Т.Н., Войлс М.Р., Джонстон К., Кон Р.Дж., Рассел С.Дж., Невилл К.А. и др. (октябрь 2007 г.). «Отдаленные результаты у детей с нейробластомой высокого риска, получавших аутологичную трансплантацию стволовых клеток» . Трансплантация костного мозга . 40 (8): 741–746. дои : 10.1038/sj.bmt.1705809 . ПМИД 17724446 .
- ^ Мозес А. (21 февраля 2007 г.). «Пережившие детский рак сталкиваются с повышенным риском развития саркомы» . День здоровья . Архивировано из оригинала 8 сентября 2015 года.
- ^ Оффингер К.С., Мертенс А.К., Склар К.А., Кавашима Т., Хадсон М.М., Медоуз А.Т. и др. (октябрь 2006 г.). «Хронические заболевания у взрослых, перенесших детский рак» . Медицинский журнал Новой Англии . 355 (15): 1572–1582. doi : 10.1056/NEJMsa060185 . ПМИД 17035650 .
- ^ Лавердьер С., Лю К., Ясуи Ю., Натан П.С., Герни Дж.Г., Стовалл М. и др. (август 2009 г.). «Долгосрочные результаты у выживших после нейробластомы: отчет об исследовании выживших после детского рака» . Журнал Национального института рака . 101 (16): 1131–1140. дои : 10.1093/jnci/djp230 . ПМЦ 2728747 . ПМИД 19648511 .
- ^ Жануэ-Лерози И., Шлейермахер Г., Михельс Э., Моссери В., Рибейро А., Лекин Д. и др. (март 2009 г.). «Общая геномная структура является предиктором исхода нейробластомы» . Журнал клинической онкологии . 27 (7): 1026–1033. дои : 10.1200/JCO.2008.16.0630 . ПМИД 19171713 .
- ^ Вандесомпель Дж., Баудис М., Де Претер К., Ван Рой Н., Амброс П., Баун Н. и др. (апрель 2005 г.). «Однозначное разграничение клинико-генетических подгрупп и разработка новой модели для улучшения прогнозирования исходов нейробластомы» (PDF) . Журнал клинической онкологии . 23 (10): 2280–2299. дои : 10.1200/JCO.2005.06.104 . ПМИД 15800319 . Архивировано из оригинала (PDF) 30 октября 2020 г. Проверено 18 ноября 2019 г.
- ^ Михельс Э., Вандесомпель Дж., Хобек Дж., Ментен Б., Де Претер К., Лорейс Г. и др. (2006). «Полногеномное измерение изменений количества копий ДНК при нейробластоме: рассечение ампликонов и картирование потерь, приростов и точек останова». Цитогенетические и геномные исследования . 115 (3–4): 273–282. дои : 10.1159/000095924 . ПМИД 17124410 . S2CID 14012430 .
- ^ Карен Х., Эриксен Дж., Олссон Л., Энербек С., Шёберг Р.М., Абрахамссон Дж. и др. (июль 2008 г.). «Анализ числа копий массива высокого разрешения для обнаружения делеции, усиления, амплификации и копийно-нейтрального LOH в первичных опухолях нейробластомы: четыре случая гомозиготных делеций гена CDKN2A» . БМК Геномика . 9 : 353. дои : 10.1186/1471-2164-9-353 . ПМК 2527340 . ПМИД 18664255 .
- ^ Данные и ссылки на круговую диаграмму находятся на странице описания файла в Wikimedia Commons.
- ^ Бродер Г.М., Хогарти М.Д., Мосс Ю.П., Марис Дж.М. (1997). "Нейробластома". В Пиццо, Пенсильвания, Поплак Д.Г. (ред.). Принципы и практика детской онкологии (6-е изд.). Wolters Kluwer Health/Lippincott Williams & Wilkins. стр. 886–922. ISBN 978-1-60547-682-7 .
- ^ Фрэнкс Л.М., Боллен А., Сигер Р.К., Страм Д.О., Маттей К.К. (май 1997 г.). «Нейробластома у взрослых и подростков: вялотекущее течение с плохой выживаемостью» . Рак . 79 (10): 2028–2035. doi : 10.1002/(SICI)1097-0142(19970515)79:10<2028::AID-CNCR26>3.0.CO;2-V . ПМИД 9149032 .
- ^ Ладенштайн Р., Пётшгер У., Хартман О., Пирсон А.Д., Клингебиль Т., Кастель В. и др. (июнь 2008 г.). «28 лет высокодозной терапии и СКТ при нейробластоме в Европе: уроки более чем 4000 процедур» . Трансплантация костного мозга . 41 (Приложение 2): S118–S127. дои : 10.1038/bmt.2008.69 . ПМИД 18545256 .
- ^ Бертольд Ф, Саймон Т (2006). «Клиническая презентация» . В Cheung NK, Cohn SL (ред.). Нейробластома . Спрингер. стр. 63–85. ISBN 978-3-540-26616-7 .
- ^ Беквит Дж. Б., Перрин Э. В. (декабрь 1963 г.). «Нейробластомы in situ: вклад в естественную историю опухолей нервного гребня» . Американский журнал патологии . 43 (6): 1089–1104. ЧВК 1949785 . ПМИД 14099453 .
- ^ Ротенберг А.Б., Бердон В.Е., Д'Анжио Г.Дж., Ямасиро Д.Д., Коулз Р.А. (февраль 2009 г.). «Нейробластома - вспоминая трех врачей, описавших ее сто лет назад: Джеймса Гомера Райта, Уильяма Пеппера и Роберта Хатчисона». Детская радиология . 39 (2): 155–160. дои : 10.1007/s00247-008-1062-z . ПМИД 19034443 . S2CID 19611725 .
- ^ Jump up to: а б с Брекевельдт Н., Вигеруп С., Гиссельссон Д., Мохлин С., Мерселиус М., Бекман С. и др. (март 2015 г.). «Ортотопические ксенотрансплантаты, полученные от пациента с нейробластомой, сохраняют метастатические структуры, а также гено- и фенотипы опухолей пациента» . Международный журнал рака . 136 (5): E252–E261. дои : 10.1002/ijc.29217 . ПМК 4299502 . ПМИД 25220031 .
- ^ Малани П., Никосия С.В., Даве В. (март 2014 г.). «Одна мышь, один пациент: новые воплощения персонализированной терапии рака» . Письма о раке . 344 (1): 1–12. дои : 10.1016/j.canlet.2013.10.010 . ПМК 4092874 . ПМИД 24157811 .
- ^ Тентлер Дж.Дж., Тан А.С., Уикс К.Д., Химено А., Леонг С., Питтс Т.М. и др. (апрель 2012 г.). «Ксенотрансплантаты опухолей, полученные от пациента, как модели для разработки онкологических лекарств» . Обзоры природы. Клиническая онкология . 9 (6): 338–350. дои : 10.1038/nrclinonc.2012.61 . ПМЦ 3928688 . ПМИД 22508028 .
- ^ «Комитет по нейробластоме — текущий фокус исследований» . Архивировано из оригинала 25 сентября 2006 года . Проверено 13 января 2008 г.
- ^ Бейкер Д.Л., Шмидт М.Л., Кон С.Л., Марис Дж.М., Лондон В.Б., Бакстон А. и др. (сентябрь 2010 г.). «Результаты сокращенной химиотерапии нейробластомы промежуточного риска» . Медицинский журнал Новой Англии . 363 (14): 1313–1323. дои : 10.1056/NEJMoa1001527 . ПМК 2993160 . ПМИД 20879880 . Архивировано из оригинала 13 января 2013 г.
- ^ Бейкер Д.Л., Шмидт М.Л., Кон С.Л., Марис Дж.М., Лондон В.Б., Бакстон А. и др. (сентябрь 2010 г.). «Результаты уменьшенной химиотерапии нейробластомы промежуточного риска» . Медицинский журнал Новой Англии . 363 (14): 1313–1323. дои : 10.1056/NEJMoa1001527 . ПМК 2993160 . ПМИД 20879880 .
- ^ Моргенштерн Д.А., Барушель С., Ирвин М.С. (июль 2013 г.). «Текущие и будущие стратегии лечения рецидивирующей нейробластомы: проблемы на пути к точной терапии». Журнал детской гематологии/онкологии . 35 (5): 337–347. дои : 10.1097/MPH.0b013e318299d637 . ПМИД 23703550 . S2CID 5529288 .
- ^ Ильхардт Т., Топорски Дж., Фейхтингер Т., Туркевич Д., Тельчик Х.М., Эбингер М. и др. (май 2018 г.). «Гаплоидентичная трансплантация стволовых клеток при рефрактерной/рецидивирующей нейробластоме» . Биология трансплантации крови и костного мозга . 24 (5). Эльзевир Б.В.: 1005–1012. дои : 10.1016/j.bbmt.2017.12.805 . ПМИД 29307718 .
- ^ Георганци К., Цолакис А.В., Стридсберг М., Якобсон О., Кристоферсон Р., Янсон Э.Т. (апрель 2011 г.). «Дифференцированная экспрессия подтипов рецепторов соматостатина в экспериментальных моделях и клинической нейробластоме: экспрессия рецепторов соматостатина в нейробластоме» . Детская кровь и рак . 56 (4): 584–589. дои : 10.1002/pbc.22913 . ПМИД 21298743 . S2CID 33330859 .
- ^ Гейнс Дж.Э., Себире, Нью-Джерси, Мороз В., Уитли К., Гейз М.Н. (01.03.2018). «Иммуногистохимическая оценка экспрессии мишеней молекулярной лучевой терапии в ткани нейробластомы» (PDF) . Европейский журнал ядерной медицины и молекулярной визуализации . 45 (3): 402–411. дои : 10.1007/s00259-017-3856-4 . ISSN 1619-7089 . ПМИД 29043399 . S2CID 30833979 .
- ^ Альберс А.Р., О'Дорисио М.С., Балстер Д.А., Капрара М., Гош П., Чен Ф., Хогер С., Ривьер Дж., Венгер Г.Д., О'Дорисио Т.М., Куалман С.Дж. (17 марта 2000 г.). «Экспрессия гена рецептора соматостатина при нейробластоме» . Регуляторные пептиды . 88 (1): 61–73. дои : 10.1016/S0167-0115(99)00121-4 . ISSN 0167-0115 . ПМИД 10706954 . S2CID 11168638 .
- ^ Гейнс Дж.Э., Боманджи Дж.Б., Фершт Н.Л., Салливан Т., Д'Суза Д., Салливан К.П. и др. (июль 2011 г.). «Молекулярная лучевая терапия 177Lu-DOTATATE при нейробластоме у детей» . Журнал ядерной медицины . 52 (7): 1041–1047. дои : 10.2967/jnumed.110.085100 . ПМИД 21680680 . S2CID 38660848 .
- ^ Конг Г., Хофман М.С., Мюррей В.К., Уилсон С., Вуд П., Дауни П. и др. (март 2016 г.). «Первоначальный опыт применения ПЭТ/КТ и радионуклидной терапии пептидных рецепторов галлия-68 с дота-октреотатом у педиатрических пациентов с рефрактерной метастатической нейробластомой» . Журнал детской гематологии/онкологии . 38 (2): 87–96. дои : 10.1097/MPH.0000000000000411 . ПМИД 26296147 . S2CID 25518501 .
- ^ Менда Ю., О'Дорисио М.С., Као С., Ханна Г., Майкл С., Коннолли М. и др. (октябрь 2010 г.). «Фаза I исследования терапии 90Y-DOTATOC у детей и молодых людей с рефрактерными солидными опухолями, которые экспрессируют рецепторы соматостатина» . Журнал ядерной медицины . 51 (10): 1524–1531. дои : 10.2967/jnumed.110.075226 . ПМЦ 3753801 . ПМИД 20847174 .
- ^ Общие данные INRG
- ^ Общие данные о педиатрическом раке
- ^ Чикко Д., Сероно Г., Кангелози Д. (2022), «Опрос общедоступных открытых наборов данных, полученных из электронных медицинских карт (ЭМК) пациентов с нейробластомой», Data Science Journal , 21 (1): 17 , номер документа : 10.5334/dsj-2022-017
- ^ "Дом" . Достижения Ассоциации исследования нейробластомы . 26 апреля 2014 года . Проверено 11 апреля 2024 г.