Атипичная тератоидная рабдоидная опухоль
| Атипичная тератоидная рабдоидная опухоль | |
|---|---|
 | |
| МРТ AT/RT | |
| Специальность | Нейроонкология |
| Обычное начало | Возраст 3 года и младше [1] |
| Прогноз | Пятилетняя выживаемость : 32,2% [2] |
| Частота | ~58 новых диагнозов в год (США) [2] |
Атипичная тератоидно-рабдоидная опухоль ( AT/RT ) — редкая опухоль, обычно диагностируемая в детстве. Хотя обычно это опухоль головного мозга , AT/RT может возникнуть в любом отделе центральной нервной системы (ЦНС), включая спинной мозг . Около 60% будет находиться в задней черепной ямке (особенно в мозжечке ). По оценкам одного обзора, 52% локализуются в задней ямке, 39% — это супратенториальные примитивные нейроэктодермальные опухоли (sPNET), 5% — в шишковидной железе , 2% — в позвоночнике и 2% — мультифокальные. [3]
В Соединенных Штатах каждый год диагностируется три ребенка на 1 000 000, или около 30 новых случаев AT/RT. AT/RT составляет около 3% случаев рака ЦНС у детей. [4] Около 17% всех случаев рака у детей поражают ЦНС, что делает этот рак наиболее распространенной солидной опухолью у детей. [ нужна ссылка ] Выживаемость при опухолях ЦНС составляет около 60%. Детский рак головного мозга является второй по значимости причиной детской смертности от рака после лейкемии . Последние тенденции показывают, что общий уровень диагностики опухолей ЦНС увеличивается примерно на 2,7% в год. Поскольку диагностические методы с использованием генетических маркеров совершенствуются и используются все чаще, ожидается, что доля диагнозов AT/RT будет увеличиваться.
AT/RT был признан как субъект только в 1996 году и добавлен в Всемирной организации здравоохранения в 2000 году (класс IV). Классификацию опухолей головного мозга [5] Относительно недавняя классификация и редкость способствовали первоначальному неправильному диагнозу и неоптимальной терапии. Это привело к исторически неблагоприятным прогнозам. [6]
Текущие исследования сосредоточены на использовании протоколов химиотерапии , эффективных против рабдомиосаркомы, в сочетании с хирургическим вмешательством и лучевой терапией.
Недавние исследования с использованием мультимодальной терапии показали значительное улучшение показателей выживаемости. В 2008 годуИнститут рака Дана-Фарбер в Бостоне сообщил о двухлетней общей выживаемости 53% и бессобытийной выживаемости 70% (средний возраст на момент постановки диагноза 26 месяцев). [7] В 2013 году Венский медицинский университет сообщил о пятилетней общей выживаемости 100% и бессобытийной выживаемости 89% (средний возраст на момент постановки диагноза 24 месяца). [8]
Показатели выживаемости могут быть значительно улучшены, если с самого начала поставить правильный генетический диагноз, а затем провести специфическое мультимодальное лечение.
Признаки и симптомы
[ редактировать ]Клинические признаки и симптомы зависят от локализации опухоли.
Поскольку многие опухоли возникают в задней ямке , они проявляются, как и другие опухоли задней ямки, часто с головной болью, рвотой, летаргией и атаксией (неустойчивой походкой). о случае семимесячного ребенка с преимущественно опухолью позвоночника , которая проявлялась прогрессирующей параплегией и ненормальной чувствительностью в ногах. Сообщалось [9]
Генетика
[ редактировать ]Генетическое сходство было обнаружено в рабдоидных опухолях. В частности, хромосомы делеция 22 очень распространена у AT/RT. Область хромосомы 22 содержит hSNF5/INI1 ген , который, по-видимому, действует как классический ген- супрессор опухоли . [10] Большинство рабдоидных опухолей имеют делеции INI1 независимо от того, возникают ли они в ЦНС, почках или где-либо еще. Эта мутация рассматривается как «первый удар», который предрасполагает детей к злокачественным новообразованиям. INI1/hSNF5 , компонент комплекса SWI/SNF, ремоделирующего хроматин , является критическим опухолевым супрессором, биаллельно инактивируемым в рабдоидных опухолях. Идентификация INI1 как супрессора опухоли облегчила точную диагностику рабдоидных опухолей.
Скорость транскрипции комплексов SWI/SNF и HDAC , по-видимому, регулируется геном INI1 . Комплекс SWI/SNF играет роль в ремоделировании хроматина. AT/RT — первая педиатрическая опухоль головного мозга, для которой был идентифицирован кандидатный ген-супрессор опухоли. Мутация или делеция гена INI1/hSNF5 встречается в большинстве опухолей AT/RT. До 90% случаев AT/RT связаны с делецией 22 хромосомы. В основном это точечные мутации в гене hSNF5/INI1 (т.е. AT/RT можно диагностировать без делеции хромосомы 22 в другом месте). Ген hSNF5/INI1 регулирует около 15 белков в структуре хроматина. Кроме того, ген OPN имеет более высокую экспрессию в опухолях AT/RT. Считается, что все виды рака AT/RT не связаны с геном hSNF5/INI1 , поскольку 14 дополнительных белков в структуре хроматина контролируются другими генами. Существуют также новые мышиные модели рака AT/RT, а также экспериментальные клеточные линии, полученные из опухолей. Несмотря на эти достижения, функция гена еще не изучена. О функции INI1 известно недостаточно: либо как независимого модулятора экспрессии генов, либо благодаря его связи с Комплекс SWI/SNF , позволяющий использовать для лечения специфические таргетные биологические агенты. Проспективные клинические и биологические исследования крайне необходимы для понимания эффективности терапевтических вмешательств, а также роли гена.
Риск для братьев и сестер и других членов семьи
[ редактировать ]Атипичные тератоидные/рабдоидные опухоли встречаются очень редко, и в литературе не сообщается об абсолютном риске для братьев и сестер. Однако существуют некоторые сообщения о наличии AT/RT у двух членов одной семьи или у одного члена семьи с AT/RT, а у другого - с рабдоидной опухолью почки или другой опухолью ЦНС. Предполагается, что они возникают в результате генетических мутаций зародышевой линии у одного из родителей, общих для затронутых братьев и сестер.
- Известна семья из трех поколений, в которой у двух сводных братьев были диагностированы атипичные тератоидно-рабдоидные опухоли ЦНС (АТ/РТ). У двух мальчиков, которым диагноз был поставлен в возрасте 2 и 17 месяцев, была инсерционная мутация зародышевой линии в экзоне 4 гена INI1 , унаследованная от их здоровой матери. Дядя по материнской линии умер в детстве от опухоли головного мозга и злокачественной рабдоидной опухоли почки. Идентификация двух незатронутых носителей в семье, разделяющей мутацию зародышевой линии и рабдоидную опухоль, подтверждает гипотезу о том, что могут существовать различные риски развития рабдоидной опухоли в контексте мутации зародышевой линии. Большинство рабдоидных опухолей могут возникать в окне развития. Эта семья подчеркивает важность анализа мутаций у всех пациентов с подозрением на рабдоидную опухоль. [11]
- В первом сообщении о случае монозиготных близнецов с опухолями головного мозга, имеющими сходные генетические изменения, авторы предполагают общий генетический путь. [12]
- Сообщалось о случае младенца, у которого развились как AT/RT, так и рабдоидные опухоли почки, которые были идентичны по макроскопической и иммунологической гистологии. [13]
- В семье было несколько поколений опухолей задней черепной ямки, включая рабдоидные опухоли и карциному сосудистого сплетения . Зародышевая мутация ( SMARCB1 ) была обнаружена как у пораженных, так и у некоторых здоровых членов семьи. [14]
- Двум сестрам был поставлен диагноз АТ/РТ с разницей в 15 дней. В отчете о случае указано, что кариотипических аномалий не отмечено. [15]
- У трех братьев и сестер была мутация гена SMARCB1 сосудистого сплетения , у одного была карцинома , а у двух - AT/RT. Хотя у матери была нормальная соматическая ДНК, мутация, по-видимому, была унаследована от зародышевой линии матери вследствие мутации во время оогенеза . [16]
- Изицка-Свешевска и др. описывают пятимесячного ребенка с ПТ/РТ, у отца которого диагностирована примитивная нейроэктодермальная опухоль (ПНЭО) позвоночного канала. Флуоресцентный in situ анализ гибридизации показал значительные генетические различия в образцах, что позволяет предположить, что возникновение этих вирулентных злокачественных новообразований ЦНС в пределах одной семьи было случайным. [17]
Патология
[ редактировать ]AT/RT и рабдоидная опухоль имеют общий термин «рабдоид», поскольку под микроскопом обе опухоли напоминают рабдомиосаркому. [ нужна ссылка ] .
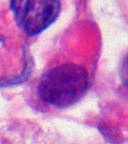
- Гистология AT/RT с многочисленными рабдоидными опухолевыми клетками
- Рабдоидная опухолевая клетка – 400-кратное увеличение
Гистология
[ редактировать ]опухоли Гистопатология представляет собой перемешанные мелкие и крупные клетки. Ткань эпителиальные этой опухоли содержит множество различных типов клеток, включая рабдоидные клетки, крупные веретенообразные клетки, и мезенхимальные клетки, а также участки, напоминающие примитивную нейроэктодермальную опухоль (ПНЭО). До 70% опухоли может состоять из PNET-подобных клеток. характерные для ультраструктуры завитки промежуточных нитей наблюдаются В рабдоидных опухолях (как и в любой области тела) . Хо и его коллеги обнаружили серповидные обхватывающие клетки, о которых ранее не сообщалось, во всех 11 случаях AT/RT. [18]
Иммуногистохимия
[ редактировать ]
Иммуногистохимическое окрашивание широко используется в диагностике и лечении рака. Специфические молекулярные маркеры характерны для определенных типов рака. Иммуногистохимия также широко используется в фундаментальных исследованиях для понимания распределения и локализации биомаркеров в различных частях ткани. Белки, обнаруженные в ATeratoid/RT: [ нужна ссылка ]
- Виментин - положительный
- Цитокератин -положительный
- Нейрон-специфическая енолаза-положительная
- Эпителиальный мембранный антиген-положительный
- Глиальный фибриллярный кислый белок - положительный
- Синаптофизин
- хромогранин
- гладких мышц Актин
- Десмин
- Карциноэмбриональный антиген
- CD99 антиген ; [19] [20]
- С-100
- нейрофиламенты
- АФП – не обнаружено
- ХГЧ – отрицательный
Цитогенетические исследования
[ редактировать ]Цитогенетика — это изучение генетического состава опухоли. Флуоресцентная гибридизация in situ может помочь обнаружить мутацию или аномалию, которая может способствовать росту опухоли. [21] Было показано, что этот метод полезен при идентификации некоторых опухолей и различении двух гистологически сходных опухолей друг от друга (например, AT/RT и PNET). В частности, медуллобластмы/ПНЭО можно цитогенетически дифференцировать от AT/RT, поскольку хромосомные делеции 17p относительно часто встречаются при медуллобластоме, а аномалии 22q11.2 не наблюдаются. Однако делеции 22 хромосомы очень распространены при AT/RT.
Подчеркивается важность гена hSNF5/INI1 , расположенного на хромосомном участке 22q11.2, поскольку наличия мутации достаточно для изменения диагноза с медуллобластомы или ПНЭО на более агрессивную классификацию AT/RT. Однако эта мутация не присутствует в 100% случаев. Следовательно, если мутация не присутствует в классической иммуногистохимической и морфологической картине AT/RT, тогда диагноз остается AT/RT.
Диагностика
[ редактировать ]Стандартное обследование при AT/RT включает в себя: [ нужна ссылка ]
- Магнитно-резонансная томография (МРТ) головного мозга и позвоночника
- Люмбальная пункция для выявления болезни М1.
- Компьютерная томография (КТ) грудной клетки и брюшной полости для проверки наличия опухоли.
- Аспирация костного мозга для проверки на наличие опухолей костей. Иногда врач выполняет трансплантацию стволовых клеток.
- Биопсия костного мозга
- Сканирование костей
Первоначальный диагноз опухоли устанавливают при рентгенологическом исследовании ( МРТ). [22] или КТ -). Если сначала была проведена КТ, обычно проводят МРТ, поскольку изображения часто более детальны и могут выявить ранее необнаруженные метастатические опухоли в других участках головного мозга. МРТ позвоночника . Кроме того, обычно проводят Опухоль AT/RT часто распространяется на позвоночник. AT/RT трудно диагностировать только на основании рентгенологического исследования; обычно патологоанатом должен провести цитологический или генетический анализ.
Важное значение имеет исследование спинномозговой жидкости (ликвора), так как у трети пациентов наблюдается внутричерепная диссеминация с вовлечением ликвора. Крупные опухолевые клетки, эксцентриситет ядер и выступающие ядрышки являются последовательными результатами. [23] Обычно только в небольшом количестве биоптатов AT/RT обнаруживаются рабдоидные клетки, что затрудняет диагностику. Все чаще рекомендуется проводить генетический анализ опухоли головного мозга, особенно для того, чтобы определить, связана ли с ней делеция гена INI1/hSNF5 (на долю которой приходится более 80% случаев). Правильный диагноз опухоли имеет решающее значение для любого протокола. Исследования показали, что от 8% до более 50% опухолей AT/RT диагностируются неправильно. [ нужна ссылка ]
Классификация
[ редактировать ]АТ/РТ может быть связана со злокачественной рабдоидной опухолью (МРТ), которая возникает за пределами ЦНС, обычно в почках. [ нужна ссылка ] Обнаружение того, что AT/RT и MRT имеют делеции гена . INI1 [ нужна ссылка ] указывает на то, что рабдоидные опухоли почек и головного мозга, по крайней мере, тесно связаны. AT/RT и MRT также имеют схожую гистологию и схожие клинические и демографические особенности. Более того, у 10–15% пациентов с МРТ одновременно или в последующем наблюдаются опухоли головного мозга, многие из которых являются вторичными или первичными МРТ.
Дифференциальный диагноз
[ редактировать ]Важнейшим шагом в планировании лечения является определение правильной гистологии опухоли. Неправильная идентификация гистологии опухоли может привести к ошибкам в лечении и прогнозе. [24]
Атипичная тератоидная/рабоидная опухоль очень напоминает медуллобластому. [25] примитивная нейроэктодермальная опухоль , карцинома сосудистого сплетения и некоторые виды опухолей зародышевых клеток . [ нужна ссылка ] Поскольку рабдоидные характеристики не являются единственным компонентом AT/RT, некоторые участки AT/RT могут напоминать другие опухоли. Эти характеристики могут присутствовать только в очаговых областях или могут быть менее выраженными. [ нужна ссылка ]
Рассмотрение АТ/ЛТ при подозрении на медуллобластому или ПНЭО важно, особенно у детей в возрасте до одного года. Цитогенетические исследования могут помочь дифференцировать MB/PNET от AT/RT. Некоторые виды опухолей зародышевых клеток секретируют опухолевые маркеры АФП или БХГЧ ; AT/RT этого не делают. [ нужна ссылка ]
Явка на рентгенологическое исследование
[ редактировать ]AT/RT могут возникать в любых участках ЦНС; однако около 60% расположены в задней ямке или области мозжечка. Исследование ASCO показало наличие задней ямки в 52% случаев; 39% СПНЕТ; 5% шишковидная железа ; 2% спинальные и 2% мультифокальные. [3]
Внешний вид опухолей на КТ и МРТ неспецифичен, имеет тенденцию к большим размерам, кальцинозам , некрозу (отмиранию тканей) и кровоизлияниям (кровотечениям). Сами по себе радиологические исследования не могут выявить AT/RT; патологоанатом почти всегда должен оценить образец ткани головного мозга.
Повышенная клеточность опухоли может выглядеть на неконтрастируемой КТ повышенным затуханием. Солидные части опухоли часто увеличиваются при контрастной МРТ. Результаты на Т1- и Т2- взвешенных изображениях варьируются. Преконтрастные Т2-взвешенные изображения могут показывать изосигнал или слегка гиперсигнал. Солидные компоненты опухоли могут усиливаться при контрастировании, но не всегда. МРТ-исследования, по-видимому, позволяют лучше выявлять метастатические очаги в других внутричерепных, а также внутрипозвоночных местах.
Для выявления метастатического заболевания необходимы предоперационные и последующие исследования.
Уход
[ редактировать ]Операция
[ редактировать ]Хирургическое вмешательство играет решающую роль в получении ткани для постановки точного диагноза . Сама по себе хирургическая операция не является излечивающей. Кроме того, 30% AT/RT расположены супратенториально, и существует склонность к мостомозжечковому углу. [26] что затрудняет хирургическую резекцию. у одной трети или более детей будет диссеминированное заболевание На момент постановки диагноза . Полная или почти полная резекция часто невозможна.
Химиотерапия
[ редактировать ]Около 50% AT/RT дают временный ответ, но химиотерапия сама по себе редко приводит к излечению. Стандартного лечения AT/RT не известно. Против AT/RT использовались различные химиотерапевтические агенты, которые также используются против других опухолей ЦНС, включая цисплатин , карбоплатину , циклофосфамид , винкристин и этопозид . Некоторые схемы химиотерапии перечислены ниже:
- Клиническое исследование CCG CCG-9921 было активировано в 1993 году, а его результаты были опубликованы в 2005 году. Предлагаемые методы лечения не имели различных результатов и не были улучшением по сравнению с предыдущими методами лечения. [27] Гейер опубликовал обзор химиотерапии у 299 младенцев с опухолями ЦНС, в котором оценивалась частота ответа, бессобытийная выживаемость (БВС) и токсичность двух химиотерапевтических схем лечения детей младше 36 месяцев со злокачественными опухолями головного мозга. Пациенты были случайным образом распределены на одну из двух схем индукционной химиотерапии (винкристин, цисплатин, циклофосфамид и этопозид против винкристина, карбоплатина, ифосфамида и этопозида). Интенсивная индукционная химиотерапия привела к высокой частоте ответа на злокачественные опухоли головного мозга у младенцев. Выживаемость была сопоставима с таковой в предыдущих исследованиях, и большинство выживших пациентов не получали лучевую терапию. [27]
- Протоколы лечения саркомы . В литературе имеется по крайней мере одно сообщение о злокачественных рабдоидных опухолях ЦНС, которые лечатся как внутричерепная саркома высокой степени злокачественности . Эти три случая лечились хирургическим путем, химиотерапией, лучевой терапией и тройной интратекальной химиотерапией, аналогично рекомендациям Межгруппового исследования рабдомиосаркомы III. [28]
- Интратекальные протоколы. Одна из трудностей при опухолях головного и спинного мозга заключается в том, что гематоэнцефалический барьер для того, чтобы лекарство могло попасть в опухоль, необходимо преодолеть . Одним из механизмов доставки препарата является устройство, называемое резервуаром Оммайя . Это устройство, которое имеет некоторые общие характеристики с шунтом, в котором трубку хирургическим путем помещают в жидкость, окружающую мозг, а резервуар в форме луковицы, прикрепленный к трубке, помещают под кожу головы. Когда ребенок должен получать интратекальную химиотерапию , препарат вводится в этот резервуар луковицы. В других случаях интратекальные химиотерапевтические агенты вводятся посредством люмбальной пункции (спинномозговой пункции). Действующий протокол Консорциума по лечению опухолей головного мозга у детей использует интратекально мафосфамид , предварительно активированное производное циклофосфамида , в дополнение к другим методам воздействия на эту опухоль. [29]
- Высокодозная химиотерапия с спасением стволовых клеток. Эта терапия использует химиотерапию в дозах, достаточно высоких, чтобы полностью подавить костный мозг . Перед началом этой терапии ребенку устанавливают центральную линию и стволовые клетки собирают . После терапии эти клетки возвращаются ребенку для восстановления костного мозга . Первоначально считалось, что спасение стволовых клеток или аутологичная трансплантация костного мозга принесет пользу широкой группе пациентов, но за время истории протоколов химиотерапии их количество уменьшилось .
Лучевая терапия
[ редактировать ]Традиционной практикой при опухолях головного мозга у детей является использование химиотерапии и отсрочка лучевой терапии до тех пор, пока ребенок не достигнет возраста трех лет. Эта стратегия основана на наблюдениях о том, что у детей в возрасте до трех лет возникают серьезные долгосрочные осложнения в результате облучения мозга. Однако долгосрочные результаты AT/RT настолько плохие, что некоторые протоколы требуют предварительной лучевой терапии, часто несмотря на молодой возраст. [30]
Доза и объем радиации не были стандартизированы, но, по-видимому, радиация действительно улучшает выживаемость. Использование радиации у детей младше трех лет ограничено из-за риска серьезных нейрокогнитивных нарушений. Протоколы с использованием конформного локального облучения у маленького ребенка используются, чтобы попытаться вылечить эту опухоль.
Внешнее лучевое (конформное) излучение использует несколько лучей, пересекающихся в месте расположения опухоли; нормальная ткань мозга получает меньше радиации, и поэтому когнитивные функции страдают меньше.
С 2002 года протонно-лучевое облучение предлагалось только в Массачусетской больнице общего профиля в Бостоне и в Лома Линда, Калифорния. С 2003 года в Соединенных Штатах открылись еще три или четыре центра протонной терапии. Детская исследовательская больница Св. Джуда находится в процессе строительства такой больницы в Мемфисе, штат Теннесси. Некоторые центры с тех пор открылись в Европе. (Германия, Швейцария и Франция). [31] [32] [33] [34] [35] [36]
Агенты ремоделирования хроматина
[ редактировать ]Этот протокол все еще находится на доклинической оценке. Ингибиторы гистондеацетилазы представляют собой новый класс противораковых средств, направленных непосредственно на ремоделирование хроматина . Эти агенты использовались при остром промиелоцитарном лейкозе, и было обнаружено, что они влияют на репрессию транскрипции, опосредованную HDAC . Понимания дефицита INI1 недостаточно, чтобы предсказать, будут ли ингибиторы HDAC эффективны против AT/RT. Некоторые лабораторные результаты показывают, что он эффективен против определенных клеточных линий AT/RT. [37]
Прогноз
[ редактировать ]Прогноз для AT/RT был очень плохим, хотя существуют некоторые признаки того, что терапия на основе IRSIII может обеспечить долгосрочную выживаемость (от 60 до 72 месяцев). Двухлетняя выживаемость составляет менее 20%, средняя выживаемость после операции составляет 11 месяцев, и врачи часто рекомендуют паллиативную помощь, особенно детям младшего возраста, из-за плохих результатов. [ нужна ссылка ] Недавно протокол, использованный в многоцентровом исследовании, опубликованный в Журнале клинической онкологии, привел к 70% выживаемости в течение 2–3 лет, при этом большинство рецидивов происходит в течение нескольких месяцев, что дает надежду на то, что существует точка, после которой пациентов можно считать излеченными. . [38]
Пациенты с метастазами (рассеянная опухоль), более крупными опухолями, опухолями, которые невозможно было полностью удалить, или с рецидивом опухоли, а также у пациентов моложе 36 месяцев имели худшие результаты (т. е. более короткое время выживания). [ нужна ссылка ]
Ретроспективное исследование 36 случаев AT/RT в детской больнице Св. Джуда с 1984 по 2003 год показало, что двухлетняя бессобытийная выживаемость (БВС) для детей в возрасте до трех лет составила 11%, а общая выживаемость (ОВ) составила 17. %. Для детей в возрасте 3 лет и старше EFS составлял 78%, а OS 89%. [6] Ретроспективный регистр в детской больнице Кливленда 42 пациентов с AT/RT показал, что медиана выживаемости составляет 16,25 месяцев, а уровень выживаемости составляет около 33%. [39] В четверти этих случаев мутация гена INI1/hSNF5 не выявлена .
Наиболее долгосрочные выживаемости, о которых сообщается в литературе:
- (а) Хильден и его коллеги сообщили о ребенке, который все еще не болел через 46 месяцев после постановки диагноза. [39]
- (б) Олсон и его коллеги сообщили о ребенке, у которого не было заболевания через пять лет с момента постановки диагноза на основании протокола IRS III. [40]
- (c) В 2003 году Хирт сообщил о пациенте, который не болел в течение шести лет. [41]
- (d) Циммерман в 2005 году сообщил о выживаемости от 50 до 72 месяцев у четырех пациентов, использующих протокол на основе IRS III. Двое из этих пациентов, выживших в течение длительного времени, прошли лечение после рецидива AT/RT. [42]
- (e) В исследовании Нью-Йоркского университета (Gardner 2004) четверо из 12 человек пережили AT/RT в течение длительного времени; самый старший был жив через 46 месяцев после постановки диагноза. [43]
- (f) Венский медицинский университет, 2013 г., сообщил о 16-летнем выжившем среди других долгосрочных выживших. [8]
Лечение рака у детей, выживших в течение длительного времени, обычно вызывает ряд негативных последствий для физического благополучия, фертильности, когнитивных функций и обучения . [44] [45] [46] [47]
Метастазирование
[ редактировать ]На момент постановки диагноза метастатическое распространение отмечается примерно в трети случаев ПТ/РТ, а опухоли могут возникать в любом месте ЦНС. Исследование ASCO 188 задокументированных случаев AT/RT до 2004 года показало, что в 30% случаев на момент постановки диагноза были метастазы. [3] Метастатическое распространение на мозговые оболочки (лептоменигиальное распространение, иногда называемое сахарным покрытием) часто встречается как на начальном этапе, так и при рецидиве. Среднее время выживания снижается при наличии метастазов. Первичные опухоли ЦНС обычно метастазируют только в пределах ЦНС.
одном случае метастатического поражения брюшной полости через вентрикулоперитонеальный шунт Сообщалось об при использовании AT/RT. Сообщалось о метастатической диссеминации по этому механизму при других опухолях головного мозга, включая герминомы , медуллобластомы , астроцитомы , глиобластомы , эпендимомы и опухоли эндодермального синуса . Гюлер и Сугита по отдельности сообщили о случаях метастазирования в легкие без шунта. [48] [49]
Эпидемиология
[ редактировать ]По оценкам, 3% опухолей головного мозга у детей представляют собой AT/RT, хотя этот процент может увеличиться при более четкой дифференциации опухолей PNET/медуллобластомы и AT/RT. [ нужна ссылка ]
Как и при других опухолях ЦНС, чаще страдают мужчины, чем женщины (соотношение 1,6:1). Исследование ASCO показало соотношение мужчин и женщин 1,4:1. [3]
История
[ редактировать ]Атипичная тератоидная/рабдоидная опухоль была впервые описана как отдельная опухоль в 1987 году. [ нужна медицинская ссылка ] До 1978 года, когда была описана рабдоидная опухоль, AT/RT, вероятно, ошибочно диагностировалась как медуллобластома . В некоторых ранних сообщениях опухоль была известна также как злокачественная рабдоидная опухоль (МРТ) ЦНС . В период с 1978 по 1987 год AT/RT обычно ошибочно диагностировали как рабдоидную опухоль . Однако как AT/RT, так и МРТ без ЦНС имеют худший прогноз, чем медуллобластома, и устойчивы к стандартным протоколам лечения медуллобластомы. [ нужна ссылка ]
К 1995 году AT/RT стали рассматривать как недавно определенный агрессивный, биологически уникальный класс опухолей головного мозга и позвоночника, обычно поражающий младенцев и детей раннего возраста. [50] США В январе 2001 года Национальный институт рака и Управление редких заболеваний провели семинар по атипичным тератоидным/рабдоидным опухолям центральной нервной системы у детей. Двадцать два участника из 14 учреждений собрались вместе, чтобы обсудить биологию, методы лечения и новые стратегии лечения этих опухолей. Консенсусный документ о биологии опухоли был опубликован в журнале Clinical Research. [51] Признание на семинаре того, что атипичные тератоидные/рабдоидные опухоли ЦНС (AT/RT) имеют делеции гена INI1, указывает на то, что рабдоидные опухоли почек и головного мозга являются идентичными или близкородственными образованиями. Это наблюдение неудивительно, поскольку рабдоидные опухоли обеих локализаций обладают сходными гистологическими, клиническими и демографическими особенностями.
Направления исследований
[ редактировать ]Атипичная тератоидно-рабдоидная опухоль встречается редко, и не было доказано, что терапия обеспечивает долгосрочную выживаемость, а набор протоколов не стал стандартным. Таким образом, большинство детей с ПТ/ЛТ участвуют в клинических исследованиях с целью найти эффективное лечение. Клиническое исследование не является стандартом лечения; это исследование. В некоторых клинических исследованиях экспериментальное лечение сравнивают со стандартным лечением, но только в том случае, если такое стандартное лечение существует.
Исследования в области трансплантации стволовых клеток продолжаются.
Общество и культура
[ редактировать ]В 2011 году The New Yorker опубликовал статью Александра Хемона о борьбе дочери автора с AT/RT. [52]
В августе 2011 года шестилетняя девочка по имени Аваланна Рут, которая боролась с AT/RT в Институте рака Даны-Фарбера, устроила мнимую свадьбу со своим кумиром Джастином Бибером , на которой врачи и медсестры предоставили картонную фигуру Бибера в натуральную величину. гитарист, цветы и футболка с надписью «Будущая миссис Бибер». В феврале 2012 года она провела день лично с Джастином Бибером, своим воображаемым мужем, после кампании в Facebook , направленной на встречу со своим кумиром. [53] 26 сентября 2012 года она умерла после пяти с половиной лет борьбы с AT/RT. [54]
Видеоигра «Этот дракон, рак» основана на опыте Райана и Эми Грин, воспитывающих их сына Джоэла после того, как в 12 месяцев ему поставили диагноз атипичная тератоидная рабдоидная опухоль, и ему осталось жить всего около четырех месяцев. Джоэл продолжал выживать еще четыре года после того, как у него развилось семь дополнительных опухолей и в конечном итоге он умер от рака 13 марта 2014 года. Райан Грин хотел представить опыт воспитания Джоэла в форме видеоигры, чтобы помочь игроку понять трудности и реалии, с которыми им пришлось иметь дело за это время. [55] [56] После смерти Джоэла игра была переработана и стала данью уважения пяти коротким годам жизни Райана и Эми с их третьим ребенком. Опыт семьи Грин также задокументирован в фильме « Спасибо за игру» .
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ «Атипичная тератоидно-рабдоидная опухоль (ATRT)» . Детская исследовательская больница Св. Иуды . Проверено 8 марта 2023 г.
- ^ Jump up to: а б «Диагностика и лечение атипичной тератоидной рабдоидной опухоли (ATRT)» . Национальный институт рака . Проверено 8 марта 2023 г.
- ^ Jump up to: а б с д Киран М.В. (2006). «Новая информация об герминогенных опухолях, атипичных тератоидных/рабдоидных опухолях и опухолях сосудистого сплетения. Редкие опухоли 3: опухоли головного мозга — герминогенные опухоли, атипичные тератоидные/рабдоидные опухоли и опухоли сосудистой сплетения» . Американское общество клинической онкологии . Образование. Книга . Архивировано из оригинала 7 января 2008 г. Проверено 20 мая 2007 г.
- ^ Показатель D6: Типы детского рака - Таблицы D6a и D6b, 2006 г. Агентство по охране окружающей среды США. Проверено 17 апреля 2008 г.
- ^ Клейхуес П. (2000). Патология и генетика опухолей нервной системы . Лион: МАИР Пресс. ISBN 92-83-22409-4 .
- ^ Jump up to: а б Текауц Т.М., Фуллер К.Э., Блейни С., Фулади М., Брониссер А., Мерчант Т.Э. и др. (март 2005 г.). «Атипичные тератоидные/рабдоидные опухоли (ATRT): улучшение выживаемости у детей в возрасте 3 лет и старше с помощью лучевой терапии и химиотерапии на основе высоких доз алкилаторов» . Журнал клинической онкологии . 23 (7): 1491–1499. дои : 10.1200/JCO.2005.05.187 . ПМИД 15735125 . См. рисунок 1.
- ^ Чи С.Н., Циммерман М.А., Яо X, Коэн К.Дж., Бургер П., Бигель Дж.А. и др. (январь 2009 г.). «Интенсивное комплексное лечение детей с впервые выявленной атипичной тератоидно-рабдоидной опухолью ЦНС» . Журнал клинической онкологии . 27 (3): 385–389. дои : 10.1200/JCO.2008.18.7724 . ПМЦ 2645855 . ПМИД 19064966 .
- ^ Jump up to: а б Славк I, Чохолус М, Лейсс У, Хаберлер С, Пейрл А, Азизи А.А. и др. (февраль 2014 г.). «Атипичная тератоидная рабдоидная опухоль: улучшение долгосрочной выживаемости с помощью интенсивной мультимодальной терапии и отсроченной лучевой терапии. Опыт Венского медицинского университета, 1992-2012» . Раковая медицина . 3 (1): 91–100. дои : 10.1002/cam4.161 . ПМЦ 3930393 . ПМИД 24402832 .
- ^ Тамия Т., Накашима Х., Оно Ю., Кавада С., Хамазаки С., Фурута Т. и др. (март 2000 г.). «Атипичная тератоидная/рабдоидная опухоль позвоночника у младенца». Детская нейрохирургия . 32 (3): 145–149. дои : 10.1159/000028920 . ПМИД 10867562 . S2CID 34074177 .
- ^ Као С.Л., Чиу С.Х., Чен Ю.Дж., Сингх С., Лин Х.Т., Лю Р.С. и др. (июнь 2005 г.). «Повышенная экспрессия гена остеопонтина в атипичной тератоидной/рабдоидной опухоли центральной нервной системы» . Современная патология . 18 (6): 769–778. doi : 10.1038/modpathol.3800270 . ПМИД 15776015 .
- ^ Янсон К., Недзи Л.А., Дэвид О., Шорин М., Уолш Дж.В., Бхаттачарджи М. и др. (сентябрь 2006 г.). «Предрасположенность к атипичной тератоидной/рабдоидной опухоли из-за наследственной мутации INI1». Детская кровь и рак . 47 (3): 279–284. дои : 10.1002/pbc.20622 . ПМИД 16261613 . S2CID 25821741 .
- ^ Фернандес С., Бувье С., Севене Н., Липранди А., Козе С., Лена Г., Фигарелла-Бранжер Д. (февраль 2002 г.). «Врожденная диссеминированная злокачественная рабдоидная опухоль и опухоль мозжечка, имитирующая медуллобластому, у монозиготных близнецов: патологический и молекулярный диагноз». Американский журнал хирургической патологии . 26 (2): 266–270. дои : 10.1097/00000478-200202000-00016 . ПМИД 11812951 . S2CID 45546297 .
- ^ Бигель Дж.А., Фогельгрен Б., Уэйнрайт Л.М., Чжоу Дж.Ю., Беван Х., Рорк Л.Б. (май 2000 г.). «Зародышевая мутация INI1 у пациента с атипичной тератоидной опухолью центральной нервной системы и рабдоидной опухолью почки» . Гены, хромосомы и рак . 28 (1): 31–37. doi : 10.1002/(SICI)1098-2264(200005)28:1<31::AID-GCC4>3.0.CO;2-Y . ПМИД 10738300 . S2CID 21250260 .
- ^ Тейлор М.Д., Гокгоз Н., Андрулис И.Л., Мейнприз Т.Г., Дрейк Дж.М., Рутка Дж.Т. (апрель 2000 г.). «Семейные опухоли задней ямки головного мозга младенчества, вторичные по отношению к зародышевой мутации гена hSNF5» . Американский журнал генетики человека . 66 (4): 1403–1406. дои : 10.1086/302833 . ПМЦ 1288204 . ПМИД 10739763 .
- ^ Пруст Ф., Лакерьер А., Константин Б., Рушу М.М., Ваннье Ж.П., Фрегер П. (май 1999 г.). «Одновременное появление атипичной тератоидной/рабдоидной опухоли у братьев и сестер». Журнал нейроонкологии . 43 (1): 63–70. дои : 10.1023/А:1006114732613 . ПМИД 10448873 . S2CID 10500489 .
- ^ Севене Н., Шеридан Э., Амрам Д., Шнайдер П., Хандгретингер Р., Делатр О. (ноябрь 1999 г.). «Конституционные мутации гена hSNF5/INI1 предрасполагают к различным видам рака» . Американский журнал генетики человека . 65 (5): 1342–1348. дои : 10.1086/302639 . ПМЦ 1288286 . ПМИД 10521299 .
- ^ Изицка-Свешевска Е., Дебиец-Рихтер М., Васаг Б., Возняк А., Гасецкий Д., Плата-Назар К. и др. (февраль 2003 г.). «Уникальный случай церебральной атипичной тератоидной/рабдоидной опухоли у младенца и примитивной нейроэктодермальной опухоли спинномозгового канала у ее отца». Журнал нейроонкологии . 61 (3): 219–225. дои : 10.1023/А:1022532727436 . ПМИД 12675315 . S2CID 2766929 .
- ^ Хо Д.М., Сюй С.И., Вонг Т.Т., Тинг Л.Т., Чан Х (май 2000 г.). «Атипичная тератоидная/рабдоидная опухоль центральной нервной системы: сравнительное исследование с примитивной нейроэктодермальной опухолью/медуллобластомой». Акта Нейропатологика . 99 (5): 482–488. дои : 10.1007/s004010051149 . ПМИД 10805090 . S2CID 22159380 .
- ^ «CD99» . Ncbi.nlm.nih.gov. 30 января 2013 г. Проверено 22 февраля 2013 г.
- ^ «2-я ссылка CD99» . Ncbi.nlm.nih.gov . Проверено 22 февраля 2013 г.
- ^ Брух Л.А., Хилл Д.А., Кай Д.Х., Леви Б.К., Денер Л.П., Перри А. (февраль 2001 г.). «Роль флуоресцентного обнаружения гибридизации in situ дозировки хромосомы 22q в различении атипичных тератоидных / рабдоидных опухолей от медуллобластомы / центральных примитивных нейроэктодермальных опухолей». Патология человека . 32 (2): 156–162. дои : 10.1053/hupa.2001.21572 . ПМИД 11230702 .
- ^ Мейерс С.П., Хадемиан З.П., Бигель Дж.А., Чуанг Ш., Коронес Д.Н., Циммерман Р.А. (май 2006 г.). «Первичные внутричерепные атипичные тератоидные/рабдоидные опухоли младенчества и детства: особенности МРТ и результаты лечения пациентов» . АДЖНР. Американский журнал нейрорадиологии . 27 (5): 962–971. ПМЦ 7975730 . ПМИД 16687525 . Проверено 5 мая 2008 г.
- ^ Лу Л., Уилкинсон Э.Дж., Яхнис А.Т. (ноябрь 2000 г.). «Цитология спинномозговой жидкости атипичной тератоидной/рабдоидной опухоли головного мозга у двухлетней девочки: клинический случай». Диагностическая цитопатология . 23 (5): 329–332. doi : 10.1002/1097-0339(200011)23:5<329::AID-DC9>3.0.CO;2-W . ПМИД 11074628 . S2CID 21276083 .
- ^ Джей В., Эдвардс В., Холлидей В., Рутка Дж., Лау Р. (1997). « Полифенотипические» опухоли центральной нервной системы: проблемы нозологии и классификации». Детская патология и лабораторная медицина . 17 (3): 369–389. дои : 10.1080/107710497174697 . ПМИД 9185218 .
- ^ Бургер П.С., Ю И.Т., Тихан Т., Фридман Х.С., Стротер Д.Р., Кепнер Дж.Л. и др. (сентябрь 1998 г.). «Атипичная тератоидная/рабдоидная опухоль центральной нервной системы: высокозлокачественная опухоль младенчества и детства, которую часто принимают за медуллобластому: исследование группы детской онкологии». Американский журнал хирургической патологии . 22 (9): 1083–1092. дои : 10.1097/00000478-199809000-00007 . ПМИД 9737241 .
- ^ «ПДФ» (PDF) . Архивировано из оригинала (PDF) 17 февраля 2013 г. Проверено 22 февраля 2013 г.
- ^ Jump up to: а б Гейер Дж.Р., Спосто Р., Дженнингс М., Бойетт Дж.М., Экстелл Р.А., Брейгер Д. и др. (октябрь 2005 г.). «Мультиагентная химиотерапия и отсроченная лучевая терапия у детей со злокачественными опухолями головного мозга: отчет Детской онкологической группы» . Журнал клинической онкологии . 23 (30): 7621–7631. дои : 10.1200/JCO.2005.09.095 . ПМИД 16234523 .
- ^ «Лечение рабдомиосаркомы у детей» . Национальный институт рака. 1 января 1980 г. Архивировано из оригинала 4 июля 2007 года . Проверено 9 июля 2007 г.
- ^ Пуссен Т., Филлипс П.С., Ваджапеям С., Фэйи Ф.Х., Робертсон Р.Л., Осганиан С. и др. (апрель 2007 г.). «Центр нейровизуализации Консорциума педиатрических опухолей головного мозга - совместная нейровизуализация в исследованиях опухолей головного мозга у детей: работа в стадии разработки» . АДЖНР. Американский журнал нейрорадиологии . 28 (4): 603–607. ПМЦ 7977358 . ПМИД 17416804 .
- ^ Сквайр С.Э., Чан, доктор медицинских наук, Маркус К.Дж. (январь 2007 г.). «Атипичная тератоидная/рабдоидная опухоль: споры вокруг лучевой терапии». Журнал нейроонкологии . 81 (1): 97–111. дои : 10.1007/s11060-006-9196-z . ПМИД 16855864 . S2CID 22170046 .
- ^ «Принципы протонно-лучевой терапии» . Massgeneral.org. Архивировано из оригинала 26 сентября 2013 г. Проверено 22 февраля 2013 г.
- ^ Оуэн К. «Протонно-лучевая лучевая терапия в Массачусетсе» . Neurosurgery.mgh.harvard.edu. Архивировано из оригинала 12 ноября 2012 г. Проверено 22 февраля 2013 г.
- ^ Статья о протонно-лучевой терапии. Архивировано 8 октября 2007 г., в Wayback Machine.
- ^ Левин В.П., Кой Х., Леффлер Дж.С., ДеЛэни Т.Ф. (октябрь 2005 г.). «Протонно-лучевая терапия» . Британский журнал рака . 93 (8): 849–854. дои : 10.1038/sj.bjc.6602754 . ПМК 2361650 . ПМИД 16189526 .
- ^ Центр протонной терапии медицинского центра Лома Линда - обзор. Архивировано 6 февраля 2007 г., в Wayback Machine.
- ^ Обзор Лома Линды детских опухолей головного мозга. Архивировано 12 апреля 2007 г., в Wayback Machine.
- ^ Чжан З.К., Дэвис К.П., Аллен Дж., Чжу Л., Пестель Р.Г., Загзаг Д., Калпана Г.В. (август 2002 г.). «Арест клеточного цикла и репрессия транскрипции циклина D1 с помощью INI1 / hSNF5» . Молекулярная и клеточная биология . 22 (16): 5975–5988. дои : 10.1128/MCB.22.16.5975-5988.2002 . ПМК 133966 . ПМИД 12138206 .
- ^ «Новая надежда для пациентов с редкими опухолями головного мозга» . Danafarberchildrens.org. 10 марта 2009 г. Проверено 22 февраля 2013 г.
- ^ Jump up to: а б Хильден Дж.М., Меербаум С., Бургер П., Финли Дж., Янсс А., Шайтауэр Б.В. и др. (июль 2004 г.). «Атипичная тератоидно-рабдоидная опухоль ЦНС: результаты терапии у детей, состоящих на учете» . Журнал клинической онкологии . 22 (14): 2877–2884. дои : 10.1200/JCO.2004.07.073 . ПМИД 15254056 .
- ^ Олсон Т.А., Баяр Э., Косник Э., Хамуди А.Б., Клопфенштейн К.Дж., Питерс Р.С., Руйманн Ф.Б. (февраль 1995 г.). «Успешное лечение диссеминированной злокачественной рабдоидной опухоли центральной нервной системы». Журнал детской гематологии/онкологии . 17 (1): 71–75. дои : 10.1097/00043426-199502000-00013 . ПМИД 7743242 . S2CID 1872438 .
- ^ Хирт А., Педерсен П.Х., Вестер К. и др. (2003). «Церебральная атипичная тератоидная/рабдоидная опухоль в младенчестве: долгосрочная выживаемость после мультимодального лечения, включая тройную интратекальную химиотерапию и радиохирургию гамма-ножом - отчет о клиническом случае (резюме)». Детская гематология и онкология . 20 (4): 327–332. дои : 10.1080/713842315 .
- ^ Циммерман М.А., Гумнерова Л.К., Проктор М., Скотт Р.М., Маркус К., Помрой С.Л. и др. (март 2005 г.). «Постоянная ремиссия недавно диагностированной и рецидивирующей атипичной тератоидной/рабдоидной опухоли центральной нервной системы». Журнал нейроонкологии . 72 (1): 77–84. дои : 10.1007/s11060-004-3115-y . ПМИД 15803379 . S2CID 22624213 .
- ^ Гарднер С.Л., Асгарзаде С., Грин А., Хорн Б., МакКоудж Г., Финли Дж. (август 2008 г.). «Интенсивная индукционная химиотерапия с последующей химиотерапией в высоких дозах с спасением аутологичных гемопоэтических клеток-предшественников у детей раннего возраста, у которых впервые диагностирована атипичная тератоидно-рабдоидная опухоль центральной нервной системы». Детская кровь и рак . 51 (2): 235–40. дои : 10.1002/pbc.21578 . ПМИД 18381756 . S2CID 1844660 .
- ^ Фулади М., Гилджер Э., Кочак М., Уоллес Д., Бьюкенен Г., Ривз С. и др. (октябрь 2005 г.). «Интеллектуальные и функциональные результаты детей 3 лет и младше со злокачественными новообразованиями ЦНС» . Журнал клинической онкологии . 23 (28): 7152–7160. дои : 10.1200/JCO.2005.01.214 . ПМИД 16192599 .
- ^ Монтелеоне П., Медоуз А.Т. (6 июня 2006 г.). «Поздние последствия детского рака и лечения» . ЭМедицина от WebMD .
- ^ Форман Н.К., Фаестел П.М., Пирсон Дж., Дисабато Дж., Пул М., Вилкенинг Г. и др. (январь 1999 г.). «Состояние здоровья 52 детей, перенесших длительные опухоли головного мозга». Журнал нейроонкологии . 41 (1): 47–53. дои : 10.1023/А:1006145724500 . ПМИД 10222422 . S2CID 10230653 .
- ^ Мейер Э.А., Киран М.В. (2002). «Психологическая адаптация педиатрических нейроонкологических пациентов, перенесших только хирургическое вмешательство: ретроспективный анализ» . Психоонкология . 11 (1): 74–79. дои : 10.1002/пон.553 . ПМИД 11835594 . S2CID 21473233 . Архивировано из оригинала 17 декабря 2012 г.
- ^ Гюлер Э., Варан А., Сойлемезоглу Ф., Ба Ф., Демирказик А., Бюйюкпамук М. (август 2001 г.). «Экстраневральные метастазы у ребенка с атипичной тератоидно-рабдоидной опухолью центральной нервной системы». Журнал нейроонкологии . 54 (1): 53–56. дои : 10.1023/A:1012540700093 . ПМИД 11763423 . S2CID 349180 .
- ^ Сугита Ю., Такахаси Ю., Хаяси И., Моримацу М., Окамото К., Сигэмори М. (декабрь 1999 г.). «Злокачественная рабдоидная опухоль шишковидной железы с образованием хондроида у взрослого» . Международная патология . 49 (12): 1114–1118. дои : 10.1046/j.1440-1827.1999.00988.x . ПМИД 10632935 . S2CID 24672683 .
- ^ Рорк Л.Б., Пакер Р., Бигель Дж. (1995). «Атипичные тератоидные/рабдоидные опухоли центральной нервной системы младенчества и детства». Журнал нейроонкологии . 24 (1): 21–28. дои : 10.1007/BF01052653 . ПМИД 8523069 . S2CID 8100347 .
- ^ Бигель Дж.А., Калпана Г., Кнудсен Э.С., Пакер Р.Дж., Робертс К.В., Тиле С.Дж. и др. (январь 2002 г.). «Роль INI1 и комплекса SWI/SNF в развитии рабдоидных опухолей: резюме семинара по атипичным тератоидным/рабдоидным опухолям у детей» . Исследования рака . 62 (1): 323–328. ПМИД 11782395 .
- ^ Хемон А (13 июня 2011 г.). «Аквариум» . Житель Нью-Йорка . Проверено 2 марта 2012 г.
- ^ «Джастин Бибер встречается с девушкой из Мерримака, страдающей от рака мозга» . CBS Бостон . CBS Local Media, подразделение CBS Radio Inc., 13 февраля 2012 г. Проверено 2 марта 2012 г.
- ^ « Миссис Бибер» Аваланна Рут умирает в возрасте 6 лет . CNN.com . 27 сентября 2012. Архивировано из оригинала 23 октября 2012 года . Проверено 26 октября 2012 г.
- ^ Робертсон А. (12 июля 2013 г.). «Этот Дракон, Рак: видеоигра, помогающая отцу справиться с болезнью сына» . «Дейли телеграф» . Проверено 13 марта 2014 г.
- ^ Футтер М. (13 марта 2014 г.). «Джоэл Грин, вдохновитель для этого дракона, рака, скончался в возрасте 5 лет» . Игровой информер . Архивировано из оригинала 17 марта 2014 года . Проверено 13 марта 2014 г.
Дальнейшее чтение
[ редактировать ]- Хильден Дж.М., Меербаум С., Бургер П., Финли Дж., Янсс А., Шайтауэр Б.В. и др. (июль 2004 г.). «Атипичная тератоидно-рабдоидная опухоль ЦНС: результаты терапии у детей, состоящих на учете» . Журнал клинической онкологии . 22 (14): 2877–2884. дои : 10.1200/JCO.2004.07.073 . ПМИД 15254056 .
- Бигель Дж.А., Калпана Г., Кнудсен Э.С., Пакер Р.Дж., Робертс К.В., Тиле С.Дж. и др. (январь 2002 г.). «Роль INI1 и комплекса SWI/SNF в развитии рабдоидных опухолей: резюме семинара по атипичным тератоидным/рабдоидным опухолям у детей». Исследования рака . 62 (1): 323–328. ПМИД 11782395 .
- Хюре Дж., Севенет Н. (2002). «Синдром рабдоидной предрасположенности» . Атлас генетики и цитогенетики в онкологии и гематологии . Архивировано из оригинала 26 декабря 2005 г.