остеопонтин
| СПП1 | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | SPP1 , BNSP, BSPI, ETA-1, OPN, секретируемый фосфопротеин 1, остеопонтин | |||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 166490 ; МГИ : 98389 ; Гомологен : 20156 ; Генные карты : SPP1 ; ОМА : SPP1 — ортологи | |||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| остеопонтин | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | остеопонтин | ||
| Пфам | PF00865 | ||
| ИнтерПро | ИПР002038 | ||
| PROSITE | PDOC00689 | ||
| |||
Остеопонтин ( OPN ), также известный как костный/сиалопротеин I ( BSP-1 или BNSP ), ранняя активация Т-лимфоцитов ( ETA-1 ), секретируемый фосфопротеин 1 ( SPP1 ), 2ar и устойчивость к риккетсиям ( Ric ), [5] представляет собой белок , который у человека кодируется геном SPP1 (секретируемый фосфопротеин 1). Мышиный ортолог — Spp1 . Остеопонтин – это SIBLING ( гликопротеин ), который был впервые идентифицирован в 1986 году в остеобластах .
Приставка остео- указывает на то, что белок экспрессируется в костях , хотя он также экспрессируется и в других тканях. Суффикс -понтин происходит от латинского слова «pons», означающего мост, и обозначает роль остеопонтина как связывающего белка. Остеопонтин представляет собой внеклеточный структурный белок и, следовательно, органический компонент кости .
Ген имеет 7 экзонов , имеет длину 5 тысяч оснований и у человека расположен на длинном плече 22- й области хромосомы 4 (4q1322.1). Белок состоит из ~300 аминокислотных остатков и имеет ~30 присоединенных углеводных остатков, в том числе 10 остатков сиаловой кислоты , которые присоединяются к белку во время посттрансляционной модификации в аппарате Гольджи . Белок богат кислотными остатками: 30-36% приходится на аспарагиновую или глутаминовую кислоту.
Структура
[ редактировать ]OPN представляет собой сильно отрицательно заряженный, сильно фосфорилированный белок внеклеточного матрикса, который лишен обширной вторичной структуры и является внутренне неупорядоченным белком. [6] [7] Он состоит примерно из 300 аминокислот (297 у мышей; 314 у человека) и экспрессируется в виде растущего белка массой 33 кДа; существуют также функционально важные сайты расщепления. OPN может подвергаться посттрансляционным модификациям , которые увеличивают его кажущуюся молекулярную массу примерно до 44 кДа. [8] Ген OPN состоит из 7 экзонов, 6 из которых содержат кодирующую последовательность. [9] [10] Первые два экзона содержат 5'-нетранслируемую область (5'-UTR). [11] Экзоны 2, 3, 4, 5, 6 и 7 кодируют 17, 13, 27, 14, 108 и 134 аминокислоты соответственно. [11] Все границы интрон-экзон относятся к типу фазы 0, поэтому альтернативный сплайсинг экзонов поддерживает рамку считывания гена OPN.

Изоформы
[ редактировать ]Полноразмерный OPN (OPN-FL) может быть модифицирован путем расщепления тромбином , при котором обнажается загадочная последовательность SVVYGLR на расщепленной форме белка, известной как OPN-R (рис. 1). Этот расщепленный тромбином OPN (OPN-R) экспонирует эпитоп для рецепторов интегрина α4β1, α9β1 и α9β4. [13] [14] Эти рецепторы интегрина присутствуют на ряде иммунных клеток, таких как тучные клетки . [15] нейтрофилы, [16] и Т-клетки. Он также экспрессируется моноцитами и макрофагами. [17] При связывании этих рецепторов клетки используют несколько путей передачи сигнала , чтобы вызвать иммунные ответы в этих клетках. OPN-R может быть дополнительно расщеплен карбоксипептидазой B (CPB) путем удаления C-концевого аргинина и стать OPN-L. Функция OPN-L в значительной степени неизвестна.
Похоже, что внутриклеточный вариант OPN (iOPN) участвует в ряде клеточных процессов, включая миграцию, слияние и подвижность. [18] [19] [20] [21] Внутриклеточный OPN генерируется с использованием альтернативного сайта начала трансляции на том же виде мРНК, который используется для создания внеклеточной изоформы. [22] Этот альтернативный сайт начала трансляции находится ниже N-концевой сигнальной последовательности, нацеленной на эндоплазматический ретикулум, что обеспечивает цитоплазматическую трансляцию OPN.
Было обнаружено, что различные виды рака человека, включая рак молочной железы, экспрессируют сплайсинговые варианты OPN. [23] [24] Специфическими для рака вариантами сплайсинга являются остеопонтин-а, остеопонтин-b и остеопонтин-с. Экзон 5 отсутствует в остеопонтине-b, тогда как в остеопонтине-с отсутствует экзон 4. [23] Было высказано предположение, что остеопонтин-с способствует независимому от прикрепления фенотипу некоторых клеток рака молочной железы человека из-за его неспособности связываться с внеклеточным матриксом. [23]
Распределение тканей
[ редактировать ]
Остеопонтин экспрессируется в различных типах тканей, включая сердечные фибробласты , [25] преостеобласты , остеобласты, остеоциты , одонтобласты , некоторые костного мозга клетки , гипертрофические хондроциты , дендритные клетки , макрофаги , [26] гладкая мускулатура , [27] скелетных мышц миобласты , [28] эндотелиальные клетки и внекостные (некостные) клетки внутреннего уха , головного мозга , почек , децидуальной оболочки и плаценты . Синтез остеопонтина стимулирует кальцитриол (1,25-дигидроксивитамин D 3 ).
Регулирование
[ редактировать ]Регуляция экспрессии гена остеопонтина до конца не изучена. Различные типы клеток могут различаться по механизмам регуляции гена OPN. Экспрессия OPN в кости преимущественно происходит с помощью остеобластов и остеоцитов (костеобразующих клеток), а также остеокластов (клеток, резорбирующих кость). [29] Факторы транскрипции Runx2 (также известный как Cbfa1) и osterix (Osx) необходимы для экспрессии OPN. [30] Runx2 и Osx связывают промоторы специфичных для остеобластов генов, таких как Col1α1 , Bsp и Opn , и усиливают транскрипцию. [31]
Гипокальциемия и гипофосфатемия (примеры, которые стимулируют клетки проксимальных канальцев почек вырабатывать кальцитриол (1α,25-дигидроксивитамин D3)) приводят к увеличению транскрипции, трансляции и секреции OPN. [32] Это связано с наличием высокоспецифичного элемента ответа на витамин D ( VDRE ) в промоторе гена OPN. [33] [34] [35]
Экспрессия остеопонтина (OPN) модулируется яичным антигеном Schistosoma mansoni . [36]
Антигены яиц Schistosoma mansoni напрямую стимулируют экспрессию профиброгенной молекулы остеопонтина (OPN), а системные уровни OPN сильно коррелируют с тяжестью заболевания, что позволяет предположить его использование в качестве потенциального биомаркера заболеваемости. Исследование влияния применения Празиквантела на системные уровни OPN и отложение коллагена в печени при хроническом шистосомозе мышей показало, что лечение празиквантелом значительно снижает системные уровни OPN и отложение коллагена в печени, что указывает на то, что OPN может быть надежным инструментом для мониторинга эффективности PZQ и регрессии фиброза. [37] [36]
Внеклеточный неорганический фосфат (ePi) также был идентифицирован как модулятор экспрессии OPN. [38]
Стимуляция экспрессии OPN также происходит при воздействии на клетки провоспалительных цитокинов. [39] классические медиаторы острого воспаления (например, фактор некроза опухоли α [TNFα], интерлейкин-1β [IL-1β]), ангиотензин II, трансформирующий фактор роста β (TGFβ) и паратиреоидный гормон (ПТГ), [40] [41] хотя детальное механистическое понимание этих регуляторных путей еще не известно. Известно также, что гипергликемия и гипоксия увеличивают экспрессию OPN. [40] [42] [43]
Функция
[ редактировать ]Апоптоз
[ редактировать ]OPN является важным антиапоптотическим фактором во многих случаях. OPN блокирует вызванную активацией гибель макрофагов и Т-клеток, а также фибробластов и эндотелиальных клеток, подвергшихся воздействию вредных раздражителей. [44] [45] OPN предотвращает непрограммируемую гибель клеток при воспалительном колите. [46]
Биоминерализация
[ редактировать ]OPN принадлежит к семейству секретируемых кислых белков (SIBLINGs, малый интегрин-связывающий LIgan и N-гликозилированные белки), члены которого имеют обилие отрицательно заряженных аминокислот, таких как Asp и Glu . [47] OPN также имеет большое количество сайтов консенсусной последовательности для посттрансляционного фосфорилирования остатков Ser с образованием фосфосерина , обеспечивая дополнительный отрицательный заряд. [48] Непрерывные участки с высоким отрицательным зарядом в OPN были идентифицированы и названы мотивом полиАсп (полиаспарагиновая кислота) и мотивом ASARM (мотив, богатый кислым серином и аспартатом), причем последняя последовательность имеет несколько сайтов фосфорилирования. [49] [50] [51] [52] Этот общий отрицательный заряд OPN, а также его специфические кислотные мотивы и тот факт, что OPN является по своей сути неупорядоченным белком. [53] [6] создание открытых и гибких структур позволяет OPN прочно связываться с атомами кальция, доступными на кристаллических поверхностях различных биоминералов. [52] [54] [55] Такое связывание OPN с различными типами биоминералов на основе кальция, таких как кальций-фосфатный минерал в костях и зубах, [56] Минерал карбоната кальция в отокониях внутреннего уха [57] и птичьей яичной скорлупы, [58] и минерал оксалата кальция в камнях в почках [59] [60] [61] – действует как ингибитор минерализации, стабилизируя переходные фазы минеральных предшественников и связываясь непосредственно с поверхностями кристаллов, которые регулируют рост кристаллов. [62] [63] [64]
OPN является белком-субстратом для ряда ферментов, действие которых может модулировать функцию OPN, ингибирующую минерализацию. PHEX (гомолог фосфат-регулирующей эндопептидазы, сцепленный с Х) является одним из таких ферментов, который активно разрушает OPN и чьи инактивирующие генные мутации (при Х-сцепленной гипофосфатемии, XLH) приводят к изменению процессинга OPN, так что ингибирующий OPN не может расщепляться и накапливается. в костном (и зубном) внеклеточном матриксе, способствуя локально остеомаляции (мягкие гипоминерализованные кости и одонтомаляция - мягкие зубы), характерной для XLH. [65] [66] [12] Взаимосвязь, описывающая местную физиологическую двойную негативную (ингибирующую ингибиторы) регуляцию минерализации с участием OPN, получила название « принципа трафарета минерализации», при котором пары фермент-субстрат отпечатывают закономерности минерализации во внеклеточном матриксе (особенно описано для кости) путем разрушения ингибиторов минерализации. ( например, фермент TNAP, ослабляющий ингибирование пирофосфата, и фермент PHEX, ослабляющий ингибирование остеопонтина). [67] [64] Что касается заболеваний минерализации, Принцип трафарета особенно актуален для остеомаляции и одонтомаляции, наблюдаемых при гипофосфатазии и Х-сцепленной гипофосфатемии.
Наряду с его ролью в регуляции нормальной минерализации во внеклеточном матриксе костей и зубов, [68] OPN также активируется в местах патологической эктопической кальцификации. [69] [70] – например, при мочекаменной болезни [59] [61] и кальцификация сосудов [71] [69] - предположительно, по крайней мере частично, для подавления изнурительной минерализации в этих мягких тканях.
Ремоделирование кости
[ редактировать ]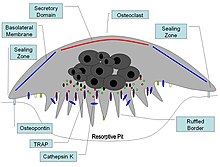
Остеопонтин считается важным фактором ремоделирования кости . [72] В частности, OPN закрепляет остеокласты на поверхности костей, где он иммобилизуется благодаря своим минералосвязывающим свойствам, что позволяет в дальнейшем использовать его RGD-мотив для связывания интегрина остеокластов для прикрепления и миграции клеток. [15] ОПН на поверхности кости располагается в тонком органическом слое, так называемой пограничной пластинке. [73] Органическая часть кости составляет около 20% сухого веса и включает, помимо остеопонтина, коллаген I типа , остеокальцин , остеонектин и щелочную фосфатазу . Коллаген типа I составляет 90% массы белка. Неорганическая часть кости представляет собой минерал гидроксиапатит Ca 10 (PO 4 ) 6 (OH) 2 . Потеря костной массы может привести к остеопорозу , поскольку кость истощается кальцием, если он не поступает с пищей.
OPN служит инициатором процесса, посредством которого у остеокластов формируются взъерошенные границы, что приводит к резорбции кости. OPN содержит и интегрин-связывающий мотив RGD.
Активация клеток
[ редактировать ]стимулирует активированные Т-клетки IL-12 к дифференцировке в сторону типа Th1, продуцируя цитокины, включая IL-12 и IFNγ . OPN ингибирует выработку цитокина Th2 IL-10, что приводит к усилению ответа Th1. OPN влияет на клеточный иммунитет и выполняет функции цитокина Th1. Он усиливает выработку и пролиферацию иммуноглобулина В-клеток. [7] OPN также индуцирует дегрануляцию тучных клеток. [74] IgE-опосредованная анафилаксия значительно снижается у мышей с нокаутом OPN по сравнению с мышами дикого типа. Роль OPN в активации макрофагов также связана с раком, поскольку опухоли, продуцирующие OPN, способны индуцировать активацию макрофагов по сравнению с опухолями с дефицитом OPN. [75]

Хемотаксис
[ редактировать ]OPN играет важную роль в рекрутировании нейтрофилов при алкогольной болезни печени. [16] [76] OPN важен для миграции нейтрофилов in vitro . [77] Кроме того, OPN рекрутирует воспалительные клетки в пораженные артритом суставы в модели ревматоидного артрита, индуцированного коллагеном. [78] [79] Недавнее исследование in vitro, проведенное в 2008 году, показало, что OPN играет роль в миграции тучных клеток. [74] Здесь культивировали тучные клетки, нокаутированные по OPN, и наблюдали пониженный уровень хемотаксиса в этих клетках по сравнению с тучными клетками дикого типа. Также было обнаружено, что OPN действует как фактор хемотаксиса макрофагов . [80] У макак-резусов OPN предотвращает выход макрофагов из места накопления в головном мозге, что указывает на повышенный уровень хемотаксиса.
Иммунная система
[ редактировать ]OPN связывается с несколькими рецепторами интегрина, включая α4β1, α9β1 и α9β4, экспрессируемые лейкоцитами . Хорошо известно, что эти рецепторы участвуют в клеточной адгезии, миграции и выживании в этих клетках.
Остеопонтин (OPN) экспрессируется в ряде иммунных клеток, включая макрофаги, нейтрофилы , дендритные клетки, микроглию и Т- и В-клетки , с различной кинетикой. Сообщается, что OPN действует как иммуномодулятор различными способами. [7] Во-первых, он обладает хемотаксическими свойствами , которые способствуют привлечению клеток в очаги воспаления. Он также действует как белок адгезии , участвующий в прикреплении клеток и заживлении ран . Кроме того, OPN опосредует активацию клеток и выработку цитокинов , а также способствует выживанию клеток путем регуляции апоптоза . [7] Встречаются следующие примеры. [7]
Клиническое значение
[ редактировать ]Тот факт, что OPN взаимодействует с множеством рецепторов клеточной поверхности, которые экспрессируются повсеместно, делает его активным участником многих физиологических и патологических процессов, включая заживление ран, обмен костной ткани, онкогенез, воспаление, ишемию и иммунные реакции. Манипулирование плазменными (или местными) уровнями OPN может быть полезно при лечении аутоиммунных заболеваний, метастазов рака, заболеваний минерализации костей (и зубов), остеопороза и некоторых форм стресса. [7]
Аутоиммунные заболевания
[ редактировать ]OPN вовлечен в патогенез ревматоидного артрита . OPN-R, расщепленная тромбином форма OPN, повышается в суставах, пораженных ревматоидным артритом. Однако роль OPN при ревматоидном артрите до сих пор неясна. Одна группа обнаружила, что мыши с нокаутом OPN были защищены от артрита. [81] в то время как другие не смогли воспроизвести это наблюдение. [82]
Было обнаружено, что OPN играет роль в других аутоиммунных заболеваниях, включая аутоиммунный гепатит , аллергические заболевания дыхательных путей и рассеянный склероз . [83]
Аллергия и астма
[ редактировать ]Недавно остеопонтин был связан с аллергическим воспалением и астмой . Экспрессия Opn значительно увеличивается в эпителиальных и субэпителиальных клетках легких у больных астмой по сравнению со здоровыми людьми. [84] Экспрессия Opn также повышается в легких мышей с аллергическим воспалением дыхательных путей. [84] Секретируемая форма Opn (Opn-s) играет провоспалительную роль во время сенсибилизации аллергена (OVA/Alum), поскольку нейтрализация Opn-s во время этой фазы приводит к значительно более легкому аллергическому воспалению дыхательных путей. [84] Напротив, нейтрализация Opn-s во время антигенной стимуляции усугубляет аллергические заболевания дыхательных путей. [84] Эти эффекты Opn-s в основном опосредованы регуляцией Th2-супрессирующих плазмацитоидных дендритных клеток (ДК) во время первичной сенсибилизации и Th2-стимулирующих обычных ДК во время вторичной антигенной стимуляции. [84] Сообщалось также, что дефицит OPN защищает от ремоделирования и бронхиальной гиперреактивности (BHR), опять же с использованием модели ремоделирования дыхательных путей с хроническим аллергеном. [85] Кроме того, недавно было продемонстрировано, что экспрессия OPN усиливается при астме у человека, связана с изменениями ремоделирования, а его субэпителиальная экспрессия коррелирует с тяжестью заболевания. [86] Также сообщалось о повышении уровня OPN в супернатанте мокроты курящих астматиков. [87] а также БАЛ и бронхиальную ткань курящих и астматиков. [88]
Колит
[ редактировать ]Уровень Opn повышается при воспалительных заболеваниях кишечника (ВЗК). [89] Экспрессия Opn сильно регулируется в иммунных и неиммунных клетках кишечника и в плазме пациентов с болезнью Крона (БК) и язвенным колитом (ЯК), а также в толстой кишке и плазме мышей с экспериментальным колитом. [89] [90] [91] Повышенные уровни Opn в плазме связаны с тяжестью воспаления БК, а некоторые гаплотипы гена Opn (Spp1) являются модификаторами восприимчивости к БК. Opn также играет провоспалительную роль при колите, вызванном TNBS и декстрансульфатом натрия (DSS), которые являются мышиными моделями воспалительного заболевания кишечника. Было обнаружено, что Opn в высокой степени экспрессируется в специфической подгруппе дендритных клеток (DC), полученных из мезентериальных лимфатических узлов (MLN) мышей, и является сильно провоспалительным при колите. [92] Дендритные клетки важны для развития воспаления кишечника у людей с ВЗК и у мышей с экспериментальным колитом. Экспрессия Opn этой воспалительной субпопуляцией MLN DC имеет решающее значение для их патогенного действия во время колита. [92]
Рак
[ редактировать ]Показано, что ОПН стимулирует Ил-17 ; производство [93] OPN сверхэкспрессируется при различных видах рака , включая рак легких , рак молочной железы , колоректальный рак , рак желудка , рак яичников , папиллярный рак щитовидной железы, меланому и плевры мезотелиому ; ОПН способствует развитию как гломерулонефрита , так и тубулоинтерстициального нефрита ; ОПН обнаруживается в атероматозных бляшках внутри артерий . Таким образом, манипулирование уровнями OPN в плазме может быть полезно при лечении аутоиммунных заболеваний, метастазов рака, остеопороза и некоторых форм стресса. [7]
Остеопонтин участвует в прогрессировании заболевания PDAC ( аденокарциномы поджелудочной железы ). [94] Он экспрессируется как один из трех вариантов сплайсинга в PDAC, при этом остеопонтин-а экспрессируется почти во всех PDAC, экспрессия остеопонтина-b коррелирует с выживаемостью, а остеопонтин-с коррелирует с метастатическим заболеванием. Поскольку PDAC секретирует альтернативно сплайсированные формы остеопонтина, он демонстрирует потенциал для нацеливания на опухоль и стадию заболевания. Хотя точные механизмы передачи сигналов остеопонтина при PDAC неизвестны, он связывается с CD44 и интегринами, запуская такие процессы, как прогрессирование опухоли и ингибирование комплемента. Остеопонтин также стимулирует метастазирование, вызывая высвобождение фактора роста эндотелия сосудов (VEGF) и матриксной металлопротеазы (MMP), которые ингибируются путем разрушения остеопонтина. Этот процесс также стимулируется никотином, который является предполагаемым механизмом, благодаря которому курильщики подвергаются повышенному риску развития ПК. Остеопонтин исследуется в качестве маркера ПК. Было обнаружено, что он работает лучше, чем CA19.9, при распознавании ВПМН [80] и резектабельных PDAC при панкреатите. Разрабатываются антитела против остеопонтина, в том числе hu1A12, которые ингибировали метастазирование в исследованиях in vivo, а также при гибридизации с антителом против VEGF бевацизумабом. По крайней мере, одно клиническое исследование изучает использование остеопонтина в качестве маркера внутриопухолевой гипоксии. Однако этот маркер остается относительно неизученным. [95]
Остеопонтин также участвует в чрезмерном образовании рубцов, и был разработан гель для подавления его эффекта. [96]
AOM1, препарат моноклональных антител против остеопонтина, разработанный компанией Pfizer, Inc. для ингибирования остеопонтина, показал многообещающую способность предотвращать прогрессирование крупных метастатических опухолей на мышиных моделях НМРЛ. [97] [98]
Несмотря на то, что Opn способствует метастазированию и может использоваться в качестве биомаркера рака, последние исследования описали новые защитные функции молекулы на врожденных популяциях клеток во время развития опухоли. В частности, поддержание пула естественных клеток-киллеров (NK) с оптимальной иммунной функцией имеет решающее значение для защиты хозяина от образования раковых опухолей. Исследование PNAS показывает, что iOpn является важным молекулярным компонентом, ответственным за поддержание функционального расширения NK-клеток. Отсутствие iOPN приводит к неспособности поддерживать нормальную клеточность NK и увеличению гибели клеток после стимуляции цитокином IL-15. NK-клетки с дефицитом OPN не могут успешно пройти фазу сокращения иммунного ответа, что приводит к нарушению размножения долгоживущих NK-клеток и дефектным ответам на опухолевые клетки. [99] Кроме того, плазмоцитоидные дендритные клетки (пДК) защищают от меланомы, и этот эффект опосредован интерферонами I типа. [100] Исследование в JCB показало, что специфический фрагмент (SLAYGLR) белка Opn может сделать пДК более «пригодными» для защиты от развития меланомы. Это было достигнуто за счет активации новой оси α4 интегрин/IFN-β, которая не зависит от MyD88 и действует через путь PI3K/mTOR/IRF3. [101]
Сердечная недостаточность
[ редактировать ]Остеопонтин минимально экспрессируется в нормальных условиях, но быстро накапливается при ухудшении функции сердца. [102] [103] В частности, он играет центральную роль в ремоделирующей реакции на инфаркт миокарда и резко активируется при гипертрофической (ГКМП) и дилатационной кардиомиопатии (ДКМП) . [103] В большом количестве он стимулирует широкий спектр физиологических изменений в миокарде , включая ангиогенез , локальную продукцию цитокинов дифференцировку миофибробластов , повышенное отложение внеклеточного матрикса и гипертрофию кардиомиоцитов , . В совокупности эти процессы реконструируют структуру сердца, фактически снижая его способность нормально функционировать и увеличивая риск сердечной недостаточности . [104] [105]
болезнь Паркинсона
[ редактировать ]OPN играет роль в окислительном и нитрозативном стрессе, апоптозе, митохондриальной дисфункции и эксайтотоксичности, которые также участвуют в патогенезе болезни Паркинсона . Изучены концентрации ОПН в сыворотке крови и спинномозговой жидкости (СМЖ) больных БП. Показано, что у больных БП уровни ОПН в жидкости организма повышены. [106]
Мышечные заболевания и травмы
[ редактировать ]Накапливаются данные, свидетельствующие о том, что остеопонтин играет ряд ролей при заболеваниях скелетных мышц , таких как мышечная дистрофия Дюшенна . Остеопонтин был описан как компонент воспалительной среды дистрофических и поврежденных мышц. [28] [107] [108] [109] а также было показано, что он усиливает рубцевание мышц диафрагмы у старых дистрофических мышей. [110] Недавнее исследование выявило, что остеопонтин является определяющим фактором тяжести заболевания у пациентов с мышечной дистрофией Дюшенна . [111] Это исследование показало, что мутация в промоторе гена остеопонтина, который, как известно, вызывает низкие уровни экспрессии остеопонтина, связана со снижением возраста, потерей способности передвигаться и мышечной силы у пациентов с мышечной дистрофией Дюшенна .
Остеоартрит тазобедренного сустава
[ редактировать ]Увеличение уровней OPN в плазме наблюдалось у пациентов с идиопатическим ОА тазобедренного сустава. Кроме того, была отмечена корреляция между уровнями OPN в плазме и тяжестью заболевания. [112]
Имплантация оплодотворенной яйцеклетки
[ редактировать ]OPN экспрессируется в клетках эндометрия во время имплантации. Из-за выработки прогестерона яичниками уровень OPN значительно повышается, что помогает в этом процессе. Эндометрий должен подвергнуться децидуализации – процессу, при котором эндометрий претерпевает изменения для подготовки к имплантации, что приведет к прикреплению эмбриона. В эндометрии находятся стромальные клетки, которые дифференцируются, создавая оптимальную среду для прикрепления эмбриона (децидуализация). OPN является жизненно важным белком для пролиферации и дифференцировки стромальных клеток, а также связывается с рецептором αvβ3, способствуя адгезии. OPN наряду с децидуализацией в конечном итоге способствует успешной имплантации раннего эмбриона. Нокаут гена OPN приводит к нестабильности прикрепления на границе между матерью и плодом. [113] [114]
Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000118785 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000029304 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ген Энтреза: секретируемый SPP1 фосфопротеин 1» .
- ^ Jump up to: а б Кальмар Л., Хомола Д., Варга Г., Томпа П. (сентябрь 2012 г.). «Структурный беспорядок в белках приводит к упорядочению роста кристаллов при биоминерализации». Кость . 51 (3): 528–534. дои : 10.1016/j.bone.2012.05.009 . ПМИД 22634174 .
- ^ Jump up to: а б с д и ж г Ван К.С., Денхардт Д.Т. (2008). «Остеопонтин: роль в иммунной регуляции и реакции на стресс» . Обзоры цитокинов и факторов роста . 19 (5–6): 333–345. doi : 10.1016/j.cytogfr.2008.08.001 . ПМИД 18952487 .
- ^ Рангасвами Х., Бульбуле А., Кунду Г.К. (февраль 2006 г.). «Остеопонтин: роль в передаче сигналов клетками и прогрессировании рака». Тенденции в клеточной биологии . 16 (2): 79–87. дои : 10.1016/j.tcb.2005.12.005 . ПМИД 16406521 .
- ^ Янг М.Ф., Керр Дж.М., Термин Дж.Д., Вевер У.М., Ван М.Г., Макбрайд О.В., Фишер Л.В. (август 1990 г.). «Клонирование кДНК, распределение и гетерогенность мРНК, хромосомное расположение и RFLP-анализ человеческого остеопонтина (OPN)» . Геномика . 7 (4): 491–502. дои : 10.1016/0888-7543(90)90191-V . ПМИД 1974876 .
- ^ Кифер MC, Бауэр DM, Барр П.Дж. (апрель 1989 г.). «КДНК и производная аминокислотная последовательность остеопонтина человека» . Исследования нуклеиновых кислот . 17 (8): 3306. doi : 10.1093/nar/17.8.3306 . ПМК 317745 . ПМИД 2726470 .
- ^ Jump up to: а б Кросби А.Х., Эдвардс С.Дж., Мюррей Дж.К., Диксон М.Дж. (май 1995 г.). «Геномная организация гена остеопонтина человека: исключение локуса из причинной роли в патогенезе несовершенного дентиногенеза II типа». Геномика . 27 (1): 155–160. дои : 10.1006/geno.1995.1018 . ПМИД 7665163 .
- ^ Jump up to: а б Баррос Н.М., Хоак Б., Невес Р.Л., Аддисон В.Н., Ассис Д.М., Муршед М. и др. (март 2013 г.). «Протеолитический процессинг остеопонтина с помощью PHEX и накопление фрагментов остеопонтина в кости мыши Hyp, мышиная модель Х-сцепленной гипофосфатемии» . Журнал исследований костей и минералов . 28 (3): 688–699. дои : 10.1002/jbmr.1766 . ПМИД 22991293 . S2CID 20840491 .
- ^ Лаффон А., Гарсия-Викунья Р., Умбрия А., Постиго А.А., Корби А.Л., де Ландасури М.О., Санчес-Мадрид Ф. (август 1991 г.). «Повышенная экспрессия и функция рецепторов фибронектина VLA-4 на активированных Т-клетках человека при ревматоидном артрите» . Журнал клинических исследований . 88 (2): 546–552. дои : 10.1172/JCI115338 . ПМК 295383 . ПМИД 1830891 .
- ^ Seiffge D (декабрь 1996 г.). «Защитное действие моноклональных антител к VLA-4 на адгезию лейкоцитов и течение заболевания при адъювантном артрите у крыс». Журнал ревматологии . 23 (12): 2086–2091. ПМИД 8970045 .
- ^ Jump up to: а б Рейнхольт Ф.П., Хультенби К., Олдберг А., Хайнегорд Д. (июнь 1990 г.). «Остеопонтин - возможный якорь остеокластов к кости» . Труды Национальной академии наук Соединенных Штатов Америки . 87 (12): 4473–4475. Бибкод : 1990PNAS...87.4473R . дои : 10.1073/pnas.87.12.4473 . ПМЦ 54137 . ПМИД 1693772 .
- ^ Jump up to: а б Банерджи А., Апте У.М., Смит Р., Рамайя С.К. (март 2006 г.). «Более высокая нейтрофильная инфильтрация, опосредованная остеопонтином, вероятно, является фактором, способствующим повышенной восприимчивости женщин к алкогольной болезни печени» . Журнал патологии . 208 (4): 473–485. дои : 10.1002/путь.1917 . ПМИД 16440289 . S2CID 45879742 .
- ^ Содек Дж., Батиста Да Силва А.П., Зохар Р. (май 2006 г.). «Остеопонтин и защита слизистой оболочки». Журнал стоматологических исследований . 85 (5): 404–415. дои : 10.1177/154405910608500503 . ПМИД 16632752 . S2CID 25898774 . [ постоянная мертвая ссылка ]
- ^ Зохар Р., Сузуки Н., Сузуки К., Арора П., Глогауэр М., Маккаллох К.А., Содек Дж. (июль 2000 г.). «Внутриклеточный остеопонтин является неотъемлемым компонентом комплекса CD44-ERM, участвующего в миграции клеток». Журнал клеточной физиологии . 184 (1): 118–130. doi : 10.1002/(SICI)1097-4652(200007)184:1<118::AID-JCP13>3.0.CO;2-Y . ПМИД 10825241 . S2CID 11548419 .
- ^ Сузуки К., Чжу Б., Риттлинг С.Р., Денхардт Д.Т., Голдберг Х.А., Маккаллох К.А., Содек Дж. (август 2002 г.). «Колокализация внутриклеточного остеопонтина с CD44 связана с миграцией, слиянием клеток и резорбцией в остеокластах». Журнал исследований костей и минералов . 17 (8): 1486–1497. дои : 10.1359/jbmr.2002.17.8.1486 . ПМИД 12162503 . S2CID 21307088 .
- ^ Чжу Б., Сузуки К., Голдберг Х.А., Риттлинг С.Р., Денхардт Д.Т., Маккаллох К.А., Содек Дж. (январь 2004 г.). «Остеопонтин модулирует CD44-зависимый хемотаксис перитонеальных макрофагов через рецепторы, связанные с G-белком: свидетельство роли внутриклеточной формы остеопонтина». Журнал клеточной физиологии . 198 (1): 155–167. дои : 10.1002/jcp.10394 . ПМИД 14584055 . S2CID 21075107 .
- ^ Джунаид А., Мун MC, Хардинг Дж.Е., Заградка П. (февраль 2007 г.). «Остеопонтин локализуется в ядре 293 клеток и связывается с поло-подобной киназой-1». Американский журнал физиологии. Клеточная физиология . 292 (2): C919–C926. doi : 10.1152/ajpcell.00477.2006 . ПМИД 17005603 .
- ^ Шинохара М.Л., Ким Х.Дж., Ким Дж.Х., Гарсия В.А., Кантор Х. (май 2008 г.). «Альтернативная трансляция остеопонтина генерирует внутриклеточные и секретируемые изоформы, которые опосредуют различную биологическую активность в дендритных клетках» . Труды Национальной академии наук Соединенных Штатов Америки . 105 (20): 7235–7239. Бибкод : 2008PNAS..105.7235S . дои : 10.1073/pnas.0802301105 . ПМЦ 2438233 . ПМИД 18480255 .
- ^ Jump up to: а б с Хе Б., Мирза М., Вебер Г.Ф. (апрель 2006 г.). «Вариант сплайсинга остеопонтина индуцирует независимость крепления в клетках рака молочной железы человека». Онкоген . 25 (15): 2192–2202. дои : 10.1038/sj.onc.1209248 . ПМИД 16288209 . S2CID 6632395 .
- ^ Мирза М., Шонесси Э., Херли Дж.К., Ванпаттен К.А., Пестано Г.А., Хе Б., Вебер Г.Ф. (февраль 2008 г.). «Остеопонтин-с является селективным маркером рака молочной железы» . Международный журнал рака . 122 (4): 889–897. дои : 10.1002/ijc.23204 . ПМИД 17960616 . S2CID 22146646 .
- ^ Ашизава Н., Граф К., До Ю.С., Нунохиро Т., Джачелли СМ, Михан В.П. и др. (ноябрь 1996 г.). «Остеопонтин вырабатывается сердечными фибробластами крыс и опосредует A(II)-индуцированный синтез ДНК и сокращение коллагенового геля» . Журнал клинических исследований . 98 (10): 2218–2227. дои : 10.1172/JCI119031 . ПМК 507670 . ПМИД 8941637 .
- ^ Марри CE, Джачелли CM, Шварц С.М., Врако Р. (декабрь 1994 г.). «Макрофаги экспрессируют остеопонтин во время восстановления некроза миокарда» . Американский журнал патологии . 145 (6): 1450–1462. ПМЦ 1887495 . ПМИД 7992848 .
- ^ Икеда Т., Ширасава Т., Эсаки Ю., Йошики С., Хирокава К. (декабрь 1993 г.). «МРНК остеопонтина экспрессируется пенистыми клетками гладкомышечного происхождения при атеросклеротических поражениях аорты человека» . Журнал клинических исследований . 92 (6): 2814–2820. дои : 10.1172/JCI116901 . ПМК 288482 . ПМИД 8254036 .
- ^ Jump up to: а б Уэсонтрачун К., Ю Х.Дж., Тюдор Э.М., Пайк Р.Н., Маки Э.Дж., Пейджел К.Н. (апрель 2008 г.). «Остеопонтин и миобласты скелетных мышц: связь с регенерацией мышц и регуляцией функции миобластов in vitro». Международный журнал биохимии и клеточной биологии . 40 (10): 2303–2314. doi : 10.1016/j.biocel.2008.03.020 . ПМИД 18490187 .
- ^ Мерри К., Доддс Р., Литтлвуд А., Гоуэн М. (апрель 1993 г.). «Экспрессия мРНК остеопонтина остеокластами и остеобластами при моделировании костей взрослого человека». Журнал клеточной науки . 104 (4): 1013–1020. дои : 10.1242/jcs.104.4.1013 . ПМИД 8314886 .
- ^ Накашима К., Чжоу X, Кункель Г., Чжан З., Дэн Дж.М., Берингер Р.Р., де Кромбрюге Б. (январь 2002 г.). «Новый транскрипционный фактор osterix, содержащий цинковые пальцы, необходим для дифференцировки остеобластов и формирования костей» . Клетка . 108 (1): 17–29. дои : 10.1016/S0092-8674(01)00622-5 . ПМИД 11792318 . S2CID 14030684 .
- ^ Дьюси П., Чжан Р., Жоффруа В., Ридалл А.Л., Карсенти Г. (май 1997 г.). «Osf2/Cbfa1: транскрипционный активатор дифференцировки остеобластов» . Клетка . 89 (5): 747–754. дои : 10.1016/S0092-8674(00)80257-3 . ПМИД 9182762 . S2CID 16979723 .
- ^ Юча С., Гатри Д. (декабрь 2003 г.). «Почечный гомеостаз кальция». Журнал сестринского дела в нефрологии . 30 (6): 755–764. ПМИД 14730782 .
- ^ Принц CW, Батлер WT (сентябрь 1987 г.). «1,25-Дигидроксивитамин D3 регулирует биосинтез остеопонтина, белка прикрепления клеток костного происхождения, в клональных остеобластоподобных клетках остеосаркомы». Коллаген и связанные с ним исследования . 7 (4): 305–313. дои : 10.1016/s0174-173x(87)80036-5 . ПМИД 3478171 .
- ^ Олдберг А., Йирског-Хед Б., Аксельссон С., Хайнегорд Д. (декабрь 1989 г.). «Регуляция мРНК костных сиалопротеинов стероидными гормонами» . Журнал клеточной биологии . 109 (6, ч. 1): 3183–3186. дои : 10.1083/jcb.109.6.3183 . ПМК 2115918 . ПМИД 2592421 .
- ^ Чанг П.Л., принц CW (апрель 1991 г.). «1 альфа,25-дигидроксивитамин D3 стимулирует синтез и секрецию нефосфорилированного остеопонтина (секретируемого фосфопротеина 1) в эпидермальных клетках мыши JB6». Исследования рака . 51 (8): 2144–2150. ПМИД 2009532 .
- ^ Jump up to: а б Перейра Т.А., Вас де Мело Триндаде Дж., Триндаде Сантос Е., Перейра Ф.Е., Соуза М.М. (май 2021 г.). «Фармакотерапия празиквантелом снижает системные уровни остеопонтина и содержание коллагена в печени при шистосомозе мышей». Международный журнал паразитологии . 51 (6): 437–440. дои : 10.1016/j.ijpara.2020.11.002 . ПМИД 33493521 . S2CID 231711719 .
- ^ «Редакция». Международный журнал паразитологии . 26 (8–9): 797–798. 9 августа 1996 г. дои : 10.1016/0020-7519(96)00065-3 . ISSN 0020-7519 .
- ^ Фатерази С., Матса-Данн Д., Фостер Б.Л., Резерфорд Р.Б., Сомерман М.Дж., Пресленд Р.Б. (январь 2009 г.). «Фосфат регулирует транскрипцию гена остеопонтина» . Журнал стоматологических исследований . 88 (1): 39–44. дои : 10.1177/0022034508328072 . ПМК 3128439 . ПМИД 19131315 .
- ^ Го Х, Цай CQ, Шредер Р.А., Куо ПК (январь 2001 г.). «Остеопонтин является регулятором отрицательной обратной связи синтеза оксида азота в мышиных макрофагах» . Журнал иммунологии . 166 (2): 1079–1086. дои : 10.4049/jimmunol.166.2.1079 . ПМИД 11145688 .
- ^ Jump up to: а б Рикардо С.Д., Францони Д.Ф., Розенер К.Д., Крисман Дж.М., Даймонд-младший (май 2000 г.). «Ангиотензиноген и антисмысловое ингибирование AT (1) трансляции остеопонтина в клетках проксимальных канальцев крысы». Американский журнал физиологии. Почечная физиология . 278 (5): Ф708–Ф716. дои : 10.1152/ajprenal.2000.278.5.F708 . ПМИД 10807582 .
- ^ Нода М., Родан Г.А. (февраль 1989 г.). «Транкрипционная регуляция продукции остеопонтина в остеобластоподобных клетках крысы с помощью паратиреоидного гормона» . Журнал клеточной биологии . 108 (2): 713–718. дои : 10.1083/jcb.108.2.713 . ПМК 2115413 . ПМИД 2465299 .
- ^ Халлингер Т.Г., Пан К., Вишванатан Х.Л., Сомерман М.Дж. (январь 2001 г.). «Активация TGFbeta и BMP-2 промотора OPN: роль smad- и hox-связывающих элементов». Экспериментальные исследования клеток . 262 (1): 69–74. дои : 10.1006/excr.2000.5074 . ПМИД 11120606 .
- ^ Содхи С.П., Пхадке С.А., Батле Д., Сахай А. (апрель 2001 г.). «Гипоксия и высокий уровень глюкозы вызывают чрезмерный рост мезангиальных клеток и синтез коллагена: роль остеопонтина». Американский журнал физиологии. Почечная физиология . 280 (4): Ф667–Ф674. дои : 10.1152/ajprenal.2001.280.4.F667 . ПМИД 11249858 . S2CID 26145407 .
- ^ Денхардт Д.Т., Нода М., О'Реган А.В., Павлин Д., Берман Дж.С. (май 2001 г.). «Остеопонтин как средство борьбы с воздействиями окружающей среды: регуляция воспаления, ремоделирование тканей и выживание клеток» . Журнал клинических исследований . 107 (9): 1055–1061. дои : 10.1172/JCI12980 . ПМК 209291 . ПМИД 11342566 .
- ^ Стандал Т., Борсет М., Сундан А. (сентябрь 2004 г.). «Роль остеопонтина в адгезии, миграции, выживании клеток и ремоделировании кости». Экспериментальная онкология . 26 (3): 179–184. ПМИД 15494684 .
- ^ Да Силва А.П., Поллетт А., Риттлинг С.Р., Денхардт Д.Т., Содек Дж., Зохар Р. (сентябрь 2006 г.). «Усиление разрушения тканей при остром колите, вызванном DSS, у мышей с нулевым уровнем OPN связано с подавлением экспрессии TNF-альфа и незапрограммированной гибелью клеток». Журнал клеточной физиологии . 208 (3): 629–639. дои : 10.1002/jcp.20701 . ПМИД 16741956 . S2CID 33704508 .
- ^ Фишер Л.В., Федарко Н.С. (2003). «Шесть генов, экспрессируемых в костях и зубах, кодируют нынешних членов семейства белков SIBLING». Исследование соединительной ткани . 44 (Приложение 1): 33–40. дои : 10.1080/03008200390152061 . ПМИД 12952171 . S2CID 29910722 .
- ^ Кристенсен Б., Нильсен М.С., Хазельманн К.Ф., Петерсен Т.Е., Соренсен Э.С. (август 2005 г.). «Посттрансляционно модифицированные остатки нативного человеческого остеопонтина расположены в кластерах: идентификация 36 сайтов фосфорилирования и пяти сайтов О-гликозилирования и их биологическое значение» . Биохимический журнал . 390 (Часть 1): 285–292. дои : 10.1042/BJ20050341 . ПМК 1184582 . ПМИД 15869464 .
- ^ Дэвид В., Мартин А., Хедж А.М., Дрезнер М.К., Роу П.С. (март 2011 г.). «Пептиды ASARM: PHEX-зависимая и независимая регуляция уровня фосфатов в сыворотке» . Американский журнал физиологии. Почечная физиология . 300 (3): F783–F791. дои : 10.1152/ajprenal.00304.2010 . ПМК 3064126 . ПМИД 21177780 .
- ^ Мартин А., Дэвид В., Лоуренс Дж.С., Шварц П.М., Лафер Э.М., Хедж А.М., Роу П.С. (апрель 2008 г.). «Деградация MEPE, DMP1 и высвобождение SIBLING ASARM-пептидов (мингибинов): ASARM-пептид(ы) непосредственно ответственны за дефектную минерализацию в HYP» . Эндокринология . 149 (4): 1757–1772. дои : 10.1210/en.2007-1205 . ПМК 2276704 . ПМИД 18162525 .
- ^ Аддисон В.Н., Накано Ю., Лойзель Т., Крин П., Макки, доктор медицинских наук (октябрь 2008 г.). «Пептиды MEPE-ASARM контролируют минерализацию внеклеточного матрикса путем связывания с гидроксиапатитом: ингибирование, регулируемое расщеплением ASARM PHEX» . Журнал исследований костей и минералов . 23 (10): 1638–1649. дои : 10.1359/jbmr.080601 . ПМИД 18597632 . S2CID 7709872 .
- ^ Jump up to: а б Аддисон В.Н., Масика Д.Л., Грей Джей-Джей, Макки, доктор медицинских наук (апрель 2010 г.). «Зависимое от фосфорилирования ингибирование минерализации пептидами остеопонтина ASARM регулируется расщеплением PHEX». Журнал исследований костей и минералов . 25 (4): 695–705. дои : 10.1359/jbmr.090832 . ПМИД 19775205 . S2CID 25689595 .
- ^ Курцбах Д., Платцер Г., Шварц Т.С., Хенен М.А., Конрат Р., Хиндербергер Д. (август 2013 г.). «Кооперативное развертывание компактных конформаций внутренне неупорядоченного белка остеопонтина» . Биохимия . 52 (31): 5167–5175. дои : 10.1021/bi400502c . ПМК 3737600 . ПМИД 23848319 .
- ^ Аззопарди П.В., О'Янг Дж., Ладжуа Дж., Карттунен М., Голдберг Х.А., Хантер Г.К. (февраль 2010 г.). «Роль электростатики и конформации во взаимодействиях белок-кристалл» . ПЛОС ОДИН . 5 (2): е9330. Бибкод : 2010PLoSO...5.9330A . дои : 10.1371/journal.pone.0009330 . ПМЦ 2824833 . ПМИД 20174473 .
- ^ Хантер Г.К., О'Янг Дж., Гроэ Б., Карттунен М., Голдберг Х.А. (декабрь 2010 г.). «Гибкая полиэлектролитная гипотеза белково-биоминерального взаимодействия». Ленгмюр . 26 (24): 18639–18646. дои : 10.1021/la100401r . ПМИД 20527831 .
- ^ Макки, доктор медицинских наук, Нэнси А. (май 1995 г.). «Иммуноцитохимия после внедрения коллоидного золота белков неколлагенового внеклеточного матрикса в минерализованных тканях». Микроскопические исследования и техника . 31 (1): 44–62. дои : 10.1002/jemt.1070310105 . ПМИД 7626799 . S2CID 5767310 .
- ^ Такемура Т., Сакагами М., Накасе Т., Кубо Т., Китамура Ю., Номура С. (сентябрь 1994 г.). «Локализация остеопонтина в отокониальных органах взрослых крыс». Исследование слуха . 79 (1–2): 99–104. дои : 10.1016/0378-5955(94)90131-7 . ПМИД 7806488 . S2CID 4765287 .
- ^ Хинке М.Т., Нис Ю., Гаутрон Дж., Манн К., Родригес-Наварро А.Б., Макки, доктор медицинских наук (январь 2012 г.). «Яичная скорлупа: строение, состав и минерализация» . Границы бионауки . 17 (4): 1266–1280. дои : 10.2741/3985 . ПМИД 22201802 .
- ^ Jump up to: а б Макки, доктор медицинских наук, Нэнси А., Хан С.Р. (декабрь 1995 г.). «Ультраструктурная иммунодетекция остеопонтина и остеокальцина как основных компонентов матрикса почечных камней». Журнал исследований костей и минералов . 10 (12): 1913–1929. дои : 10.1002/jbmr.5650101211 . ПМИД 8619372 . S2CID 37508279 .
- ^ О'Янг Дж., Кирико С., Аль Тархуни Н., Гроэ Б., Карттунен М., Голдберг Х.А., Хантер Г.К. (2009). «Фосфорилирование пептидов остеопонтина опосредует адсорбцию и включение в кристаллы оксалата кальция». Клетки Ткани Органы . 189 (1–4): 51–55. дои : 10.1159/000151724 . ПМИД 18728346 . S2CID 5534110 .
- ^ Jump up to: а б Чиен Ю.К., Масика Д.Л., Грей Дж.Дж., Нгуен С., Вали Х., Макки, доктор медицинских наук (август 2009 г.). «Модуляция роста дигидрата оксалата кальция путем селективного связывания с гранями кристаллов фосфорилированного остеопонтина и полиаспартатного пептида, демонстрирующего окклюзию за счет секторального (композиционного) зонирования» . Журнал биологической химии . 284 (35): 23491–23501. дои : 10.1074/jbc.M109.021899 . ПМЦ 2749123 . ПМИД 19581305 .
- ^ Содек Дж., Гансс Б., Макки, доктор медицины (2000). «Остеопонтин» . Критические обзоры по оральной биологии и медицине . 11 (3): 279–303. дои : 10.1177/10454411000110030101 . ПМИД 11021631 .
- ^ Резников Н., Хоак Б., Басс DJ, Эддисон В.Н., Баррос Н.М., Макки, доктор медицинских наук (сентябрь 2020 г.). «Биологическое трафаретирование минерализации в скелете: местное ферментативное удаление ингибиторов во внеклеточном матриксе». Кость . 138 : 115447. doi : 10.1016/j.bone.2020.115447 . ПМИД 32454257 . S2CID 218909350 .
- ^ Jump up to: а б Макки, доктор медицинских наук, Басс DJ, Резников Н. (март 2022 г.). «Минеральная мозаика в кости и принцип трафарета для минерализации внеклеточного матрикса». Журнал структурной биологии . 214 (1): 107823. doi : 10.1016/j.jsb.2021.107823 . ПМИД 34915130 . S2CID 245187449 .
- ^ Макки, доктор медицинских наук, Хоак Б., Аддисон В.Н., Баррос Н.М., Миллан Дж.Л., Шоссен С. (октябрь 2013 г.). «Минерализация внеклеточного матрикса в тканях пародонта: белки неколлагенового матрикса, ферменты и связь с гипофосфатазией и Х-сцепленной гипофосфатемией» . Пародонтология 2000 . 63 (1): 102–122. дои : 10.1111/прд.12029 . ПМЦ 3766584 . ПМИД 23931057 .
- ^ Букпесси Т., Хоак Б., Койак Б.Р., Леже Т., Гарсия С., Викарт П. и др. (февраль 2017 г.). «Остеопонтин и зубочелюстная патобиология Х-сцепленной гипофосфатемии». Кость . 95 : 151–161. дои : 10.1016/j.bone.2016.11.019 . ПМИД 27884786 .
- ^ Резников Н., Хоак Б., Басс DJ, Эддисон В.Н., Баррос Н.М., Макки, доктор медицинских наук (сентябрь 2020 г.). «Биологическое трафаретирование минерализации в скелете: местное ферментативное удаление ингибиторов во внеклеточном матриксе». Кость . 138 : 115447. doi : 10.1016/j.bone.2020.115447 . ПМИД 32454257 . S2CID 218909350 .
- ^ Макки, доктор медицинских наук, Аддисон В.Н., Каартинен М.Т. (2005). «Иерархия внеклеточного матрикса и минеральной организации костей черепно-лицевого комплекса и скелета». Клетки Ткани Органы . 181 (3–4): 176–188. дои : 10.1159/000091379 . ПМИД 16612083 . S2CID 40705942 .
- ^ Jump up to: а б Стейц С.А., Спир М.Ю., Макки М.Д., Лиав Л., Алмейда М., Ян Х., Джачелли К.М. (декабрь 2002 г.). «Остеопонтин ингибирует отложение минералов и способствует регрессу эктопической кальцификации» . Американский журнал патологии . 161 (6): 2035–2046. дои : 10.1016/S0002-9440(10)64482-3 . ПМК 1850905 . ПМИД 12466120 .
- ^ Джачелли CM (март 1999 г.). «Эктопическая кальцификация: сбор достоверных фактов о минерализации мягких тканей» . Американский журнал патологии . 154 (3): 671–675. дои : 10.1016/S0002-9440(10)65313-8 . ПМК 1866412 . ПМИД 10079244 .
- ^ Каартинен М.Т., Муршед М., Карсенти Г., Макки, доктор медицинских наук (апрель 2007 г.). «Повышение регуляции и полимеризация остеопонтина с помощью трансглутаминазы 2 в кальцинированных артериях мышей с дефицитом белка Matrix Gla» . Журнал гистохимии и цитохимии . 55 (4): 375–386. дои : 10.1369/jhc.6A7087.2006 . ПМИД 17189522 .
- ^ Чхве С.Т., Ким Дж.Х., Кан Э.Дж., Ли С.В., Пак МС, Пак Ю.Б., Ли С.К. (декабрь 2008 г.). «Остеопонтин может участвовать в ремоделировании кости, а не в воспалении при анкилозирующем спондилите» . Ревматология . 47 (12): 1775–1779. doi : 10.1093/ревматология/ken385 . ПМИД 18854347 .
- ^ Макки, доктор медицинских наук, Нэнси А. (1996). «Остеопонтин: межфазный белок внеклеточного матрикса в минерализованных тканях». Исследование соединительной ткани . 35 (1–4): 197–205. дои : 10.3109/03008209609029192 . ПМИД 9084658 .
- ^ Jump up to: а б Нагасака А., Мацуэ Х., Мацусима Х., Аоки Р., Накамура Ю., Камбе Н. и др. (февраль 2008 г.). «Остеопонтин вырабатывается тучными клетками и влияет на IgE-опосредованную дегрануляцию и миграцию тучных клеток» . Европейский журнал иммунологии . 38 (2): 489–499. дои : 10.1002/eji.200737057 . ПМИД 18200503 .
- ^ Кроуфорд Х.К., Матрисиан Л.М., Лиав Л. (ноябрь 1998 г.). «Особая роль остеопонтина в защитной активности хозяина и выживании опухоли во время прогрессирования плоскоклеточного рака in vivo». Исследования рака . 58 (22): 5206–5215. ПМИД 9823334 .
- ^ Апте У.М., Банерджи А., Макри Р., Веллберг Э., Рамайя С.К. (август 2005 г.). «Роль остеопонтина в нейтрофильной инфильтрации печени при алкогольном стеатогепатите». Токсикология и прикладная фармакология . 207 (1): 25–38. дои : 10.1016/j.taap.2004.12.018 . ПМИД 15885730 .
- ^ Ко А., да Силва А.П., Бансал А.К., Бансал М., Сан С., Ли Х. и др. (декабрь 2007 г.). «Роль остеопонтина в функции нейтрофилов» . Иммунология . 122 (4): 466–475. дои : 10.1111/j.1365-2567.2007.02682.x . ПМК 2266047 . PMID 17680800 .
- ^ Осима С., Кобаяши Х., Ямагути Н., Нисиока К., Умешита-Сасаи М., Мима Т. и др. (апрель 2002 г.). «Экспрессия остеопонтина в местах эрозии кости в мышиной экспериментальной модели коллаген-индуцированного артрита: возможное участие остеопонтина в разрушении кости при артрите» . Артрит и ревматизм . 46 (4): 1094–1101. дои : 10.1002/арт.10143 . ПМИД 11953989 .
- ^ Саката М., Цуруха Дж.И., Масуко-Хонго К., Накамура Х., Мацуи Т., Судо А. и др. (июль 2001 г.). «Аутоантитела к остеопонтину у больных остеоартритом и ревматоидным артритом». Журнал ревматологии . 28 (7): 1492–1495. ПМИД 11469452 .
- ^ Бурдо Т.Х., Вуд М.Р., Фокс Х.С. (июнь 2007 г.). «Остеопонтин предотвращает рециркуляцию и апоптоз моноцитов» . Журнал биологии лейкоцитов . 81 (6): 1504–1511. дои : 10.1189/jlb.1106711 . ПМК 2490714 . ПМИД 17369493 .
- ^ Юмото К., Исиджима М., Риттлинг С.Р., Цудзи К., Цучия Ю., Кон С. и др. (апрель 2002 г.). «Дефицит остеопонтина защищает суставы от разрушения при артрите у мышей, индуцированном антителами к коллагену II типа» . Труды Национальной академии наук Соединенных Штатов Америки . 99 (7): 4556–4561. Бибкод : 2002PNAS...99.4556Y . дои : 10.1073/pnas.052523599 . ПМК 123686 . ПМИД 11930008 .
- ^ Джейкобс Дж.П., Петтит А.Р., Шинохара М.Л., Янссон М., Кантор Х., Граваллезе Э.М. и др. (август 2004 г.). «Отсутствие потребности в остеопонтине при воспалении, эрозии кости и повреждении хряща в модели K/BxN артрита, опосредованного аутоантителами». Артрит и ревматизм . 50 (8): 2685–2694. дои : 10.1002/арт.20381 . ПМИД 15334485 .
- ^ Шабас Д., Баранзини С.Э., Митчелл Д., Бернард К.С., Риттлинг С.Р., Денхардт Д.Т. и др. (ноябрь 2001 г.). «Влияние провоспалительного цитокина остеопонтина на аутоиммунное демиелинизирующее заболевание». Наука . 294 (5547): 1731–1735. Бибкод : 2001Sci...294.1731C . дои : 10.1126/science.1062960 . ПМИД 11721059 . S2CID 86208485 .
- ^ Jump up to: а б с д и Ксанту Г., Алиссафи Т., Семитеколоу М., Симоэс Д.С., Экономиду Э., Гага М. и др. (май 2007 г.). «Остеопонтин играет решающую роль при аллергических заболеваниях дыхательных путей посредством регуляции дендритных клеток» . Природная медицина . 13 (5): 570–578. дои : 10.1038/нм1580 . ПМЦ 3384679 . ПМИД 17435770 .
- ^ Симоэс Д.С., Ксанту Г., Петрочилу К., Панутсакопулу В., Руссос С., Грациу С. (май 2009 г.). «Дефицит остеопонтина защищает от ремоделирования дыхательных путей и гиперреактивности при хронической астме». Американский журнал респираторной медицины и медицины интенсивной терапии . 179 (10): 894–902. дои : 10.1164/rccm.200807-1081OC . ПМИД 19234104 .
- ^ Самитас К., Зервас Е., Витторакис С., Семитеколоу М., Алиссафи Т., Боссиос А. и др. (февраль 2011 г.). «Экспрессия остеопонтина и связь с тяжестью заболевания при астме у человека» . Европейский респираторный журнал . 37 (2): 331–341. дои : 10.1183/09031936.00017810 . ПМИД 20562127 .
- ^ Хиллас Г., Лукидес С., Костикас К., Симоес Д., Петта В., Константеллу Е. и др. (январь 2013 г.). «Повышенный уровень остеопонтина в супернатанте мокроты курящих астматиков». Цитокин . 61 (1): 251–255. дои : 10.1016/j.cyto.2012.10.002 . ПМИД 23098767 .
- ^ Самитас К., Зервас Э., Ксанту Г., Панутсакопулу В., Гага М. (март 2013 г.). «Остеопонтин увеличивается в жидкости бронхоальвеолярного лаважа и бронхиальной ткани у курящих астматиков». Цитокин . 61 (3): 713–715. дои : 10.1016/j.cyto.2012.12.028 . ПМИД 23384656 .
- ^ Jump up to: а б Гасслер Н., Аутшбах Ф., Гауэр С., Бон Дж., Сидо Б., Отто Х.Ф. и др. (ноябрь 2002 г.). «Экспрессия остеопонтина (Эта-1) при болезни Крона терминального отдела подвздошной кишки». Скандинавский журнал гастроэнтерологии . 37 (11): 1286–1295. дои : 10.1080/003655202761020560 . ПМИД 12465727 . S2CID 6381267 .
- ^ Сато Т., Накаи Т., Тамура Н., Окамото С., Мацуока К., Сакураба А. и др. (сентябрь 2005 г.). «Остеопонтин/Эта-1, повышенная активность при болезни Крона, регулирует иммунный ответ Th1» . Гут . 54 (9): 1254–1262. дои : 10.1136/gut.2004.048298 . ПМЦ 1774642 . ПМИД 16099792 .
- ^ Мисима Р., Такэсима Ф., Савай Т., Охба К., Онита К., Исомото Х. и др. (февраль 2007 г.). «Высокие уровни остеопонтина в плазме у пациентов с воспалительными заболеваниями кишечника». Журнал клинической гастроэнтерологии . 41 (2): 167–172. дои : 10.1097/MCG.0b013e31802d6268 . ПМИД 17245215 . S2CID 25039321 .
- ^ Jump up to: а б Курепини Э., Аггелакопулу М., Алиссафи Т., Паскалидис Н., Симоэс Д.С., Панутсакопулу В. (март 2014 г.). «Экспрессия остеопонтина дендритными клетками CD103 вызывает воспаление кишечника» . Труды Национальной академии наук Соединенных Штатов Америки . 111 (9): Е856–Е865. Бибкод : 2014PNAS..111E.856K . дои : 10.1073/pnas.1316447111 . ПМЦ 3948306 . ПМИД 24550510 .
- ^ Штейнман Л. (февраль 2007 г.). «Краткая история T(H)17, первого серьезного пересмотра гипотезы T(H)1/T(H)2 о повреждении тканей, опосредованном Т-клетками». Природная медицина . 13 (2): 139–145. дои : 10.1038/nm1551 . ПМИД 17290272 . S2CID 10640379 .
- ^ Клэй Р., Сиддики С.А. (январь 2019 г.). «Последние достижения в области молекулярной диагностики и терапевтических целей рака поджелудочной железы». Тераностический подход к раку поджелудочной железы : 325–367. дои : 10.1016/B978-0-12-819457-7.00016-5 . ISBN 9780128194577 . S2CID 214323538 .
- ^ Клей Р., Сиддики С.А. (01 января 2019 г.). «Последние достижения в области молекулярной диагностики и терапевтических целей рака поджелудочной железы». Тераностический подход к раку поджелудочной железы : 325–367. дои : 10.1016/B978-0-12-819457-7.00016-5 . ISBN 9780128194577 . S2CID 214323538 .
- ^ Мори Р., Шоу Т.Дж., Мартин П. (январь 2008 г.). «Молекулярные механизмы, связывающие воспаление раны и фиброз: нокдаун остеопонтина приводит к быстрому восстановлению и уменьшению рубцов» . Журнал экспериментальной медицины . 205 (1): 43–51. дои : 10.1084/jem.20071412 . ПМЦ 2234383 . ПМИД 18180311 .
- «Гель «для ускорения заживления ран» » . Новости Би-би-си . 22 января 2008 г.
- ^ Шоджаи Ф., Скотт Н., Канг X, Лаппин П.Б., Фицджеральд А.А., Карличек С. и др. (март 2012 г.). «Остеопонтин индуцирует рост метастатических опухолей в доклинической модели немелкоклеточного рака легких» . Журнал экспериментальных и клинических исследований рака . 31 (1): 26. дои : 10.1186/1756-9966-31-26 . ПМЦ 3325875 . ПМИД 22444159 .
- ^ Фаррохи В., Шабо-младший, Нойберт Х., Ян З. (май 2018 г.). «Оценка возможности нейтрализации остеопонтина различными методами лечения антителами» . Научные отчеты . 8 (1): 7781. Бибкод : 2018NatSR...8.7781F . doi : 10.1038/s41598-018-26187-w . ПМЦ 5958109 . ПМИД 29773891 .
- ^ Ливенворт Дж.В., Вербиннен Б., Ван К., Шен Э., Кантор Х. Внутриклеточный остеопонтин регулирует гомеостаз и функцию естественных клеток-киллеров. Proc Natl Acad Sci, США, 13 января 2015 г.; 112 (2): 494-9. дои: 10.1073/pnas.1423011112. Epub, 30 декабря 2014 г. PMID 25550515; PMCID: PMC4299239.
- ^ Дробитс Б., Хольцманн М., Амберг Н., Свецки М., Грундтнер Р., Хаммер М., Колонна М., Сибилия М. Имиквимод очищает опухоли у мышей независимо от адаптивного иммунитета, превращая pDC в эффекторные клетки, убивающие опухоли. Джей Клин Инвест. 2012 февраль;122(2):575-85. дои: 10.1172/JCI61034. Epub 2012, 17 января. PMID 22251703; PMCID: PMC3266798.
- ^ Давина Камарго Мадейра Симоес, Николаос Паскалидис, Евангелия Курепини, Вили Пануцакопулу; Ось интегрина индуцирует продукцию IFN-β в плазмацитоидных дендритных клетках. J Cell Biol, 5 сентября 2022 г.; 221 (9): e202102055. дои: https://doi.org/10.1083/jcb.202102055
- ^ Сингх М., Далал С., Сингх К. (ноябрь 2014 г.). «Остеопонтин: на перекрестке выживания миоцитов и функции миокарда» . Науки о жизни . 118 (1): 1–6. дои : 10.1016/j.lfs.2014.09.014 . ПМЦ 4254317 . ПМИД 25265596 .
- ^ Jump up to: а б Сингх М., Фостер Ч.Р., Далал С., Сингх К. (март 2010 г.). «Остеопонтин: роль в отложении внеклеточного матрикса и ремоделировании миокарда после ИМ» . Журнал молекулярной и клеточной кардиологии . 48 (3): 538–543. дои : 10.1016/j.yjmcc.2009.06.015 . ПМЦ 2823840 . ПМИД 19573532 .
- ^ Сиракава К., Сано М. (июль 2021 г.). «Остеопонтин при сердечно-сосудистых заболеваниях» . Биомолекулы . 11 (7): 1047. doi : 10.3390/biom11071047 . ПМК 8301767 . ПМИД 34356671 .
- ^ Граф К., До Ю.С., Ашизава Н., Михан В.П., Джачелли С.М., Марбое CC и др. (ноябрь 1997 г.). «Экспрессия миокардиального остеопонтина связана с гипертрофией левого желудочка». Тираж . 96 (9): 3063–3071. дои : 10.1161/01.CIR.96.9.3063 . ПМИД 9386176 .
- ^ Мецлер В., Берг Д., Шаламберидзе Н., Мелмс А., Шотт К., Мюллер Дж.К. и др. (март 2007 г.). «При болезни Паркинсона повышается уровень остеопонтина, а его отсутствие приводит к снижению нейродегенерации в модели MPTP». Нейробиология болезней . 25 (3): 473–482. дои : 10.1016/j.nbd.2006.10.020 . ПМИД 17188882 . S2CID 30275400 .
- ^ Портер Дж.Д., Ханна С., Камински Х.Дж., Рао Дж.С., Мерриам А.П., Ричмондс С.Р. и др. (февраль 2002 г.). «Хроническая воспалительная реакция доминирует в молекулярной сигнатуре скелетных мышц у мышей mdx с дефицитом дистрофина» . Молекулярная генетика человека . 11 (3): 263–272. дои : 10.1093/hmg/11.3.263 . ПМИД 11823445 .
- ^ Хаслетт Дж.Н., Сануду Д., Хо А.Т., Беннетт Р.Р., Гринберг С.А., Кохане И.С. и др. (ноябрь 2002 г.). «Сравнение экспрессии генов в биоптатах мышечной дистрофии Дюшенна (МДД) и нормальных скелетных мышц» . Труды Национальной академии наук Соединенных Штатов Америки . 99 (23): 15 000–15 005. Бибкод : 2002PNAS...9915000H . дои : 10.1073/pnas.192571199 . ПМЦ 137534 . ПМИД 12415109 .
- ^ Хирата А., Масуда С., Тамура Т., Кай К., Одзима К., Фукасе А. и др. (июль 2003 г.). «Профиль экспрессии цитокинов и родственных генов в регенерации скелетных мышц после инъекции кардиотоксина: роль остеопонтина» . Американский журнал патологии . 163 (1): 203–215. дои : 10.1016/S0002-9440(10)63644-9 . ПМК 1868192 . ПМИД 12819025 .
- ^ Ветрон С.А., Монтечино-Родригес Е., Кудряшова Е., Крамерова И., Хоффман Е.П., Лю С.Д. и др. (июнь 2009 г.). «Остеопонтин способствует фиброзу дистрофических мышц мыши путем модуляции субпопуляций иммунных клеток и внутримышечного TGF-бета» . Журнал клинических исследований . 119 (6): 1583–1594. дои : 10.1172/JCI37662 . ПМК 2689112 . ПМИД 19451692 .
- ^ Пегораро Э., Хоффман Э.П., Пива Л., Гавасини Б.Ф., Каннин С., Эрмани М. и др. (январь 2011 г.). «Генотип SPP1 является определяющим фактором тяжести заболевания при мышечной дистрофии Дюшенна» . Неврология . 76 (3): 219–226. doi : 10.1212/WNL.0b013e318207afeb . ПМК 3034396 . ПМИД 21178099 .
- ^ Эль Диб С., Абдельнаби Р., Хачаб А., Блазиус К., Тингарт М., Рат Б. (июль 2016 г.). «Остеопонтин как биохимический маркер и индикатор тяжести идиопатического остеоартрита тазобедренного сустава». Хип Интернэшнл . 26 (4): 397–403. дои : 10.5301/hipint.5000361 . ПМИД 27229171 . S2CID 40819265 .
- ^ Кан Ю.Дж., Форбс К., Карвер Дж., Аплин Дж.Д. (апрель 2014 г.). «Роль взаимодействия остеопонтин-интегрин αvβ3 при имплантации: функциональный анализ с использованием трех различных моделей in vitro». Репродукция человека . 29 (4): 739–749. дои : 10.1093/humrep/det433 . ПМИД 24442579 .
- ^ Джонсон Г.А., Бургхардт Р.С., Базер Ф.В., Спенсер Т.Е. (ноябрь 2003 г.). «Остеопонтин: роль в имплантации и плацентации» . Биология размножения . 69 (5): 1458–1471. дои : 10.1095/biolreprod.103.020651 . ПМИД 12890718 .
Дальнейшее чтение
[ редактировать ]- Фудзисава Р. (март 2002 г.). «[Последние достижения в исследованиях белков костного матрикса]». Нихон Ринсё. Японский журнал клинической медицины . 60. 60 (Приложение 3): 72–78. ПМИД 11979972 .
- Денхардт Д.Т., Мистретта Д., Чемберс А.Ф., Кришна С., Портер Дж.Ф., Рагурам С., Риттлинг С.Р. (2003). «Регуляция транскрипции остеопонтина и метастатический фенотип: доказательства наличия Ras-активируемого усилителя в промоторе OPN человека». Клинические и экспериментальные метастазы . 20 (1): 77–84. дои : 10.1023/А:1022550721404 . ПМИД 12650610 . S2CID 20286402 .
- Йитман Т.Дж., Чемберс А.Ф. (2003). «Остеопонтин и прогрессирование рака толстой кишки». Клинические и экспериментальные метастазы . 20 (1): 85–90. дои : 10.1023/А:1022502805474 . ПМИД 12650611 . S2CID 25253392 .
- О'Риган А. (декабрь 2003 г.). «Роль остеопонтина в заболеваниях легких». Обзоры цитокинов и факторов роста . 14 (6): 479–488. дои : 10.1016/S1359-6101(03)00055-8 . ПМИД 14563350 .
- Вай П.Ю., Куо ПК (октябрь 2004 г.). «Роль остеопонтина в метастазировании опухоли». Журнал хирургических исследований . 121 (2): 228–241. дои : 10.1016/j.jss.2004.03.028 . ПМИД 15501463 .
- Конно С., Хизава Н., Нисимура М., Хуанг С.К. (декабрь 2006 г.). «Остеопонтин: потенциальный биомаркер для успешной иммунотерапии пчелиным ядом и потенциальная молекула для ингибирования IgE-опосредованных аллергических реакций» . Международная аллергология . 55 (4): 355–359. дои : 10.2332/аллерголинт.55.355 . ПМИД 17130676 .
- Родригес ЛР, Тейшейра Х.А., Шмитт Ф.Л., Паулссон М., Линдмарк-Манссон Х. (июнь 2007 г.). «Роль остеопонтина в прогрессировании опухоли и метастазировании рака молочной железы» . Эпидемиология рака, биомаркеры и профилактика . 16 (6): 1087–1097. doi : 10.1158/1055-9965.EPI-06-1008 . hdl : 1822/7274 . ПМИД 17548669 .
- Рамайя С.К., Риттлинг С. (август 2007 г.). «Роль остеопонтина в регуляции воспалительных реакций печени и токсического поражения печени». Экспертное заключение по метаболизму и токсикологии лекарственных средств . 3 (4): 519–526. дои : 10.1517/17425225.3.4.519 . ПМИД 17696803 .
Внешние ссылки
[ редактировать ]- Остеопонтин Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)
- Обзор всей структурной информации, доступной в PDB для UniProt : P10451 (Остеопонтин) в PDBe-KB .