Рецептор интерферона-альфа/бета
| рецептор интерферона (альфа, бета и омега) 1 | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | ИФНАР1 | ||
| Альт. символы | ИФНАР | ||
| ген NCBI | 3454 | ||
| HGNC | 5432 | ||
| МОЙ БОГ | 107450 | ||
| RefSeq | НМ_000629 | ||
| ЮниПрот | P17181 | ||
| Другие данные | |||
| Локус | Хр. 21 q22.1 | ||
| |||
| рецептор интерферона (альфа, бета и омега) 2 | |||
|---|---|---|---|
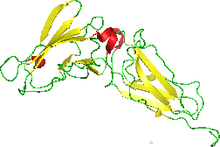 ЯМР-структура интерферонсвязывающего эктодомена рецептора интерферона человека. [ 1 ] | |||
| Идентификаторы | |||
| Символ | ИФНАР2 | ||
| Альт. символы | ИФНАБР | ||
| ген NCBI | 3455 | ||
| HGNC | 5433 | ||
| МОЙ БОГ | 602376 | ||
| RefSeq | НМ_207585 | ||
| ЮниПрот | P48551 | ||
| Другие данные | |||
| Локус | Хр. 21 q22.1 | ||
| |||
Рецептор интерферона-α/β (IFNAR) представляет собой практически повсеместно распространенный мембранный рецептор, который связывает эндогенные цитокины интерферона I типа (IFN). Эндогенные человеческие интерфероны типа I включают множество подтипов, таких как интерфероны-α, -β, -ε, -κ, -ω и -ζ. [ 2 ]
Функция
[ редактировать ]Активация различных сигнальных путей врожденного иммунитета ( TLR3 , TLR4 , TLR7 , TLR8 , TLR9 , cGAS , RIG-I , MDA-5 ) приводит к быстрой индукции IFN типа I из-за их (в основном) безинтронной генной структуры. [ 3 ] [ 4 ] Регуляторные элементы, расположенные выше генов IFN типа I, различаются, что обеспечивает дифференциальную транскрипцию IFN типа I в ответ на стимулы. [ 5 ] В частности, IFNβ содержит регуляторный сайт κB, тогда как подтипы IFNα его не имеют. Производство специфических IFN I типа обычно ограничивается небольшим числом подтипов IFN I типа. [ 5 ] После секреции ИФН I типа передают сигнал через ИФНАР паракринным и аутокринным образом. [ 6 ]
IFNAR представляет собой гетеромерный рецептор клеточной поверхности, состоящий из двух субъединиц, называемых субъединицей с низким сродством, IFNAR1 , и субъединицей с высоким сродством, IFNAR2 . [ 7 ] [ 8 ] При связывании интерферонов I типа IFNAR активирует сигнальный путь JAK-STAT , а также MAPK , PI3K и Akt . сигнальные пути [ 2 ] Агонизм IFNAR приводит к изменениям транскрипции с возможностью усиления или подавления транскрипции более 2000 различных генов. [ 9 ] Например, IFN типа I индуцируют стимулируемую интерфероном экспрессию генов ( ISG ), что обычно приводит к устойчивому противовирусному иммунному ответу. Кроме того, интерфероны в значительной степени влияют на здоровье и жизнеспособность клеток, влияя на апоптоз , аутофагию , клеток . дифференцировку и пролиферацию [ 10 ] Разнообразные эффекты IFN типа I, вероятно, зависят от клеточного и экологического контекста. [ 8 ]
Были изучены различные ответы, например противовирусные и антипролиферативные ответы, на подтипы IFN I типа, и проксимальная передача сигналов, такая как фосфорилирование STAT , по-видимому, не коррелирует с исходом. Более того, хотя дифференциальные эффекты проявляются после нескольких дней хронической стимуляции, изменения в структуре, ориентации или стехиометрии рецепторов не выявили причину дифференциальной передачи сигналов через разные подтипы IFN I типа. [ 8 ] [ 11 ] Текущие гипотезы дифференциальной передачи сигналов включают специфичные для лиганда различия в стабильности или времени жизни тройного комплекса. [ 12 ] лиганд-индуцированные изменения в интернализации и транспортировке рецептора [ 8 ] и в настоящее время недооцененные различия в структуре лиганд-рецептор. [ 12 ]
Структура
[ редактировать ]Рецептор IFN типа I образует тройной комплекс, состоящий из двух субъединиц IFNAR1 и IFNAR2 и лиганда IFN типа I. Связывание лиганда с любой субъединицей необходимо и предшествует димеризации и активации рецептора. Каждая субъединица IFNAR содержит N-концевой лиганд-связывающий домен (с двумя или четырьмя субдоменами, подобными фибронектину типа II, для IFNAR2 и IFNAR1 соответственно), трансмембранный (TM) домен и цитоплазматический домен. [ 7 ] Каждый лиганд IFN типа I содержит «горячую точку» или последовательность консервативных аминокислот, которые участвуют в связывании с рецептором, в частности с рецептором с высоким сродством IFNAR2, который определяет сродство каждого лиганда к рецептору. [ 11 ]
Структурный анализ рецептора IFN типа I с различными подтипами лиганда IFN типа I выявил сходный сайт связывания для разных агонистов. [ 8 ] Исследования мутагенеза IFN типа I, IFNAR1 и IFNAR2 продемонстрировали важные остатки связывания, т.е. «горячие точки», на подтипах IFN типа I, которые влияют на его способность связываться с IFNAR2. На связывание IFN типа I с IFNAR1 менее сильно влияла мутация отдельных аминокислот на аланин. [ 9 ] Важно отметить, что структурные исследования не выявили различий в структурах тройных комплексов с IFNAR и различными подтипами IFN I типа, несмотря на различия в сродстве к лигандам. [ 8 ] Эволюционная консервативность подтипов IFN типа I, связывающих один и тот же рецептор IFNAR в одном и том же сайте с разным сродством, позволяет предположить, что IFN типа I не дублируются и потенциально регулируют различные клеточные реакции. [ 2 ] [ 11 ] Попытки создать более мощный IFNα2 вызвали клеточный ответ, аналогичный IFNβ, что позволяет предположить, что сродство IFN типа I к IFNAR играет важную роль в регуляции нижестоящего ответа. [ 9 ]
Субъединицы
[ редактировать ]Гены IFNAR1 и IFNAR2 человека расположены на хромосоме 21q22.1. [ 13 ] [ 14 ]
ИФНАР1
[ редактировать ]IFNAR1 представляет собой субъединицу с низким сродством, первоначально клонированную в 1990 году и состоящую из четырех субдоменов, подобных фибронектину типа II (FNII-подобных), называемых SD1-4. [ 7 ] [ 15 ] ИФН типа I связывают SD1-3 с типичной аффинностью связывания 0,5–5 мкм; Исключением являются IFNα1 и IFNβ со аффинностью связывания 220 нМ и 100 нМ соответственно. [ 7 ] IFN типа I имеют степень связывания 5x10. 5 M/s с переменной скоростью диссоциации, которая определяет сродство подтипа IFN I типа к IFNAR1. [ 2 ]
Цитоплазматический домен IFNAR1 связан с Tyk2 и Tyk2, что необходимо для мембранной экспрессии IFNAR1. [ 2 ] В отсутствие Tyk2 цитоплазматический мотив IFNAR1 фосфорилируется, индуцируя интернализацию рецептора. [ 9 ] Затем IFNAR1 локализуется в перинуклеарном эндосомальном компартменте и разрушается. [ 8 ] Нулевые клетки Tyk2 сохраняют некоторую чувствительность к IFNβ. Однако чувствительность к IFNα снижается, вероятно, из-за снижения мембранной экспрессии IFNAR1. [ 8 ] Было предложено, что связывание IFNAR1 с лигандами с низким сродством, такими как подтипы IFNα, является стадией, лимитирующей скорость образования тройного комплекса. [ 8 ] Следовательно, если мембранные уровни IFNAR1 слишком низкие, бинарный комплекс IFNα-IFNAR2 не сможет рекрутировать его для индукции передачи сигналов. Эта гипотеза подтверждается наблюдениями о том, что клеточные линии с низкой экспрессией IFNAR1 реагируют на IFNβ, но не на IFNα. [ 8 ]
ИФНАР2
[ редактировать ]IFNAR2 представляет собой субъединицу с высоким сродством, первоначально клонированную в 1994 году и состоящую из двух FNII-подобных субдоменов, названных D1 и D2. [ 7 ] [ 15 ] ИФН типа I связывают D1 и D2 с типичной аффинностью связывания 0,4–5 нМ; IFNβ связывается с несколько меньшим сродством (0,1 нМ). [ 7 ] IFN типа I имеют коэффициент обязательной ассоциации 10. −6 –10 −7 M/s с переменной скоростью диссоциации, которая определяет сродство подтипа IFN типа I к IFNAR2. [ 7 ]
IFNAR2 экспрессируется в виде трех изоформ благодаря альтернативному сплайсингу, пропуску экзонов и множественным сайтам полиаденилирования; IFNAR2a (растворимая форма, лишенная домена TM), IFNAR2b (растворимая форма, лишенная цитоплазматического домена) и IFNAR2c (мембраносвязанная, компетентная в передаче сигнала форма). [ 2 ] Цитоплазматический домен IFNAR2c связывается с JAK1 . [ 2 ]
Сигнализация
[ редактировать ]IFN типа I связываются с IFNAR1 или IFNAR2, образуя бинарный комплекс. [ 9 ] Бинарный комплекс далее рекрутирует оставшуюся субъединицу IFNAR, завершая тройной комплекс и активируя нижестоящую передачу сигналов JAK/STAT . [ 9 ] Связывание IFN с IFNAR приводит к тесному сближению рецептор-ассоциированных киназ JAK1 и Tyk2, что приводит к трансфосфорилированию киназы и последующему фосфорилированию тирозинов на IFNAR1 и IFNAR2. [ 5 ] [ 7 ] Остатки фосфотирозина на IFNAR1 и IFNAR2 привлекают STAT . белки [ 7 ] (классически STAT1 , STAT2 или STAT3 , хотя STAT4 , STAT5 и STAT6 могут играть роль в определенных типах клеток). [ 16 ] ) через свои домены SH2 . После рекрутирования белки STAT фосфорилируются, что вызывает их гомо- или гетеродимеризацию. [ 17 ] Эти димеры транслоцируются в ядро, связывая интерферон-стимулированные элементы ответа (ISRE) и гамма-активирующие последовательности (GAS), способствуя транскрипции генов. [ 7 ] [ 17 ]
Регулирование
[ редактировать ]В нормальных условиях уровни IFN типа I гомеостатически регулируются, чтобы сбалансировать преимущества защиты от вирусной инфекции с другими клеточными эффектами, связанными с передачей сигналов IFN типа I, такими как апоптоз, остановка клеточного цикла и иммунная модуляция. [ 9 ] Строгое регулирование передачи сигналов IFN типа I предполагает важность выбора времени и местоположения. [ 5 ] Передача сигналов IFN типа I контролируется с помощью различных механизмов, включая дифференциальную экспрессию компонентов сигнализации, [ 18 ] дифференциальная сигнализация после включения IFNAR, [ 9 ] эндоцитоз и подавление рецепторов. [ 2 ] [ 9 ] [ 15 ] и механизмы отрицательной обратной связи [ 9 ]
Дифференциальное выражение
[ редактировать ]Чувствительность к IFN типа I требует экспрессии сигнальных компонентов внутри данной клетки-мишени, включая IFNAR и STAT. Уровни экспрессии и посттрансляционные модификации IFNAR и STAT могут изменять чувствительность клеток. [ 18 ] Важно отметить, что на передачу сигналов влияют различные уровни экспрессии белка STAT и активация гетеродимеров STAT и гомодимеров STAT; снижение уровня экспрессии STAT изменяет противовирусные, антипролиферативные и воспалительные реакции на IFN типа I. [ 18 ] И наоборот, повышенная экспрессия STAT1 и IRF9 поддерживает экспрессию ISG даже в отсутствие продолжающейся передачи сигналов рецептора цитокинов, тем самым усиливая передачу сигналов IFNAR. [ 18 ] Поскольку передача сигналов IFN типа I модулирует белки, участвующие в трансляции белков, она также может косвенно изменять уровни белков индуцированных генов и белков, участвующих в передаче сигналов. [ 18 ]
Все подтипы IFN типа I, гомология которых варьируется от 30 до 70%, связываются с одним и тем же рецептором. [ 9 ] Предвзятый агонизм изучался, чтобы лучше понять, как один рецептор по-разному реагирует на несколько родственных лигандов, что приводит к разным результатам.
Эндоцитоз и даунрегуляция
[ редактировать ]IFNAR1 и IFNAR2 могут интернализоваться посредством эндоцитоза в ответ на агонизм посредством клатрин-зависимых и клатрин-независимых механизмов. [ 2 ] Субъединицы IFNAR могут по-разному подавляться после стимуляции IFN. Например, мембранный IFNAR1 снижается в ответ на IFNα, но поверхностные уровни IFNAR1 и IFNAR2 снижаются в ответ на связывание IFNβ. [ 8 ] В соответствии с этими наблюдениями, интернализация IFNAR часто связана со способностью соответствующего агониста вызывать антипролиферативный эффект. [ 7 ]
Интернализация субъединицы IFNAR также наблюдается в базальных условиях, с более высоким базальным оборотом IFNAR1, чем IFNAR2. [ 2 ] IFNAR1 содержит дегрон или мотив убиквитинирования, который обеспечивает его интернализацию и деградацию. [ 2 ] Tyk2 может заблокировать этот дегрон, предотвращая его интернализацию. [ 8 ]
Клатрин-зависимый эндоцитоз
[ редактировать ]После агонизма рецептора С-конец IFNAR фосфорилируется с последующим его убиквитинированием и интернализацией. [ 8 ] [ 15 ] Поверхностная экспрессия IFNAR поддерживается в присутствии стимуляции, когда клатрин-зависимый путь эндоцитоза ингибируется нокдауном siRNA клатрина или использованием низкомолекулярного ингибитора ГТФазы динамина . [ 15 ] Интернализация может привести к деградации рецептора, тем самым снижая мембранную экспрессию. [ 15 ] или это может привести к повторному использованию рецептора без длительного воздействия на уровни мембранных рецепторов. [ 2 ] Однако клатрин-опосредованный эндоцитоз может также способствовать концентрации рецепторов IFNAR и сигнальных компонентов, тем самым усиливая передачу сигналов. [ 15 ] Эксперименты с электронной микроскопией показывают, что рецепторы IFNAR сконцентрированы в ямках, покрытых клатрином, а ингибирование клатрин-опосредованного эндоцитоза приводит к снижению фосфорилирования JAK1, Tyk2, STAT и уменьшению ядерной транслокации STAT. [ 9 ] [ 15 ]
Механизмы отрицательной обратной связи
[ редактировать ]Негативные регуляторы передачи сигналов IFN типа I, такие как супрессор передачи сигналов цитокина 1 (SOCS1) и убиквитин-специфическая пептидаза 18 ( USP18 ), индуцируются через 4 часа. [ 9 ] SOCS1 ингибирует передачу сигналов IFN типа I, ингибируя JAK и связывая фосфорилированный Tyk2. [ 9 ] USP18 связывается с С-концом IFNAR2. [ 9 ] USP18 может регулировать передачу сигналов IFN типа I, препятствуя образованию тройных комплексов, а не посредством своей пептидазной функции. [ 7 ] Потеря USP18 приводит к воспалительному интерферон-опосредованному заболеванию ЦНС. [ 3 ]
Клинические последствия
[ редактировать ]Интерферон I типа может оказывать как благотворное, так и вредное воздействие при различных заболеваниях. Считается, что интерферон типа I является движущей силой многих аутоиммунных заболеваний и может играть роль в развитии хронической инфекции. [ 18 ] И наоборот, IFN типа I также назначаются в качестве терапевтических средств при других заболеваниях. [ 18 ]
В частности, ИФН I типа участвуют в патогенезе следующих аутоиммунных заболеваний: системной красной волчанки (СКВ), синдрома Шегрена , системной склеродермии , ревматоидного артрита (РА) и миозита . [ 18 ] Считается, что повышенные уровни внутримозгового IFNα играют пагубную роль при синдроме Айкарди-Гутьера (АГС), ВИЧ-ассоциированной деменции и волчанке ЦНС. [ 12 ] Хотя IFN типа I являются одними из классических цитокинов, необходимых для эффективного противовирусного ответа, более высокие уровни IFN I типа связаны с ухудшением течения бактериальных инфекций, таких как туберкулез и лепроматозная проказа . [ 18 ] IFN типа I также исследуется на предмет потенциальной роли в нейродегенерации; потеря экспрессии IFNAR продлила выживаемость на мышиных моделях бокового амиотрофического склероза (БАС). [ 12 ]
IFNα также использовался в клинике для лечения IFN-чувствительных гематологических злокачественных опухолей, таких как хронический миелогенный лейкоз (ХМЛ), множественная миелома и волосатоклеточный лейкоз . [ 16 ] Важно отметить, что раковые опухоли, резистентные к IFN типа I, характеризуются низкой экспрессией IFNAR или ее отсутствием. [ 16 ] Кроме того, IFNα также применялся в терапевтических целях для лечения некоторых потенциально хронических вирусных инфекций, таких как гепатит B и гепатит C. Парадоксально, но IFNβ был препаратом первой линии лечения центрального аутоиммунного заболевания — рассеянного склероза (РС), хотя механизм действия IFNβ при рассеянном склерозе окончательно не продемонстрирован. [ 12 ] [ 16 ] [ 19 ]
Ссылки
[ редактировать ]- ^ PDB : 1n6u ; Чилл Дж. Х., Квадт С. Р., Леви Р., Шрайбер Г., Англистер Дж. (июль 2003 г.). «Человеческий рецептор интерферона I типа: структура ЯМР раскрывает молекулярную основу связывания лиганда» . Структура . 11 (7): 791–802. дои : 10.1016/S0969-2126(03)00120-5 . ПМИД 12842042 .
- ^ Перейти обратно: а б с д и ж г час я дж к л де Верд Н.А., Нгуен Т. (май 2012 г.). «Интерфероны и их рецепторы — распределение и регуляция» . Иммунология и клеточная биология . 90 (5): 483–91. дои : 10.1038/icb.2012.9 . ПМЦ 7165917 . ПМИД 22410872 .
- ^ Перейти обратно: а б МакГлассон С., Джури А., Джексон А., Хант Д. (сентябрь 2015 г.). «Нарушение регуляции интерферона I типа и неврологические заболевания». Обзоры природы. Неврология . 11 (9): 515–23. дои : 10.1038/nrneurol.2015.143 . ПМИД 26303851 . S2CID 9640903 .
- ^ Наллар СК, Калваколану Д.В. (август 2014 г.). «Интерфероны, пути передачи сигнала и центральная нервная система» . Журнал исследований интерферона и цитокинов . 34 (8): 559–76. дои : 10.1089/jir.2014.0021 . ПМЦ 4118707 . ПМИД 25084173 .
- ^ Перейти обратно: а б с д Герцог П.Дж., Уильямс Б.Р. (июнь 2013 г.). «Точная настройка ответов интерферона I типа». Обзоры цитокинов и факторов роста . 24 (3): 217–25. doi : 10.1016/j.cytogfr.2013.04.002 . ПМИД 23711406 .
- ^ Кочча Э.М., Баттистини А. (март 2015 г.). «Ранний ответ на IFN типа I: изучение стратегий уклонения от микробов» . Семинары по иммунологии . 27 (2): 85–101. дои : 10.1016/j.smim.2015.03.005 . ПМЦ 7129383 . ПМИД 25869307 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н Пилер Дж., Томас С., Гарсия К.К., Шрайбер Г. (ноябрь 2012 г.). «Структурные и динамические детерминанты сборки рецептора интерферона I типа и их функциональная интерпретация» . Иммунологические обзоры . 250 (1): 317–34. дои : 10.1111/imr.12001 . ПМЦ 3986811 . ПМИД 23046138 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м Узе Г., Шрайбер Г., Пилер Дж., Пеллегрини С. (2007). «Рецептор семейства интерферонов I типа». Интерферон: 50 лет . Актуальные темы микробиологии и иммунологии. Том. 316. стр. 71–95. дои : 10.1007/978-3-540-71329-6_5 . ISBN 978-3-540-71328-9 . ПМИД 17969444 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р Шрайбер Г., Пилер Дж. (март 2015 г.). «Молекулярная основа функциональной пластичности передачи сигналов интерферона I типа». Тенденции в иммунологии . 36 (3): 139–49. дои : 10.1016/j.it.2015.01.002 . ПМИД 25687684 .
- ^ Тринкьери Дж. (сентябрь 2010 г.). «Интерферон I типа: друг или враг?» . Журнал экспериментальной медицины . 207 (10): 2053–63. дои : 10.1084/jem.20101664 . ПМК 2947062 . ПМИД 20837696 .
- ^ Перейти обратно: а б с Нг КТ, Мендоса Х.Л., Гарсия К.К., Олдстоун М.Б. (январь 2016 г.). «Передача сигналов интерферона альфа- и бета-типа 1: путь к разнообразным биологическим результатам» . Клетка . 164 (3): 349–52. дои : 10.1016/j.cell.2015.12.027 . ПМЦ 4733246 . ПМИД 26824652 .
- ^ Перейти обратно: а б с д и Оуэнс Т., Хороши Р., Влодарчик А., Асгари Н. (март 2014 г.). «Интерфероны в центральной нервной системе: несколько инструментов играют много мелодий». Глия . 62 (3): 339–55. дои : 10.1002/glia.22608 . ПМИД 24588027 . S2CID 5826145 .
- ^ Лутфалла Г., Рокель Н., Могенсен К.Е., Маттей М.Г., Узе Г. (октябрь 1990 г.). «Присвоение гена рецептора человеческого интерферона-α хромосоме 21q22.1 путем гибридизации in situ». Журнал исследований интерферона . 10 (5): 515–7. дои : 10.1089/jir.1990.10.515 . ПМИД 2148760 .
- ^ Лутфалла Г., Холланд С.Дж., Чинато Э., Моннерон Д., Ребул Дж., Роджерс Н.К., Смит Дж.М., Старк Г.Р., Гардинер К., Могенсен К.Э. (октябрь 1995 г.). «Мутантные клетки U5A дополняются субъединицей рецептора интерферона-αβ, генерируемой альтернативным процессингом нового члена кластера генов цитокинового рецептора» . Журнал ЭМБО . 14 (20): 5100–8. дои : 10.1002/j.1460-2075.1995.tb00192.x . ПМЦ 394613 . ПМИД 7588638 .
- ^ Перейти обратно: а б с д и ж г час Клаудинон Дж., Монье М.Н., Ламаз С. (2007). «Вмешательство в сортировку и оборот рецепторов интерферона: влияние на передачу сигналов». Биохимия . 89 (6–7): 735–43. дои : 10.1016/j.biochi.2007.03.014 . ПМИД 17493737 .
- ^ Перейти обратно: а б с д Деонарайн Р., Чан Д.К., Платаниас Л.К., Фиш Э.Н. (2002). «Взаимодействие интерферона-α/β-рецептора: разворачивается сложная история». Текущий фармацевтический дизайн . 8 (24): 2131–7. дои : 10.2174/1381612023393288 . ПМИД 12369858 .
- ^ Перейти обратно: а б Хебенстрайт Д., Хорейс-Хёк Дж., Душл А. (май 2005 г.). «JAK/STAT-зависимая регуляция генов цитокинами». Новости и перспективы наркотиков . 18 (4): 243–9. дои : 10.1358/dnp.2005.18.4.908658 . ПМИД 16034480 .
- ^ Перейти обратно: а б с д и ж г час я Ивашкив Л.Б., Донлин Л.Т. (январь 2014 г.). «Регуляция реакции интерферона I типа» . Обзоры природы. Иммунология . 14 (1): 36–49. дои : 10.1038/nri3581 . ПМК 4084561 . ПМИД 24362405 .
- ^ Киезейер, Британская Колумбия (июнь 2011 г.). «Механизм действия интерферона-β при рецидивирующем рассеянном склерозе». Препараты ЦНС . 25 (6): 491–502. дои : 10.2165/11591110-000000000-00000 . ПМИД 21649449 . S2CID 25516515 .
Внешние ссылки
[ редактировать ]- Рецептор + интерферон + альфа-бета в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)