Рецептор эритропоэтина
| ЭПОР | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | ЭПОР , ЭПО-Р, рецептор эритропоэтина | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 133171 ; МГИ : 95408 ; Гомологен : 95 ; GeneCards : EPOR ; ОМА : ЭПОР - ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
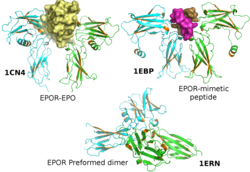
Рецептор эритропоэтина ( EpoR ) представляет собой белок , который у человека кодируется EPOR геном . [5] EpoR представляет собой массой 52 кДа пептид с одной углеводной цепью, в результате чего на поверхности клеток, отвечающих на ЭПО, обнаруживается белок массой примерно 56–57 кДа. Он является членом семейства цитокиновых рецепторов . EpoR изначально существует в виде димеров. Первоначально считалось, что эти димеры образуются в результате взаимодействий внеклеточных доменов. [6] однако сейчас предполагается, что он образуется в результате взаимодействия трансмембранного домена [7] [8] и что исходная структура сайта внеклеточного взаимодействия возникла из-за условий кристаллизации и не отражает нативную конформацию. [9] Связывание лиганда эритропоэтина (Epo) массой 30 кДа изменяет конформационные изменения рецептора, что приводит к аутофосфорилированию киназ Jak2 , которые предварительно связаны с рецептором (т.е. EpoR не обладает собственной киназной активностью и зависит от активности Jak2). [10] [11] В настоящее время наиболее изученной функцией EpoR является содействие пролиферации и спасению предшественников эритроцитов (эритроцитов) от апоптоза . [5]
Функция и механизм действия
[ редактировать ]
Цитоплазматические домены EpoR содержат ряд фосфотирозинов, которые фосфорилируются с помощью Jak2 и служат сайтами стыковки для различных активаторов внутриклеточных путей и Stats (таких как Stat5 ). Помимо активации киназы Ras/AKT и ERK/MAP, пути фосфатидилинозитол-3-киназы /AKT и факторов транскрипции STAT , фосфотирозины также служат сайтами стыковки для фосфатаз, которые отрицательно влияют на передачу сигналов EpoR, чтобы предотвратить гиперактивацию, которая может привести к таким нарушениям, как эритроцитоз. В целом дефекты рецептора эритропоэтина могут вызывать эритролейкемию и семейный эритроцитоз . Мутации киназ Jak2, связанных с EpoR, также могут приводить к истинной полицитемии. [12]
Выживание эритроидов
[ редактировать ]Основная роль EpoR заключается в стимулировании пролиферации эритроидных клеток-предшественников и спасении эритроидных предшественников от гибели клеток. [13] EpoR индуцирует передачу сигналов Jak2-Stat5 вместе с транскрипционным фактором GATA-1 индуцирует транскрипцию белка, способствующего выживанию Bcl-xL. [14] Кроме того, EpoR участвует в подавлении экспрессии рецепторов смерти Fas, Trail и TNFa, которые отрицательно влияют на эритропоэз. [15] [16] [17]
На основании имеющихся данных до сих пор неизвестно, вызывают ли Epo/EpoR непосредственно «пролиферацию и дифференцировку» предшественников эритроида in vivo, хотя такие прямые эффекты были описаны на основе исследований in vitro.
Дифференциация эритроида
[ редактировать ]Считается, что дифференцировка эритроидов в первую очередь зависит от присутствия и индукции эритроидных транскрипционных факторов, таких как GATA-1, FOG-1 и EKLF, а также от подавления миелоидных/лимфоидных транскрипционных факторов, таких как PU.1. [18] Прямые и значимые эффекты передачи сигналов EpoR, в частности, на индукцию эритроид-специфичных генов, таких как бета-глобин, в основном неуловимы. Известно, что GATA-1 может индуцировать экспрессию EpoR. [19] В свою очередь, сигнальный путь PI3-K/AKT EpoR увеличивает активность GATA-1. [20]
Эритроидный клеточный цикл/пролиферация
[ редактировать ]Индукция пролиферации с помощью EpoR, вероятно, зависит от типа клеток. Известно, что EpoR может активировать митогенные сигнальные пути и может приводить к пролиферации клеток в линиях эритролейкозных клеток in vitro , различных неэритроидных клетках и раковых клетках. До сих пор нет достаточных доказательств того, что in vivo передача сигналов EpoR может индуцировать деление клеток-предшественников эритроида или могут ли уровни Epo модулировать клеточный цикл. [13] Передача сигналов EpoR все еще может иметь эффект пролиферации на предшественников BFU-e, но эти предшественники не могут быть напрямую идентифицированы, изолированы и изучены. Предшественники CFU-e входят в клеточный цикл во время индукции GATA-1 и подавления PU.1 в процессе развития, а не благодаря передаче сигналов EpoR. [21] Последующие стадии дифференцировки (от проэритробласта до ортохроматического эритробласта) включают уменьшение размера клеток и возможное изгнание ядра и, вероятно, зависят только от передачи сигналов EpoR для их выживания. Кроме того, некоторые данные о макроцитозе при гипоксическом стрессе (когда Epo может увеличиваться в 1000 раз) позволяют предположить, что митоз фактически пропускается на более поздних эритроидных стадиях, когда экспрессия EpoR низкая/отсутствует, чтобы обеспечить экстренный резерв эритроцитов, как только насколько это возможно. [22] [23] Такие данные, хотя иногда и косвенные, утверждают, что существует ограниченная способность к размножению именно в ответ на ЭПО (а не на другие факторы). В совокупности эти данные позволяют предположить, что EpoR при дифференцировке эритроидов может функционировать в первую очередь как фактор выживания, тогда как его влияние на клеточный цикл (например, скорость деления и соответствующие изменения уровней циклинов и ингибиторов Cdk) in vivo ожидает дальнейшего изучения. Однако в других клеточных системах EpoR может обеспечивать специфический пролиферативный сигнал.
Принадлежность мультипотентных предшественников к эритроидной линии
[ редактировать ]Роль EpoR в приверженности линии передачи в настоящее время неясна. Экспрессия EpoR может распространяться даже на компартмент гемопоэтических стволовых клеток. [24] Неизвестно, играет ли передача сигналов EpoR пермиссивную (т.е. индуцирует только выживание) или инструктивную (т.е. активирует эритроидные маркеры, чтобы зафиксировать предшественников на заранее определенном пути дифференцировки) роль у ранних мультипотентных предшественников, чтобы продуцировать достаточное количество эритробластов. Текущие публикации в этой области предполагают, что это в первую очередь разрешительный характер. Было показано, что генерация предшественников BFU-e и CFU-e является нормальной у эмбрионов грызунов, нокаутированных либо по Epo, либо по EpoR. [25] Аргументом против такого отсутствия потребности является то, что в ответ на ЭПО или гипоксический стресс количество ранних эритроидных стадий, BFU-e и CFU-e, резко увеличивается. Однако неясно, является ли это поучительным сигналом или, опять же, разрешающим сигналом. Еще одним моментом является то, что сигнальные пути, активируемые EpoR, являются общими для многих других рецепторов; Замена EpoR на рецептор пролактина поддерживает выживаемость и дифференцировку эритроидов in vitro . [26] [27] В совокупности эти данные позволяют предположить, что приверженность эритроидной линии, вероятно, происходит не из-за пока неизвестной инструктивной функции EpoR, а, возможно, из-за его роли в выживании на стадиях мультипотентных предшественников.
Исследования на животных мутаций рецептора ЭПО
[ редактировать ]Мыши с укороченным EpoR [28] жизнеспособны, что позволяет предположить, что активности Jak2 достаточно для поддержания базального эритропоэза путем активации необходимых путей без необходимости в сайтах стыковки фосфотирозина. EpoR-H форма усечения EpoR содержит первый и, что можно утверждать, самый важный тирозин 343, который служит местом стыковки для молекулы Stat5, но лишен остальной части цитоплазматического хвоста. У этих мышей наблюдается повышенный эритропоэз, что согласуется с идеей о том, что рекрутирование фосфатазы (и, следовательно, прекращение передачи сигналов) у этих мышей является аберрантным.
Рецептор EpoR-HM также лишен большей части цитоплазматического домена и содержит тирозин 343, который был мутирован в фенилаланин, что делает его непригодным для эффективного стыковки и активации Stat5. Эти мыши страдают анемией и плохо реагируют на гипоксический стресс, такой как лечение фенилгидразином или инъекции эритропоэтина. [28]
Мыши с нокаутом EpoR имеют дефекты сердца, головного мозга и сосудистой сети. Эти дефекты могут быть связаны с блокировкой образования эритроцитов и, следовательно, с недостаточной доставкой кислорода к развивающимся тканям, поскольку мыши, сконструированные так, чтобы экспрессировать рецепторы ЭПО только в эритроидных клетках, развиваются нормально.
Клиническое значение
[ редактировать ]Дефекты рецептора эритропоэтина могут вызывать эритролейкемию и семейный эритроцитоз . [5] Перепроизводство эритроцитов увеличивает вероятность неблагоприятных сердечно-сосудистых событий, таких как тромбоз и инсульт.
Редко могут возникать, казалось бы, полезные мутации в EpoR, когда увеличение количества эритроцитов позволяет улучшить доставку кислорода в соревнованиях на выносливость без видимых неблагоприятных последствий для здоровья спортсмена (как, например, у финского спортсмена Ээро Мянтюранта ). [29]
Сообщалось, что эритропоэтин поддерживает эндотелиальные клетки и способствует ангиогенезу опухолей , следовательно, нарушение регуляции EpoR может влиять на рост некоторых опухолей. [30] [31] Однако эта гипотеза не является общепринятой.
Взаимодействия
[ редактировать ]Было показано, что рецептор эритропоэтина взаимодействует с:
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с GRCh38: Версия Ensembl 89: ENSG00000187266 – Ensembl , май 2017 г.
- ^ Перейти обратно: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000006235 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Перейти обратно: а б с «Ген Энтрез: рецептор эритропоэтина EPOR» .
- ^ Ливна О, Стура Э.А., Миддлтон С.А., Джонсон Д.Л., Джоллифф Л.К., Уилсон И.А. (февраль 1999 г.). «Кристаллографические доказательства образования димеров рецептора эритропоэтина до активации лиганда». Наука . 283 (5404): 987–90. Бибкод : 1999Sci...283..987L . дои : 10.1126/science.283.5404.987 . ПМИД 9974392 .
- ^ Эби, Александра З.; Флеминг, Карен Г. (февраль 2007 г.). «Димеризация трансмембранного домена рецептора эритропоэтина в мицеллах» . Журнал молекулярной биологии . 366 (2): 517–524. дои : 10.1016/j.jmb.2006.11.035 . ПМИД 17173930 .
- ^ Ли, Цинсинь; Вонг, Ин Лэй; Хуан, Цивэй; Кан, Конг Бао (ноябрь 2014 г.). «Структурное понимание трансмембранного домена и околомембранной области рецептора эритропоэтина в мицеллах» . Биофизический журнал . 107 (10): 2325–2336. Бибкод : 2014BpJ...107.2325L . дои : 10.1016/j.bpj.2014.10.013 . ПМЦ 4241451 . ПМИД 25418301 .
- ^ Пан, Сяодун; Чжоу, Хуан-Сян (8 марта 2012 г.). «Общая модель активации цитокиновых рецепторов: комбинированное ножницеобразное вращение и самовращение димера рецептора, индуцированное цитокином класса I» . PLOS Вычислительная биология . 8 (3): e1002427. Бибкод : 2012PLSCB...8E2427P . дои : 10.1371/journal.pcbi.1002427 . ISSN 1553-7358 . ПМЦ 3297564 . ПМИД 22412367 .
- ^ Юсуфян Х., Лонгмор Дж., Нейман Д., Йошимура А., Лодиш Х.Ф. (май 1993 г.). «Структура, функции и активация рецептора эритропоэтина» . Кровь . 81 (9): 2223–36. дои : 10.1182/blood.V81.9.2223.2223 . ПМИД 8481505 .
- ^ Уилсон И.А., Джоллифф Л.К. (декабрь 1999 г.). «Структура, организация, активация и пластичность рецептора эритропоэтина». Современное мнение в области структурной биологии . 9 (6): 696–704. дои : 10.1016/S0959-440X(99)00032-9 . ПМИД 10607675 .
- ^ Джеймс С., Уго В., Ле Куэдик Ж.П., Стаерк Дж., Деломмо Ф., Лаку С., Гарсон Л., Раслова Х., Бергер Р., Беннасер-Гриселли А., Виллеваль Дж.Л., Константинеску С.Н., Касадевалл Н., Вайнченкер В. (апрель 2005 г.). «Уникальная клональная мутация JAK2, приводящая к конститутивной передаче сигналов, вызывает истинную полицитемию». Природа . 434 (7037): 1144–8. Бибкод : 2005Natur.434.1144J . дои : 10.1038/nature03546 . ПМИД 15793561 . S2CID 4399974 .
- ^ Перейти обратно: а б Кури MJ, Bondurant MC (апрель 1990 г.). «Эритропоэтин замедляет распад ДНК и предотвращает запрограммированную гибель эритроидных клеток-предшественников». Наука . 248 (4953): 378–81. Бибкод : 1990Sci...248..378K . дои : 10.1126/science.2326648 . ПМИД 2326648 .
- ^ Соколовский М., Фэллон А.Е., Ван С., Бругнара С., Лодиш Х.Ф. (июль 1999 г.). «Фетальная анемия и апоптоз предшественников эритроцитов у мышей Stat5a-/-5b-/-: прямая роль Stat5 в индукции Bcl-X(L)» . Клетка . 98 (2): 181–91. дои : 10.1016/S0092-8674(00)81013-2 . ПМИД 10428030 . S2CID 17925652 .
- ^ Де Мария Р., Теста У., Лучетти Л., Цойнер А., Стасси Дж., Пелоси Е., Риччони Р., Фелли Н., Самоджа П., Пешле К. (февраль 1999 г.). «Апоптотическая роль системы лигандов Fas/Fas в регуляции эритропоэза». Кровь . 93 (3): 796–803. дои : 10.1182/blood.V93.3.796 . ПМИД 9920828 .
- ^ Лю Ю, Поп Р., Садег С., Бругнара С., Хаасе В.Х., Соколовский М. (июль 2006 г.). «Подавление коэкспрессии Fas-FasL эритропоэтином опосредует расширение эритробластов во время реакции эритропоэтического стресса in vivo» . Кровь . 108 (1): 123–33. дои : 10.1182/кровь-2005-11-4458 . ПМК 1895827 . ПМИД 16527892 .
- ^ Фелли Н., Педини Ф., Цойнер А., Петруччи Е., Теста У., Контичелло С., Биффони М., Ди Катальдо А., Винклс Дж.А., Пешле С., Де Мария Р. (август 2005 г.). «Несколько членов суперсемейства TNF способствуют ингибированию эритропоэза, опосредованному IFN-гамма» . Журнал иммунологии . 175 (3): 1464–72. дои : 10.4049/гиммунол.175.3.1464 . ПМИД 16034083 .
- ^ Кантор А.Б., Оркин С.Х. (май 2002 г.). «Транскрипционная регуляция эритропоэза: дело с участием нескольких партнеров» . Онкоген . 21 (21): 3368–76. дои : 10.1038/sj.onc.1205326 . ПМИД 12032775 .
- ^ Зон Л.И., Юсуфян Х., Мазер С., Лодиш Х.Ф., Оркин Ш.Х. (декабрь 1991 г.). «Активация промотора рецептора эритропоэтина фактором транскрипции GATA-1» . Труды Национальной академии наук Соединенных Штатов Америки . 88 (23): 10638–41. Бибкод : 1991PNAS...8810638Z . дои : 10.1073/pnas.88.23.10638 . ПМК 52985 . ПМИД 1660143 .
- ^ Чжао В., Китидис С., Флеминг, доктор медицинских наук, Лодиш Х.Ф., Гаффари С. (февраль 2006 г.). «Эритропоэтин стимулирует фосфорилирование и активацию GATA-1 через сигнальный путь PI3-киназы/AKT» . Кровь . 107 (3): 907–15. дои : 10.1182/кровь-2005-06-2516 . ЧВК 1895894 . ПМИД 16204311 .
- ^ Поп Р., Ширстоун-младший, Шен К., Лю Ю., Холлстром К., Коулнис М., Грибнау Дж., Соколовский М. (2010). «Ключевой этап эритропоэза синхронизируется с часами клеточного цикла посредством взаимного ингибирования между прогрессированием PU.1 и S-фазы» . ПЛОС Биология . 8 (9): e1000484. дои : 10.1371/journal.pbio.1000484 . ПМЦ 2943437 . ПМИД 20877475 .
- ^ Сено С., Мияхара М., Асакура Х., Оти О, Мацуока К., Тояма Т. (ноябрь 1964 г.). «Макроцитоз в результате раннего денуклеации предшественников эритроида» . Кровь . 24 (5): 582–93. дои : 10.1182/blood.V24.5.582.582 . ПМИД 14236733 .
- ^ Борсук Х., Лингрел Дж.Б., Скари Дж.Л., Миллетт Р.Л. (октябрь 1962 г.). «Синтез гемоглобина в связи с созреванием эритроидных клеток». Природа . 196 (4852): 347–50. Бибкод : 1962Natur.196..347B . дои : 10.1038/196347a0 . ПМИД 14014098 . S2CID 34948124 .
- ^ Форсберг Э.К., Серволд Т., Коган С., Вайсман И.Л., Пассеге Э. (июль 2006 г.). «Новые данные, подтверждающие мегакариоцитарно-эритроцитарный потенциал мультипотентных гемопоэтических предшественников flk2/flt3+» . Клетка . 126 (2): 415–26. дои : 10.1016/j.cell.2006.06.037 . ПМИД 16873070 .
- ^ Ву Х, Лю X, Джениш Р., Лодиш Х.Ф. (октябрь 1995 г.). «Поколение коммитированных эритроидных предшественников BFU-E и CFU-E не требует эритропоэтина или рецептора эритропоэтина» . Клетка . 83 (1): 59–67. дои : 10.1016/0092-8674(95)90234-1 . ПМИД 7553874 . S2CID 17401291 .
- ^ Соколовский М., Фэллон А.Е., Лодиш Х.Ф. (сентябрь 1998 г.). «Рецептор пролактина спасает EpoR-/- эритроидные предшественники и заменяет EpoR в синергическом взаимодействии с c-kit». Кровь . 92 (5): 1491–6. дои : 10.1182/blood.V92.5.1491 . ПМИД 9716574 .
- ^ Соколовский М., Дюсантер-Фурт I, Лодиш Х.Ф. (май 1997 г.). «Рецептор пролактина и сильно укороченные рецепторы эритропоэтина поддерживают дифференцировку эритроидных предшественников» . Журнал биологической химии . 272 (22): 14009–12. дои : 10.1074/jbc.272.22.14009 . ПМИД 9162017 .
- ^ Перейти обратно: а б Занг Х., Сато К., Накадзима Х., Маккей С., Ней П.А., Иле Дж.Н. (июнь 2001 г.). «Дистальная область и рецепторные тирозины рецептора ЭПО не являются существенными для эритропоэза in vivo» . Журнал ЭМБО . 20 (12): 3156–66. дои : 10.1093/emboj/20.12.3156 . ПМК 150206 . ПМИД 11406592 .
- ^ де ла Шапель А., Трескелин А.Л., Ювонен Э. (май 1993 г.). «Укороченный рецептор эритропоэтина вызывает преимущественно наследственный доброкачественный эритроцитоз человека» . Труды Национальной академии наук Соединенных Штатов Америки . 90 (10): 4495–9. Бибкод : 1993PNAS...90.4495D . дои : 10.1073/pnas.90.10.4495 . ПМЦ 46538 . ПМИД 8506290 .
- ^ Фаррелл Ф., Ли А. (2004). «Рецептор эритропоэтина и его экспрессия в опухолевых клетках и других тканях» . Онколог . 9 (Приложение 5): 18–30. doi : 10.1634/теонколог.9-90005-18 . ПМИД 15591419 .
- ^ Елкманн В., Болиус Дж., Халлек М., Ситковски А.Дж. (июль 2008 г.). «Рецептор эритропоэтина в нормальных и раковых тканях». Критические обзоры по онкологии/гематологии . 67 (1): 39–61. дои : 10.1016/j.critrevonc.2008.03.006 . ПМИД 18434185 .
- ^ Чин Х, Сайто Т, Араи А, Ямамото К, Камияма Р, Миясака Н, Миура О (октябрь 1997 г.). «Эритропоэтин и IL-3 индуцируют фосфорилирование тирозина CrkL и его ассоциацию с Shc, SHP-2 и Cbl в кроветворных клетках». Связь с биохимическими и биофизическими исследованиями . 239 (2): 412–7. дои : 10.1006/bbrc.1997.7480 . ПМИД 9344843 .
- ^ Арай А., Канда Э., Носака Ю., Миясака Н., Миура О. (август 2001 г.). «CrkL рекрутируется через свой домен SH2 к рецептору эритропоэтина и играет роль в Lyn-опосредованной передаче сигналов рецептора» . Журнал биологической химии . 276 (35): 33282–90. дои : 10.1074/jbc.M102924200 . ПМИД 11443118 .
- ^ Миддлтон С.А., Барбоне Ф.П., Джонсон Д.Л., Термонд Р.Л., Ю Ю, МакМэхон Ф.Дж., Джин Р., Ливна О, Таллай Дж., Фаррелл Ф.С., Голдсмит М.А., Уилсон И.А., Джоллифф Л.К. (май 1999 г.). «Общие и уникальные детерминанты рецептора эритропоэтина (ЭПО) важны для связывания ЭПО и пептида-миметика ЭПО» . Журнал биологической химии . 274 (20): 14163–9. дои : 10.1074/jbc.274.20.14163 . ПМИД 10318834 .
- ^ Ливна О, Джонсон Д.Л., Стура Э.А., Фаррелл Ф.К., Барбоне Ф.П., Ю Ю, Лю К.Д., Голдсмит М.А., Хе В., Краузе К.Д., Пестка С., Джоллифф Л.К., Уилсон И.А. (ноябрь 1998 г.). «Комплекс пептид-антагонист-рецептор ЭПО предполагает, что димеризация рецептора недостаточна для активации». Структурная биология природы . 5 (11): 993–1004. дои : 10.1038/2965 . ПМИД 9808045 . S2CID 24052881 .
- ^ Таучи Т., Фэн Г.С., Шен Р., Хоатлин М., Бэгби Г.К., Кабат Д., Лу Л., Броксмейер Х.Э. (март 1995 г.). «Участие SH2-содержащей фосфотирозинфосфатазы Syp в путях передачи сигнала рецептора эритропоэтина» . Журнал биологической химии . 270 (10): 5631–5. дои : 10.1074/jbc.270.10.5631 . ПМИД 7534299 .
- ^ Фэн Г.С., Оуян Ю.Б., Ху Д.П., Ши ZQ, Генц Р., Ни Дж. (май 1996 г.). «Grap — это новый адаптерный белок SH3-SH2-SH3, который соединяет тирозинкиназы с путем Ras» . Журнал биологической химии . 271 (21): 12129–32. дои : 10.1074/jbc.271.21.12129 . ПМИД 8647802 .
- ^ Хуанг Л.Дж., Константинеску С.Н., Лодиш Х.Ф. (декабрь 2001 г.). «N-концевой домен Янус-киназы 2 необходим для процессинга Гольджи и экспрессии рецептора эритропоэтина на клеточной поверхности» . Молекулярная клетка . 8 (6): 1327–38. дои : 10.1016/S1097-2765(01)00401-4 . ПМИД 11779507 .
- ^ Виттун Б.А., Квелле Ф.В., Сильвеннойнен О., Йи Т, Тан Б., Миура О., Илье Дж.Н. (июль 1993 г.). «JAK2 связывается с рецептором эритропоэтина, фосфорилируется и активируется тирозином после стимуляции эритропоэтином». Клетка . 74 (2): 227–36. дои : 10.1016/0092-8674(93)90414-L . ПМИД 8343951 . S2CID 37503350 .
- ^ Чин Х, Араи А, Вакао Х, Камияма Р, Миясака Н, Миура О (май 1998 г.). «Лин физически связывается с рецептором эритропоэтина и может играть роль в активации пути Stat5» . Кровь . 91 (10): 3734–45. дои : 10.1182/blood.V91.10.3734 . ПМИД 9573010 .
- ^ Сигемацу Х., Ивасаки Х., Оцука Т., Оно Ю., Арима Ф., Нихо Ю. (май 1997 г.). «Роль протоонкогенного продукта vav (Vav) в опосредованной эритропоэтином пролиферации клеток и активности фосфатидилинозитол-3-киназы» . Журнал биологической химии . 272 (22): 14334–40. дои : 10.1074/jbc.272.22.14334 . ПМИД 9162069 .
- ^ Дэмен Дж.Э., Катлер Р.Л., Цзяо Х., И Т., Кристал Дж. (октябрь 1995 г.). «Фосфорилирование тирозина 503 в рецепторе эритропоэтина (EpR) необходимо для связывания субъединицы P85 фосфатидилинозитол (PI) 3-киназы и для EpR-ассоциированной активности PI 3-киназы» . Журнал биологической химии . 270 (40): 23402–8. дои : 10.1074/jbc.270.40.23402 . ПМИД 7559499 .
- ^ Клингмюллер У., Лоренц У., Кэнтли Л.С., Нил Б.Г., Лодиш Х.Ф. (март 1995 г.). «Специфическое привлечение SH-PTP1 к рецептору эритропоэтина вызывает инактивацию JAK2 и прекращение пролиферативных сигналов» . Клетка . 80 (5): 729–38. дои : 10.1016/0092-8674(95)90351-8 . ПМИД 7889566 . S2CID 16866005 .
- ^ Эйкерман С., Верхи А., дер Хейден Й.В., Лемменс I, Остаде XV, Вандекеркхове Дж., Тавернье Дж. (декабрь 2001 г.). «Разработка и применение ловушки взаимодействия цитокинов и рецепторов». Природная клеточная биология . 3 (12): 1114–9. дои : 10.1038/ncb1201-1114 . ПМИД 11781573 . S2CID 10228882 .
- ^ Сасаки А., Ясукава Х., Шуда Т., Китамура Т., Дикич И., Ёсимура А. (сентябрь 2000 г.). «CIS3/SOCS-3 подавляет передачу сигналов эритропоэтина (ЭПО) путем связывания рецептора ЭПО и JAK2» . Журнал биологической химии . 275 (38): 29338–47. дои : 10.1074/jbc.M003456200 . ПМИД 10882725 .
- ^ Хёртнер М., Нильш У., Майр Л.М., Генрих ПК, Хаан С. (май 2002 г.). «Новый сайт связывания с высоким сродством для супрессора передачи сигнала цитокина-3 на рецепторе эритропоэтина» . Европейский журнал биохимии . 269 (10): 2516–26. дои : 10.1046/j.1432-1033.2002.02916.x . ПМИД 12027890 .
- ^ Чин Х., Накамура Н., Камияма Р., Миясака Н., Илье Дж.Н., Миура О. (декабрь 1996 г.). «Физические и функциональные взаимодействия между Stat5 и тирозин-фосфорилированными рецепторами эритропоэтина и интерлейкина-3» . Кровь . 88 (12): 4415–25. doi : 10.1182/blood.V88.12.4415.bloodjournal88124415 . ПМИД 8977232 .
Дальнейшее чтение
[ редактировать ]- Чжу Ю, Д'Андреа А.Д. (март 1994 г.). «Молекулярная физиология эритропоэтина и рецептора эритропоэтина». Современное мнение в гематологии . 1 (2): 113–8. ПМИД 9371269 .
- Лакомб С., Майе П. (август 1998 г.). «Биология эритропоэтина». Гематологическая . 83 (8): 724–32. ПМИД 9793257 .
- Бонифачино Дж.С. (январь 2002 г.). «Контроль качества рецептор-киназных сигнальных комплексов» . Развивающая клетка . 2 (1): 1–2. дои : 10.1016/S1534-5807(01)00114-9 . ПМИД 11782306 .
- Такешита А., Синдзё К., Наито К., Ониши К., Хигучи М., Оно Р. (февраль 2002 г.). «Рецептор эритропоэтина при миелодиспластическом синдроме и лейкемии». Лейкемия и лимфома . 43 (2): 261–4. дои : 10.1080/10428190290006026 . ПМИД 11999556 . S2CID 34605746 .
- Кралович Р, Skoda RC (январь 2005 г.). «Молекулярный патогенез миелопролиферативных заболеваний, отрицательных по филадельфийской хромосоме». Обзоры крови . 19 (1): 1–13. дои : 10.1016/j.blre.2004.02.002 . ПМИД 15572213 .
- Мадедду П., Эмануэли С. (март 2007 г.). «Включение репаративного ангиогенеза: существенная роль сосудистого рецептора эритропоэтина» . Исследование кровообращения . 100 (5): 599–601. дои : 10.1161/01.RES.0000261610.11754.b1 . ПМЦ 2827860 . ПМИД 17363704 .
Внешние ссылки
[ редактировать ]- Эритропоэтин + рецепторы Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)
Эта статья включает текст из Национальной медицинской библиотеки США , который находится в свободном доступе .








![1eba: COMPLEX BETWEEN THE EXTRACELLULAR DOMAIN OF ERYTHROPOIETIN (EPO) RECEPTOR [EBP] AND AN INACTIVE PEPTIDE [EMP33] CONTAINS 3,5-DIBROMOTYROSINE IN POSITION 4 (DENOTED DBY)](http://upload.wikimedia.org/wikipedia/commons/thumb/e/e3/PDB_1eba_EBI.jpg/180px-PDB_1eba_EBI.jpg)
![1ebp: COMPLEX BETWEEN THE EXTRACELLULAR DOMAIN OF ERYTHROPOIETIN (EPO) RECEPTOR [EBP] AND AN AGONIST PEPTIDE [EMP1]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/16/PDB_1ebp_EBI.jpg/180px-PDB_1ebp_EBI.jpg)
![1ern: NATIVE STRUCTURE OF THE EXTRACELLULAR DOMAIN OF ERYTHROPOIETIN (EPO) RECEPTOR [EBP]](http://upload.wikimedia.org/wikipedia/commons/thumb/9/9d/PDB_1ern_EBI.jpg/180px-PDB_1ern_EBI.jpg)