Ингибитор тирозинкиназы Bcr-Abl
Эту статью необходимо обновить . ( январь 2017 г. ) |
Ингибиторы тирозинкиназы Bcr-Abl ( ИТК ) являются терапией первой линии для большинства пациентов с хроническим миелогенным лейкозом (ХМЛ). Более 90% случаев ХМЛ вызваны хромосомной аномалией, приводящей к образованию так называемой Филадельфийской хромосомы . Эту аномалию обнаружил Питер Ноуэлл в 1960 году. [ 1 ] и является следствием слияния Абельсона ( Abl гена тирозинкиназы ) на хромосоме 9 и гена кластера точки разрыва ( Bcr ) на хромосоме 22 , что приводит к образованию химерного онкогена ( Bcr-Abl ) и конститутивно активной тирозинкиназы Bcr-Abl. что было вовлечено в патогенез ХМЛ. Были разработаны соединения для избирательного ингибирования тирозинкиназы.
США (FDA) в 2001 году Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов До одобрения иматиниба не существовало лекарств, способных повлиять на естественное развитие ХМЛ. только цитотоксические препараты, такие как бусульфан , гидроксимочевина или интерферон Использовались «волшебной пулей» для лечения рака -альфа (rIFN-α). Несмотря на то, что первый ингибитор Bcr-Abl TK был назван журналом Time , впоследствии было разработано второе поколение Bcr-Abl TKI для борьбы с первоначальной устойчивостью . возникшей [ 2 ]
Новые формы резистентности могут возникать в виде миссенс-мутаций в домене киназы Abl , сверхэкспрессии Bcr-Abl, увеличения продукции трансмембранных белков плазмы или конститутивной активации нижестоящих сигнальных молекул, таких как киназы семейства Src . [ нужна ссылка ]
ИТК Bcr-Abl также исследуются в качестве потенциальных методов лечения болезни Паркинсона. Хотя первоначальные результаты показали скромную эффективность, необходимы дальнейшие исследования с участием сильнодействующих представителей этого класса препаратов. [ 3 ]
История
[ редактировать ]ХМЛ имеет четко определенную молекулярную мишень и относительно селективную терапию, направленную на эту мишень, чего нельзя сказать о большинстве видов рака и химиотерапии сегодня. [ 4 ] Bcr-Abl считался весьма привлекательной мишенью для лекарственного вмешательства Bcr-Abl , поскольку слитый ген кодирует конститутивно активированную киназу. Открытие лекарства, которое специфически воздействовало бы на участок связывания АТФ одной киназы, рассматривалось как довольно сложная задача, поскольку в геноме человека были известны сотни протеинкиназ . [ 5 ] В присутствии ИТК связывание АТФ блокируется, фосфорилирование предотвращается, и клетки, экспрессирующие Bcr-Abl, либо страдают от недостатка селективного роста, либо подвергаются апоптотической гибели клеток. [ 6 ] [ 7 ]
Из-за растущей резистентности и непереносимости иматиниба были предприняты усилия по разработке новых препаратов, которые могли бы ингибировать тирозинкиназу Bcr-Abl. Это привело к открытию лекарств второго поколения. В то время как для разработки иматиниба использовался скрининг лекарств, ИТК второго поколения были разработаны с использованием рационального подхода к разработке лекарств благодаря расширению знаний в области структурной биологии тирозинкиназы Bcr-Abl. [ 8 ]
Первое поколение
[ редактировать ]Иматиниб (STI571)
[ редактировать ]Иматиниб (Гливек) был открыт в 1992 году. [ 9 ] и считается препаратом первого поколения, поскольку это первый ингибитор тирозинкиназы Bcr-Abl, используемый при лечении ХМЛ.
Разработка
[ редактировать ]
В разработке иматиниба структура тирозинкиназы Bcr-Abl сыграла ограниченную роль, поскольку она была неизвестна. [ 8 ] был проведен высокопроизводительный скрининг химических библиотек В компании Novartis для идентификации исходной молекулы, названной « Пиримидин А». Это соединение служило ведущим соединением , а затем было протестировано и модифицировано для разработки иматиниба. [ 10 ] При замене имидазольной группы на бензамидную специфичность соединения увеличивалась при его активности сохранении как ингибитора киназы. Впоследствии введение метильного заместителя в орто -пиримидиниламиногруппе увеличивало эффективность . [ 5 ]
Связывание
[ редактировать ]
С тех пор кристаллографические исследования показали, что иматиниб связывается с киназным доменом Abl только тогда, когда домен принимает неактивную или «закрытую» конформацию. [ 11 ] Здесь богатая глицином P-связывающая фосфатная петля (P-петля) сгибается над сайтом связывания АТФ , а петля активации принимает конформацию, в которой она закрывает сайт связывания субстрата и разрушает сайт связывания АТФ-фосфата, блокируя каталитическая активность фермента. [ 12 ] Сдвиг триады Asp Phe Gly (DFG) на N-конце петли активации приводит к обнажению кармана связывания, который может быть использован ингибиторами. [ 13 ] Эта конформация называется DFGout .
Иматиниб связывается с доменом Abl посредством шести взаимодействий водородных связей . Это стабилизирует комплекс иматиниба Bcr-Abl и предотвращает достижение АТФ места связывания. [ 5 ] [ 9 ] [ 11 ] Водородные связи включают пиридин -N и основную цепь -NH Met -318, аминопиримидин и гидроксил боковой цепи Thr - 315 , амид-NH и карбоксилат боковой цепи Glu -286, карбонил и основную цепь-NH Asp. -381, протонированный метилпиперазин с карбонильными атомами основной цепи Ile -360 и His -361. ряд взаимодействий Ван-дер-Ваальса . Кроме того, связыванию способствует [ 9 ] Гидрофобный - карман образован аминокислотными остатками Ile-293, Leu -298, Leu-354 и Val 379 вокруг фенильного кольца, соседнего с пиперазинил -метильной группой иматиниба. [ 11 ] На момент открытия из-за отсутствия структурной информации не удалось найти четкого объяснения впечатляющей селективности иматиниба. [ 7 ]
Хотя лечение первого поколения позволило добиться чрезвычайно высокого уровня ответа и низкой частоты рецидивов у пациентов с ХМЛ, у некоторых пациентов наблюдается резистентность или непереносимость иматиниба. [ 2 ]
Лекарственная устойчивость
[ редактировать ]Лекарственная устойчивость является основной движущей силой продолжающихся исследований и разработок Bcr-Abl TKI. Вскоре после появления иматиниба исследователи начали описывать ряд in vitro, полученных клеточных линий, с устойчивостью к этому препарату. [ 14 ] За этим вскоре последовало клиническое описание клеток, устойчивых к иматинибу, у пациентов, что привело к попыткам лучше понять биологию, лежащую в основе этих наблюдений. Оценка терапевтического ответа иматиниба у пациентов с ХМЛ основана на соблюдении гематологических , цитогенных и молекулярных показателей. Пациенты, которым не удается достичь определенных ответов в заранее определенные моменты времени, описываются как первично резистентные к терапии, а те, кто теряет ранее достигнутые этапы регрессии заболевания, называются вторично резистентными. [ 4 ] Прежде чем сделать вывод, важно учитывать, что ретроспективные данные показали высокую частоту несоблюдения режима лечения иматинибом у пациентов с ХМЛ, и это может привести к нежелательным клиническим результатам. [ 2 ]

В целом устойчивость к иматинибу можно разделить на Bcr-Abl-зависимый и независимый механизмы. Зависимые от Bcr-Abl механизмы включают чрезмерную экспрессию или амплификацию гена Bcr-Abl и точечные мутации в киназном домене Bcr-Abl, которые препятствуют связыванию иматиниба. Независимые от Bcr-Abl механизмы включают факторы, влияющие на концентрацию иматиниба внутри клетки, например, путем изменения притока и оттока лекарственного средства и активации независимых от Bcr-Abl путей, таких как члены семейства киназ Src. [ 2 ] Устойчивость к иматинибу также может быть вызвана другими механизмами, которые здесь не будут упомянуты, поскольку важность этих механизмов все еще остается под вопросом из-за отсутствия клинических данных.
Bcr-Abl-зависимые механизмы резистентности
[ редактировать ]Дублирование Bcr-Abl
[ редактировать ]В первых сообщениях о резистентности к иматинибу описывалось развитие амплификации онкогена . То есть ген , кодирующий патогенную тирозинкиназу Bcr-Abl, дублируется в последовательности ДНК , что приводит к более высокой экспрессии возбудителя. [ 4 ] Увеличение дозы иматиниба может преодолеть этот вид резистентности при условии, что серьезные или непереносимые побочные эффекты . не возникнут [ 2 ]
Мутация Bcr-Abl
[ редактировать ]Точечные мутации могут вызывать аминокислотные замены внутри киназного домена белка Bcr-Abl и нарушать сайт связывания иматиниба с тирозинкиназой, что приводит к потере чувствительности к препарату. Эти мутации обычно влияют на структуру белка Bcr-Abl, приводя либо к нарушению критических точек контакта между лекарственным средством и белком Bcr-Abl, либо к индукции конформационных изменений, в результате которых образуется белок, с которым иматиниб не может связываться. [ 2 ]
Частота мутаций, по-видимому, увеличивается по мере того, как заболевание ХМЛ прогрессирует от хронической фазы к бластной фазе . Наиболее важными мутациями являются мутации P-петли и мутация T315I. Сообщалось также о мутациях в других сайтах киназы, например, в C- спирали , домене SH2 , сайте связывания субстрата, петле активации и C-концевой доле. Некоторые из этих мутаций имеют клиническое значение, но не такое большое, как мутации P-петли и T315I. [ 4 ]
Мутация T315I
[ редактировать ]T315I является уникальной мутацией из-за ее устойчивости ко всем одобренным ингибиторам Bcr-Abl до понатиниба . [ 15 ] Это вызвано заменой одной цитозина на тимин (C -> T) пары оснований в положении 944 последовательности гена Abl ( кодон «315» белка Abl), в результате чего аминокислота Т- треонин заменяется I- солейцином в этом положении. - таким образом, «T315I». Эта замена устраняет критическую молекулу кислорода, необходимую для образования водородных связей между иматинибом и киназой Abl, а также создает стерические препятствия для связывания большинства ИТК. [ 4 ] После обнаружения было подсчитано, что каждые 6 из 9 случаев поздних стадий ХМЛ с резистентностью к иматинибу имеют эту мутацию. [ 16 ] T315I обеспечивает самую высокую степень устойчивости из всех мутаций как к иматинибу, так и к ИТК второго поколения. [ 2 ] Понатиниб (Иклусиг) компании Ariad был одобрен в 2013 году для использования в качестве терапии второй линии ХМЛ и является единственным лицензированным ИТК, который успешно связывается с мутантной киназой T315I.
Мутации P-петли
[ редактировать ]Структура Bcr-Abl содержит две гибкие петли: АТФ-связывающую P-петлю и петлю активации. Эти петли имеют особое расположение в неактивной конформации Bcr-Abl, которое стабилизирует базальную конформацию. Мутации в этих петлях дестабилизируют расположение петель, так что киназный домен не может принять неактивную конформацию, необходимую для связывания иматиниба. Мутации в районе P-петли являются наиболее распространенными и составляют 36-48% всех мутаций. Имеются клинические данные, указывающие на то, что мутации Bcr-Abl в P-петле в 70–100 раз менее чувствительны к иматинибу по сравнению с нативным Bcr-Abl. [ 2 ]
Bcr-Abl Независимые механизмы резистентности
[ редактировать ]Были постулированы дополнительные механизмы для описания резистентности, наблюдаемой в различных модельных системах, хотя ни один из них не был четко идентифицирован как единственный источник клинической резистентности. [ 4 ]
Отток лекарств, вызванный P-гликопротеинами
[ редактировать ]Некоторые исследования клеточных линий показали, что устойчивость к иматинибу может быть частично обусловлена увеличением экспрессии откачивающего насоса P-гликопротеина . При использовании агентов, ингибирующих активность Р-гликопротеина, чувствительность к иматинибу в некоторых случаях восстанавливалась. [ 4 ]
Импорт лекарств транспортером органических катионов 1
[ редактировать ]Проникновение иматиниба в клетки зависит от переносчика органических катионов ( OCT1 ). OCT1 играет значительную роль в резистентности к иматинибу, ингибируя его приток и, таким образом, снижая внутриклеточную биодоступность иматиниба. [ 17 ] Пациенты с низкой экспрессией, активностью или полиморфизмом OCT1 имели значительно более низкие внутриклеточные уровни иматиниба. Реакция пациентов с низкой активностью OCT1 в значительной степени зависела от дозы. Эти данные указывают на то, что активность OCT1 является важным фактором, определяющим молекулярный ответ на иматиниб. [ 2 ]
Активация альтернативного сигнального пути
[ редактировать ]У некоторых групп пациентов резистентность может быть вызвана активацией других сигнальных путей, особенно киназ семейства Src. Киназы семейства Src участвуют в передаче сигналов Bcr-Abl и опосредуют устойчивость к иматинибу путем стабилизации активной конформации Bcr-Abl, конформации, которая не связывается с иматинибом. Кроме того, появляется все больше данных, свидетельствующих о том, что киназы семейства Src также участвуют в Bcr-Abl-независимых формах резистентности к иматинибу.
Решения
[ редактировать ]Варианты лечения пациентов с ХМЛ, резистентных или непереносимых к иматинибу , могут включать такие стратегии, как увеличение дозы иматиниба или использование препаратов второго поколения. Было показано, что повышение дозы иматиниба позволяет преодолеть некоторые случаи первичной резистентности к иматинибу, такие как дупликация Bcr-Abl, но ответ обычно кратковременный. [ 2 ] В случае резистентности или непереносимости может быть полезно проверить наличие мутаций Bcr-Abl, чтобы определить выбор лечения второй линии, поскольку различные варианты имеют различный профиль функции в отношении различных механизмов резистентности. [ 15 ] Препараты второго поколения обладают улучшенной эффективностью и большей вероятностью успеха у резистентных пациентов. [ 2 ] Также растет интерес к проверке гипотезы о том, что введение нескольких ингибиторов Abl-киназы пациентам на ранней стадии может быть использовано для задержки или предотвращения появления клонов , устойчивых к лекарствам . Комбинация двух агентов, воздействующих на разные пути, участвующие в ХМЛ, может значительно улучшить показатели ответа и потенциально увеличить выживаемость. [ 18 ] [ 19 ]
Препараты второго поколения
[ редактировать ]Предполагается, что препараты второго поколения имеют меньшую резистентность и непереносимость, чем иматиниб. В настоящее время на рынке представлены препараты второго поколения: нилотиниб, дазатиниб, босутиниб и понатиниб.
Нилотиниб (AMN107)
[ редактировать ]Разработка
[ редактировать ]Нилотиниб представляет собой производное фениламинопиримидина, структурно родственное иматинибу. [ 12 ] Он был разработан на основе структуры комплекса Абли-иматиниб для удовлетворения потребностей, связанных с непереносимостью и резистентностью к иматинибу. [ 13 ] [ 18 ] [ 20 ] В молекулу иматиниба были внесены небольшие изменения, чтобы сделать ее более мощным и селективным ингибитором Bcr-Abl, и эти изменения привели к открытию нилотиниба. Нилотиниб является селективным ингибитором киназы Bcr-Abl. [ 13 ] [ 18 ]
Нилотиниб в 10–30 раз более эффективен, чем иматиниб, в ингибировании активности тирозинкиназы Bcr-Abl и пролиферации клеток, экспрессирующих Bcr-Abl. [ 12 ] [ 18 ] [ 20 ] [ 21 ] Препарат эффективно ингибирует аутофосфорилирование Bcr-Abl на Tyr -177, которое участвует в патогенезе ХМЛ. [ 21 ] синергической Сообщалось о активности иматиниба и нилотиниба при одновременном применении. Это может быть результатом того, что препараты поглощаются клетками по разным механизмам: приток иматиниба зависит от OCT1, а нилотиниба — нет. Нилотиниб также не является субстратом для откачивающего транспортера P-гликопротеинового насоса, в отличие от иматиниба. [ 18 ] [ 21 ] Хотя двумерные молекулярные структуры этих двух препаратов могут выглядеть схожими, они различны с точки зрения пространственной структуры и молекулярных свойств. [ 13 ]

Связывание
[ редактировать ]Нилотиниб связывается с неактивной конформацией киназного домена Abl, в основном за счет липофильных взаимодействий, и таким образом блокирует его каталитическую активность. [ 12 ] [ 18 ] Нилотиниб связывается с киназным доменом, образуя четыре взаимодействия водородных связей с участием пиридила -N и основной цепи NH Met-318, анилино -NH и боковой цепи OH Thr-315, амидо-NH и карбоксилата боковой цепи Glu. -286 и амидокарбонил с основной цепью NH Asp-381. [ 13 ] [ 21 ] [4-(3-пиридинил)-2-пиримидинил]анилино-сегмент нилотиниба имеет тесные связывающие взаимодействия с остатками Met-318, Phe-317 и Thr-315 области внутри сайта связывания АТФ. Оставшаяся половина соединения выходит за пределы привратника Thr-315 и связывается внутри дополнительного кармана. 3-метилимидазол и трифторметильные группы нилотиниба осуществляют важные взаимодействия с киназным доменом Abl. Эти группы также сильно отличают форму нилотиниба от формы иматиниба. Нилотиниб также связывается с киназой посредством большого количества слабых ван-дер-ваальсовых взаимодействий. [ 13 ]
Сопротивление
[ редактировать ]Нилотиниб продемонстрировал эффект против большинства мутаций (32/33), связанных с устойчивостью к иматинибу, но мутант T315I остается устойчивым к нилотинибу. [ 12 ] [ 13 ] [ 18 ] Его неэффективность против мутанта T315I, по-видимому, является следствием потери взаимодействия H-связи между треонином-O и анилин-NH на нилотинибе и стерического столкновения между изолейцин-метильной группой и 2-метилфенил-фенильной группой нилотиниба. [ 12 ] С другой стороны, устойчивость к нилотинибу связана с ограниченным спектром мутаций киназы Bcr-Abl, которые в основном затрагивают P-петлю и T315I. Однако все мутации, кроме T315I, были эффективно подавлены увеличением концентрации нилотиниба. [ 18 ] Хотя нилотиниб более эффективен, чем иматиниб, возможно, что его специфический способ связывания с Abl может сделать другие сайты уязвимыми для новых видов лекарственной устойчивости. [ 20 ]
Дазатиниб (BMS-354825)
[ редактировать ]
Разработка
[ редактировать ]Дазатиниб представляет собой тиазолиламинопиримидин, разработанный в виде гидрохлоридной соли. Он был обнаружен в рамках программы, направленной на создание иммунодепрессантов , и он в 325 раз более эффективен против клеток, экспрессирующих Bcr-Abl дикого типа, чем иматиниб. [ 12 ] [ 20 ] Дазатиниб является многоцелевым ингибитором киназ семейств Bcr-Abl и Src. [ 12 ] [ 20 ] Он также обладает ингибирующей активностью в отношении дополнительных нижестоящих киназ. [ 20 ] [ 22 ]

Связывание
[ редактировать ]Дазатиниб связывается с Abl с менее строгими конформационными требованиями, чем иматиниб, поэтому он проявляет повышенную эффективность, но пониженную селективность по сравнению с иматинибом. [ 20 ] Дазатиниб связывает как активную, так и неактивную конформацию киназы Abl, в отличие от большинства других ИТК, связывающихся только с активной формой. [ 24 ] Соединения, нацеленные на активную конформацию, были идентифицированы, но сайт связывания во всех сотнях протеинкиназ человека очень похож. Следовательно, существует значительно больше различий между неактивными конформациями, поэтому усилия по открытию высокоселективных ингибиторов киназ направлены на молекулы, которые связываются с неактивной конформацией. [ 12 ]
Дазатиниб имеет некоторые общие структурные элементы с нилотинибом, в частности, расположение аминопиримидиновых и карбоксамидных групп. Аминотиазольный . сегмент дазатиниба образует бидентатную Н-связь с основной цепью CO и NH Met-318, а амид-NH образует Н-связь с кислородом боковой цепи Thr-315 [ 12 ]
Сопротивление
[ редактировать ]Поскольку дазатиниб является ингибитором киназ семейства Src, он может преодолевать резистентность за счет активации киназы семейства Src. Поскольку он не связывается с Bcr-Abl с такими же строгими конформационными требованиями, как иматиниб, он может ингибировать все мутанты киназного домена Bcr-Abl, за исключением T315I. Дазатиниб также не является субстратом многолекарственных насосов оттока P-гликопротеина, таких как иматиниб. По этой причине дазатиниб может быть активен у некоторых пациентов после неэффективности терапии как иматинибом, так и нилотинибом. [ 20 ] Хотя дазатиниб гораздо более эффективен, чем иматиниб, возможно, как и в случае с нилотинибом, его специфический способ связывания с Abl может привести к появлению новых уязвимых участков, которые могут придать новые виды лекарственной устойчивости. Были обнаружены мутации Phe317, так что это потенциально уязвимое место для этого препарата. [ 20 ]
Босутиниб (SKI-606)
[ редактировать ]Разработка
[ редактировать ]
Структура бозутиниба основана на хинолиновом каркасе и структурно связана с хиназолиновой матрицей AstraZeneca. [ 12 ] Скрининг дрожжей, зависимый от киназы Src, позволил охарактеризовать 4-анилино-3-хинолинкарбонитрил как ингибитор Src. Сочетание свойств этого соединения и родственного соединения, а также присоединение солюбилизирующих групп привело к открытию босутиниба. Было высказано предположение, что он является ингибитором киназы Abl, и при тестировании он оказался немного более эффективным против Abl, чем Src ( IC50 1,4 нМ против 3,5 нМ ). [ 25 ] Активность бозутиниба была впервые описана в 2001 году, а в 2003 году он был раскрыт как ингибитор киназы Abl. Сначала считалось, что босутиниб является селективным ингибитором киназы Src, но теперь известно, что его профиль ингибирования киназы гораздо менее ограничен, чем первоначально предполагалось. Босутиниб ингибирует Src, Abl и широкий спектр тирозиновых и серин-треониновых киназ. [ 25 ]
Сопротивление
[ редактировать ]Бозутиниб ингибировал клетки, экспрессирующие различные мутации, некоторые из которых приводили к устойчивости к иматинибу, но мутация Т315 была полностью устойчива к бозутинибу. [ 12 ] [ 25 ] В отличие от иматиниба, нилотиниба и дазатиниба, бозутиниб не является эффективным субстратом для переносчиков множественной лекарственной устойчивости (МЛУ) , который способствует оттоку чужеродных молекул из клеток. Босутиниб даже ингибирует эти белки-переносчики в более высоких концентрациях. [ 25 ]
Понатиниб (AP24534)
[ редактировать ]Компания ARIAD Pharmaceuticals , Inc. объявила 10 сентября 2010 г., что понатиниб , перорально активный ИТК Bcr-Abl, эффективный против мутации T315I, был одобрен для клинического исследования фазы II. [ 26 ]
Путь к открытию может быть связан с AP23464, одним из первых двойных конкурентных АТФ-ингибиторов Src/Abl от Ariad. AP23464 был идентифицирован с использованием структурной основы лекарственного средства и целевых синтетических библиотек тризамещенных аналогов пурина . Вещество эффективно ингибирует в наномолярном масштабе киназы Src и Bcr-Abl, включая многие распространенные мутации Bcr-Abl, устойчивые к иматинибу. Однако AP23464 не ингибирует мутацию T315I, тогда как AP24534 (понатиниб) ингибирует. [ 27 ]
Разработка
[ редактировать ]
Ариад использовал высокоэффективный препарат AP23464 для дальнейшего исследования ингибирующих возможностей матриц с пуриновым ядром для двойных ингибиторов Src/Abl. Во-первых, в поисках веществ, эффективных в отношении неактивной конформации Abl, боковая цепь, связанная с азотом пуринового ядра, была заменена диариламидной структурой , которая, как известно, имела высокое сродство к неактивной конформации за счет образования важных водородных связей и заполнение гидрофобных карманов киназы. Кроме того, в этом подтверждении было установлено, что циклопентильная группа на пуриновом ядре конфликтует с богатой глицином P-петлей и, таким образом, удаляется из молекулы. Затем с помощью испытаний in vitro на ингибирующую активность и анализов пероральной абсорбции in vivo было обнаружено, что более липофильная, связанная с амидом, циклопропильная группа на C6 пуринового ядра демонстрирует как удовлетворительную фармакокинетику, так и эффективность. Наконец, модификации боковой цепи диариламида путем добавления придатков имидазола были вдохновлены недавно выпущенной структурой нилотиниба. Эти модификации привели к появлению так называемого AP24163. В ходе этого цикла разработки Ариад протестировал несколько веществ против клеток, трансфицированных мутированной киназой T315I Bcr-Abl, и, что удивительно, обнаружил, что AP24163 демонстрирует разумное ингибирующее действие помимо мощного ингибирования нативного Bcr-Abl. [ 28 ]
После этого прорыва Ариад начал дальнейшие исследования по повышению эффективности соединения AP24163 против мутации T315I. Стыковка молекулы с сайтом связывания АТФ мутированной киназы Bcr-Abl T315I показала, что ожидаемое стерическое столкновение с изолейцином не наблюдалось из-за меньшей стерически требовательной виниловой связи между пуриновым ядром и боковой цепью диариламида по сравнению с другими ИТК. Первым шагом была попытка найти еще менее стерически требовательную структуру. Сначала была протестирована ацетиленовая связь, которая привела к более высокой эффективности, но неблагоприятной фармакокинетике. Позже была выбрана более стабильная 2-бутиновая связь. использовали имидазол[1,2-а]пиридиновое ядро Для достижения этой связи в качестве исходного материала для реакции Соногаширы ; но фармакокинетика все еще была плохой. При разработке AP24163 добавление циклопропановой боковой цепи к C8 в пуриновом ядре привело к благоприятной фармакокинетике. Затем было протестировано несколько различных боковых цепей, но лучшие результаты были получены вообще без боковой цепи, в результате чего получилось вещество с удовлетворительной фармакокинетикой, но теперь также с пониженной активностью в отношении T315I. Первым шагом к повторному повышению эффективности было рассмотрение других ИТК. Иматиниб имеет концевую метилпиперазиновую группу, которая, как было показано, образует водородную связь с карбонильным атомом кислорода остатка Ile-360 в петле активации киназы Abl. Пиперазиновое кольцо также является распространенной солюбилизирующей группой, которая может еще больше улучшить фармакокинетические свойства молекулы. Эти предположения были подтверждены двукратным увеличением ингибирующего действия в отношении мутированной киназы Bcr-Abl T315I, и это стало лучшим моментом. Связывание с белками плазмы вещества (названного «19а»), по-видимому, уменьшилось, что позволяет применять меньшие дозы с той же эффективностью. Хотя «19а» продемонстрировал хорошую фармакокинетику при пероральном приеме как у мышей, так и у крыс, он также сохранил высокий коэффициент распределения — 6,69. Итак, в попытках еще больше снизить липофильность молекулы была произведена замена одного атома углерода в имидазо[1,2-а]пиридиновом ядре; в результате появилось то, что теперь известно как соединение понатиниб . [ 29 ]

Связывание
[ редактировать ]Рентгеноструктурный анализ понатиниба и мутированной киназы T315I Bcr-Abl показывает, что имидазо[1,2b] пиридазиновое ядро находится в адениновом кармане фермента. Метилфенильная группа занимает гидрофобный карман позади I315, этинильная связь образует благоприятные ван-дер-ваальсовые взаимодействия с аминокислотой, а трифторметильная группа связывается с карманом, индуцированным неактивной конформационной киназой. Также в конформации киназы, в которой находится понатиниб, возникают дополнительные благоприятные ван-дер-ваальсовые взаимодействия между препаратом и Tyr-253 и Phe-382. Образуются пять водородных связей с основной цепью Met-318 в шарнирной области, с основной цепью Asp-381, с боковой цепью Glu-286 и протонированного метилпиперазина с карбонильными атомами основной цепи Ile-360 и His. -361. [ 30 ]
Было показано, что при такой структуре понатиниб обладает относительно широким профилем киназной специфичности, что, вероятно, может быть связано с линейностью участка связи молекулы. Благодаря такой линейной структуре препарат, по-видимому, избегает стерических столкновений с гидрофобными остатками ТК-привратника. Несмотря на это или даже благодаря этому, понатиниб является мощным препаратом и воздействует не только на большинство известных мутаций TK Bcr-Abl, но, что наиболее важно, на T315I. Эта мутация становится распространенной причиной неудачи лечения как первой, так и второй линии. В отличие от других разрабатываемых ингибиторов, нацеленных на T315I, понатиниб не воздействует на киназы Авроры, что четко отличает его от них и подчеркивает значимость его открытия. [ 30 ]
Бафетиниб (ИННО-406)
[ редактировать ]В связи с появлением резистентности к лечению иматинибом после его запуска альтернативное лечение стало пользоваться большим спросом. Бафетиниб стал результатом попытки создать более мощный препарат, чем иматиниб, с эффективностью против различных точечных мутаций киназы Bcr-Abl, с меньшим количеством побочных эффектов и с более узким спектром киназ, а именно Lyn и Bcr-Abl. [ 31 ]
Разработка
[ редактировать ]В поисках вещества, соответствующего указанным критериям, была исследована кристаллическая структура иматиниба, связанного с Abl. Это выявило гидрофобный карман вокруг фенильного кольца, примыкающего к пиперазинилметильной группе иматиниба. Попытки использовать этот карман для повышения эффективности привели к добавлению различных гидрофобных групп, включая одиночные фтор- , бром- и хлор- заместители. Наконец, было обнаружено, что трифторметильная группа в положении 3 дает наилучшие результаты, примерно в 36 раз лучше, чем иматиниб. Теперь необходимо было противодействовать добавлению гидрофобной группы, чтобы поддерживать растворимость вещества. Более тщательное изучение кристаллической структуры комплекса иматиниб-киназа показало, что Tyr-236 находился в непосредственной близости от пиридинового кольца иматиниба, что позволяет предположить, что там было мало или вообще не было места для более крупной группы. С учетом этого пиридин был заменен более гидрофильным пиримидиновым кольцом, что, как было обнаружено, увеличивало растворимость, оставляя при этом эффективность такой же или даже немного большей. Наконец, для улучшения водородных связей пиперазинового кольца иматиниба с Ile-360 и His-361 были введены производные пирролидина и азетидина. Наиболее многообещающее вещество из этих последних модификаций получило обозначение NS-187. [ 11 ]
Связывание
[ редактировать ]Из-за структурного сходства иматиниба и бафетиниба их связывание с Bcr-Abl также весьма схоже. Единственное заметное различие заключается в гидрофобном взаимодействии между трифторметильной группой и гидрофобным карманом, созданным Ile-293, Leu-298, Leu-354 и Val-379. Эту группу также можно связать со специфичностью бафетиниба к Lyn, поскольку сайт связывания там почти идентичен сайту связывания Bcr-Abl. [ 32 ]
Бафетиниб имеет свое место в терапии ИТК, поскольку он эффективен как против большинства мутаций, устойчивых к иматинибу (исключая T315I), так и против некоторых мутаций, устойчивых к дазатинибу. Бафетиниб также имеет большее сродство к Bcr-Abl, чем нилотиниб (но меньшее, чем дазатиниб), но нацелен только на киназы семейства Bcr-Abl и Src Lck и Lyn; с непревзойденной специфичностью, что предполагает вероятность меньшего количества побочных эффектов. [ 33 ]
По состоянию на май 2010 года CytRx проходит II фазу клинических испытаний бафетиниба в качестве средства лечения лейкемии. [ 34 ]
Производные 1,3,4-тиадиазола - Вещество 14
[ редактировать ]Некоторый интерес вызывают производные тиазола и тиадиазола и их способность ингибировать ТК Bcr-Abl.
Разработка
[ редактировать ]
обнаружила Одна итальянская исследовательская группа с помощью цифрового скрининга , что коммерчески доступные производные тиадиазола обладают умеренным ингибирующим действием как на киназы Abl, так и на Src. [ 35 ] Используя 1,3,4-тиадиазольное ядро и пробуя разные группы или молекулы в бензольных кольцах, было получено несколько различных веществ с ингибирующими свойствами. Гибкость ядра позволила ряду конформаций веществ связываться с АТФ-сайтом киназы Abl, хотя все они связывались с активной формой киназы. [ 35 ] Дальнейшее изучение связывания показало, что положение серы, которая связывается со структурой толуола, играет важную роль в связывании Abl, а также что только один из тиадиазолов азота образует водородную связь. Кроме того, компьютерный анализ структуры показал, что связанный амидом бензолкетон может быть заменен на более подходящее тиофеновое кольцо. [ 36 ] Хотя следует отметить, что этот анализ был проведен со сравнением кристаллической структуры Abl и дазатиниба, который представляет собой неактивную конформацию Abl, знания, полученные в результате стыковки и анализа структуры, привели к идентификации соединения, называемого веществом 14. с высокой близостью к Абл.
Связывание
[ редактировать ]Связывание вещества 14 частично аналогично дазатинибу: аминотиазольный сегмент вещества 14 образует бидентатное взаимодействие H-связей с основной цепью CO и NH Met-318, в то время как метокси -бензол прекрасно попадает в гидрофобный карман, созданный Валом. 256, Ала 253, Лис 271 и Ала 380. [ 36 ] Хотя свойства связывания, аналогичные свойствам дазатиниба, позволяют предположить, что возможность получения Bcr-Abl TKI из тиазольных ядер реальна, остается открытым вопрос, приведет ли это исследование просто к аналогу дазатиниба или к новому способу ингибирования TK.
Другие
[ редактировать ]Ребастиниб (DCC-2036) Также является ингибитором TIE-2 и VEGFR-2. [ 37 ] Он провел клинические испытания фазы 1 для лечения лейкозов (Ph+ CML с мутацией T315I). [ 38 ] Он находится в первой фазе клинических испытаний комбинированной терапии метастатического рака молочной железы. [ 39 ]
Ациминиб (ABL001) представляет собой ингибитор киназы Абельсона, нацеленный на миристоиловый карман и аллостерически ингибирующий фермент. [ 40 ] По состоянию на август 2020 года компания завершила исследование III фазы ХМЛ (ASCEMBL), продемонстрировав более высокую эффективность по сравнению с босутинибом.
Краткое содержание
[ редактировать ]| Лекарство | Структура | Н-облигации | Н-связывающие аминокислоты | Подтверждение привязки | Открытие | Статус по состоянию на 2017 год |
|---|---|---|---|---|---|---|
| Иматиниб (STI571) | 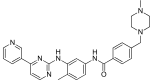
|
6 | Мет-318, Thr-315, Glu-286, Asp-381, Ile-380, His-361 | Неактивный | Проверка на наркотики | Продается как терапия первой линии. |
| Нилотиниб (AMN107) | 
|
4 | Мет-318, Thr-315, Glu-286, Asp-381 | Неактивный | Рациональный дизайн лекарств | Продается как терапия второй линии. |
| Дазатиниб (BMS-345825) | 
|
3 | Мет-318, ТР-315 | Активный | Рациональный дизайн лекарств | Продается как терапия второй линии. |
| Босутиниб (SKI-606) | 
|
- | - | Неактивный | Рациональный дизайн лекарств | Продается как терапия второй линии. |
| Понатиниб (AP-24534) | 
|
5 | Мет-318, Асп-381, Глу-286, Гис-381, Иле-380 | Неактивный | Рациональный дизайн лекарств | Продается как терапия второй линии. |
| Бафетиниб (ИННО-406) | 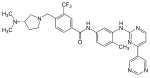
|
6 | Мет-318, Thr-315, Glu-286, Asp-381, His-361, Ile-360 | Неактивный | Рациональный дизайн лекарств | Продается как терапия второй линии. |
Текущий статус - относительно Ph+ CML
[ редактировать ]Иматиниб остается стандартным ИТК первой линии. Нилотиниб и дазатиниб также одобрены FDA в качестве препаратов первой линии в июне и октябре 2010 г. соответственно. Четыре из этих препаратов — нилотиниб, дазатиниб, бозутиниб и понатиниб — одобрены для лечения ХМЛ, резистентного или непереносимого иматиниба. Данные первой линии по этим соединениям обнадеживают и позволяют предположить, что некоторые или все из них могут заменить иматиниб в качестве передового стандартного ИТК в будущем. [ 41 ]
Ссылки
[ редактировать ]- ^ Ноуэлл, Питер; Хангерфорд, Дэвид (1960). «Минутная хромосома при хроническом гранулоцитарном лейкозе человека». Наука . 132 :1497.
- ^ Перейти обратно: а б с д и ж г час я дж к Ан, Х.; Тивари, А.; Сан, Ю.; Дин, П.; Эшби-младший, К.; Чен, З. (2010). «Ингибиторы тирозинкиназы BCR-ABL в лечении хронического миелолейкоза с положительной филадельфийской хромосомой: обзор». Исследования лейкемии . 34 (10): 1255–1268. doi : 10.1016/j.leukres.2010.04.016 . ПМИД 20537386 .
- ^ Гош Бертон, Джованни; Синтия Лима Фонсека Родригес, Аманда; дос Сантос Борхес, Рафаэль; РОДРИГЕС КАРДОСО, Николь; де Оливейра, Тьяго Абрахан; Оливейра Маркес, Маркос Винисиус. «Ингибиторы тирозинкиназы Абельсона при болезни Паркинсона и деменции с тельцами Леви: систематический обзор, метаанализ и метарегрессия» . Клиническая нейрофармакология : 10.1097/WNF.0000000000000597. дои : 10.1097/WNF.0000000000000597 . ISSN 0362-5664 .
- ^ Перейти обратно: а б с д и ж г Биксби Д., Талпас М. (2009). «Механизмы устойчивости к ингибиторам тирозинкиназы при хроническом миелолейкозе и новейшие терапевтические стратегии по преодолению устойчивости». Гематология : 461-476.
- ^ Перейти обратно: а б с Мэнли, П.В., Коуэн-Джейкоб, С.В., Бухдангер, Э., Фаббро, Д., Фендрих, Г., Фюре, П., Мейер, Т. и Циммерманн, Дж. (2002). «Иматиниб: селективный ингибитор тирозинкиназы». Европейский журнал рака : S19-S27.
- ^ Шаувер, Л.К., Сламон, Д. и Ульрих, А. (2002). «Умные лекарства: ингибиторы тирозинкиназы в терапии рака». Раковая клетка : 117-123.
- ^ Перейти обратно: а б Друкер, Б.Дж. и Лайдон, Н.Б. (2000). «Уроки, извлеченные из разработки ингибитора тирозинкиназы Abl для лечения хронического миелогенного лейкоза». Журнал клинических исследований : 3-7.
- ^ Перейти обратно: а б Бьюкенен, С.Г. (2003) «Структура белка: открытие селективных ингибиторов протеинкиназы». Цели : 101-108.
- ^ Перейти обратно: а б с Эк, М.; Мэнли, П. (2009). «Взаимодействие структурной информации и функциональных исследований при разработке киназных препаратов: идеи BCR-Abl». Современное мнение в области клеточной биологии . 21 (2): 288–295. дои : 10.1016/j.ceb.2009.01.014 . ПМИД 19217274 .
- ^ Мандал, С.; Муджил, М.; Мандал, С. (2009). «Рациональный дизайн лекарств». Европейский журнал фармакологии . 625 (1–3): 90–100. дои : 10.1016/j.ejphar.2009.06.065 . ПМИД 19835861 .
- ^ Перейти обратно: а б с д Асаки, Т.; Сугияма, Ю.; Хамамото, Т.; Хигасиока, М.; Умехара, М.; Найто, Х.; Нива, Т. (2006). «Разработка и синтез 3-замещенных производных бензамида в качестве ингибиторов киназы Bcr-Abl». Письма по биоорганической и медицинской химии . 16 (5): 1421–1425. дои : 10.1016/j.bmcl.2005.11.042 . ПМИД 16332440 .
- ^ Перейти обратно: а б с д и ж г час я дж к л Мэнли, П.; Коуэн-Джейкоб, С.; Местан, Дж. (2005). «Достижения в структурной биологии, дизайне и клинической разработке ингибиторов киназы Bcr-Abl для лечения хронического миелолейкоза». Biochimica et Biophysical Acta (BBA) - Белки и протеомика . 1754 (1–2): 3–13. дои : 10.1016/j.bbapap.2005.07.040 . ПМИД 16172030 .
- ^ Перейти обратно: а б с д и ж г Мэнли, П.; Штифл, Н.; Коуэн-Джейкоб, С.; Кауфман, С.; Местан, Дж.; Вартманн, М.; Висманн, М.; Вудман, Р.; Галлахер, Н. (2010). «Структурное сходство и сравнение относительных фармакологических свойств иматиниба и нилотиниба». Биоорганическая и медицинская химия . 18 (19): 6977–6986. дои : 10.1016/j.bmc.2010.08.026 . ПМИД 20817538 .
- ^ Махон (1 августа 2000 г.). «Отбор и характеристика BCR-ABL-положительных клеточных линий с дифференциальной чувствительностью к ингибитору тирозинкиназы STI571: разнообразные механизмы устойчивости». Кровь . 96 (3): 1070–9. дои : 10.1182/blood.V96.3.1070 . ПМИД 10910924 .
- ^ Перейти обратно: а б Стейн Б., Смит Б.Д. (2010). «Варианты лечения пациентов с хроническим миелолейкозом, устойчивых к иматинибу или неспособных переносить его». Клиническая терапия : 804-820.
- ^ Горре, М.; Мохаммед, М.; Эллвуд, К.; Сюй, Н.; Пакетт, Р.; Рао, ПН; Сойерс, CL (2001). «Клиническая устойчивость к терапии рака STI-571, вызванная мутацией или амплификацией гена BCR-ABL» . Наука . 293 (5531): 876–880. дои : 10.1126/science.1062538 . ПМИД 11423618 . S2CID 1279564 .
- ^ Томас, Дж.; Ван, Л.; Кларк, Р.; Пирмохамед, М. (2004). «Активный транспорт иматиниба в клетки и из клеток: последствия для лекарственной устойчивости» . Кровь . 104 (12): 3739–3745. дои : 10.1182/кровь-2003-12-4276 . ПМИД 15315971 .
- ^ Перейти обратно: а б с д и ж г час Джаббур, Э.; Кортес, Дж.; Кантарджян, Х. (2009). «Нилотиниб для лечения хронического миелолейкоза: обзор фактических данных» . Основные доказательства . 4 : 207–213. дои : 10.2147/CE.S6003 . ПМЦ 2899790 . ПМИД 20694077 .
- ^ Чаттерджи, С.; Санджив, Б.С. (2023). «Обнаружение сообщества карцином, связанных с вирусом Эпштейна-Барра, и роль тирозинкиназы в этиологических механизмах онкогенеза». Микробный патогенез . 180 : 106115. doi : 10.1016/j.micpath.2023.106115 . ПМИД 37137346 . S2CID 258446069 .
- ^ Перейти обратно: а б с д и ж г час я Оливьери, А.; Манционе, Л. (2007). «Дазатиниб: новый шаг в молекулярной таргетной терапии» . Анналы онкологии . 18 : vi42–vi46. дои : 10.1093/annonc/mdm223 . ПМИД 17591830 .
- ^ Перейти обратно: а б с д Брекча, М.; Алимена, Г. (2010). «Нилотиниб: ингибитор тирозинкиназы второго поколения при хроническом миелолейкозе». Исследования лейкемии . 34 (2): 129–134. doi : 10.1016/j.leukres.2009.08.031 . ПМИД 19783301 .
- ^ Хан, Л.; Шуринга Дж.; Малдер, А.; Велленга, Э. (2010). «Дазатиниб препятствует долгосрочному распространению предшественников лейкемии в некоторых случаях острого миелолейкоза» . Анналы гематологии . 89 (9): 861–871. дои : 10.1007/s00277-010-0948-7 . ПМК 2908401 . ПМИД 20387067 .
- ^ Токарский, Дж.С.; Ньюитт, Дж.А.; Чанг, CY ; Ченг, JD; Виттекинд, М.; Кифер, SE; Киш, К.; Ли, штат Нью-Йорк; Борзиллерри, Р.; Ломбардо, Эл Джей; Се, Д.; Чжан, Ю.; Клей, HE (2006). «Структура дазатиниба (BMS-354825), связанного с активированным киназным доменом ABL, объясняет его ингибирующую активность в отношении устойчивых к иматинибу мутантов ABL» . Исследования рака . 66 (11): 5790–5797. дои : 10.1158/0008-5472.CAN-05-4187 . ПМИД 16740718 .
- ^ Агилера, Долли Джи (31 октября 2006 г.). «Дазатиниб при хроническом миелолейкозе: обзор» . Терапия и управление клиническими рисками . 5 (2): 281–289. дои : 10.2147/tcrm.s3425 . ПМЦ 2697539 . ПМИД 19536317 .
- ^ Перейти обратно: а б с д Бошелли, Ф.; Арндт, К.; Гамбакорти-Пассерини, К. (2010). «Бозутиниб: обзор доклинических исследований хронического миелогенного лейкоза». Европейский журнал рака . 46 (10): 1781–1789. дои : 10.1016/j.ejca.2010.02.032 . ПМИД 20399641 .
- ^ http://www.ariad.com
- ^ О'Хара, Т.; Поллок, Р.; Стоффреген, EP; Китс, Дж. А.; Абдулла, ОМ; Мозесон, Э.М.; Ривера, ВМ; Тан, Х.; Меткалф, Калифорния; Бохачек, Р.С.; Ван, Ю.; Сундараморти, Р.; Шекспир, туалет; Далгарно, Д.; Клаксон, Т.; Сойер, ТК; Дейнингер, М.В.; Друкер, Би Джей (2004). «Ингибирование Bcr-Abl дикого типа и мутанта с помощью AP23464, мощного ингибитора онкогенной протеинкиназы на основе АТФ: последствия для ХМЛ» . Кровь . 104 (8): 2532–2539. doi : 10.1182/blood-2004-05-1851 . ПМИД 15256422 . S2CID 6853673 .
- ^ Хуанг, В.; Чжу, X.; Ван, Ю.; Азам, М.; Вэнь, Д.; Сундараморти, Р.; Томас, Р.; Лю, С.; Банда, Г.; Лентини, СП; Дас, С.; Сюй, Кью; Китс, Дж.; Ван, Ф.; Уордвелл, С.; Нин, Ю.; Снодграсс, Джей Ти; Броуди, Мичиган; Русский, К.; Дейли, GQ; Юлиуччи, Дж.; Далгарно, округ Колумбия; Клаксон, Т.; Сойер, ТК; Шекспир, WC (2009). «9-(Арентенил)пурины как двойные ингибиторы киназы Src/Abl, нацеленные на неактивную конформацию: дизайн, синтез и биологическая оценка». Журнал медицинской химии . 52 (15): 4743–4756. дои : 10.1021/jm900166t . ПМИД 19572547 .
- ^ Хуанг, WS; Меткалф, Калифорния; Сундараморти, Р.; Ван, Ю.; Цзоу, Д.; Томас, РМ; Чжу, X.; Кай, Л.; Вэнь, Д. (2010). «Открытие 3-[2-(Имидазо[1,2-b]пиридазин-3-ил)этинил]-4-метил-N-{4-[(4-метилпиперазин-1-ил)метил]-3- (трифторметил)фенил}бензамид (AP24534), мощный, перорально активный пан-ингибитор киназы области кластера точки останова-Абельсона (BCR-ABL), включая мутант T315I Gatekeeper». Журнал медицинской химии . 53 (12): 4701–19. дои : 10.1021/jm100395q . ПМИД 20513156 .
- ^ Перейти обратно: а б О'Хара, Т.; Шекспир, В.; Чжу, X.; Эйде, К.; Ривера, В.; Ван, Ф.; Адриан, Л.; Чжоу, Т.; Хуанг, В.; Сюй, Кью; Меткалф, Калифорния; Тайнер, Дж.В.; Лорио, ММ; Корбин, А.С.; Уордвелл, С.; Нин, Ю.; Китс, Дж. А.; Ван, Ю.; Сундараморти, Р.; Томас, М.; Чжоу, Д.; Снодграсс, Дж.; Коммодор, Л.; Сойер, ТК; Далгарно, округ Колумбия; Дейнингер, MWN; Друкер, Би Джей; Клаксон, Т. (2009). «AP24534, ингибитор пан-BCR-ABL для лечения хронического миелолейкоза, мощно ингибирует мутант T315I и преодолевает резистентность, основанную на мутациях» . Раковая клетка . 16 (5): 401–412. дои : 10.1016/j.ccr.2009.09.028 . ПМК 2804470 . ПМИД 19878872 .
- ^ Кимура, С.; Найто, Х.; Сегава, Х.; Курода Дж.; Юаса, Т.; Сато, К.; Йокота, А.; Камицудзи, Ю.; Кавата, Э.; Ашихара, Э.; Накая, Ю.; Наруока, Х.; Вакаяма, Т.; Насу, К.; Асаки, Т.; Нива, Т.; Хирабаяши, К.; Маэкава, Т. (2005). «NS-187, мощный и селективный двойной ингибитор тирозинкиназы Bcr-Abl/Lyn, является новым средством для лечения резистентного к иматинибу лейкоза» . Кровь 106 (12): 3948–3954. дои : 10.1182/кровь-2005-06-2209 . ПМИД 16105974 . S2CID 15211440 .
- ^ Хорио, Т.; Хамасаки, Т.; Иноуэ, Т.; Вакаяма, Т.; Иту, С.; Найто, Х.; Асаки, Т.; Хаясе, Х.; Нива, Т. (2007). «Структурные факторы, способствующие двойной ингибирующей активности Abl/Lyn 3-замещенных производных бензамида». Письма по биоорганической и медицинской химии . 17 (10): 2712–2717. дои : 10.1016/j.bmcl.2007.03.002 . ПМИД 17376680 .
- ^ Дегучи, Ю.; Кимура, С.; Ашихара, Э.; Нива, Т.; Ходохара, К.; Фудзияма, Ю.; Маэкава, Т. (2008). «Сравнение иматиниба, дазатиниба, нилотиниба и INNO-406 в клеточных линиях, устойчивых к иматинибу». Исследования лейкемии . 32 (6): 980–983. дои : 10.1016/j.leukres.2007.11.008 . ПМИД 18191450 .
- ^ «CytRx начинает вторую фазу клинических испытаний бафетиниба при распространенном раке простаты» . Жестокие биотехнологии . 7 сентября 2010 г. Проверено 17 мая 2022 г.
- ^ Перейти обратно: а б Ради, М.; Креспан, Э.; Ботта, Г.; Фальчи, Ф.; Мага, Г.; Манетти, Ф.; Корради, В.; Манчини, М.; Сантуччи, М.; Шеноне, С.; Ботта, М. (2008). «Открытие и SAR производных 1,3,4-тиадиазола как мощных ингибиторов тирозинкиназы Abl и цитодифференцирующих агентов». Письма по биоорганической и медицинской химии . 18 (3): 1207–1211. дои : 10.1016/j.bmcl.2007.11.112 . hdl : 11381/2432276 . ПМИД 18078752 .
- ^ Перейти обратно: а б Манетти, Ф.; Фальчи, Ф.; Креспан, Э.; Шеноне, С.; Мага, Г.; Ботта, М. (2008). «Производные N-(тиазол-2-ил)-2-тиофенкарбоксамида как ингибиторы Abl, идентифицированные с помощью скрининга коммерчески доступных соединений на основе базы данных фармакофоров». Письма по биоорганической и медицинской химии . 18 (15): 4328–4331. дои : 10.1016/j.bmcl.2008.06.082 . ПМИД 18621522 .
- ^ Ребастиниб
- ^ Безопасность исследования и предварительная эффективность DCC-2036 у пациентов с лейкозами (Ph + CML с мутацией T315I)
- ^ Ребастиниб плюс антитубулиновая терапия с паклитакселом или эрибулином при метастатическом раке молочной железы
- ^ «Исследовательский новый ингибитор STAMP асциминиб (ABL001) компании Novartis соответствует первичной конечной точке исследования III фазы хронического миелолейкоза» .
- ^ Валент, П. (2010). «Стандартное лечение Ph+ ХМЛ в 2010 году: как, когда и где не использовать какой ингибитор киназы BCR/ABL1?» . Европейский журнал клинических исследований . 40 (10): 918–931. дои : 10.1111/j.1365-2362.2010.02328.x . ПМИД 20597967 .