Хиназолин
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК Хиназолин [1] | |||
| Другие имена 1,3-диазанафталин бензопиримидин фенмиазин бензо-1,3-диазин | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| ЧЭБИ | |||
| ЧЕМБЛ | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.005.424 | ||
| Номер ЕС |
| ||
ПабХим CID | |||
| НЕКОТОРЫЙ | |||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| С 8 Ч 6 Н 2 | |||
| Молярная масса | 130.150 g·mol −1 | ||
| Появление | светло-желтые кристаллы | ||
| Плотность | 1,351 г/см 3 , твердый | ||
| Температура плавления | 48 ° С (118 ° F; 321 К) | ||
| Точка кипения | 243 ° С (469 ° F; 516 К) | ||
| Растворимый | |||
| Кислотность ( pKa ) | 3.51 [2] | ||
| Структура | |||
| 2,2 Д [3] | |||
| Опасности | |||
| Безопасность и гигиена труда (OHS/OSH): | |||
Основные опасности | Раздражающий | ||
| СГС Маркировка : | |||
 | |||
| Предупреждение | |||
| Х315 , Х319 , Х335 | |||
| P261 , P264 , P271 , P280 , P302+P352 , P304+P340 , P305+P351+P338 , P312 , P321 , P332+P313, P337+P313 P362 , P403 , P301 , P403+P233 , P405, P5013 +P233, P405, P501, P501, P501 , , P362 , P403+P233, P3 | |||
| точка возгорания | 106 ° С (223 ° F; 379 К) | ||
| Паспорт безопасности (SDS) | Внешний паспорт безопасности материалов | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
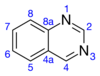
Хиназолин – органическое соединение формулы C 8 H 6 N 2 . Это ароматический гетероцикл с бициклической структурой, состоящий из двух конденсированных шестичленных ароматических колец, бензольного кольца и пиримидинового кольца. Это светло-желтое кристаллическое твердое вещество, растворимое в воде. Хиназолин, также известный как 1,3-диазанафталин, получил свое название потому, что является аза- производным хинолина . Хотя исходная молекула хиназолина сама по себе редко упоминается в технической литературе, замещенные производные были синтезированы для медицинских целей, таких как противомалярийные и противораковые средства. Хиназолин представляет собой плоскую молекулу. Он изомерен другим диазанафталинам подгруппы бензодиазинов : циннолину , хиноксалину и фталазину . более 200 биологически активных хиназолиновых и хинолиновых алкалоидов . Идентифицировано [4] [5]
Синтез [ править ]
О синтезе хиназолина впервые сообщили в 1895 году Август Бишлер и Ланг путем декарбоксилирования 2-карбоксильного производного (хиназолин-2-карбоновой кислоты). [6] В 1903 году Зигмунд Габриэль сообщил о синтезе исходного хиназолина из о -нитробензиламина, который был восстановлен йодоводородом и красным фосфором до 2- аминобензиламина . Восстановленное промежуточное соединение конденсируется с муравьиной кислотой с образованием дигидрохиназолина, который окисляется до хиназолина. [7]
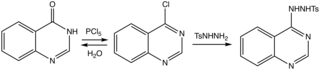
Методы рассмотрены. [8] Эффективный путь к исходному гетероциклу идет через 4-хлорпроизводное к тозилгидразиду, который удаляется основанием. [9]
Реакция [ править ]
Реакции гидратации и присоединения [ править ]
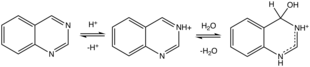
Хиназолин протонирует (и метилирует) по N3. Протонирование вызывает гидратацию. Многие слабокислые субстраты присоединяются по связи C=N3, к ним относятся цианистый водород , бисульфит натрия и метилкетоны. [10]
Гидролиз [ править ]
В теплом растворе хиназолин гидролизуется в кислых и щелочных условиях до 2-аминобензальдегида (или продуктов его самоконденсации) и муравьиной кислоты и аммиака/аммония. [3]
Электрофильное и нуклеофильное замещение [ править ]
Пиримидиновое кольцо устойчиво к электрофильному замещению , хотя положение 4 более реакционноспособно, чем положение 2. Для сравнения, бензольное кольцо более подвержено электрофильному замещению. Порядок реакционной способности кольца: 8 > 6 > 5 > 7. 2- и 4-галогенпроизводные хиназолина подвергаются замещению нуклеофилами, такими как пиперидин. [3]
Биологическое и фармакологическое значение [ править ]
Гефитиниб [ править ]
В мае 2003 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило хиназолин гефитиниб . Препарат, производимый компанией AstraZeneca , является ингибитором протеинкиназы рецептора эпидермального фактора роста (EGFR). Он связывается с АТФ-связывающим участком EGFR, тем самым инактивируя антиапоптотический каскад передачи сигнала Ras, предотвращая дальнейший рост раковых клеток. [11] [12] [13]
Лапатиниб [ править ]
В марте 2007 года GlaxoSmithKline компании препарат лапатиниб был одобрен FDA США для лечения поздней стадии или метастатического рака молочной железы в сочетании с Roche компании капецитабином . Лапатиниб устраняет рост стволовых клеток рака молочной железы, вызывающих рост опухоли. Связывание лапатиниба с АТФ-связывающим сайтом в EGFR и рецептора эпидермального фактора роста человека 2 (HER2) ингибирует активацию сигнального механизма (посредством обратимого конкурентного ингибирования). доменах протеинкиназы [14] [15] [16] [17]
Эрлотиниб [ править ]
В мае 2013 года эрлотиниб , препарат производства Astellas , был одобрен FDA США для лечения пациентов с НМРЛ с опухолями, вызванными мутациями EGFR. Связывание эрлотиниба с АТФ-связывающими сайтами рецепторов EGFR предотвращает выработку EGFR остатков фосфотирозина (из-за конкурентного ингибирования), что делает рецептор неспособным генерировать сигнальные каскады, способствующие росту клеток. [18] [19]
Afatinib[editАфатиниб
В июле 2013 года FDA США одобрило афатиниб , препарат, разработанный компанией Boehringer Ingelheim , в качестве необратимого конкурентного ингибитора киназ HER2 и EGFR. Хотя афатиниб демонстрирует механизм, аналогичный лаптинибу, в котором он действует как необратимый ингибитор HER2 и EGFR, афатиниб также продемонстрировал активность против тирозинкиназ, которые стали устойчивыми к гефинитибу и эрлотинибу. [20]
- Хиназолинсодержащие препараты
- Гефитиниб для лечения немелкоклеточного рака легкого .
- Лапатиниб для лечения поздней стадии или метастатического рака молочной железы.
- Эрлотиниб , противоопухолевое средство.
- Афатиниб для лечения рака, резистентного к гефинитибу и эрлотинибу.
См. также [ править ]
Ссылки [ править ]
- ^ Международный союз теоретической и прикладной химии (2014). Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 . Королевское химическое общество . п. 212. дои : 10.1039/9781849733069 . ISBN 978-0-85404-182-4 .
- ^ Армарего, WLF (1963). Квиназолины . Достижения гетероциклической химии. Том. 1. С. 253–309. дои : 10.1016/S0065-2725(08)60527-9 . ISBN 9780120206018 . ПМИД 14087221 .
- ↑ Перейти обратно: Перейти обратно: а б с Бюхель, К.Х., изд. Методы органической химии (Губен-Вейль): Дополнительные тома к 4-му изданию. Нью-Йорк: Георг Тиме Верлаг Штутгарт, 2001.
- ^ Шан, XF; Моррис-Начке, СЛ; Лю, YQ; Го, Х; Сюй, XS; Гото, М; Ли, Дж. К.; Ян, Г.З.; Ли, К.Х. (май 2018 г.). «Биологически активные хинолиновые и хиназолиновые алкалоиды часть I». Обзоры медицинских исследований . 38 (3): 775–828. дои : 10.1002/мед.21466 . ПМК 6421866 . ПМИД 28902434 .
- ^ Шан, Сяо-Фэй; Моррис-Начке, Сьюзен Л.; Ян, Гуань-Чжоу; Лю, Ин-Цянь; Го, Сяо; Сюй, Сяо-Шань; Гото, Масуо; Ли, Цзюнь-Кай; Чжан, Цзи-Ю; Ли, Го-Сюн (сентябрь 2018 г.). «Биологически активные хинолиновые и хиназолиновые алкалоиды часть II» . Обзоры медицинских исследований . 38 (5): 1614–1660. дои : 10.1002/мед.21492 . ISSN 0198-6325 . ПМК 6105521 . ПМИД 29485730 .
- ^ Асиф, М. Химические характеристики, синтетические методы и биологический потенциал производных хиназолина и хиназолинона , Международный журнал медицинской химии, идентификатор статьи 395637, 2014. дои : 10.1155/2014/395637
- ^ Морган, GT, изд. Аннотация статей . Журнал Химического общества. Лондон: Герни и Джексон, 1904. Печать.
- ^ Коннолли, Дэвид Дж.; Кьюсак, Деклан; О'Салливан, Тимоти П.; Гири, Патрик Дж. (2005). «Синтез хиназолинонов и хиназолинов». Тетраэдр . 61 (43): 10153–10202. дои : 10.1016/j.tet.2005.07.010 .
- ^ ВЛФ Армарего (1967). «Галогенохиназолины». В WLF Армарего (ред.). Химия гетероциклических соединений . стр. 11–38. дои : 10.1002/9780470186916.ch7 . ISBN 9780470186916 .
- ^ WLF Армарего (1967). «Хиназолин». В WLF Армарего (ред.). Химия гетероциклических соединений . Химия гетероциклических соединений: Серия монографий. стр. 11–38. дои : 10.1002/9780470186916.ch2 . ISBN 9780470186916 .
- ^ «Иресса (Гефитиниб)» (PDF) . Управление по контролю за продуктами и лекарствами США. 2 мая 2003 г.
- ^ Линч, Томас Дж.; Белл, Дафна В.; Сорделла, Рафаэлла; Гурубхагаватула, Сарада; Окимото, Росс А.; Брэнниган, Брайан В.; Харрис, Патрисия Л.; Хасерлат, Сара М.; Супко, Джеффри Г.; Халуска, Фрэнк Г.; Луи, Дэвид Н.; Кристиани, Дэвид С.; Сеттлман, Джефф; Хабер, Дэниел А. (20 мая 2004 г.). «Активация мутаций в рецепторе эпидермального фактора роста, лежащая в основе реакции немелкоклеточного рака легких на гефитиниб» (PDF) . НЭМ . 350 (21): 2129–39. дои : 10.1056/nejmoa040938 . ПМИД 15118073 .
- ^ Такимото Ч., Кальво Э. «Принципы онкологической фармакотерапии» в Паздуре Р., Вагман Л.Д., Кампхаузен К.А., Хоскинс В.Дж. (редакторы) Лечение рака: междисциплинарный подход . 11 изд. 2008.
- ^ «Лапатиниб» . Управление по контролю за продуктами и лекарствами США. 13 марта 2007 г.
- ^ Вуд Э.Р., Трусдейл А.Т., Макдональд О.Б., Юань Д., Хасселл А., Дикерсон Ш.Х., Эллис Б., Пенниси С. и др. (2004). «Уникальная структура рецептора эпидермального фактора роста, связанного с GW572016 (лапатиниб): взаимосвязь между конформацией белка, скоростью отключения ингибитора и активностью рецептора в опухолевых клетках» . Исследования рака . 64 (18): 6652–9. дои : 10.1158/0008-5472.CAN-04-1168 . ПМИД 15374980 .
- ^ Родригес, А. (апрель 2008 г.). Новый тип препарата значительно уменьшает первичные опухоли молочной железы всего за шесть недель; исследования приводят к появлению новой цели в лечении рака – раковых стволовых клеток . Архивировано из оригинала 26 ноября 2008 г.
- ^ Нельсон М.Х., Долдер Ч.Р. (февраль 2006 г.). «Лапатиниб: новый двойной ингибитор тирозинкиназы, обладающий активностью в отношении солидных опухолей». Энн Фармакотер . 40 (2): 261–9. дои : 10.1345/aph.1G387 . ПМИД 16418322 . S2CID 21622641 .
- ^ «Эрлотиниб» . Управление по контролю за продуктами и лекарствами США. 14 мая 2013 г.
- ^ Раймонд Э., Фавр С., Арманд Дж. (2000). «Тирозинкиназа рецептора эпидермального фактора роста как мишень для противораковой терапии» . Наркотики . 60 Приложение 1: 15–23, обсуждение 41–2. дои : 10.2165/00003495-200060001-00002 . ПМИД 11129168 . S2CID 10555942 .
- ^ «Афатиниб» . Управление по контролю за продуктами и лекарствами США. 12 июля 2013 г.