Декарбоксилирование

Декарбоксилирование – это химическая реакция , в ходе которой удаляется карбоксильная группа и выделяется углекислый газ (CO 2 ). Обычно под декарбоксилированием понимают реакцию карбоновых кислот , удаляющую атом углерода из углеродной цепи. Обратный процесс, который является первой химической стадией фотосинтеза , называется карбоксилированием , то есть присоединением CO 2 к соединению. Ферменты, катализирующие декарбоксилирование, называются декарбоксилазами или, более формальный термин, карбоксилазами ( номер ЕС 4.1.1).
В органической химии
[ редактировать ]Термин «декарбоксилирование» обычно означает замену карбоксильной группы ( −C(O)OH ) с атомом водорода :
- RCO 2 H → RH + CO 2
Декарбоксилирование — одна из старейших известных органических реакций. Предполагается, что это один из процессов, сопровождающих пиролиз и деструктивную дистилляцию .
карбаниона В целом декарбоксилирование зависит от стабильности синтона R. −
, [1] [2] хотя анион может и не быть настоящим химическим промежуточным продуктом . [3] [4] Обычно карбоновые кислоты декарбоксилируются медленно, но карбоновые кислоты с α -электроноакцепторной группой (например, β- кетокислоты , β-нитрилы, α- нитрокислоты или арилкарбоновые кислоты ) декарбоксилируются легко. Декарбоксилирование хлордифторацетата натрия приводит к образованию дифторкарбена :
- CF 2 ClCO 2 Na → NaCl + CF 2 + CO 2 [5]
Декарбоксилирование играет важную роль в синтезе малонового и ацетоуксусного эфира . позволяет Конденсация Кнёвенагеля кетокислотам служить стабилизирующей защитной группой для енолов карбоновых кислот . [6] [ нужна страница ] [4]
Для свободных кислот условия, которые депротонируют карбоксильную группу (возможно, протонируют электроноакцепторную группу с образованием цвиттер-ионного таутомера ), ускоряют декарбоксилирование. [7] Сильное основание является ключом к кетонизации , при которой пара карбоновых кислот объединяется с одноименной функциональной группой : [8] [3]
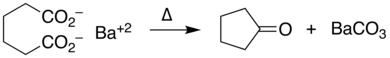
Соли переходных металлов , особенно меди , соединения [9] облегчают декарбоксилирование через промежуточные соединения карбоксилатного комплекса . Таким образом, металлы, которые катализируют реакции кросс-сочетания, рассматривают арилкарбоксилаты как синтон ариланиона; эта синтетическая стратегия представляет собой реакцию декарбоксилативного кросс-сочетания . [10]
При нагревании в циклогексаноне аминокислоты декарбоксилируются. В родственной реакции Хэммика некаталитическое декарбоксилирование пиколиновой кислоты дает стабильный карбен , который атакует карбонильный электрофил.
Окислительное декарбоксилирование обычно является радикальными реакциями. К ним относятся электролиз Кольбе и Хунсдикера - реакции Кочи . Декарбоксилирование Бартона — необычное радикально-восстановительное декарбоксилирование.
Как описано выше, большинство декарбоксилирования начинаются с карбоновой кислоты или ее соли щелочного металла, но декарбоксилирование Крапчо начинается с метиловых эфиров . В этом случае реакция начинается с галогенид -опосредованного отщепления сложного эфира с образованием карбоксилата.
В биохимии
[ редактировать ]Декарбоксилирование широко распространено в биологии. Их часто классифицируют по кофакторам, катализирующим трансформации. [11] Процессы, связанные с биотином, приводят к декарбоксилированию малонил-КоА в ацетил-КоА . Тиамин (Т:) является активным компонентом декарбоксилирования альфа-кетокислот , включая пируват:
- Т: + RC(O)CO 2 H → T=C(OH)R + CO 2
- Т=C(OH)R + R'COOH → Т! : + RC(O)CH(OH)R'
Пиридоксальфосфат способствует декарбоксилированию аминокислот. Флавин -зависимые декарбоксилазы участвуют в превращениях цистеина.Гидроксилазы железа действуют за счет восстановительной активации O 2 с использованием декарбоксилирования альфа-кетоглутарата в качестве донора электронов. Декарбоксилирование можно представить так:
- RC(O)CO 2 Fe O 2 → RCO 2 Fe{IV}=O + CO 2
- RCO 2 Fe=O + R'H → RCO 2 Fe + R'OH
Декарбоксилирование аминокислот
[ редактировать ]Обычными биосинтетическим окислительным декарбоксилированием в являются амины аминокислот :
- триптофан в триптамин
- фенилаланин в фенилэтиламин
- тирозин в тирамин
- гистидин в гистамин
- серин в этаноламин
- глутаминовая кислота в ГАМК
- лизин в кадаверин
- аргинин в агматин
- орнитин в путресцин
- 5-HTP в серотонин
- L-ДОФА в дофамин
Другие реакции декарбоксилирования цикла лимонной кислоты включают:
- пируват в ацетил-КоА (см. декарбоксилирование пирувата )
- оксалосукцинат в α- кетоглутарат
- α- кетоглутарат до сукцинил-КоА .
Синтез жирных кислот
[ редактировать ]
Синтез жирных кислот с прямой цепью происходит в результате повторяющихся реакций, включающих декарбоксилирование малонил-КоА . [12]
Тематические исследования
[ редактировать ]
При нагревании Δ9-тетрагидроканнабиноловая кислота декарбоксилируется с образованием психоактивного соединения Δ9- тетрагидроканнабинол . [13] Когда каннабис нагревается в вакууме, декарбоксилирование тетрагидроканнабиноловой кислоты (THCA), по-видимому, подчиняется кинетике первого порядка . Логарифмическая доля присутствующего THCA неуклонно снижается с течением времени, и скорость уменьшения варьируется в зависимости от температуры. При увеличении температуры на 10 градусов от 100 до 140 ° C половина THCA расходуется за 30, 11, 6, 3 и 2 минуты; следовательно, константа скорости соответствует закону Аррениуса и находится в диапазоне от 10 −8 и 10 −5 в линейной логарифмической зависимости с обратной температурой. Однако моделирование декарбоксилирования салициловой кислоты молекулой воды показало, что барьер активации составляет 150 кДж/моль для одной молекулы в растворителе, что слишком высоко для наблюдаемой скорости. Таким образом, был сделан вывод, что эта реакция, проводимая в твердой фазе в растительном материале с высокой долей карбоновых кислот, следует кинетике псевдопервого порядка, при которой соседняя карбоновая кислота осаждается, не влияя на наблюдаемую константу скорости. Возможны два переходных состояния, соответствующие непрямому и прямому кето-енольному пути, с энергиями 93 и 104 кДж/моль. Оба промежуточных соединения включают протонирование альфа -углерода , разрывая одну из двойных связей ароматического кольца и позволяя бета-кетогруппе (которая принимает форму енола в THCA и THC) участвовать в декарбоксилировании. [14]
В напитках, хранящихся в течение длительного времени, очень небольшие количества бензола могут образовываться из бензойной кислоты в результате декарбоксилирования, катализируемого присутствием аскорбиновой кислоты . [15]
добавление каталитических количеств циклогексенона Сообщалось, что катализирует декарбоксилирование аминокислот . [16] Однако использование таких катализаторов может также привести к появлению некоторого количества нежелательных побочных продуктов.
Ссылки
[ редактировать ]- ^ Марч, Джерри (1985), Продвинутая органическая химия: реакции, механизмы и структура, 3-е издание , Нью-Йорк: Wiley, ISBN 9780471854722 , OCLC 642506595
- ^ «Декарбоксилирование, доктор Ян А. Хант, химический факультет Университета Калгари» . Архивировано из оригинала 21 декабря 2022 г. Проверено 7 декабря 2008 г.
- ^ Jump up to: а б Ренц, М. (2005). «Кетонизация карбоновых кислот путем декарбоксилирования: механизм и область применения» (PDF) . Евро. Дж. Орг. Хим . 2005 (6): 979–988. doi : 10.1002/ejoc.200400546 – через Веспиарий.
- ^ Jump up to: а б «Синтез малонового эфира» . Портал органической химии . Проверено 26 октября 2007 г.
- ^ Ташнер, Майкл Дж. (2001). «Натрия хлордифторацетат». Энциклопедия реагентов для органического синтеза . дои : 10.1002/047084289X.rs058 . ISBN 0-471-93623-5 .
- ^ Органический синтез: подход к отключению , 2 nd ред.
- ^ Джим Кларк (2004). «Декарбоксилирование карбоновых кислот и их солей» . Химгид . Проверено 22 октября 2007 г.
- ^ Торп, Дж. Ф.; Кон, ГАР (1925). «Циклопентанон». Орг. Синтез . 5 : 37. дои : 10.15227/orgsyn.005.0037 .
- ^ Уайли, Ричард Х.; Смит, Ньютон Р. (1953). «м-Нитростирол» . Органические синтезы . 33:62 . дои : 10.15227/orgsyn.033.0062 .
- ^ Уивер, доктор медицинских наук; Ресио, А.; Греннинг, Эй Джей; Тунге, Дж. А. (2011). «Реакции декарбоксилативного аллилирования и бензилирования, катализируемые переходными металлами» . хим. Преподобный . 111 (3): 1846–1913. дои : 10.1021/cr1002744 . ПМК 3116714 . ПМИД 21235271 .
- ^ Ли, Т.; Хо, Л.; Пулли, К.; Лю, А. (2012). «Механизмы декарбоксилирования в биологической системе. Биоорганическая химия». Биоорганическая химия . 43 : 2–14. дои : 10.1016/j.bioorg.2012.03.001 . ПМИД 22534166 .
- ^ «Жирные кислоты: насыщенные с прямой цепью, структура, возникновение и биосинтез» . Lipidlibrary.aocs.org . Липидная библиотека, Американское общество химиков-нефтяников. 30 апреля 2011 г. Архивировано из оригинала 21 июля 2011 г.
- ^ Перротен-Брюнель, Элен; Буйс, Вим; Спронсен, Яап ван; Роосмален, фургон Мааике Дж.Э.; Питерс, Кор Дж.; Верпорте, Роб; Виткамп, Герт-Ян (2011). «Декарбоксилирование Δ9-тетрагидроканнабинола: кинетика и молекулярное моделирование». Журнал молекулярной структуры . 987 (1–3): 67–73. Стартовый код : 2011JMoSt.987...67P . doi : 10.1016/j.molstruc.2010.11.061 .
- ^ Перротен-Брюнель, Элен; Буйс, Вим; Спронсен, Яап ван; Роосмален, фургон Мааике Дж.Э.; Питерс, Кор Дж.; Верпорте, Роб; Виткамп, Герт-Ян (февраль 2011 г.). «Декарбоксилирование Δ9-тетрагидроканнабинола: кинетика и молекулярное моделирование» . Журнал молекулярной структуры . 987 (1–3): 67–73. Стартовый код : 2011JMoSt.987...67P . doi : 10.1016/j.molstruc.2010.11.061 .
- ^ «Данные о бензоле в безалкогольных и других напитках» . Архивировано из оригинала 26 марта 2008 г. Проверено 26 марта 2008 г.
- ^ Хасимото, Мицунори; Эда, Ютака; Осанаи, Ясутомо; Иваи, Тошиаки; Аоки, Сейичи (1986). «Новое декарбоксилирование α-аминокислот. Простой метод декарбоксилирования с использованием 2-циклогексен-1-она в качестве катализатора». Химические письма . 15 (6): 893–896. дои : 10.1246/кл.1986.893 .