Декарбоксильное кросс-сочетание
декарбоксилативного кросс-сочетания Реакции представляют собой химические реакции , в которых карбоновая кислота реагирует с органическим галогенидом с образованием новой углерод-углеродной связи, сопровождающейся потерей CO 2 . Участвуют арил- и алкилгалогениды . металлический катализатор , основание и окислитель Требуются .
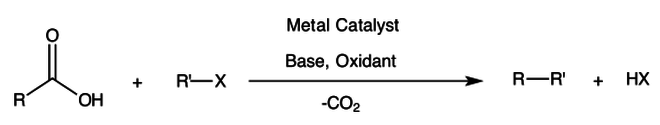
Существенным преимуществом этой реакции является то, что в ней используются относительно недорогие карбоновые кислоты (или их соли) и она гораздо менее чувствительна к воздуху и влаге по сравнению с типичными металлоорганическими реагентами кросс-сочетания. Более того, карбоксильная группа является общей особенностью натуральных продуктов и может быть также получена путем относительно щадящего окисления на воздухе . Дополнительные преимущества включают широкую толерантность к функциональным группам , а также возможность избежать использования сильных оснований . Важным элементарным этапом в этой реакции является протодекарбоксилирование или металлирование, в ходе которого связь C–COOH сначала превращается в связь C–H или C–M соответственно. [ 1 ]
История и развитие катализатора
[ редактировать ]Медные монометаллические системы
[ редактировать ]Первой описанной реакцией декарбоксилирующего кросс-сочетания была реакция Ульмана , проведенная в 1966 году Нильссоном и др. термическое декарбоксилирование бензоатов меди в присутствии арилгалогенида приводит к образованию (как симметричных, так и несимметричных) биарилов через промежуточные соединения арил-Cu. Было обнаружено, что [ 2 ]

Эта монометаллическая медная система требовала резких условий для полного кросс-сочетания и имела различные внутренние ограничения, оба из которых препятствовали развитию каталитической , подготовительной версии этой реакции. [ 3 ] Лишь в 2009 году Лю и Шан и др. обнаружили, что декарбоксилирующее кросс-сочетание арилбромидов и йодидов с полифторбензоатами калия может быть достигнуто с использованием монометаллического йодида меди в качестве катализатора. Было установлено, что стадия окислительного присоединения является лимитирующей стадией цикле , состоящем только из меди в каталитическом (в отличие от катализируемой Pd декарбоксилирующей кросс-сочетания ). [ 4 ]

Также было обнаружено, что системы, содержащие только Cu (I), способствуют связыванию алкинилкарбоновых кислот с арилгалогенидами (см. Арилалкины ниже), а также декарбоксилативному дегидрогенативному перекрестному сочетанию аминокислот с алкинами (или подобными нуклеофилами ). [ 5 ] [ 6 ]

Катализаторы декарбоксилативного кросс-сочетания имеют общую форму ML2 с широким спектром типов лигандов, оптимизированных для разных субстратов. Медные (и серебряные ) центры часто образуют комплексы с фенантролинами , и сообщается, что активность увеличивается с богатыми электронами заместителями на лигандах. [ 1 ]
Палладиевые монометаллические системы
[ редактировать ]В 2000 году Стеглих и др. сообщили о внутримолекулярной реакции декарбоксилативного кросс-сочетания, опосредованной Pd(II), при синтезе ламелларина L. [ 7 ] Майерс и др. сообщили о декарбоксилирующем олефинировании орто -замещенных аренкарбоксилатов в присутствии окислителя ( Ag2CO3) в 2002 году. [ 8 ]

Последующие исследования показали, что гомогенные палладийные катализаторы способны декарбоксилировать кислоты при более низких температурах, чем их аналоги из меди и серебра, но ограничиваются обогащенными электронами орто -замещенными ароматическими карбоновыми кислотами. [ 9 ] [ 10 ] Несмотря на это, палладиевые катализаторы способны стимулировать широкий спектр реакций кросс-сочетания, включая образование биарила и образование арилалкина, а также множество реакций кросс-сочетания, в которых карбоновая кислота не связана с ароматическим соединением. [ 5 ] [ 11 ] [ 12 ] Другие реакции кросс-сочетания декарбоксилирования, катализируемые Pd, включают получение сопряженных диенов (см. Диены и триены ниже) и реакции дегидрирования (с различными комбинациями субстратов и катализаторов ). [ 1 ] [ 13 ]

В отличие от систем, содержащих только медь , декарбоксилирующее палладирование является стадией, лимитирующей скорость в каталитическом цикле палладия. [ 4 ]

Биметаллические системы палладий-медь
[ редактировать ]Биметаллическая система Pd-Cu не была открыта до 2006 года, когда Goossen et al. сообщили о декарбоксилирующей кросс-сочетании арилгалогенидов с орто -замещенными ароматическими карбоновыми кислотами. [ 14 ] В ходе последующих исследований было обнаружено, что использование арилтрифлатов позволило расширить диапазон субстратов для кросс-сочетания до некоторых ароматических карбоксилатов, лишенных какого-либо орто -замещения (менее реакционноспособных). Это было результатом того, что любой галогенид-анион, образующийся в реакции, ингибировал катализируемый Cu процесс декарбоксилирования. [ 15 ] Дальнейшая оптимизация системы и условий катализатора сделала декарбоксилирующую кросс-сочетание с использованием биметаллических систем Pd–Cu применимой в органическом синтезе, преимущественно при образовании биарилов. [ 3 ] Кроме того, изменчивость этой комбинированной каталитической системы позволяет стимулировать широкий спектр реакций, включая образование арилкетона, кросс-сочетание c-гетероатома и многие другие. [ 1 ]

Биметаллические системы палладий–серебро.
[ редактировать ]Находясь в одной группе с медью, биметаллические системы Pd–Ag(I) по своей сути подобны каталитическим системам Pd–Cu. Однако соли серебра лучше подходят для протодекарбоксилирования карбоновых кислот, чем их медные эквиваленты, что обеспечивает более мягкие условия реакции в циклах Pd-Ag по сравнению с циклами Pd-Cu. [ 16 ] Также сообщалось о монометаллических системах, катализируемых Ag (I). Их эффективность (по сравнению с медью ), вероятно, объясняется более низкой электроотрицательностью и большим расширением d-орбиталей , которые способствуют декарбоксилированию субстрата. [ 17 ] Одним из ограничений этой комбинации катализаторов является то, что соли серебра будут образовывать нерастворимые галогениды серебра, в результате чего для реакции потребуется стехиометрическое количество Ag, если галогениды присутствуют. Это препятствие было преодолено Гусеном и др. в 2010 году с использованием арилтрифлатов , о каталитической реакции с арилсульфонатами . а также сообщалось [ 3 ] [ 18 ]

Ассортимент продукции за счет разнообразия подложек
[ редактировать ]Область продуктов этой реакции чрезвычайно широка при использовании различных субстратов; однако разработка различных функциональных возможностей потребовала сопутствующих исследований для определения подходящей каталитической системы. Наиболее типичный класс реакций включает взаимодействие связей C–COOH и C–X, однако кросс-сочетание C–COOH и C–M, гомосочетание карбоновых кислот, сочетание Хека и дегидрирующее кросс-сочетание также могут быть включены в этот класс, поскольку они выделяют CO 2 . Также были продемонстрированы реакции кросс-сочетания гетероатомов с образованием связей C–N, C–S, C–P и C–X. [ 1 ]
Биарильное образование
[ редактировать ]Согласно ИЮПАК, термин «биарил» относится к совокупности двух ароматических колец, соединенных одинарной связью. [ 19 ] начиная с самого простого, бифенила . Биарилы представляют собой важный структурный мотив, представляющий физический органический, синтетический и каталитический интерес — например, лежащий в основе области атропоизомеров в энантиоселективном синтезе — и они появляются во многих фармацевтических, агрохимических и материальных приложениях (например, ЖК). [ нужна ссылка ] Пример реакции сочетания, использованной при их получении, является альтернативой традиционным реакциям кросс-сочетания Сузуки и Стилле, и для этого преобразования использовались различные катализаторы; Гуссен и др. сообщили об образовании биарилов в результате реакций кросс-сочетания, катализируемых палладием и медью, арил- или гетероарилкарбоновой кислоты и арилгалогенида (I, Br или Cl) в присутствии основания. [ 20 ]

Арилалкины
[ редактировать ]Арилалкины обычно получают с использованием реакции Соногаширы, которая представляет собой катализируемую палладием реакцию перекрестного сочетания концевых алкинов и арилгалогенидов. По сравнению с концевыми алкинами преимущества алкинкарбоновых кислот заключаются в простоте обращения и хранения. О первом декарбоксилирующем сочетании алкинкарбоновых кислот сообщил в 2008 году С. Ли. В качестве источника алкинов они использовали пропиоловую кислоту. Год спустя С. Ли применил реакции декарбоксильного сочетания к 2-октиновой кислоте и фенилпропиоловой кислоте. В 2010 году Сюэ и др. сообщили о сочетании арилгалогенида и алкинилкарбоновой кислоты в мягких условиях реакции и катализаторе, состоящем только из меди, с получением арилалкинов.

Арилкетоны
[ редактировать ]Дальнейшая работа Goossen et al. описал синтез кетонов из α-оксокарбоновых кислот с арил- или гетероарилбромидами через промежуточный ациланион. [ 25 ]

Ариловые эфиры
[ редактировать ]Шан и др. открыл декарбоксилирующее сочетание моноэфиров оксалата калия с арилгалогенидами с получением ариловых или алкениловых эфиров. [ 5 ]

сп 3 С-карбоновые кислоты
[ редактировать ]Многие реакции декарбоксилативного кросс-сочетания включают разрыв sp. 2 Связи C–COOH и sp C–COOH, поэтому последующие исследования попытались сделать возможной перекрестную связь с sp 3 С-карбоновые кислоты. Одна из таких реакций Shang et al. описал катализируемую палладием перекрестную реакцию, которая позволяет образовывать функционализированные пиридины, пиразины, хинолины, бензотиазолы и бензоксазолы. Обнаружено, что положение атома азота в положении «2» относительно связи является необходимым, что предполагает его связывание с Pd в переходном состоянии. [ 26 ]
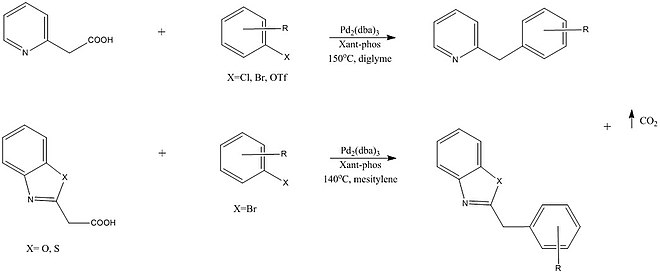
Диены и триены
[ редактировать ]Миура и др. сообщили о перекрестном сочетании винилбромидов с алкенилкарбоновой кислотой с использованием палладиевого катализатора. Сообщалось, что некоторые из полученных сопряженных диенов проявляют флуоресценцию в твердом состоянии. [ 27 ]
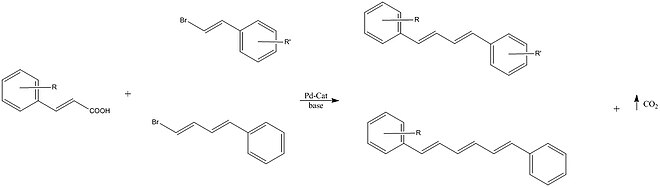
Олефины через тип Хека
[ редактировать ]Декарбоксилирующее соединение Хека, проведенное Su et al. может быть использован для получения арилолефина с использованием бензохинона в качестве окислителя. [ 28 ]

Производные фенантрена
[ редактировать ]Ван и др. предложил новый метод аннуляции [4+2] посредством межмолекулярного пути, катализируемого палладием. Производные финансовые инструменты формируются с доходностью от умеренной до хорошей; акридин необходим для высокой эффективности реакции. [ 29 ]

Связь C – N
[ редактировать ]Цзяо и др. позволил образовать связь C–N посредством кросс-сочетания с использованием воздуха в качестве окислителя и медного катализатора. Условия кросс-связи C–N, приводящие к нарушению sp, неизвестны. 3 или сп 2 Связь С–СООН. [ 30 ]

CS-муфта
[ редактировать ]Лю и др. сообщили о сочетании CS арилкарбоновых кислот с дисульфидами или тиолами с использованием каталитической системы Pd/Cu. [ 31 ]

Муфта C–P
[ редактировать ]Используя катализаторы Pd–Cu или Cu Yang et al. сообщили о первом примере декарбоксилативного кросс-сочетания C–P. [ 32 ]

Муфта C – X
[ редактировать ]Ву и др. сообщили о перекрестном сочетании C–X с использованием CuX 2 (X = Br, Cl) и серебряного катализатора для получения арилгалогенидов. [ 33 ]

Механистические исследования
[ редактировать ]Декарбоксилативная типа Хека
[ редактировать ]В 2005 году Мейерс и др. Предложил следующий механизм реакции декарбоксилативного кросс-сочетания. [ 10 ] Начальным и определяющим скорость этапом является декарбоксилирование. Считается, что ипсо-углерод аренового кольца первоначально координируется с палладиевым центром, после чего происходит выброс углекислого газа с образованием арил-палладиевого промежуточного соединения. Затем олефин внедряется между ареном и палладиевым центром, который затем подвергается бета-элиминированию с образованием желаемого винилгалогенида, а также гидрида палладия. Этот протон отрывается карбонатом серебра, который действует как основание и окислитель, регенерируя исходный комплекс палладия, завершая каталитический цикл.

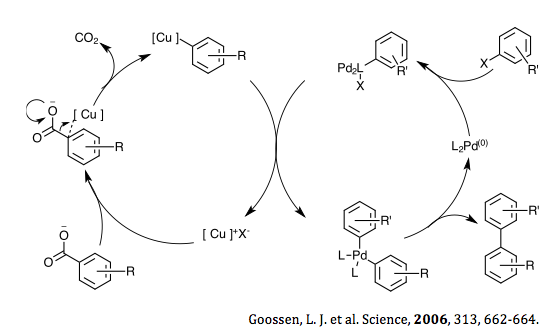
Синтез биарилов посредством окислительно-нейтрального декарбоксилирующего кросс-сочетания
[ редактировать ]В 2006 году Гуссен и др. предложил реакцию синтеза биарильных соединений посредством каталитического декарбоксильного кросс-сочетания. [ 34 ] Механизм включает два перекрывающихся цикла: один с использованием галогенида меди, а другой с использованием палладия. Стадия декарбоксилирования происходит между замещенной бензойной кислотой и галогенидом меди с образованием промежуточных арилсодержащих меди. Палладий первоначально подвергается окислительному присоединению из арилгалогенида с образованием арильного комплекса Pd(II). После обеих этих начальных стадий замещенный арилмеди подвергается трансметаллированию комплексом палладия. На этом этапе образуется галогенид меди, который затем подвергается анионному обмену с замещенной бензойной кислотой с образованием промежуточного арилмедного соединения, продолжая каталитический цикл. Другой комплекс, образующийся на стадии транс-металлирования, представляет собой бис-арил палладия (II), который затем подвергается восстановительному отщеплению с образованием желаемых бис-арильных частиц, а также исходного комплекса Pd (0), завершая, таким образом, каталитический цикл.
Соединение гетероароматической кислоты
[ редактировать ]Форджионе П., Билодо Ф. и др. сообщили, что гетероатомы, содержащие карбоновую кислоту, также переносятся монометаллическими системами палладия и подвергаются декарбоксилированному перекрестному сочетанию с арилгалогенидами. [ 35 ] В предлагаемом механизме начальным этапом является окислительное присоединение арилгалогенида с образованием промежуточного арил-палладия. Затем происходит электрофильное палладирование по углероду-3 гетероатома. Из этого промежуточного продукта есть два возможных пути продолжения цикла. Первый — это миграция палладия от углерода-3 к углероду-2 вместе с выбросом углекислого газа. При этом образуется промежуточное соединение арил-палладий-гетероатом, которое подвергается восстановительному отщеплению с образованием конечного гетероароматического соединения. Второй путь имеет место только тогда, когда R является протоном. В этом случае происходит депротонирование для восстановления ароматичности гетероатома. Затем это промежуточное соединение подвергается восстановительному элиминированию, связывая арил с положением углерода-3 гетероатома. Поскольку это соединение все еще содержит карбоновую кислоту, оно затем может снова войти в каталитический цикл, где оно подвергается связыванию по положению углерода 2 вместе с выделением диоксида углерода с образованием биарильного гетероатома. Поскольку этот путь конкурирует со стадией декарбоксилирования, образуются два продукта, что делает эту реакцию менее селективной. В результате гетероатомы, которые замещены в положении углерода 3, являются более предпочтительными из-за более высокого уровня контроля, который они обеспечивают.

Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и Шан Р., Лю Л. Реакции декарбоксилативного кросс-сочетания, катализируемые переходными металлами. Science China-Chemistry , 2011 , 11 , 54: 1670–1687 DOI: 10.1007/s11426-011-4381-0
- ^ Нильссон М. Новый синтез биарилов, иллюстрирующий связь между синтезом биарилов Ульмана и декарбоксилированием, катализируемым медью. Acta Chem Scand , 1966 , 20: 423–426. DOI: 10.3891/acta.chem.scand.20-0423.
- ^ Перейти обратно: а б с Родригес Н., Гуссен Л. Реакции декарбоксилативного сочетания: современная стратегия образования связи C–C. Chem Soc Rev , 2011 , 40:5030–5048. DOI: 10.1039/C1CS15093F
- ^ Перейти обратно: а б Шан Р., Фу И., Ван Ю., Сюй К., Ю Х.З., Лю Л. Катализируемое медью декарбоксилирующее кросс-сочетание полифторбензоатов калия с арилиодидами и бромидами. Angew Chem Int Ed , 2009 , 48: 9350–9354. DOI:10.1002/anie.200904916
- ^ Перейти обратно: а б с Шан Р., Фу Ю, Ли Дж.Б., Чжан С.Л., Го QX, Лю Л. Синтез ароматических эфиров посредством Pd-катализируемого декарбоксилационного сочетания моноэфиров оксалата калия с арилбромидами и хлоридами. J Am Chem Soc , 2009 , 131: 5738–5739 DOI: 10.1021/ja900984x
- ^ Би Х.П., Чжао Л., Лян Ю.М., Ли CJ. Катализируемое медью декарбоксильное связывание sp3-гибридизированных атомов углерода α-аминокислот. Angew Chem Int Ed , 2009 , 48: 792–795 DOI: 10.1002/anie.200805122
- ^ Пешко С., Винкльхофер С., Стеглих В. Биомиметический полный синтез ламелларина l путем соединения двух разных единиц арилпировиноградной кислоты. Chem Eur J , 2000 , 6: 1147–52 DOI: 10.1002/(SICI)1521-3765(20000403)6:7<1147::AID-CHEM1147>3.0.CO;2-1
- ^ Майерс А.Г., Танака Д., Мэннион М.Р. Разработка реакции декарбоксилативного палладирования и ее использование в олефинировании аренкарбоксилатов по Хеку. J Am Chem Soc , 2002 , 124: 11250–51 DOI: 10.1021/ja027523m
- ^ Дикштейн Дж.С., Малруни Калифорния, О'Брайен Э.М., Морган Б.Дж., Козловски MC. Развитие каталитической реакции декарбоксилирования ароматических соединений. Org Lett , 2007 , 9: 2441–44 DOI: 10.1021/ol070749f
- ^ Перейти обратно: а б Мейерс и др. О механизме катализируемого палладием(II) декарбоксилативного олефинирования аренкарбоновых кислот. Кристаллографическая характеристика нефосфиновых интермедиатов палладия(II) и наблюдение их ступенчатого превращения в процессах типа Хека JACS, 2005, 127, 10323–33 DOI: 10.1021/ja052099l
- ^ Чжан WW, Чжан XG, Ли Дж.Х. Катализируемое палладием декарбоксилирующее сочетание алкинилкарбоновых кислот с бензилгалогенидами или арилгалогенидами . J Org Chem , 2010 , 75: 5259–5264. DOI: 10.1021/jo1010284.
- ^ Юнг П.Ю., Чунг К.Х., Квонг Ф.Ю. Палладий-катализируемое декарбоксилирующее арилирование цианоацетата калия: синтез α-диарилнитрилов из арилгалогенидов. Org Lett , 2011 , 13: 2912–15 DOI: 10.1021/ol2009522
- ^ Ямасита М., Хирано К., Сато Т., Миура М. Синтез α,ω-диарилбутадиенов и гексатриенов посредством декарбоксилационного сочетания коричных кислот с винилбромидами при катализе палладием. Org Lett , 2010 , 12: 592–95 DOI: 10.1021/ol9027896
- ^ Гуссен Л.Дж., Дэн Г.Дж., Леви Л.М. Синтез биарилов путем каталитического декарбоксилирующего сочетания. Наука , 2006 , 313: 662–64 DOI: 10.1126/science.1128684
- ^ Гуссен Л. Дж., Родриуэс Н., Линдер К. Декарбоксилативный синтез биарилов из ароматических карбоксилатов и арилтрифлатов. J Am Chem Soc , 2008 , 130: 15248–49 DOI: 10.1021/ja8050926
- ^ Гуссен Л.Дж., Родригес Н., Линдер С., Ланге П.П., Фромм А. Сравнительное исследование катализируемого медью и серебром протодекарбоксилирования карбоновых кислот. ChemCatChem , 2010 , 2: 430–42 DOI: 10.1002/cctc.200900277
- ^ Лу П., Санчес С., Корнелла Дж., Ларроса И. Катализируемое серебром протодекарбоксилирование гетероароматических карбоновых кислот. Org Lett , 2009 , 11: 5710–5713 DOI:10.1021/ol902482p
- ^ Гуссен Л.Дж., Ланге П.П., Родригес Н., Линдер К. Низкотемпературное декарбоксилирующее кросс-сочетание, катализируемое Ag/Pd, арилтрифлатов с ароматическими карбоксилатными солями. Chem Eur J , 2010 , 16: 3906–09 DOI: 10.1002/chem.200903319
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Сборка колец ». дои : 10.1351/goldbook.R05393
- ^ Гуссен Л.Дж., Родригес Н., Мельцер Б., Линдер С., Денг Г.Дж., Леви Л.М. Синтез биарилов путем декарбоксилирующего сочетания ароматических карбоксилатов с арилгалогенидами, катализируемого Pd. J Am Chem Soc , 2007 , 129: 4824–33 DOI: 10.1021/ja068993+
- ^ Парк, К. Ли, С. Реакции декарбоксилативного сочетания алкинилкарбоновых кислот, катализируемые переходными металлами, RSC Advances 2013 , 3: 14165-14182 DOI: 10.1039/C3RA41442F
- ^ Мун, Дж. Чон, М. Нам, Х. Джу, Дж. Мун, Дж. Х. Юнг, Х. М. Ли, С. Синтез диарилалкинов в одном горшке с использованием катализируемой палладием реакции Соногаширы и декарбоксилирующего связывания sp углерода и sp2 углерода Org. Летт. , 2008 , 10: 945–948. DOI: 10.1021/ol703130y
- ^ Мун, Дж. Джанг, М. Ли, С. Катализируемое палладием декарбоксилирующее соединение алкинилкарбоновых кислот и арилгалогенидов J. Org. хим. , 2009 , 74: 1403-1406.. DOI: 10.1021/jo802290r
- ^ Чжао Д.Б., Гао С., Су XY, He YQ, Ю Дж.С., Сюэ Ю. Катализируемое медью декарбоксилирующее кросс-сочетание алкинилкарбоновых кислот с арилгалогенидами. Chem Commun , 2010 , 46: 9049–51 DOI: 10.1039/c0cc03772a
- ^ Гуссен Л.Дж., Рудольфи Ф., Оппель С., Родригес Н. Синтез кетонов из α-оксокарбоксилатов и арилбромидов путем декарбоксилирующего кросс-сочетания, катализируемого Cu/Pd. Angew Chem Int Ed , 2008 , 47: 3043–3045 DOI: 10.1002/anie.200705127
- ^ Шан Р., Ян З.В., Ван Ю, Чжан С.Л., Лю Л. Катализируемый палладием декарбоксильные реакции 2-(2-азаарил)ацетатов с арилгалогенидами и трифлаты. J Am Chem Soc , 2010 , 132: 14391–93 DOI:10.1021/ja107103b
- ^ Ямасита М., Хирано К., Сато Т., Миура М. Синтез α,ω-диарилбутадиены и гексатриены посредством декарбоксилирующего сочетания коричных кислот с винилбромидами в условиях палладиевого катализа. Org Lett , 2010 , 12: 592–95 DOI: 10.1021/ol9027896
- ^ Ху П., Кан Дж., Су В., Хун М. Pd(O2CCF3)2/бензохинон: универсальный Каталитическая система декарбоксилативного олефинирования арена карбоновые кислоты. Org Lett , 2009 , 11: 2341–44 DOI: 10.1021/ol9007553
- ^ Ван С.И., Ракшит С., Глориус Ф. Межмолекулярная связь, катализируемая палладием декарбоксильное сочетание 2-фенилбензойных кислот с алкинами через Активация связей CH и CC. J Am Chem Soc , 2010 , 132: 14006– 14008DOI: 10.1021/ja106130r
- ^ Цзя В., Цзяо Н. Cu-катализируемое окислительное амидирование пропиоловых кислот на воздухе посредством декарбоксильной связи. ОргПисьмо , 2010 , 12:2000– 03 DOI: 10.1021/ol1004615
- ^ Дуань З.Ю., Ранджит С., Чжан П.Ф., Лю С.Г. Синтез арилсульфидов методом декарбоксильные кросс-сочетания CS. Chem Eur J , 2009 , 15: 3666–3669 DOI:10.1002/chem.200900133
- ^ Ху Дж, Чжао Н, Ян Б, Ван Г, Го ЛН, Лян ЮМ, Ян СД. Катализируемое медью сочетание C–P посредством декарбоксилирования. Chem Eur J , 2011 , 17: 5516–5521 DOI: 10.1002/chem.201003561
- ^ Луо Ю, Пан XL, Ву Дж. Декарбоксилирующее галогенирование карбоновых кислот, катализируемое серебром. Tetrahedron Lett , 2010 , 51: 6646–48 DOI: 10.1016/j.tetlet.2010.10.054
- ^ Лукас Дж. Гуссен и др. Синтез биарилов посредством каталитического декарбоксилативного сочетания, Science 313, 662 (2006), DOI: 10.1126/science.1128684
- ^ Форджионе, П., Билодо. Ф. и др. Неожиданная межмолекулярная реакция перекрестного сочетания, катализируемая Pd, с использованием гетероароматических карбоновых кислот в качестве партнеров сочетания J. Am. хим. Социум, 2006, 128 (35), стр. 11350–51 DOI: 10.1021/ja063511f