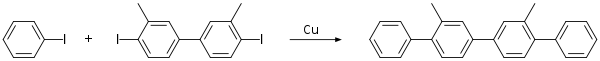
Реакция Ульмана
| Реакция Ульмана | |
|---|---|
| Назван в честь | Фриц Ульманн |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| Портал органической химии | реакция Ульмана |
| RSC Идентификатор онтологии | RXNO: 0000040 |
Реакция Ульмана или сочетание Ульмана , названная в честь Фрица Ульмана , соединяет две арильные или алкильные группы с помощью меди. Впервые о реакции сообщили Ульманн и его ученик Белецкий в 1901 году. Позже было показано, что палладий и никель также можно эффективно использовать. [1] [2]

Образование арил-ариловой связи является фундаментальным инструментом в современном органическом синтезе, который применяется в синтезе натуральных продуктов, фармацевтике , агрохимии , а также в разработке коммерческих красителей и полиароматических соединений . Реакция Ульмана, имеющая более чем вековую историю, была одной из первых, в которой использовался переходный металл, в первую очередь медь, в более высоких степенях окисления. Несмотря на значительные последствия биарильного сочетания в промышленности, реакция Ульмана на раннем этапе своего развития столкнулась с рядом проблем. Однако в наше время интерес к реакции Ульмана возродился из-за ряда преимуществ меди перед другими каталитическими металлами.
Механизм
[ редактировать ]Механизм реакции Ульмана широко изучен. Электронный спиновый резонанс исключает радикальное промежуточное соединение. Это было подтверждено в серии экспериментов, проведенных в 2008 году Хартвигом и его коллегами. [3] Последовательность окислительного присоединения / восстановительного отщепления, наблюдаемая для палладиевых катализаторов, маловероятна для меди, поскольку медь (III) наблюдается редко. Реакция, вероятно, включает образование медьорганического соединения (RCuX), которое реагирует с другим арильным реагентом в результате нуклеофильного ароматического замещения . Были предложены альтернативные механизмы, такие как метатезис σ-связи . [4] [5] [6] Упрощенный механизм, показанный ниже, является общепринятым. [7]
Объем
[ редактировать ]Фриц Ульман и его ученик Белецкий первыми сообщили о реакции. [8] Этот новаторский результат был первым, который показал, что переходный металл может способствовать образованию арильной связи углерод-углерод.
Типичным примером классической биарильной реакции Ульмана является превращение орто - хлорнитробензола в 2,2'-динитродифенил сплавом и бронзы меди . [9] [10]
- 2 C 6 H 4 (NO 2 )Cl + 2 Cu → (C 6 H 4 (NO 2 )) 2 + 2 CuCl
Реакция была применена к довольно сложным субстратам.
Традиционная версия реакции Ульмана требует стехимоэтических эквивалентов меди, жестких условий реакции, а реакция имеет репутацию нестабильного выхода. Таким образом, традиционная реакция Ульмана имела плохую экономию атомов и давала токсичный CuI . Из-за этих проблем было введено множество улучшений и альтернативных процедур. [11] [12] [13]
Классическая реакция Ульмана ограничена арилгалогенидами с дефицитом электронов (отсюда и приведенный выше пример 2-нитрофенилхлорида) и требует жестких условий реакции. Современные варианты реакции Ульмана с использованием палладия и никеля расширили спектр субстратов реакции и сделали условия реакции более мягкими. Однако урожайность, как правило, все еще умеренная. [14] В органическом синтезе эту реакцию часто заменяют реакциями сочетания палладия ( реакция Хека , реакция Хиямы , реакция Соногаширы ).
Бифенилены были получены ранее с разумными выходами, используя ион 2,2-дииодбифенила или 2,2-дииодбифенилония в качестве исходного материала.
Замыкание пятичленных колец происходит проще, но с использованием этого подхода были созданы и более крупные кольца.

- Современные разработки также включают использование гетерогенных медных катализаторов и наночастиц . Это очень желательно, поскольку катализатор можно легко отделить от продуктов, что снижает отходы и стоимость. [15] В случае наночастиц меди каталитическая активность зависела от их размера и образования агрегатов.
Бидентатные лиганды для соединения Ульмана
[ редактировать ]Примерно в 2000 году было обнаружено, что различные бидентатные лиганды повышают эффективность реакции Ульмана. Бидентатные лиганды обеспечивают более мягкие условия реакции и более высокую толерантность к функциональным группам. Они включали аминокислоты, оксины , основания Шиффа и многие другие бидентаты OO или NN. [16] [17] [18] Эти первоначальные бидентатные системы повысили практичность реакций Ульмана, но все же имели недостатки. Требовалась высокая концентрация меди и лиганда, а активация заведомо сложного арилхлорида все еще была невозможна. Эти проблемы были решены в 2015 году с разработкой специальных щавелевых диаминовых лигандов, что сделало реакцию Ульмана жизнеспособной для промышленного применения. [19]
Несимметричные и асимметричные муфты
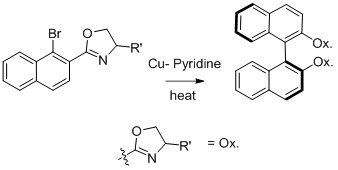
[ редактировать ]Синтез биарильных соединений Ульмана можно использовать для получения хиральных продуктов из хиральных реагентов. [20] Нельсон и его коллеги работали над синтезом асимметричных биарильных соединений и получили термодинамически контролируемый продукт. [20]
Диастереомерное соотношение продуктов усиливается за счет более объемных групп R во вспомогательной оксазолиновой группе.
Несимметричные реакции Ульмана реализуются редко, но они достигаются, когда один из двух сочетающих компонентов находится в избытке. [12]
Реакция имидазола Ульмана
[ редактировать ]Реакция Ульмана ограничена арилгалогенидами с дефицитом электронов и требует жестких условий реакции. В органическом синтезе эту реакцию часто заменяют реакциями сочетания палладия, такими как реакция Хека , реакция Хиямы и реакция Соногаширы.
В варианте реакции Ульмана β- взаимодействует бромстирол с имидазолом в ионной жидкости , такой как тетрафторборат 1-бутил-3-метилимидазолия, с образованием N- стирилимидазола. [21] Для реакции требуется L- пролин в дополнение к йодиду меди в качестве катализатора.

Промышленное применение
[ редактировать ]Водные реакции Ульмана использовались в масштабах пилотной установки. [22]
См. также
[ редактировать ]- Конденсация Ульмана - превращение арилгалогенидов в простые эфиры, промотируемое медью, также разработанное Фрицем Ульманом.
- Тиофен-2-карбоксилат меди (I) , реагент меди, используемый в реакции Ульмана.
- Реакция Вюрца-Фиттига , аналогичная реакция, полезная для синтеза алкилбензолов.
Ссылки
[ редактировать ]- ^ Инь; Либшер, Юрген (1 января 2007 г.). «Реакции углерод-углеродного взаимодействия, катализируемые гетерогенными палладиевыми катализаторами» . Химические обзоры . 107 (1): 133–173. дои : 10.1021/cr0505674 . ISSN 0009-2665 .
- ^ Нельсон, Тодд Д.; Крауч, Р. Дэвид (23 ноября 2004 г.). «Реакции гомосочетания, опосредованные Cu-, Ni- и Pd, в синтезе биарилов: реакция Ульмана» . ХимИнформ . 35 (51). дои : 10.1002/chin.200451250 . ISSN 0931-7597 .
- ^ Тай, Джесси В.; Вэн, Чжицян; Джонс, Адам М.; Инкарвито, Кристофер Д.; Хартвиг, Джон Ф. (1 июля 2008 г.). «Медные комплексы анионных азотных лигандов при амидировании и имидировании арилгалогенидов» . Журнал Американского химического общества . 130 (30): 9971–9983. дои : 10.1021/ja076668w . ISSN 0002-7863 . ПМЦ 2819338 . ПМИД 18597458 .
- ^ Дерек ван Аллен, докторская диссертация, Массачусетский университет в Амхерсте, 2004 г. Электронная диссертация
- ^ Бэкон, RGR; Хилл, ХАО (1964). «210. Ионы и комплексы металлов в органических реакциях. Часть I. Реакции замещения между арилгалогенидами и солями меди в органических растворителях» . Журнал Химического общества (обновленный) : 1097. doi : 10.1039/jr9640001097 . ISSN 0368-1769 .
- ^ Вайнгартен, Гарольд (декабрь 1964 г.). «Механизм конденсации Ульмана 1» . Журнал органической химии . 29 (12): 3624–3626. дои : 10.1021/jo01035a046 . ISSN 0022-3263 .
- ^ Самбьяджо, Карло; Марсден, Стивен П.; Блэкер, А. Джон; Макгоуэн, Патрик К. (22 апреля 2014 г.). «Химия типа Ульмана, катализируемая медью: от механистических аспектов к современному развитию» . Обзоры химического общества . 43 (10): 3525–3550. дои : 10.1039/C3CS60289C . ISSN 1460-4744 .
- ^ Ульманн, Ф.; Белецкий, Жан (май 1901 г.). «О синтезах в ряду бифенилов» . Отчеты Немецкого химического общества . 34 (2): 2174–2185. дои : 10.1002/cber.190103402141 . ISSN 0365-9496 .
- ^ Рейнольд К. Фьюсон; Э.А. Кливленд (1940). «2,2'-Динитробифенил». Орг. Синтез . 20:45 . дои : 10.15227/orgsyn.020.0045 .
- ^ Фанта, ЧП (1974). «Синтез биарилов Ульмана». Синтез . 1974 : 9–21. дои : 10.1055/s-1974-23219 . ПМИД 21016995 . S2CID 30018391 .
- ^ Белетка, ИП; Чепраков, А.В. (2004). «Медь в реакциях перекрестного сочетания: Химия Поста Ульмана». Коорд. хим. Преподобный . 248 : 2337–2364. дои : 10.1016/j.ccr.2004.09.014 .
- ^ Перейти обратно: а б Дж. Хасан; М. Севиньон; К. Гоцци; Э. Шульц; М. Лемэр (2002). «Образование арил-ариловой связи через столетие после открытия реакции Ульмана». Химические обзоры . 102 (5): 1359–1470. дои : 10.1021/cr000664r . ПМИД 11996540 .
- ^ Самбьяджо, Карло; Марсден, Стивен П.; Блэкер, А. Джон; Макгоуэн, Патрик К. (22 апреля 2014 г.). «Химия типа Ульмана, катализируемая медью: от механистических аспектов к современному развитию» . Обзоры химического общества . 43 (10): 3525–3550. дои : 10.1039/C3CS60289C . ISSN 1460-4744 . ПМИД 24585151 .
- ^ Нельсон, Т.Д.; Крауч, Р.Д. (2004). «Реакции гомосочетания, опосредованные Cu, Ni и Pd, в синтезе биарила: реакция Ульмана». Орг. Реагируйте . 63 : 265. дои : 10.1002/0471264180.or063.03 . ISBN 0-471-26418-0 .
- ^ Самбьяджо, Карло; Марсден, Стивен П.; Блэкер, А. Джон; Макгоуэн, Патрик К. (22 апреля 2014 г.). «Химия типа Ульмана, катализируемая медью: от механистических аспектов к современному развитию» . Обзоры химического общества . 43 (10): 3525–3550. дои : 10.1039/C3CS60289C . ISSN 1460-4744 .
- ^ Ма, Давэй; Чжан, Юнда; Яо, Цзянчао; Ву, Шихуэй; Тао, Фэнган (27 апреля 1999 г.). "ХимИнформ Реферат: Ускоряющий эффект, индуцируемый структурой α-аминокислоты, в катализируемой медью реакции сочетания арилгалогенидов с α-аминокислотами. Синтез бензолактама-V8" . ХимИнформ . 30 (17). дои : 10.1002/chin.199917212 . ISSN 0931-7597 .
- ^ Кристо, Анри-Жан; Селье, Паскаль П.; Шпиндлер, Жан-Франсис; Тайлефер, Марк (29 октября 2004 г.). «Высокоэффективное и мягкое катализируемое медью N- и C-арилирование с арилбромидами и йодидами» . Химия – Европейский журнал . 10 (22): 5607–5622. дои : 10.1002/chem.200400582 . ISSN 0947-6539 .
- ^ Фэган, Пол Дж.; Гауптман, Элизабет; Шапиро, Рафаэль; Казальнуово, Альберт (01 мая 2000 г.). «Использование интеллектуального/случайного скрининга библиотек для разработки целенаправленных библиотек для оптимизации гомогенных катализаторов: образование эфира Ульмана» . Журнал Американского химического общества . 122 (21): 5043–5051. дои : 10.1021/ja000094c . ISSN 0002-7863 .
- ^ «Сборка первичных (гетеро)ариламинов посредством катализируемого CuI/диамидом щавелевой кислоты сочетания арилхлоридов и аммиака» . dx.doi.org . doi : 10.1021/acs.orglett.5b03230.s001 . Проверено 8 декабря 2023 г.
- ^ Перейти обратно: а б Нельсон, Т.Д.; Мейерс, А.И. (1994). «Асимметричная реакция Ульмана, 2. Синтез энантиомерно чистых C 2 -симметричных бинафтилов». Дж. Орг. Хим . 59 (9): 2655–2658. дои : 10.1021/jo00088a066 .
- ^ Чжимин Ван, Вэйлян Бао и Юн Цзян, « L -пролин способствует реакции винилбромидов с имидазолами в ионных жидкостях типа Ульмана», Chemical Communications , 2005 , 2849-51. два : 10.1039/b501628b
- ^ Бухвальд, Стивен Л.; Могер, Кристель; Миньяни, Жерар; Шольц, Ульрих (2006). «Промышленное катализируемое палладием сочетание арилгалогенидов и аминов - личный отчет». Расширенный синтез и катализ . 348 (1–2): 23–39. дои : 10.1002/adsc.200505158 . S2CID 55030715 .