Черт возьми реакция
| Черт возьми реакция | |
|---|---|
| Назван в честь | Ричард Ф. Хек |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| Портал органической химии | черт-реакция |
| RSC Идентификатор онтологии | RXNO: 0000024 |
Реакция Хека (также называемая реакцией Мизороки-Хека ) [1] представляет собой химическую реакцию ненасыщенного галогенида (или трифлата ) с алкеном в присутствии основания и палладиевого катализатора с образованием замещенного алкена. Он назван в честь Цутому Мизороки и Ричарда Ф. Хека . Хек был удостоен Нобелевской премии по химии 2010 года , которую он разделил с Эйичи Негиси и Акирой Судзуки , за открытие и развитие этой реакции. Эта реакция была первым примером реакции образования углерод-углеродной связи, которая следовала за каталитическим циклом Pd(0)/Pd(II), тем же каталитическим циклом, который наблюдается в других реакциях перекрестного сочетания, катализируемых Pd(0) . Реакция Хека – это способ замены алкенов. [2] [3] [4] [5]
 |
| Чертова реакция |
|---|
История
[ редактировать ]Оригинальная реакция Цутому Мизороки (1971) описывает реакцию сочетания йодбензола и стирола в метаноле с образованием стильбена при 120 ° C ( автоклав ) с использованием ацетата калия и катализа хлорида палладия . Эта работа была продолжением более ранней работы Фудзивара (1967) по Pd(II)-опосредованному связыванию аренов (Ar-H) и алкенов. [6] [7] и более ранняя работа Хека (1969) по сочетанию арилртутьгалогенидов (ArHgCl) с алкенами с использованием стехиометрического количества палладия (II). [8]
 |
| Мизороки 1971 г. |
|---|
В 1972 году Хек признал публикацию Мизороки и подробно описал независимо открытую работу. Условия реакции Хека различаются катализатором (ацетат палладия), загрузкой катализатора (0,01 экв.), основанием (затрудненный амин) и отсутствием растворителя. [9] [10]
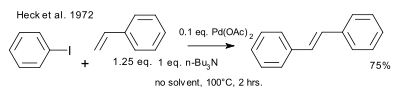 |
| Черт возьми, 1972 год |
|---|
В 1974 году Хек показал, что фосфиновые лиганды облегчают реакцию. [11]
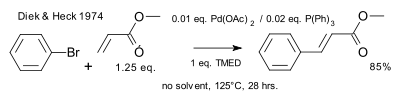 |
| Черт возьми, реакция 1974 года, фосфины |
|---|
Катализатор и субстраты
[ редактировать ]Реакцию катализируют комплексы палладия. Типичные катализаторы и предкатализаторы включают тетракис(трифенилфосфин)палладий(0) , хлорид палладия и ацетат палладия(II) . Типичными поддерживающими лигандами являются трифенилфосфин , PHOX и BINAP . Типичными основаниями являются триэтиламин , карбонат калия и ацетат натрия .
Арильный электрофил может представлять собой галогенид (Br, Cl) или трифлат, а также бензил- или винилгалогениды . Алкен должен содержать хотя бы один sp 2 -СН облигация. Электроноакцепторные заместители усиливают реакцию, поэтому акрилаты идеальны. [12]
Механизм реакции
[ редактировать ]В механизме этого винилирования участвуют палладийорганические промежуточные соединения. Требуемое соединение палладия(0) часто получают in situ из предшественника палладия(II). [13] [14]
Например, ацетат палладия(II) восстанавливается трифенилфосфином до бис(трифенилфосфин)палладия(0) ( 1 ) одновременно с окислением трифенилфосфина до оксида трифенилфосфина . Шаг А представляет собой окислительное присоединение , при котором палладий внедряется в арилбромидную связь. Образующийся комплекс палладия(II) затем связывает алкен ( 3 ). На этапе B алкен встраивается в связь Pd-C на этапе син-присоединения . Шаг C включает отщепление бета-гидрида (здесь стрелки показывают обратное) с образованием нового π-комплекса палладия с алкеном ( 5 ). Этот комплекс разрушается на следующем этапе. регенерируется путем восстановительного отщепления соединения палладия(II) карбонатом калия на заключительной стадии D. Комплекс Pd(0 ) В ходе реакции карбонат расходуется стехиометрически, а палладий действительно является катализатором и используется в каталитических количествах. Похожий палладиевый цикл, но с другими сценами и действующими лицами, наблюдается в процессе Вакера .
 |
| Черт возьми, механизм реакции |
|---|
Этот цикл не ограничивается виниловыми соединениями: в реакции Соногаширы одним из реагентов является алкин , а в реакции Сузуки алкен заменяется арилбороновой кислотой , а в реакции Стилле арилстаннаном - . Цикл также распространяется на другой элемент 10-й группы, никель, например, при реакции Негиши между арилгалогенидами и цинкорганическими соединениями. Платина образует прочные связи с углеродом и не обладает каталитической активностью в реакциях этого типа.
Стереоселективность
[ редактировать ]Эта реакция сочетания является стереоселективной со склонностью к транс -сочетанию, поскольку группа галогенида палладия и объемистый органический остаток удаляются друг от друга в последовательности реакций на стадии вращения. Реакция Хека применяется в промышленности при производстве напроксена и солнцезащитного компонента октилметоксициннамата . Синтез напроксена включает взаимодействие бромированного соединения нафталина с этиленом : [15]
 |
| Реакция Хека при производстве напроксена |
|---|
Вариации
[ редактировать ]Ионная жидкость Реакция Хека
[ редактировать ]В присутствии ионной жидкости реакция Хека протекает в отсутствие фосфорного лиганда. В одной модификации ацетат палладия и ионная жидкость (bmim)PF 6 иммобилизованы внутри полостей обращенно-фазового силикагеля . [16] Таким образом, реакция протекает в воде, и катализатор можно использовать повторно.
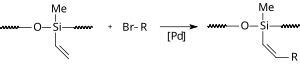 |
| Применение силоксана |
|---|
Черт возьми, оксиарилирование
[ редактировать ]В модификации оксиарилирования Хека палладиевый заместитель в промежуточном соединении син-присоединения замещается гидроксильной группой, и продукт реакции содержит дигидрофурановое кольцо. [17]
 |
| Черт возьми, оксиарилирование |
|---|
Амино-Хека реакция
[ редактировать ]В -Хека азот - углерод реакции амино образуется связь . В одном примере [18] оксим реагирует с с сильно электроноакцепторной группой внутримолекулярно концом диена с образованием пиридинового соединения. Катализатором тетракис является (трифенилфосфин)палладий(0) , основанием является триэтиламин .
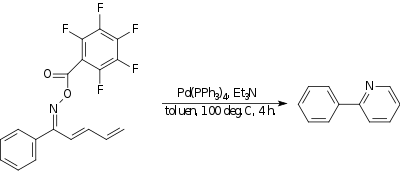 |
| Амино-Хека реакция |
|---|
См. также
[ редактировать ]- Хияма муфта
- Реакция Стилле
- Реакция Сузуки
- Муфта Соногашира
- Внутримолекулярная реакция Хека
- Муфта Негиши
Ссылки
[ редактировать ]- ^ Драль, Кармен (17 мая 2010 г.). «В именах, истории и наследии» . хим. англ. Новости . 88 (22): 31–33. doi : 10.1021/cen-v088n020.p031 . Проверено 4 июня 2011 г.
- ^ Черт возьми, РФ (1982). «Катализируемое палладием винилирование органических галогенидов». Орг. Реагировать. 27 : 345–390. дои : 10.1002/0471264180.или 027.02 . ISBN 978-0471264187 .
- ^ де Мейере, А.; Мейер, Ф.Е. (1994). «Из тонких перьев получаются прекрасные птицы: чертовская реакция в современной одежде». Энджью. хим. Межд. Эд. англ. 33 (2324): 2379–2411. дои : 10.1002/anie.199423791 .
- ^ Белецкая, ИП ; Чепраков, А.В. (2000). «Чертова реакция как точильный камень палладиевого катализа». хим. Откр. 100 (8): 3009–3066. дои : 10.1021/cr9903048 . ПМИД 11749313 .
- ^ Маккартни, Деннис; Гири, Патрик Дж. (2011). «Асимметричный Хек и родственные реакции». хим. Соц. Откр. 40 (10): 5122–5150. дои : 10.1039/C1CS15101K . ПМИД 21677934 .
- ^ Моритани, Ичиро; Фудзивара, Юзо (1967). «Ароматическое замещение хлоридного комплекса стирола с палладием». Тетраэдр Летт. 8 (12): 1119–1122. дои : 10.1016/S0040-4039(00)90648-8 .
- ^ Фудзивара, Юзо; Норитани, Ичиро; Данно, Садао; Асано, Рюдзо; Тераниши, Сиитиро (1969). «Ароматическое замещение олефинов. VI. Арилирование олефинов ацетатом палладия (II)». Дж. Ам. хим. Соц. 91 (25): 7166–9. дои : 10.1021/ja01053a047 . ПМИД 27462934 .
- ^ Ричард Ф. Хек (1969). «Механизм арилирования и карбометоксилирования олефинов палладийорганическими соединениями». Дж. Ам. хим. Соц . 91 (24): 6707–6714. дои : 10.1021/ja01052a029 .
- ^ Хек, РФ ; Нолли, JP (1972). «Катализируемые палладием реакции замещения винилового водорода арил-, бензил- и стирилгалогенидами». Дж. Орг. хим. 37 (14): 2320–2322. дои : 10.1021/jo00979a024 .
- ^ Мизороки, Т.; Мори, К.; Одзаки, А. (1971). «Арилирование олефина арилйодидом, катализируемое палладием». Бык. хим. Соц. Япония. 44 (2): 581. doi : 10.1246/bcsj.44.581 .
- ^ Дик, ХА; Черт возьми, РФ (1974). «Органофосфинпалладиевые комплексы как катализаторы реакций замещения винилового водорода». Дж. Ам. хим. Соц . 96 (4): 1133. doi : 10.1021/ja00811a029 .
- ^ Литтке, А.Ф.; Фу, GC (2005). «Реакции Хека арилхлоридов, катализируемые палладием/три- трет -бутилфосфином: бутиловый эфир ( Е )-2-метил-3-фенилакрикислоты и ( Е )-4-(2-фенилэтенил)бензонитрил» . Органические синтезы . 81:63 .
- ^ Одзава, Ф.; Кубо, А.; Хаяши, Т. (1992). «Получение третичных фосфин-координированных форм Pd (0) из Pd (OAc) 2 в каталитической реакции Хека». Химические письма . 21 (11): 2177–2180. дои : 10.1246/кл.1992.2177 .
- ^ Брэдшоу, Майкл; Цзоу, Цзяньли; Бирн, Линдси; Сваминатан Айер, К.; Стюарт, Скотт Г.; Растон, Колин Л. (2011). «Маты из нановолокон хитозана, конъюгированных с Pd (II), для применения в реакциях кросс-сочетания Хека». хим. Коммун. 47 (45): 12292–12294. дои : 10.1039/C1CC14717J . ПМИД 22011792 .
- ^ Де Врис; Йоханнес Г. (2001). «Реакция Хека в производстве тонких химикатов». Может. Дж. Хим. 79 (5–6): 1086. doi : 10.1139/cjc-79-5-6-1086 .
- ^ Хагивара, Хисахиро; Сугавара, Ёситака; Хоши, Такаши; Сузуки, Тошио (2005). «Устойчивая реакция Мизороки-Хека в воде: чрезвычайно высокая активность Pd(OAc) 2 , иммобилизованного на силикагеле с обращенной фазой с помощью ионной жидкости». хим. Коммун. (23): 2942–2944. дои : 10.1039/b502528a . ПМИД 15957033 .
- ^ Лоранд Кисс; Тибор Куртан; Шандор Антус; Анри Бруннер (2003). «Дальнейшее понимание механизма оксиарилирования Хека в присутствии хиральных лигандов» . Аркивок : GB–653J.
- ^ Мицуру Китамура; Дайсуке Кудо; Коичи Нарасака (2005). «Катализируемый палладием (0) синтез пиридинов из β-ацетокси-γ,δ-ненасыщенных кетоноксимов» . Аркивок : JC–1563E.
Внешние ссылки
[ редактировать ]- Реакция Хека на сайте органической химии.org. Статья