Окисление Байера-Виллигера
| Окисление Байера-Виллигера | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Назван в честь | Адольф фон Байер Виктор Виллигер | ||||||||
| Тип реакции | Органическая окислительно-восстановительная реакция | ||||||||
| Реакция | |||||||||
| |||||||||
| Идентификаторы | |||||||||
| Портал органической химии | окисление по Байеру-Виллиджеру | ||||||||
| RSC Идентификатор онтологии | RXNO: 0000031 | ||||||||
Окисление Байера -Виллигера представляет собой органическую реакцию , в ходе которой образуется сложный эфир из кетона или лактон из циклического кетона с использованием пероксикислот или пероксидов в качестве окислителя . [ 1 ] Реакция названа в честь Адольфа фон Байера и Виктора Виллигера, которые впервые сообщили о реакции в 1899 году. [ 1 ]

Механизм реакции
[ редактировать ]На первом этапе механизма протонирует кислород реакции пероксикислота карбонильной группы . [ 1 ] Это делает карбонильную группу более восприимчивой к атаке пероксикислоты. [ 1 ] Затем пероксикислота атакует углерод карбонильной группы, образуя так называемое промежуточное соединение Криджи . [ 1 ] По согласованному механизму один из заместителей кетоновой группы мигрирует к кислороду пероксидной группы, а карбоновая кислота уходит. [ 1 ] Считается, что этот этап миграции является этапом, определяющим скорость . [ 2 ] [ 3 ] Наконец, депротонирование иона оксокарбения дает сложный эфир . [ 1 ]

Считается, что продукты окисления Байера-Виллигера контролируются как первичными, так и вторичными стереоэлектронными эффектами . [ 4 ] Первичный стереоэлектронный эффект при окислении Байера-Виллигера связан с необходимостью того, чтобы связь кислород-кислород в пероксидной группе была антиперипланарной по отношению к мигрирующей группе. [ 4 ] [ 3 ] Такая ориентация способствует оптимальному перекрытию 𝛔-орбитали мигрирующей группы с 𝛔*-орбиталью пероксидной группы. [ 1 ] Вторичный стереоэлектронный эффект относится к необходимости того, чтобы неподеленная пара кислорода гидроксильной группы была антиперипланарной по отношению к мигрирующей группе. [ 4 ] Это обеспечивает оптимальное перекрытие несвязывающей кислородной орбитали орбитали 𝛔* мигрирующей группы. [ 5 ] Этому этапу миграции также (по крайней мере, in silico ) способствуют две или три единицы пероксикислоты, позволяющие гидроксильному протону перемещаться в новое положение. [ 6 ]
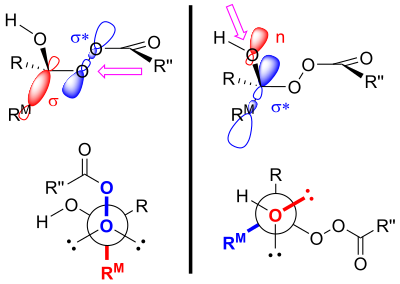
Миграционная способность ранжируется: третичная > вторичная > арил > первичная. [ 7 ] Аллильные группы более склонны к миграции, чем первичные алкильные группы, но менее склонны к миграции, чем вторичные алкильные группы. [ 5 ] Электроноакцепторные группы заместителя уменьшают скорость миграции. [ 8 ] Есть два объяснения этой тенденции в способности к миграции. [ 9 ] Одно из объяснений основано на накоплении положительного заряда в переходном состоянии для распада промежуточного соединения Криджи (иллюстрируемого карбокатионной резонансной структурой промежуточного соединения Криги). [ 9 ] Принимая во внимание эту структуру, становится понятным, что заместитель, который может лучше всего сохранять положительный заряд, с наибольшей вероятностью будет мигрировать. [ 9 ] Чем выше степень замещения, тем более стабильным является карбокатион. [ 10 ] Поэтому наблюдается третичная > вторичная > первичная тенденция.

Другое объяснение использует стереоэлектронные эффекты и стерические аргументы. [ 11 ] Как уже упоминалось, заместитель, антиперипланарный по отношению к пероксидной группе в переходном состоянии, будет мигрировать. [ 4 ] Это переходное состояние имеет жесткое взаимодействие между пероксикислотой и немигрирующим заместителем. [ 11 ] Если более объемная группа расположена антиперипланарно пероксидной группе, взаимодействие между заместителем в образующемся сложном эфире и карбонильной группой пероксикислоты будет уменьшено. [ 11 ] Таким образом, именно более объемная группа предпочтет быть антиперипланарной по отношению к пероксидной группе, увеличивая ее способность к миграции. [ 11 ]

Мигрирующая группа в ациклических кетонах обычно не является 1°-алкильной группой. Однако их можно убедить мигрировать в пользу групп 2° или 3°, используя в качестве реагентов CF 3 CO 3 H или BF 3 + H 2 O 2 . [ 12 ]
Историческая справка
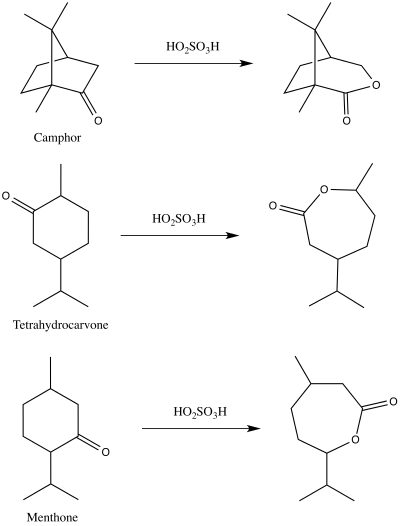
[ редактировать ]В 1899 году Адольф Байер и Виктор Виллигер впервые опубликовали демонстрацию реакции, которую мы теперь знаем как окисление Байера-Виллигера. [ 13 ] [ 14 ] Они использовали пероксимоносерную кислоту для получения соответствующих лактонов из камфоры , ментона и тетрагидрокарвона. [ 14 ] [ 15 ]
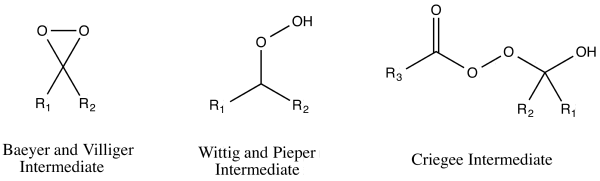
Было предложено три механизма реакции окисления Байера-Виллигера, которые, по-видимому, соответствовали наблюдаемым результатам реакции. [ 16 ] Эти три механизма реакции действительно можно разделить на два пути атаки пероксикислоты – либо на кислород, либо на углерод карбонильной группы . [ 17 ] Атака на кислород могла привести к образованию двух возможных промежуточных продуктов : Байер и Виллигер предложили промежуточный продукт диоксиран , а Георг Виттиг и Густав Пипер предложили пероксид без образования диоксирана. [ 17 ] Углеродная атака была предложена Рудольфом Криге . [ 17 ] На этом пути перкислота атакует карбонильный углерод, образуя то, что теперь известно как промежуточное соединение Криджи . [ 17 ]
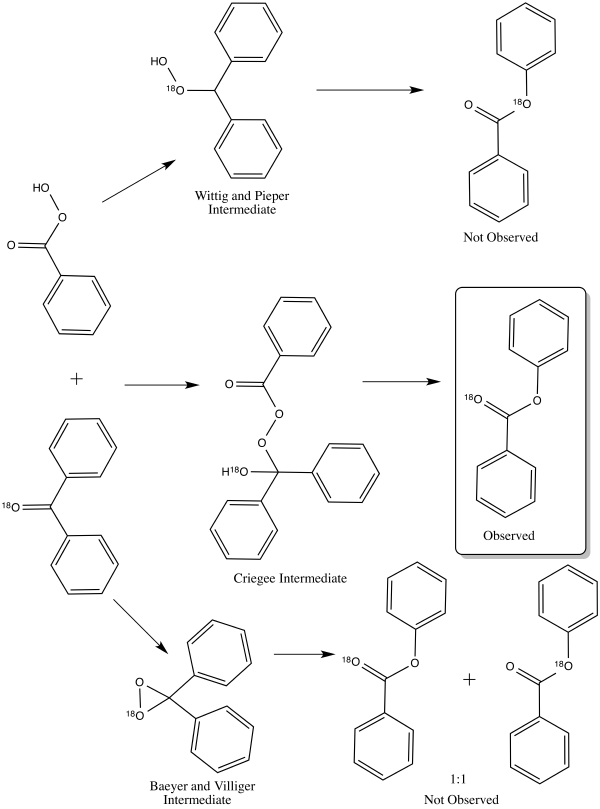
В 1953 году Уильям фон Эггерс Деринг и Эдвин Дорфман выяснили правильный путь механизма реакции окисления Байера-Виллигера, используя кислородом-18 мечение бензофенона . [ 16 ] Каждый из трех различных механизмов приведет к различному распределению маркированных продуктов. Промежуточное соединение Криджи приведет к образованию продукта, меченного только карбонильным кислородом. [ 16 ] Продукт промежуточного соединения Виттига и Пипера помечен только на алкоксигруппе сложного эфира. [ 16 ] Промежуточное соединение Байера и Виллигера приводит к распределению обоих вышеуказанных продуктов 1:1. [ 16 ] Результат эксперимента по маркировке подтвердил наличие промежуточного продукта Criegee, [ 16 ] что сейчас является общепринятым путем. [ 1 ]
Стереохимия
[ редактировать ]Миграция не меняет стереохимию перемещающейся группы, то есть: она стереосохраняется . [ 18 ] [ 19 ]
Реагенты
[ редактировать ]Хотя для окисления Байера-Виллигера используется множество различных пероксикислот, некоторые из наиболее распространенных окислителей включают метахлорпербензойную кислоту (mCPBA) и трифторперуксусную кислоту (TFPAA). [ 2 ] Общая тенденция состоит в том, что более высокая реакционная способность коррелирует с более низким pK a (т.е. более высокой кислотностью) соответствующей карбоновой кислоты (или спирта в случае пероксидов). [ 5 ] Таким образом, тенденция реакционной способности показывает: TFPAA > 4-нитропербензойная кислота > mCPBA и надмуравьиная кислота > надуксусная кислота > перекись водорода > трет-бутилгидропероксид . [ 5 ] Пероксиды гораздо менее реакционноспособны, чем пероксикислоты. [ 2 ] Использование перекиси водорода даже требует катализатора . [ 7 ] [ 20 ] Кроме того, использование органических пероксидов и перекиси водорода имеет тенденцию вызывать большую побочную реактивность из-за их беспорядочных связей. [ 21 ]
Ограничения
[ редактировать ]Использование пероксикислот и пероксидов при проведении окисления Байера-Виллигера может вызвать нежелательное окисление других функциональных групп . [ 22 ] Алкены и амины — лишь немногие из групп, которые могут окисляться . [ 22 ] Например, алкены в субстрате, особенно богатые электронами, могут окисляться до эпоксидов . [ 22 ] [ 23 ] Однако были разработаны методы, позволяющие обеспечить толерантность этих функциональных групп. [ 22 ] В 1962 году Дж. Б. Пейн сообщил, что использование перекиси водорода в присутствии селенового катализатора приведет к образованию эпоксида из алкенилкетонов, а использование пероксиуксусной кислоты приведет к образованию сложного эфира. [ 24 ]

Модификации
[ редактировать ]Каталитическое окисление Байера-Виллигера
[ редактировать ]Использование перекиси водорода в качестве окислителя было бы выгодным, поскольку сделало бы реакцию более экологически безопасной, поскольку единственным побочным продуктом является вода. [ 7 ] Сообщалось, что производные бензоселениновой кислоты в качестве катализаторов обеспечивают высокую селективность по отношению к пероксиду водорода в качестве окислителя. [ 25 ] Другим классом катализаторов, которые демонстрируют высокую селективность по отношению к пероксиду водорода в качестве окислителя, являются твердые катализаторы на основе кислот Льюиса, такие как станносиликаты. [ 26 ] Среди станносиликатов особенно зеотип Sn-бета и аморфный Sn-MCM-41 демонстрируют многообещающую активность и близкую к полной селективности по отношению к желаемому продукту. [ 27 ] [ 28 ]
Асимметричное окисление Байера-Виллигера
[ редактировать ]Были попытки использовать металлоорганические катализаторы для проведения энантиоселективного окисления Байера-Виллигера. [ 7 ] В первом зарегистрированном случае такого окисления прохирального кетона в качестве окислителя использовался дикислород с медным катализатором. [ 23 ] Затем последовали другие катализаторы, в том числе соединения платины и алюминия . [ 23 ]
Монооксигеназы Байера-Виллигера
[ редактировать ]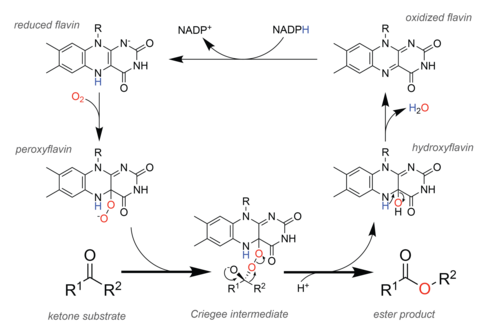
В природе ферменты , называемые монооксигеназами Байера-Виллигера (БВМО), осуществляют окисление аналогично химической реакции. [ 29 ] Чтобы облегчить этот химический процесс, BVMO содержат флавинадениндинуклеотид (FAD) кофактор . [ 30 ] В каталитическом цикле (см. рисунок справа) клеточный окислительно-восстановительный эквивалент НАДФН сначала восстанавливает кофактор, что позволяет ему впоследствии вступить в реакцию с молекулярным кислородом . Образующийся пероксифлавин является каталитическим веществом, насыщающим субстрат кислородом , и теоретические исследования показывают, что реакция протекает через тот же промежуточный продукт Криге, что и наблюдаемый в химической реакции. [ 31 ] После стадии перегруппировки с образованием сложноэфирного продукта остается гидроксифлавин, который самопроизвольно удаляет воду с образованием окисленного флавина, тем самым замыкая каталитический цикл.
БВМО тесно связаны с флавинсодержащими монооксигеназами (ФМО). [ 32 ] которые также встречаются в организме человека, функционируя в рамках передовой системы метаболической детоксикации печени ферменты , по типу монооксигеназ цитохрома Р450 . [ 33 ] Фактически было показано, что человеческий FMO5 способен катализировать реакции Байера-Виллигера, что указывает на то, что реакция может происходить и в организме человека. [ 34 ]
БВМО широко изучались из-за их потенциала в качестве биокатализаторов , то есть для применения в органическом синтезе. [ 35 ] Учитывая экологические проблемы большинства химических катализаторов, использование ферментов считается более экологичной альтернативой. [ 29 ] BVMO, в частности, интересны для применения, поскольку они соответствуют ряду критериев, обычно предъявляемых к биокатализу: помимо их способности катализировать синтетически полезную реакцию, было обнаружено, что некоторые природные гомологи имеют очень широкий спектр субстратов (т.е. их реакционная способность не ограничивается одно соединение, как часто предполагается в ферментативном катализе), [ 36 ] их можно легко производить в больших масштабах, а поскольку трехмерная структура многих BVMO определена, ферментную инженерию можно применять для получения вариантов с улучшенной термостабильностью и/или реакционной способностью. [ 37 ] [ 38 ] фермента Еще одним преимуществом использования ферментов для реакции является их часто наблюдаемая регио- и энантиоселективность, обусловленная стерическим контролем ориентации субстрата во время катализа внутри активного центра . [ 29 ] [ 35 ]
Приложения
[ редактировать ]Зоапатанол
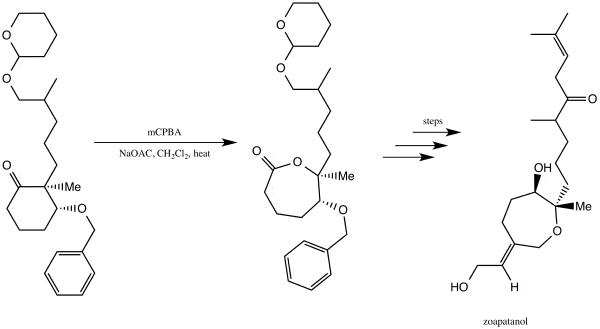
[ редактировать ]Зоапатанол — это биологически активная молекула, которая естественным образом встречается в растении зеопатле, которое в Мексике используется для приготовления чая, который может вызвать менструацию и роды. [ 39 ] В 1981 году Винаяк Кейн и Дональд Дойл сообщили о синтезе зоапатанола. [ 40 ] [ 41 ] Они использовали окисление Байера-Виллигера, чтобы получить лактон , который послужил важнейшим строительным блоком, который в конечном итоге привел к синтезу зоапатанола. [ 40 ] [ 41 ]
Стероиды
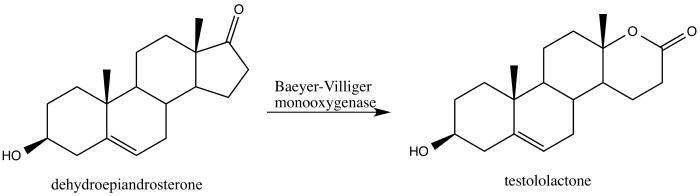
[ редактировать ]В 2013 году Алина Свиздор сообщила о преобразовании стероида дегидроэпиандростерона в противораковый агент тестололактон с помощью окисления Байера-Виллигера, индуцированного грибком, который продуцирует монооксигеназы Байера-Виллигера. [ 42 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г час я Курти, Ласло; Чако, Барбара (2005). Стратегическое применение названных реакций в органическом синтезе . Берлингтон; Сан-Диего; Лондон: Elsevier Academic Press. п. 28 . ISBN 978-0-12-369483-6 .
- ^ Jump up to: а б с Кроу, Грант Р. (1993). «Окисление кетонов и альдегидов по Байеру-Виллигеру». Органические реакции . 43 (3): 251–798. дои : 10.1002/0471264180.или043.03 . ISBN 0471264180 .
- ^ Jump up to: а б Кэри, Фрэнсис А.; Сундберг, Ричард Дж. (2007). Продвинутая органическая химия: Часть B: Реакции и синтез (5-е изд.). Нью-Йорк: Спрингер. п. 1135. ИСБН 978-0387683546 .
- ^ Jump up to: а б с д Крадден, Кэтлин М.; Чен, Остин С.; Калхун, Ларри А. (2000). «Демонстрация первичного стереоэлектронного эффекта при окислении α-фторциклогексанонов по Байеру-Виллигеру». Энджью. хим. Межд. Эд . 39 (16): 2851–2855. doi : 10.1002/1521-3773(20000818)39:16<2851::aid-anie2851>3.0.co;2-y . ПМИД 11027987 .
- ^ Jump up to: а б с д Майерс, Эндрю Г. «Раздаточные материалы по химии 115: окисление» (PDF) . Гарвардский университет.
- ^ Ямабе, Шиничи (2007). «Роль водородных связей в реакциях Байера-Виллигера». Журнал органической химии . 72 (8): 3031–3041. дои : 10.1021/jo0626562 . ПМИД 17367197 .
- ^ Jump up to: а б с д тен Бринк, Г.-Ж.; Арендс, WCE ; Шелдон, РА (2004). «Реакция Байера-Виллигера: новые разработки на пути к более экологичным процедурам». хим. Преподобный . 104 (9): 4105–4123. дои : 10.1021/cr030011l . ПМИД 15352787 .
- ^ Ли, Цзе Джек; Кори, Э.Дж., ред. (2007). Название Реакции превращений функциональных групп . Хобокен, Нью-Джерси: Wiley-Interscience.
- ^ Jump up to: а б с Хоторн, М. Фредерик; Эммонс, Уильям Д.; МакКаллум, Канзас (1958). «Повторное исследование пероксикислотного расщепления кетонов. I. Относительные миграционные способности». Дж. Ам. хим. Соц . 80 (23): 6393–6398. дои : 10.1021/ja01556a057 .
- ^ Джонс-младший, Мейтленд; Флеминг, Стивен А. (2010). Органическая химия (4-е изд.). Канада: WW Norton & Company. п. 293 . ISBN 978-0-393-93149-5 .
- ^ Jump up to: а б с д Эванс Д.А. «Стереоэлектронные эффекты-2» . Химия 206 (осень 2006-2007 гг.) .
- ^ Саньял, С.Н. (2003). Реакции, перегруппировки и реагенты (4-е изд.). п. 90. ИСБН 978-81-7709-605-7 .
- ^ Байер, Адольф; Виллигер, Виктор (1899). «Действие реактива Каро на кетоны» . Бер. Немецкий. Хим . 32 (3): 3625–3633. дои : 10.1002/cber.189903203151 .
- ^ Jump up to: а б Хассал, Швейцария (1957). «Окисление альдегидов и кетонов по Байеру-Виллигеру». Органические реакции . 9 (3): 73–106. дои : 10.1002/0471264180.или009.03 . ISBN 0471264180 .
- ^ Ренц, Майкл; Менье, Бернар (1999). «100 лет окисления Байера-Виллигера». Евро. Дж. Орг. Хим . 1999 (4): 737–750. doi : 10.1002/(SICI)1099-0690(199904)1999:4<737::AID-EJOC737>3.0.CO;2-B .
- ^ Jump up to: а б с д и ж Деринг, В. фон Э.; Дорфман, Эдвин (1953). «Механизм конверсии кетон-эфир перкислоты. Анализ органических соединений на кислород-18». Дж. Ам. хим. Соц . 75 (22): 5595–5598. дои : 10.1021/ja01118a035 .
- ^ Jump up to: а б с д Деринг, В. фон Э.; Спирс, Луиза (1950). «Расщепление несимметричных кетонов надуксусной кислотой». Журнал Американского химического общества . 72 (12): 5515–5518. дои : 10.1021/ja01168a041 .
- ^ Тернер, Ричард Б. (1950). «Стереохимия перкислотного окисления кетонов». Дж. Ам. хим. Соц . 72 (2): 878–882. дои : 10.1021/ja01158a061 .
- ^ Галлахер, Т.Ф.; Кричевский, Теодор Х. (1950). «Окисление 20-кетостероидов пербензойной кислотой и стереохимия C-17». Дж. Ам. хим. Соц . 72 (2): 882–885. дои : 10.1021/ja01158a062 .
- ^ Каварзан, Алессандра; Скарсо, Алессандро; Сгарбосса, Паоло; Мишлен, Рино А.; Струкул, Джорджио (2010). «Зеленое каталитическое окисление Байера-Виллигера перекисью водорода в воде, опосредованное катализаторами Pt (II)». ChemCatChem . 2 (10): 1296–1302. дои : 10.1002/cctc.201000088 . S2CID 98508888 .
- ^ Швейцер-Шапут, Бертран; Куртен, Тео; Клуссманн, Мартин (2015). «Кислотно-опосредованное образование радикалов или окисление Байера-Виллигера из аддуктов Криджи». Международное издание «Прикладная химия» . 54 (40): 11848–11851. дои : 10.1002/anie.201505648 . ПМИД 26267787 .
- ^ Jump up to: а б с д Грант Р. Кроу (1991). Трост, Барри М.; Флеминг, Ян (ред.). Комплексный органический синтез - селективность, стратегия и эффективность в современной органической химии, тома 1–9 . Эльзевир. стр. 671–688. ISBN 978-0-08-035930-4 .
- ^ Jump up to: а б с Сеймур, Крейг. «Страница 1 Асимметричное окисление Байера-Виллигера» (PDF) . scs.illinois.edu .
- ^ Пейн, Великобритания (1962). «Упрощенная процедура эпоксидирования бензонитрил-перекисью водорода. Селективное окисление 2-аллилциклогексанона». Тетраэдр . 18 (6): 763–765. дои : 10.1016/S0040-4020(01)92726-7 .
- ^ тен Бринк, Герд-Ян; Вис, Ян-Мартин; Арендс, Изабель WCE; Шелдон, Роджер А. (2001). «Катализируемое селеном окисление водной перекисью водорода. 2. Реакции Байера-Виллигера в гомогенном растворе». Дж. Орг. Хим . 66 (7): 2429–2433. дои : 10.1021/jo0057710 . ПМИД 11281784 .
- ^ Феррини, Паола; Дейкманс, Джон; Клерк, Рик Де; Вивер, Стейн Ван де; Дюсселье, Майкл; Джейкобс, Пьер А.; Селс, Берт Ф. (2017). «Кислотный катализ Льюиса на одноцентровых центрах Sn, включенных в кремнеземные хозяева». Обзоры координационной химии . 343 : 220–255. дои : 10.1016/j.ccr.2017.05.010 .
- ^ Корма, А; Наварро, Монтана; Немет, Л; Ренц, М. (7 ноября 2001 г.). «Sn-MCM-41 — гетерогенный селективный катализатор окисления Байера-Виллигера пероксидом водорода». Химические коммуникации (21): 2190–1. дои : 10.1039/B105927K . ISSN 1364-548X . ПМИД 12240094 .
- ^ Ренц, М; Бласко, Т; Корма, А; Форнес, В; Дженсен, Р; Немет, Л. (18 октября 2002 г.). «Селективное и формоселективное окисление ароматических альдегидов и циклических кетонов по Байеру-Виллигеру с помощью Sn-бета-цеолитов и H2O2». Химия: Европейский журнал . 8 (20): 4708–17. doi : 10.1002/1521-3765(20021018)8:20<4708::AID-CHEM4708>3.0.CO;2-U . ISSN 1521-3765 . ПМИД 12561111 .
- ^ Jump up to: а б с Лейш, Ханнес; Морли, Криста; Лау, Питер С.К. (13 июля 2011 г.). «Монооксигеназы Байера-Виллигера: больше, чем просто зеленая химия» . Химические обзоры . 111 (7): 4165–4222. дои : 10.1021/cr1003437 . ISSN 0009-2665 . ПМИД 21542563 .
- ^ Шэн, Давэй; Баллоу, Дэвид П.; Мэсси, Винсент (1 сентября 2001 г.). «Механистические исследования циклогексанонмонооксигеназы: химические свойства промежуточных продуктов, участвующих в катализе». Биохимия . 40 (37): 11156–11167. дои : 10.1021/bi011153h . ISSN 0006-2960 . ПМИД 11551214 .
- ^ Поляк, Яков; Ритц, Манфред Т.; Тиль, Уолтер (8 февраля 2012 г.). «Квантово-механическое/молекулярно-механическое исследование механизма ферментативной реакции Байера-Виллигера». Журнал Американского химического общества . 134 (5): 2732–2741. дои : 10.1021/ja2103839 . ISSN 0002-7863 . ПМИД 22239272 .
- ^ ван Беркель, WJH; Камербек, Нью-Мексико; Фрайе, М.В. (5 августа 2006 г.). «Флавопротеинмонооксигеназы, разнообразный класс окислительных биокатализаторов» . Журнал биотехнологии . 124 (4): 670–689. doi : 10.1016/j.jbiotec.2006.03.044 . hdl : 11370/99a1ac5c-d4a4-4612-90a3-4fe1d4d03a11 . ISSN 0168-1656 . ПМИД 16712999 .
- ^ Иянаги, Такаши (1 января 2007 г.). «Молекулярный механизм ферментов фазы I и фазы II, метаболизирующих лекарства: значение для детоксикации» . Международный обзор цитологии . 260 . Академическая пресса: 35–112. дои : 10.1016/S0074-7696(06)60002-8 . ISBN 9780123741141 . ПМИД 17482904 .
- ^ Фиорентини, Филиппо; Гейер, Мартина; Бинда, Клаудия; Винклер, Маргит; Фабер, Курт; Холл, Мелани; Маттеви, Андреа (15 апреля 2016 г.). «Биокаталитическая характеристика человеческого FMO5: обнаружение реакций Байера-Виллигера у людей». АКС Химическая биология . 11 (4): 1039–1048. дои : 10.1021/acschembio.5b01016 . ISSN 1554-8929 . ПМИД 26771671 .
- ^ Jump up to: а б Фюрст, Максимилиан JLJ; Гран Шойх, Алехандро; Ольберс, Фрисо С.; Фрайе, Марко В. (6 декабря 2019 г.). «Монооксигеназы Байера-Виллигера: настраиваемые окислительные биокатализаторы» . АКС-катализ . 9 (12): 11207–11241. дои : 10.1021/acscatal.9b03396 .
- ^ Фюрст, Максимилиан JLJ; Ромеро, Эльвира; Гомес Кастельянос, Х. Рубен; Фраайе, Марко В.; Маттеви, Андреа (7 декабря 2018 г.). «Обрезка боковой цепи оказывает ограниченное влияние на предпочтение субстрата в беспорядочном ферменте» . АКС-катализ . 8 (12): 11648–11656. дои : 10.1021/acscatal.8b03793 . ПМК 6345240 . PMID 30687578 .
- ^ Фюрст, Максимилиан JLJ; Бунстра, Марджон; Бандстра, Селле; Фрайе, Марко В. (2019). «Стабилизация циклогексанонмонооксигеназы путем компьютерного и экспериментального проектирования библиотеки» . Биотехнология и биоинженерия . 116 (9): 2167–2177. дои : 10.1002/бит.27022 . ISSN 1097-0290 . ПМК 6836875 . ПМИД 31124128 .
- ^ Ли, Гуанъюэ; Гарсиа-Боррас, Марк; Фюрст, Максимилиан JLJ; Илие, Адриана; Фраайе, Марко В.; Хоук, К.Н.; Ритц, Манфред Т. (22 августа 2018 г.). «Преодоление традиционных электронных эффектов в биокаталитических реакциях Байера – Виллигера посредством направленной эволюции» . Журнал Американского химического общества . 140 (33): 10464–10472. дои : 10.1021/jacs.8b04742 . ISSN 0002-7863 . ПМК 6314816 . ПМИД 30044629 .
- ^ Левин, Сеймур Д.; Адамс, Ричард Э.; Чен, Роберт; Коттер, Мэри Лу; Хирш, Аллен Ф.; Кейн, Винаяк В.; Каноджиа, Рамеш М.; Шоу, Чарльз; Вахтер, Майкл П.; Чин, Ева; Хюттеманн, Ричард; Островский, Пол (1979). «Зоапатанол и монтанол, новые оксепандитерпеноиды из мексиканского растения зоапатле ( Montanoa tomentosa )». Дж. Ам. хим. Соц . 101 (12): 3405–3407. дои : 10.1021/ja00506a057 .
- ^ Jump up to: а б Кейн, Винаяк В.; Дойл, Дональд Л. (1981). «Полный синтез (±) зоапатанола: стереоспецифический синтез ключевого промежуточного продукта». Тетраэдр Летт . 22 (32): 3027–3030. дои : 10.1016/S0040-4039(01)81818-9 .
- ^ Jump up to: а б Кейн, Винаяк В.; Дойл, Дональд Л. (1981). «Полный синтез (±) зоапатанола». Тетраэдр Летт . 22 (32): 3031–3034. дои : 10.1016/S0040-4039(01)81819-0 .
- ^ Свиздор, Алина (2013). «Окисление Байером-Виллигером некоторых стероидов C19 Penicillium lanosocoeruleum » . Молекулы . 18 (11): 13812–13822. дои : 10.3390/molecules181113812 . ПМК 6270215 . ПМИД 24213656 .