Разрыхляющая молекулярная орбиталь
Эта статья нуждается в дополнительных цитатах для проверки . ( август 2012 г. ) |
Эта статья включает список общих ссылок , но в ней отсутствуют достаточные соответствующие встроенные цитаты . ( Август 2012 г. ) |

В теоретической химии орбиталь — это тип молекулярной орбитали , который ослабляет химическую связь между двумя атомами и помогает повысить энергию молекулы разрыхляющая по сравнению с разделенными атомами. Такая орбиталь имеет один или несколько узлов в области связи между ядрами . Плотность на орбитали сосредоточена за пределами области связи и электронов . оттягивает одно ядро от другого и имеет тенденцию вызывать взаимное отталкивание между двумя атомами [1] [2] В этом отличие от связывающей молекулярной орбитали , которая имеет более низкую энергию, чем у отдельных атомов, и отвечает за химические связи.
Двухатомные молекулы
[ редактировать ]Разрыхляющие молекулярные орбитали (МО) обычно имеют более высокую энергию, чем связывающие молекулярные орбитали. Связывающие и разрыхляющие орбитали образуются, когда атомы объединяются в молекулы. [3] Если два атома водорода изначально находятся далеко друг от друга, они имеют одинаковые атомные орбитали . Однако по мере того, как расстояние между двумя атомами становится меньше, волновые функции электронов начинают перекрываться. Принцип Паули запрещает любым двум электронам (e-) в молекуле иметь одинаковый набор квантовых чисел . [4] Поэтому каждая исходная атомная орбиталь изолированных атомов (например, энергетический уровень основного состояния, 1 s ) распадается на две молекулярные орбитали, принадлежащие паре: одну ниже по энергии, чем исходный атомный уровень, и одну выше. Орбиталь, находящаяся в более низком энергетическом состоянии, чем орбитали отдельных атомов, является связывающей орбиталью, которая более стабильна и способствует связыванию двух атомов H в H 2 . Орбиталь с более высокой энергией — это разрыхляющая орбиталь, которая менее стабильна и противодействует связыванию, если она занята. В такой молекуле, как H 2 , два электрона обычно занимают связывающую орбиталь с более низкой энергией, так что молекула более стабильна, чем отдельные атомы H.
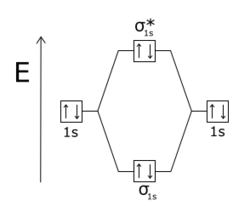
Молекулярная орбиталь становится разрыхляющей, когда между двумя ядрами меньше электронная плотность , чем было бы, если бы связывающего взаимодействия вообще не было. [5] Когда молекулярная орбиталь меняет знак (с положительного на отрицательный) в узловой плоскости между двумя атомами, говорят, что она является разрыхляющей по отношению к этим атомам . Разрыхляющие орбитали часто обозначаются звездочкой ( *) на диаграммах молекулярных орбиталей.
В гомоядерных двухатомных молекулах разрыхляющие орбитали σ* ( сигма-звезда ) не имеют узловых плоскостей, проходящих через два ядра, как сигма-связи , а орбитали π* ( пи-звезда ) имеют одну узловую плоскость, проходящую через два ядра, как связи пи . Принцип Паули гласит, что никакие два электрона во взаимодействующей системе не могут иметь одинаковое квантовое состояние. Если связывающие орбитали заполнены, то любые дополнительные электроны займут разрыхляющие орбитали. Это происходит в молекуле He 2 , у которой заполнены обе орбитали 1sσ и 1sσ*. [6] Поскольку разрыхляющая орбиталь является более разрыхляющей, чем связывающая орбиталь , молекула имеет более высокую энергию, чем два отдельных атома гелия, и поэтому она нестабильна.
Многоатомные молекулы
[ редактировать ]
В молекулах с несколькими атомами некоторые орбитали могут быть делокализованы по более чем двум атомам. Определенная молекулярная орбиталь может быть связывающей по отношению к некоторым соседним парам атомов и разрыхляющей по отношению к другим парам . Если связывающие взаимодействия превышают количество разрыхляющих взаимодействий, МО называют связывающей , тогда как, если разрыхляющих взаимодействий больше, чем связывающих, молекулярная орбиталь называется разрыхляющей .
Например, бутадиен имеет пи-орбитали , которые делокализованы по всем четырем атомам углерода. заняты две связывающие пи-орбитали В основном состоянии : π 1 — связь между всеми атомами углерода, π 2 — связь между C 1 и C 2 и между C 3 и C 4 и разрыхление между C 2 и C 3 . Существуют также разрыхляющие пи-орбитали с двумя и тремя разрыхляющими взаимодействиями, как показано на схеме; они свободны в основном состоянии , но могут быть заняты в возбужденных состояниях .
Точно так же бензол с шестью атомами углерода имеет три связывающие пи-орбитали и три разрыхляющие пи-орбитали.Поскольку каждый атом углерода вносит один электрон в π-систему бензола, есть шесть пи-электронов, которые заполняют три пи-орбитали молекул с самой низкой энергией (связывающие пи-орбитали).
Разрыхляющие орбитали также важны для объяснения химических реакций с точки зрения теории молекулярных орбиталей. Роальд Хоффманн и Кеничи Фукуи получили Нобелевскую премию по химии 1981 года за свою работу и дальнейшее развитие качественных молекулярно-орбитальных объяснений химических реакций. [7]
См. также
[ редактировать ]- Связывающая молекулярная орбиталь
- Валентность и зоны проводимости
- Теория валентной связи
- Теория молекулярных орбиталей
- Сопряженная система
Ссылки
[ редактировать ]- ^ Аткинс П. и де Паула Дж. Аткинс Физическая химия . 8-е изд. (WH Freeman 2006), стр.371. ISBN 0-7167-8759-8
- ^ Мисслер Г.Л. и Тарр Д.А., Неорганическая химия , 2-е изд. (Прентис-Холл 1999), стр.111. ISBN 0-13-841891-8
- ^ «Молекулярная орбиталь — обзор | Темы ScienceDirect» .
- ^ «Химическая связь - влияние принципа Паули на химическое связывание» .
- ^ Нордхольм, Стуре; Бакскай, Джордж Б. (2020). «Основы ковалентной связи с точки зрения энергии и динамики» . Молекулы . 25 (11): 2667. doi : 10,3390/molecules25112667 . ПМЦ 7321125 . ПМИД 32521828 .
- ^ «2.1. Объединение атомных орбиталей, сигма- и пи-связей | Органическая химия 1: Открытый учебник» .
- ^ «Нобелевская премия по химии 1981 года» . Нобелевская премия.org. Архивировано из оригинала 21 декабря 2008 года . Проверено 15 марта 2022 г.
Дальнейшее чтение
[ редактировать ]- Орчин, М. Яффе, Х.Х. (1967) Важность разрыхляющих орбиталей . Хоутон Миффлин. ISBN B0006BPT5O