Уровень энергии

| Часть серии статей о |
| Квантовая механика |
|---|
Квантово -механическая система или частица , которая связана , то есть ограничена в пространстве, может принимать только определенные дискретные значения энергии, называемые уровнями энергии . Это контрастирует с классическими частицами, которые могут иметь любое количество энергии. Этот термин обычно используется для энергетических уровней электронов в атомах , ионах или молекулах , которые связаны электрическим полем ядра , но может также относиться к энергетическим уровням ядер или колебательным или вращательным энергетическим уровням в молекулах. Энергетический спектр системы с такими дискретными уровнями энергии называется квантованным .
В химии и атомной физике электронную оболочку или главный энергетический уровень можно рассматривать как орбиту одного или электронов вокруг атома ядра нескольких . Ближайшая к ядру оболочка называется « оболочкой 1 » (также называемой «оболочкой К»), за ней следует « оболочка 2 » (или «оболочка L»), а затем « оболочка 3 » (или «оболочка М»). , и так далее все дальше от ядра. Оболочки соответствуют главным квантовым числам ( n = 1, 2, 3, 4...) или помечены в алфавитном порядке буквами, используемыми в рентгеновских обозначениях (K, L, M, N...).
Каждая оболочка может содержать только фиксированное количество электронов: первая оболочка может содержать до двух электронов, вторая оболочка может содержать до восьми (2 + 6) электронов, третья оболочка может содержать до 18 (2 + 6 + 10 электронов). ) и так далее. Общая формула такова: n- я оболочка в принципе может вместить до 2 n 2 электроны. [1] Поскольку электроны электрически притягиваются к ядру, электроны атома обычно занимают внешние оболочки только в том случае, если более внутренние оболочки уже полностью заполнены другими электронами. Однако это не строгое требование: атомы могут иметь две и даже три неполные внешние оболочки. (Более подробную информацию см. в правиле Маделунга .) Объяснение того, почему электроны существуют в этих оболочках, см. в разделе «Конфигурация электронов» . [2]
Если потенциальная энергия равна нулю на бесконечном расстоянии от атомного ядра или молекулы (обычное соглашение), то связанные электронные состояния имеют отрицательную потенциальную энергию.
Если атом, ион или молекула находится на самом низком энергетическом уровне, говорят, что он и его электроны находятся в основном состоянии . Если он находится на более высоком энергетическом уровне, его называют возбужденным , любые электроны, энергия которых выше, чем у основного состояния или возбуждаются . Уровень энергии считается вырожденным, если с ним связано более одного измеримого квантовомеханического состояния .
Объяснение [ править ]
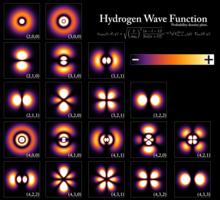
Квантованные уровни энергии возникают в результате волнового поведения частиц, что определяет связь между энергией частицы и ее длиной волны . Для ограниченной частицы, такой как электрон в атоме , волновые функции с четко определенной энергией имеют форму стоячей волны . [3] Состояния с четко определенной энергией называются стационарными состояниями , поскольку это состояния, которые не меняются во времени. Неформально эти состояния соответствуют целому числу длин волн волновой функции по замкнутому пути (путь, который заканчивается там, где он начался), например, круговой орбите вокруг атома, где количество длин волн дает тип атомной орбитали (0 для s-орбиталей, 1 для p-орбиталей и так далее). Элементарными примерами, которые математически показывают, как возникают энергетические уровни, являются частица в ящике и квантовый гармонический осциллятор .
Любая суперпозиция ( линейная комбинация ) энергетических состояний также является квантовым состоянием, но такие состояния изменяются со временем и не имеют четко определенных энергий. Измерение энергии приводит к коллапсу волновой функции, что приводит к появлению нового состояния, состоящего только из одного энергетического состояния. Измерение возможных уровней энергии объекта называется спектроскопией .
История [ править ]
Первым свидетельством квантования в атомах было наблюдение спектральных линий в солнечном свете в начале 1800-х годов Йозефом фон Фраунгофером и Уильямом Хайдом Волластоном . Понятие энергетических уровней было предложено в 1913 году датским физиком Нильсом Бором в Бора теории атома . Современная квантовомеханическая теория, объясняющая эти уровни энергии с помощью уравнения Шредингера, была выдвинута Эрвином Шредингером и Вернером Гейзенбергом в 1926 году.
Атомы [ править ]
энергии Внутренние уровни
В приведенных ниже формулах энергии электронов на различных уровнях в атоме нулевая точка энергии устанавливается тогда, когда рассматриваемый электрон полностью покинул атом; электрона т.е. когда главное квантовое число n = ∞ . Когда электрон связан с атомом при любом более близком значении n , энергия электрона ниже и считается отрицательной.
ион с ядром + электрон Уровень энергии орбитального состояния: атом / один
находится один электрон на данной атомной орбитали Предположим, что в водородоподобном атоме (ионе) . Энергия его состояния определяется главным образом электростатическим взаимодействием (отрицательного) электрона с (положительным) ядром. Энергетические уровни электрона вокруг ядра определяются формулой:
(обычно от 1 эВ до 10 3 эВ),
где R ∞ — постоянная Ридберга , Z — атомный номер , n — главное квантовое число , h — постоянная Планка , а c — скорость света . Только для водородоподобных атомов (ионов) уровни Ридберга зависят только от главного квантового числа n .
Это уравнение получено путем объединения формулы Ридберга для любого водородоподобного элемента (показанной ниже) с E = h ν = h c / λ в предположении, что главное квантовое число n, указанное выше, = n 1 в формуле Ридберга и n 2 = ∞ (главное квантовое число энергетического уровня, с которого спускается электрон при испускании фотона ). Формула Ридберга была выведена на основе эмпирических данных спектроскопической эмиссии .
Эквивалентная формула может быть получена квантово-механически из независимого от времени уравнения Шредингера с оператором Гамильтона кинетической энергии, использующим волновую функцию в качестве собственной функции для получения уровней энергии в качестве собственных значений , но константа Ридберга будет заменена другими фундаментальными физическими константами.
Электрон-электронные взаимодействия в атомах [ править ]
Если вокруг атома находится более одного электрона, электрон-электронные взаимодействия повышают энергетический уровень. Этими взаимодействиями часто пренебрегают, если пространственное перекрытие волновых функций электронов мало.
Для многоэлектронных атомов взаимодействия между электронами приводят к тому, что предыдущее уравнение перестает быть точным, как указано просто с Z в качестве атомного номера . Простой (хотя и не полный) способ понять это — это эффект экранирования , когда внешние электроны видят эффективное ядро с уменьшенным зарядом, поскольку внутренние электроны прочно связаны с ядром и частично компенсируют его заряд. Это приводит к приблизительной поправке, в которой Z заменяется эффективным зарядом ядра , обозначаемым как Z eff , который сильно зависит от главного квантового числа.
В таких случаях типы орбиталей (определяемые азимутальным квантовым числом ℓ ), а также их уровни внутри молекулы влияют на Z eff и, следовательно, также влияют на различные уровни энергии атомных электронов. Принцип Ауфбау по заполнению атома электронами для электронной конфигурации учитывает эти различные энергетические уровни. При заполнении атома электронами в основном состоянии сначала заполняются самые низкие энергетические уровни, что соответствует принципу Паули , принципу Ауфбау и правилу Хунда .
Расщепление тонкой структуры [ править ]
Тонкая структура возникает из-за поправок к релятивистской кинетической энергии, спин-орбитального взаимодействия и движением электрона (электродинамического взаимодействия между спином и электрическим полем ядра) и члена Дарвина (контактного взаимодействия s- оболочки [ который? ] электроны внутри ядра). Они влияют на уровни типично порядка 10 −3 эВ.
Сверхтонкая структура [ править ]
Эта еще более тонкая структура обусловлена спин-спиновым взаимодействием электрона и ядра , что приводит к типичному изменению энергетических уровней на типичный порядок величины 10. −4 эВ.
обусловленные внешними Уровни энергии , полями
Эффект Зеемана [ править ]
Существует энергия взаимодействия, связанная с магнитным дипольным моментом µ L , возникающим из электронного орбитального углового момента L , определяемого выражением
с
- .
Дополнительно учитывается магнитный момент, возникающий из-за спина электрона.
Из-за релятивистских эффектов ( уравнение Дирака ) существует магнитный момент µ S , возникающий из-за спина электрона.
- ,
где g S спина электрона - g-фактор (около 2), что приводит к полному магнитному моменту μ ,
- .
Таким образом, энергия взаимодействия становится
- .
Эффект Старка [ править ]
Молекулы [ править ]
Химические связи между атомами в молекуле образуются потому, что они делают ситуацию более стабильной для вовлеченных атомов, что обычно означает, что суммарный уровень энергии участвующих атомов в молекуле ниже, чем если бы атомы не были так связаны. Когда отдельные атомы приближаются друг к другу, образуя ковалентную связь , их орбитали влияют на энергетические уровни друг друга, образуя связывающие и разрыхляющие молекулярные орбитали . Энергетический уровень связывающих орбиталей ниже, а энергетический уровень разрыхляющих орбиталей выше. Чтобы связь в молекуле была стабильной, ковалентные связывающие электроны занимают нижнюю энергетическую связывающую орбиталь, что в зависимости от ситуации может обозначаться такими символами, как σ или π. Соответствующие разрыхляющие орбитали можно обозначить добавлением звездочки, чтобы получить орбитали σ* или π*. в Несвязывающая орбиталь молекуле — это орбиталь, на внешних оболочках которой находятся электроны, не участвующие в связывании, и ее энергетический уровень такой же, как у составного атома. Такие орбитали можно обозначить как n орбиталей. Электроны на n-орбитали обычно представляют собой неподеленные пары . [4] В многоатомных молекулах также задействованы различные колебательные и вращательные уровни энергии.
Грубо говоря, энергетическое состояние молекулы (т.е. собственное состояние молекулярного гамильтониана ) представляет собой сумму электронных, колебательных, вращательных, ядерных и поступательных компонентов, таких что:
где Eэлектрон — электронного собственное значение молекулярного гамильтониана (значение поверхности потенциальной энергии ) в равновесной геометрии молекулы .
Уровни молекулярной энергии обозначены символами молекулярных терминов . Удельные энергии этих компонентов варьируются в зависимости от конкретного энергетического состояния и вещества.
Диаграммы уровней энергии [ править ]
Существуют различные типы диаграмм энергетических уровней связей между атомами в молекуле.
- Примеры
- Молекулярные орбитальные диаграммы , диаграммы Яблонского и Франка-Кондона . диаграммы
энергетических уровней Переходы


Электроны в атомах и молекулах могут менять (совершать переходы ) энергетические уровни, испуская или поглощая фотон ( электромагнитного излучения ), энергия которого должна быть точно равна разнице энергий между двумя уровнями.
Электроны также можно полностью удалить из химического вещества, такого как атом, молекула или ион . Полное удаление электрона из атома может быть формой ионизации , которая эффективно перемещает электрон на орбиталь с бесконечным главным квантовым числом , фактически настолько далеко, что практически не оказывает никакого влияния на оставшийся атом ( ион). Для различных типов атомов существуют 1-я, 2-я, 3-я и т. д. энергии ионизации для удаления соответственно 1-го, затем 2-го, затем 3-го и т. д. электронов высшей энергии из атома, первоначально находящегося в основном состоянии . Энергия в соответствующих противоположных количествах также может высвобождаться, иногда в форме энергии фотонов , когда электроны присоединяются к положительно заряженным ионам, а иногда и к атомам. Молекулы также могут претерпевать переходы на своих колебательных или вращательных энергетических уровнях. Переходы энергетических уровней также могут быть безызлучательными, то есть испускание или поглощение фотона не происходит.
Если атом, ион или молекула находится на самом низком энергетическом уровне, говорят, что он и его электроны находятся в основном состоянии . Если он находится на более высоком энергетическом уровне, его называют возбужденным , любые электроны, энергия которых выше, чем у основного состояния или возбуждаются . Такой вид можно перевести на более высокий энергетический уровень, поглотив фотон, энергия которого равна разнице энергий между уровнями. И наоборот, возбужденный вид может перейти на более низкий энергетический уровень, спонтанно излучая фотон, равный разнице энергий. Энергия фотона равна постоянной Планка ( h ), умноженной на его частоту ( f ), и, таким образом, пропорциональна его частоте или обратно пропорциональна его длине волны ( λ ). [4]
- Δ E знак равно час ж знак равно час c / λ ,
поскольку c , скорость света, равна f λ [4]
Соответственно, многие виды спектроскопии основаны на обнаружении частоты или длины волны испускаемых или поглощаемых фотонов для получения информации об анализируемом материале, включая информацию об энергетических уровнях и электронной структуре материалов, полученную путем анализа спектра .
Звездочка обычно используется для обозначения возбужденного состояния. Переход электрона в связи молекулы из основного состояния в возбужденное состояние может иметь такое обозначение, как σ → σ*, π → π* или n → π*, что означает возбуждение электрона из σ-связывающей на σ- разрыхляющую орбиталь. , от π-связывающей к π-разрыхляющей орбитали или от n-несвязывающей орбитали к π-разрыхляющей орбитали. [4] [5] Обратные электронные переходы для всех этих типов возбужденных молекул также возможны с возвращением в их основные состояния, которые можно обозначить как σ* → σ, π* → π или π* → n.
Переход на энергетическом уровне электрона в молекуле можно объединить с колебательным переходом и назвать вибронным переходом . Колебательный и вращательный переход можно объединить посредством колебательно-колебательной связи . В ровибронной связи электронные переходы одновременно сочетаются как с колебательными, так и с вращательными переходами. Фотоны, участвующие в переходах, могут иметь энергию различных диапазонов электромагнитного спектра, например рентгеновское , ультрафиолетовое , видимое , инфракрасное или микроволновое излучение, в зависимости от типа перехода. В самом общем смысле, различия в энергетических уровнях между электронными состояниями больше, различия между колебательными уровнями являются промежуточными, а различия между вращательными уровнями меньше, хотя они могут перекрываться. Уровни поступательной энергии практически непрерывны и могут быть рассчитаны как кинетическая энергия с использованием классической механики .
Более высокая температура заставляет атомы и молекулы жидкости двигаться быстрее, увеличивая их поступательную энергию, и термически возбуждает молекулы до более высоких средних амплитуд колебательных и вращательных мод (возбуждает молекулы до более высоких уровней внутренней энергии). Это означает, что по мере повышения температуры поступательные, колебательные и вращательные вклады в молекулярную теплоемкость позволяют молекулам поглощать тепло и удерживать больше внутренней энергии . Теплопроводность обычно происходит при столкновении молекул или атомов, передающих тепло друг другу. При еще более высоких температурах электроны могут быть термически возбуждены на орбитали с более высокой энергией в атомах или молекулах. Последующее падение электрона на более низкий энергетический уровень может выпустить фотон, вызывая, возможно, цветное свечение.
Электрон, находящийся дальше от ядра, имеет более высокую потенциальную энергию, чем электрон, расположенный ближе к ядру, поэтому он становится менее связанным с ядром, поскольку его потенциальная энергия отрицательна и обратно зависит от его расстояния от ядра. [6]
Кристаллические материалы [ править ]
кристаллические твердые тела Обнаружено, что имеют энергетические зоны вместо энергетических уровней или в дополнение к ним. Электроны могут принимать любую энергию в незаполненной зоне. На первый взгляд это кажется исключением из требования к энергетическим уровням. Однако, как показано в зонной теории , энергетические зоны на самом деле состоят из множества дискретных энергетических уровней, которые расположены слишком близко друг к другу, чтобы их можно было различить. Внутри зоны количество уровней порядка числа атомов в кристалле, поэтому, хотя электроны на самом деле ограничены этими энергиями, они, по-видимому, способны принимать континуум значений. Важными энергетическими уровнями в кристалле являются верх валентной зоны , низ зоны проводимости , уровень Ферми , уровень вакуума и уровни энергии любых дефектных состояний в кристалле.
См. также [ править ]
Ссылки [ править ]
- ^ Re: Почему у электронных оболочек есть ограничения? madsci.org, 17 марта 1999 г., Дэн Бергер, факультет химии/естественных наук, Блаффтон-колледж
- ^ Электронные подоболочки . Источник коррозии. Проверено 1 декабря 2011 г.
- ^ Типлер, Пол А.; Моска, Джин (2004). Физика для ученых и инженеров, 5-е изд . Том. 2. WH Freeman and Co. с. 1129. ИСБН 0716708108 .
- ↑ Перейти обратно: Перейти обратно: а б с д Спектры поглощения УФ-видимой области
- ^ Теория ультрафиолето-видимой (УФ-Вид) спектроскопии
- ^ «Электронная плотность и потенциальная энергия» . Архивировано из оригинала 18 июля 2010 г. Проверено 7 октября 2010 г.









