Принцип конструкции
| Часть серии о |
| Периодическая таблица |
|---|
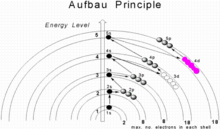 |
В атомной физике и квантовой химии Ауфбау ( / ˈaʊ f принцип b aʊ / , от немецкого : Aufbauprinzip , букв. принцип наращивания »), также называемый правилом Ауфбау , утверждает, что в основном состоянии атома « или ионе электроны В сначала заполняют подоболочки с наименьшей доступной энергией , затем заполняют подоболочки с более высокой энергией. Например, подоболочка 1s заполняется до того, как будет занята подоболочка 2s. Таким образом, электроны атома или иона образуют наиболее стабильную электронную конфигурацию . Примером является конфигурация 1s. 2 2 с 2 2р 6 3 с 2 3р 3 для атома фосфора это означает, что подоболочка 1s имеет 2 электрона и так далее.
Конфигурацию часто сокращают, явно записывая только валентные электроны , а электроны ядра заменяются символом последнего предыдущего благородного газа в таблице Менделеева , помещенным в квадратные скобки. Для фосфора последним предыдущим благородным газом является неон, поэтому конфигурация сокращается до [Ne] 3s. 2 3р 3 , где [Ne] означает основные электроны, конфигурация которых в фосфоре идентична конфигурации неона.
Поведение электрона разрабатывается другими принципами атомной физики , такими как правило Хунда и принцип исключения Паули . Правило Хунда утверждает, что если несколько орбиталей одинаковой энергии доступно , электроны будут занимать разные орбитали по отдельности и с одинаковым спином , прежде чем какая-либо из них будет занята дважды. Если двойное заселение действительно имеет место, принцип Паули требует, чтобы электроны, занимающие одну и ту же орбиталь, имели разные спины (+ 1 ⁄ 2 и − 1 ⁄ 2 ).
При переходе от одного элемента к другому со следующим более высоким атомным номером один протон к нейтральному атому каждый раз добавляется и один электрон.Максимальное количество электронов в любой оболочке — 2 n 2 , где n — главное квантовое число .Максимальное число электронов в подоболочке равно 2(2 l + 1), где азимутальное квантовое число l равно 0, 1, 2 и 3 для подоболочек s, p, d и f, так что максимальное количество электронов составляет 2, 6, 10 и 14 соответственно. В основном состоянии электронная конфигурация может быть построена путем размещения электронов в самой нижней доступной подоболочке до тех пор, пока общее количество добавленных электронов не станет равным атомному номеру. Таким образом, подоболочки заполняются в порядке возрастания энергии с использованием двух общих правил, помогающих предсказывать электронные конфигурации:
- Электроны распределяются по подоболочкам в порядке возрастания значения n + l .
- Для подоболочек с одинаковым значением n + l электроны сначала отдаются подоболочке с меньшим n .
Версия принципа Ауфбау, известная как модель ядерной оболочки, используется для предсказания конфигурации протонов и нейтронов в атомном ядре . [1]
Правило заказа энергии Маделунга
[ редактировать ]

В нейтральных атомах приблизительный порядок заполнения подоболочек определяется правилом n + l , также известным как:
- Правило Маделунга (по Эрвину Маделунгу )
- Правило Джанет (после Чарльза Джанет )
- Правило Клечковского (по Всеволоду Клечковскому )
- Правило Висвессера (после Уильяма Висвессера )
- правило ауфбау (наращивания) или
- диагональное правило [2]
Здесь n представляет собой главное квантовое число, а l — азимутальное квантовое число; значения l = 0, 1, 2, 3 соответствуют подоболочкам s, p, d и f соответственно. Подоболочки с меньшим значением n + l заполняются раньше подоболочек с более высокими значениями n + l . Во многих случаях равных значений n + l подоболочка с меньшим значением n сначала заполняется . Порядок подоболочек по этому правилу следующий: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, 8s, 5g, . .. Например, таллий ( Z = 81) имеет конфигурацию основного состояния 1s 2 2 с 2 2р 6 3 с 2 3р 6 4 с 2 3d 10 4р 6 5 с 2 4д 10 5 пенсов 6 6 с 2 4 ж 14 5д 10 6р 1 [3] или в конденсированной форме, [Xe]6s 2 4 ж 14 5д 10 6р 1 .
Другие авторы записывают подоболочки вне ядра благородного газа в порядке увеличения n или, если они равны, увеличения n + l , например Tl ( Z = 81) [Xe]4f 14 5д 10 6 с 2 6р 1 . [4] Они делают это, чтобы подчеркнуть, что если этот атом ионизирован , электроны покидают его примерно в порядке 6p, 6s, 5d, 4f и т. д. Кстати, такое написание конфигураций подчеркивает крайние электроны и их участие в химической связи.
В целом подоболочки с одинаковым значением n + l имеют схожие энергии, но s-орбитали (с l = 0) являются исключительными: их энергетические уровни заметно далеки от уровней энергии их группы n + l и ближе к уровням энергии группы n + l. следующая n + l группа. Вот почему периодическую таблицу обычно рисуют сначала с элементов s-блока. [5]
Правило энергетического упорядочения Маделунга применимо только к нейтральным атомам в их основном состоянии. Существует двадцать элементов (одиннадцать в d-блоке и девять в f-блоке), для которых правило Маделунга предсказывает электронную конфигурацию, отличную от определенной экспериментально, хотя предсказанные Маделунгом электронные конфигурации по крайней мере близки к основному состоянию. даже в таких случаях.
В одном учебнике по неорганической химии правило Маделунга описывается как, по сути, приблизительное эмпирическое правило, хотя и с некоторым теоретическим обоснованием, основанное на модели атома Томаса-Ферми как многоэлектронной квантово-механической системы. [4]
Исключения в d-блоке
[ редактировать ]Валентная . d-подоболочка «заимствует» один электрон (в случае палладия два электрона) у валентной s-подоболочки
| Атом | 24 Кр | 29 меди | 41 НБ | 42 мес. | 44 Ру | 45 резус | 46 ПД | 47 Аг | 78 баллов | 79 Ау | 103 лр |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Электроны ядра | [С] | [С] | [кр] | [кр] | [кр] | [кр] | [кр] | [кр] | [Транспортное средство] 4f 14 | [Транспортное средство] 4f 14 | [Рн] 5f 14 |
| Правило Маделунга | 3d 4 4 с 2 | 3d 9 4 с 2 | 4д 3 5 с 2 | 4д 4 5 с 2 | 4д 6 5 с 2 | 4д 7 5 с 2 | 4д 8 5 с 2 | 4д 9 5 с 2 | 5д 8 6 с 2 | 5д 9 6 с 2 | 6д 1 7 с 2 |
| Экспериментальный | 3d 5 4 с 1 | 3d 10 4 с 1 | 4д 4 5 с 1 | 4д 5 5 с 1 | 4д 7 5 с 1 | 4д 8 5 с 1 | 4д 10 | 4д 10 5 с 1 | 5д 9 6 с 1 | 5д 10 6 с 1 | 7 с 2 7р 1 |
Например, в меди 29 Cu согласно правилу Маделунга подоболочка 4s ( n + l = 4 + 0 = 4) занята раньше подоболочки 3d ( n + l = 3 + 2 = 5). Затем правило предсказывает электронную конфигурацию 1s 2 2 с 2 2р 6 3 с 2 3р 6 3d 9 4 с 2 , сокращенно [Ar] 3d 9 4 с 2 где [Ar] обозначает конфигурацию аргона , предыдущего благородного газа. Однако измеренная электронная конфигурация атома меди равна [Ar] 3d 10 4 с 1 . Заполняя 3d-оболочку, медь может находиться в более низкоэнергетическом состоянии .
Особым исключением является лоуренсий 103 Lr, где электрон 6d, предсказанный правилом Маделунга, заменяется электроном 7p: правило предсказывает [Rn] 5f 14 6д 1 7 с 2 , но измеренная конфигурация [Rn] 5f 14 7 с 2 7р 1 .
Исключения в f-блоке
[ редактировать ]Валентная d-подоболочка часто «заимствует» один электрон (в случае тория два электрона) у валентной f-подоболочки. Например, в уране 92 U согласно правилу Маделунга подоболочка 5f ( n + l = 5 + 3 = 8) занята раньше подоболочки 6d ( n + l = 6 + 2 = 8). Затем это правило предсказывает электронную конфигурацию [Rn] 5f 4 7 с 2 где [Rn] обозначает конфигурацию радона , предшествующего благородного газа. Однако измеренная электронная конфигурация атома урана равна [Rn] 5f 3 6д 1 7 с 2 .
| Атом | 57 Ла | 58 CE | 64 Гд | 89 Ак | 90 тыс. | 91 Па | 9292У | 93 Нп | 96 см |
|---|---|---|---|---|---|---|---|---|---|
| Электроны ядра | [Машина] | [Машина] | [Машина] | [Рн] | [Рн] | [Рн] | [Рн] | [Рн] | [Рн] |
| Правило Маделунга | 4 ж 1 6 с 2 | 4 ж 2 6 с 2 | 4 ж 8 6 с 2 | 5ф 1 7 с 2 | 5ф 2 7 с 2 | 5ф 3 7 с 2 | 5ф 4 7 с 2 | 5ф 5 7 с 2 | 5ф 8 7 с 2 |
| Экспериментальный | 5д 1 6 с 2 | 4 ж 1 5д 1 6 с 2 | 4 ж 7 5д 1 6 с 2 | 6д 1 7 с 2 | 6д 2 7 с 2 | 5ф 2 6д 1 7 с 2 | 5ф 3 6д 1 7 с 2 | 5ф 4 6д 1 7 с 2 | 5ф 7 6д 1 7 с 2 |
Все эти исключения не очень актуальны для химии, так как различия в энергии весьма малы. [6] и присутствие соседнего атома может изменить предпочтительную конфигурацию. [7] Таблица Менделеева игнорирует их и следует идеализированным конфигурациям. [8] Они возникают в результате эффектов межэлектронного отталкивания; [6] [7] когда атомы положительно ионизированы, большинство аномалий исчезает. [6]
Предполагается, что вышеуказанные исключения будут единственными до элемента 120 , где оболочка 8s будет завершена. Исключением должен стать элемент 121 , запускающий g-блок, в котором ожидаемый 5g-электрон переносится на 8p (аналогично лоуренцию). После этого источники не пришли к единому мнению относительно предсказанных конфигураций, но из-за очень сильных релятивистских эффектов не ожидается, что будет намного больше элементов, которые будут показывать ожидаемую конфигурацию по правилу Маделунга за пределами 120. [9] Общая идея о том, что после двух элементов 8s следуют области химической активности 5g, затем 6f, затем 7d и затем 8p, тем не менее, по большей части верна, за исключением того, что теория относительности «расщепляет» оболочку 8p на стабилизированная часть (8p 1/2 , которая вместе с 8s действует как дополнительная покрывающая оболочка и медленно утопает в ядре в сериях 5g и 6f) и дестабилизированная часть (8p 3/2 , которая имеет почти ту же энергию, что и 9p 1/2 ), и что оболочка 8s заменяется оболочкой 9s в качестве покрывающей s-оболочки для элементов 7d. [9] [10]
История
[ редактировать ]Принцип Ауфбау в новой квантовой теории
[ редактировать ]
Этот принцип получил свое название от немецкого Aufbauprinzip , «принцип построения», а не от имени ученого. Она была сформулирована Нильсом Бором в начале 1920-х годов. [11] Это было раннее применение квантовой механики к свойствам электронов и объяснение химических свойств в физических терминах. Каждый добавленный электрон находится под действием электрического поля, создаваемого положительным зарядом атомного ядра и отрицательным зарядом других электронов, связанных с ядром. Хотя в водороде нет разницы в энергии между подоболочками с одинаковым главным квантовым числом n , это неверно для внешних электронов других атомов.
В старой квантовой теории, предшествовавшей квантовой механике, предполагалось, что электроны занимают классические эллиптические орбиты. Орбиты с наибольшим угловым моментом являются «круговыми орбитами» вне внутренних электронов, но орбиты с низким угловым моментом (s- и p-подоболочки) имеют высокий эксцентриситет подоболочки , так что они приближаются к ядру и ощущают в среднем меньшее количество движения. сильно экранированный ядерный заряд .
Вольфганга Паули , включающая эффекты спина электрона, дала более полное объяснение эмпирических правил ауфбау. Модель атома [11]
Правило n + l энергетического упорядочения
[ редактировать ]Таблица Менделеева, в которой каждая строка соответствует одному значению n + l (где значения n и l соответствуют главному и азимутальному квантовым числам соответственно), была предложена Шарлем Жане в 1928 году, а в 1930 году он подробно описал квантовый базис. этой закономерности, основанной на знании основных состояний атомов, определенных путем анализа атомных спектров . Эту таблицу стали называть таблицей левого шага. Джане «скорректировал» некоторые фактические значения n + l элементов, поскольку они не соответствовали его правилу энергетического упорядочения, и он считал, что соответствующие расхождения, должно быть, возникли из-за ошибок измерений. Как оказалось, фактические значения были правильными, и правило энергетического упорядочения n + l оказалось скорее приближением, чем идеальным соответствием, хотя для всех элементов, которые являются исключениями, регуляризованная конфигурация является низкоэнергетическим возбужденным состоянием, вполне достижимым. энергии химических связей.
В 1936 году немецкий физик Эрвин Маделунг предложил это как эмпирическое правило порядка заполнения атомных подоболочек, и поэтому большинство англоязычных источников ссылаются на правило Маделунга. Маделунг, возможно, знал об этой закономерности еще в 1926 году. [12] Российско-американский инженер Владимир Карапетов первым опубликовал это правило в 1930 году. [13] [14] хотя Джанет также опубликовала эту иллюстрацию в том же году.
В 1945 году американский химик Уильям Висвессер предположил, что подоболочки заполняются в порядке возрастания значений функции. [15]
Эта формула правильно предсказывает как первую, так и вторую части правила Маделунга (вторая часть заключается в том, что для двух подоболочек с одинаковым значением n + l первой заполняется та, у которой меньшее значение n ). Висвессер приводил доводы в пользу этой формулы, основываясь на структуре как угловых, так и радиальных узлов, концепции, теперь известной как орбитальное проникновение , и влиянии основных электронов на валентные орбитали.
В 1961 году русский агрохимик В. М. Клечковский предложил теоретическое объяснение важности суммы n + l , основанное на модели атома Томаса–Ферми. [16] Поэтому многие франко- и русскоязычные источники ссылаются на правило Клечковского. [17] '
Полное правило Маделунга было выведено на основе аналогичного потенциала в 1971 году Юрием Н. Демковым и Валентином Н. Островским. [18] Они рассмотрели потенциал
где и – постоянные параметры; это приближается к кулоновскому потенциалу для малых . Когда удовлетворяет условию
- ,
где для этого потенциала с нулевой энергией решения уравнения Шрёдингера могут быть описаны аналитически с помощью полиномов Гегенбауэра . Как проходит через каждое из этих значений, многообразие, содержащее все состояния с этим значением возникает при нулевой энергии, а затем становится связанным, восстанавливая порядок Маделунга. Применение теории возмущений показывает, что состояния с меньшими имеют меньшую энергию и что s-орбитали (с ) их энергии приближаются к следующему группа. [18] [19]
В последние годы замечено, что порядок заполнения подоболочек в нейтральных атомах не всегда соответствует порядку добавления или удаления электронов у данного атома. Например, в четвертой строке таблицы Менделеева правило Маделунга указывает, что подоболочка 4s занята перед подоболочкой 3d. Следовательно, конфигурация основного состояния нейтрального атома для K равна [Ar] 4s. 1 , Ca представляет собой [Ar] 4s 2 , Sc представляет собой [Ar] 4s 2 3d 1 и так далее. Однако если атом скандия ионизируется за счет удаления электронов (только), конфигурации различаются: Sc представляет собой [Ar] 4s. 2 3d 1 , наук + [ Ar ] 4s 1 3d 1 и Sc 2+ это [Ar] 3d 1 . Энергии подоболочек и их порядок зависят от заряда ядра; 4s ниже, чем 3d по правилу Маделунга в K с 19 протонами, но 3d ниже в Sc. 2+ с 21 протоном. Помимо того, что существует множество экспериментальных доказательств в поддержку этой точки зрения, это делает объяснение порядка ионизации электронов в этом и других переходных металлах более понятным, учитывая, что 4s-электроны неизменно преимущественно ионизируются. [20] Обычно правило Маделунга следует использовать только для нейтральных атомов; однако даже для нейтральных атомов есть исключения в d-блоке и f-блоке (как показано выше).
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Коттингем, Западная Нью-Йорк; Гринвуд, Д. (1986). «Глава 5: Свойства основного состояния ядер: оболочечная модель» . Введение в ядерную физику . Издательство Кембриджского университета. ISBN 0-521-31960-9 .
- ^ «Электронная конфигурация» . ВизАнт . 19 сентября 2013 г.
- ^ Мисслер, Гэри Л.; Тарр, Дональд А. (1998). Неорганическая химия (2-е изд.). Прентис Холл. п. 38. ISBN 0-13-841891-8 .
- ^ Jump up to: а б Джолли, Уильям Л. (1984). Современная неорганическая химия (1-е изд.). МакГроу-Хилл. стр. 10–12 . ISBN 0-07-032760-2 .
- ^ Островский В.Н. (1981). «Динамическая симметрия атомного потенциала». Физический журнал B: Атомная и молекулярная физика . 14 (23): 4425–4439 (4429). Бибкод : 1981JPhB...14.4425O . дои : 10.1088/0022-3700/14/23/008 .
- ^ Jump up to: а б с Йоргенсен, Кристиан (1973). «Слабая связь между электронной конфигурацией и химическим поведением тяжелых элементов (трансуранов)». Angewandte Chemie, международное издание . 12 (1): 12–19. дои : 10.1002/anie.197300121 .
- ^ Jump up to: а б Фейнман, Ричард; Лейтон, Роберт Б.; Сэндс, Мэтью (1964). «19. Атом водорода и периодическая таблица». Фейнмановские лекции по физике . Том. 3. Аддисон–Уэсли. ISBN 0-201-02115-3 .
- ^ Дженсен, Уильям Б. (2009). «Неправильное применение Периодического закона» . Журнал химического образования . 86 (10): 1186. Бибкод : 2009JChEd..86.1186J . дои : 10.1021/ed086p1186 .
- ^ Jump up to: а б Фрике, Буркхард (1975). «Сверхтяжелые элементы: предсказание их химических и физических свойств» . Недавнее влияние физики на неорганическую химию . Структура и связь. 21 : 89–144 . дои : 10.1007/BFb0116498 . ISBN 978-3-540-07109-9 . Проверено 4 октября 2013 г.
- ^ Пюиккё, Пекка (2016). С периодической таблицей всё в порядке («PT OK»)? (PDF) . Нобелевский симпозиум NS160 – Химия и физика тяжелых и сверхтяжелых элементов.
- ^ Jump up to: а б Краг, Хельге, «7 Теория химических элементов», Нильс Бор и квантовый атом: модель атомной структуры Бора 1913–1925 (Оксфорд, 2012; онлайн-издание, Oxford Academic, 24 мая 2012 г.), https:// doi.org/10.1093/acprof:oso/9780199654987.003.0007 , по состоянию на 23 февраля 2024 г.
- ^ Гаудсмит, ЮАР; Ричардс, Пол I. (1964). «Порядок электронных оболочек в ионизированных атомах» (PDF) . Учеб. Натл. акад. наук. 51 (4): 664–671 (с исправлением в вып. 5, стр. 906 ). Бибкод : 1964PNAS...51..664G . дои : 10.1073/pnas.51.4.664 . ПМК 300183 . ПМИД 16591167 .
- ^ Карапетов, Владимир (1930). «Диаграмма последовательных наборов электронных орбит внутри атомов химических элементов». Журнал Института Франклина . 210 (5): 609–624. дои : 10.1016/S0016-0032(30)91131-3 .
- ^ Островский, Валентин Н. (2003). «Физическое объяснение таблицы Менделеева». Анналы Нью-Йоркской академии наук . 988 (1): 182–192. Бибкод : 2003NYASA.988..182O . дои : 10.1111/j.1749-6632.2003.tb06097.x . ПМИД 12796101 . S2CID 21629328 .
- ^ Висвессер, Уильям Дж. (июль 1945 г.). «Периодическая система и атомная структура I. Элементарный физический подход» . Журнал химического образования . 22 (7): 314–322. Бибкод : 1945JChEd..22..314W . дои : 10.1021/ed022p314 . Проверено 5 сентября 2020 г.
- ^ Клечковский, В. М. (1962). «Обоснование правила последовательного заполнения (n+l) групп» . Журнал экспериментальной и теоретической физики . 14 (2): 334 . Проверено 23 июня 2022 г.
- ^ Сахо, Ибрагима (2019). Введение в квантовую механику 1: Тепловое излучение и экспериментальные факты, касающиеся квантования материи . Уайли. п. 115. ИСБН 978-1786304872 . Проверено 11 апреля 2021 г.
- ^ Jump up to: а б Демков Юрий Н.; Островский, Валентин Николаевич (1972). «Правило заполнения n+l в периодической системе и фокусирующие потенциалы» . Журнал экспериментальной и теоретической физики . 35 (1): 66–69. Бибкод : 1972ЖЭТП...35...66Д . Проверено 25 ноября 2022 г.
- ^ Тиссен, Питер; Сеулеманс, Арну (2017). Нарушенная симметрия: теория групп от восьмеричного пути к таблице Менделеева . Издательство Оксфордского университета. стр. 360–381. ISBN 9780190611392 .
- ^ Шерри, Эрик (7 ноября 2013 г.). «Проблема с принципом Ауфбау» . Химическое образование . Том. 50, нет. 6. Королевское химическое общество . стр. 24–26.
Дальнейшее чтение
[ редактировать ]- Изображение: Порядок заполнения оболочки. Архивировано 15 ноября 2014 г. на Wayback Machine.
- Бойенс, JCA : Химия из первых принципов . Берлин: Springer Science 2008, ISBN 978-1-4020-8546-8
- Островский В.Н. (2005). «О недавней дискуссии по поводу квантового обоснования периодической таблицы элементов». Основы химии . 7 (3): 235–39. дои : 10.1007/s10698-005-2141-y . S2CID 93589189 .
- Китагавара, Ю.; Барут, АО (1984). «О динамической симметрии таблицы Менделеева. II. Модифицированная модель атома Демкова-Островского». Дж. Физ. Б. 17 (21): 4251–59. Бибкод : 1984JPhB...17.4251K . дои : 10.1088/0022-3700/17/21/013 .
- Ванкуикенборн, LG (1994). «Переходные металлы и принцип Ауфбау» (PDF) . Журнал химического образования . 71 (6): 469–471. Бибкод : 1994ЖЧЭд..71..469В . дои : 10.1021/ed071p469 .
- Шерри, ER (2017). «О правиле Маделунга» . Вывод . 1 (3). Архивировано из оригинала 12 апреля 2017 г. Проверено 15 апреля 2018 г.










