Магнитное квантовое число
Эта статья нуждается в дополнительных цитатах для проверки . ( май 2016 г. ) |
В атомной физике магнитное квантовое число — это квантовое число, используемое для различения квантовых состояний электрона или другой частицы в соответствии с его угловым моментом вдоль заданной оси в пространстве. Орбитальное магнитное квантовое число ( m l или m [а] ) различает орбитали, доступные внутри данной подоболочки атома. Он определяет компонент орбитального углового момента, который лежит вдоль данной оси, условно называемой осью z , поэтому он описывает ориентацию орбитали в пространстве. Спиновое магнитное квантовое число m s определяет z по оси компонент спинового углового момента для частицы, имеющей спиновое квантовое число s . Для электрона s равно 1 ⁄ 2 , а m s либо + 1 ⁄ 2 или - 1 ⁄ 2 , часто называемый «раскруткой вверх» и «раскруткой вниз», или α и β. [1] [2] Термин «магнитный» в названии относится к магнитному дипольному моменту, связанному с каждым типом углового момента, поэтому состояния, имеющие разные магнитные квантовые числа, смещаются по энергии в магнитном поле в соответствии с эффектом Зеемана . [2]
Четыре квантовых числа, традиционно используемые для описания квантового состояния электрона в атоме, — это главное квантовое число n , азимутальное (орбитальное) квантовое число. и магнитные квантовые числа m l и m s . Электроны в данной подоболочке атома (например, s, p, d или f) определяются значениями (0, 1, 2 или 3). Орбитальное магнитное квантовое число принимает целые значения в диапазоне от к , включая ноль. [3] Таким образом, подоболочки s, p, d и f содержат по 1, 3, 5 и 7 орбиталей каждая. На каждой из этих орбиталей может разместиться до двух электронов (с противоположными спинами), составляющих основу таблицы Менделеева .
Другие магнитные квантовые числа определяются аналогичным образом, например, m j для z, компонента оси полного электронного углового момента j , [1] и m I для ядерного спина I . [2] квантовые числа пишутся с заглавной буквы, чтобы указать общие суммы для системы частиц, например, ML L или m Магнитные для полного орбитального углового момента по оси z всех электронов в атоме. [2]
Вывод
[ редактировать ]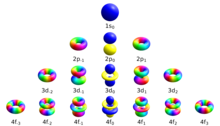
Существует набор квантовых чисел, связанных с энергетическими состояниями атома. Четыре квантовых числа , , , и определить полное квантовое состояние одного электрона в атоме, называемое его волновой функцией или орбиталью . Уравнение Шрёдингера для волновой функции атома с одним электроном представляет собой разделяющееся уравнение в частных производных . (Это не относится к нейтральному атому гелия или другим атомам с взаимно взаимодействующими электронами, которые требуют более сложных методов решения. [4] ) Это означает, что волновую функцию, выраженную в сферических координатах, можно разбить на произведение трех функций радиуса, угла широты (или полярности) и азимута: [5]
Дифференциальное уравнение для можно решить в виде . Поскольку значения азимутального угла отличаются на 2 радианы (360 градусов) представляют одно и то же положение в пространстве, а общая величина не растет со сколь угодно большими как и в случае с действительным показателем, коэффициент должно быть квантовано до целого числа, кратного , производя мнимую степень : . [6] Эти целые числа являются магнитными квантовыми числами. Та же константа появляется в уравнении широты, где большие значения имеют тенденцию уменьшать величину и ценности больше азимутального квантового числа не допускайте какого-либо решения для
| Связь между квантовыми числами | |||
|---|---|---|---|
| орбитальный | Ценности | Количество значений для [7] | Электронов на подоболочку |
| с | 1 | 2 | |
| п | 3 | 6 | |
| д | 5 | 10 | |
| ж | 7 | 14 | |
| г | 9 | 18 | |
Как составляющая углового момента
[ редактировать ]
Ось, используемая для полярных координат в этом анализе, выбрана произвольно. Квантовое число относится к проекции углового момента в этом произвольно выбранном направлении, условно называемом -направление или ось квантования . , величина углового момента в -направление, определяется формулой: [7]
- .
Это составляющая полного орбитального углового момента атомного электрона. , величина которого связана с азимутальным квантовым числом его подоболочки по уравнению:
- ,
где – приведенная постоянная Планка . Обратите внимание, что это для и приближает для высокого . Невозможно измерить угловой момент электрона по всем трем осям одновременно. Эти свойства были впервые продемонстрированы в эксперименте Штерна-Герлаха Отто Штерном и Вальтером Герлахом . [8]
Эффект в магнитных полях
[ редактировать ]Квантовое число в общих чертах относится к направлению углового момента вектора . Магнитное квантовое число влияет на энергию электрона только в том случае, если он находится в магнитном поле, поскольку в отсутствие такового все сферические гармоники, соответствующие различным произвольным значениям эквивалентны. Магнитное квантовое число определяет энергетический сдвиг атомной орбитали из-за внешнего магнитного поля ( эффект Зеемана ) — отсюда и название магнитного квантового числа. Однако реальный магнитный дипольный момент электрона на атомной орбитали возникает не только из углового момента электрона, но и из спина электрона, выраженного в спиновом квантовом числе .
Поскольку каждый электрон обладает магнитным моментом в магнитном поле, на него будет действовать крутящий момент, который стремится сделать вектор параллельно полю происходит явление, известное как ларморовская прецессия .
См. также
[ редактировать ]Примечания
[ редактировать ]- ^ m только один вид магнитного квантового числа, например m l или m j . часто используется, когда в тексте используется
Ссылки
[ редактировать ]- ^ Перейти обратно: а б Мартин, туалет; Визе, WL (2019). «Атомная спектроскопия - сборник основных идей, обозначений, данных и формул» . Национальный институт стандартов и технологий, Лаборатория физических измерений . НИСТ . Проверено 17 мая 2023 г.
- ^ Перейти обратно: а б с д Аткинс, Питер Уильям (1991). Кванта: Справочник концепций (2-е изд.). Издательство Оксфордского университета, США. п. 297. ИСБН 0-19-855572-5 .
- ^ Гриффитс, Дэвид Дж. (2005). Введение в квантовую механику (2-е изд.). Река Аппер-Седл, Нью-Джерси: Пирсон Прентис Холл. стр. 136–137. ISBN 0-13-111892-7 . OCLC 53926857 .
- ^ «Атом гелия» . 20 июля 2010 г.
- ^ «Уравнение Шрёдингера для водорода» . гиперфизика.phy-astr.gsu.edu .
- ^ «Уравнение Шрёдингера для водорода» . гиперфизика.phy-astr.gsu.edu .
- ^ Перейти обратно: а б Герцберг, Герхард (1950). Молекулярные спектры и молекулярная структура (2-е изд.). Компания Д ван Ностранд. стр. 17–18.
- ^ «Спектроскопия: квантовое число углового момента» . Британская энциклопедия.


































