Курий
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Курий | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Произношение | / ˈ k j ʊər i ə m / | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Появление | серебристый металлик, светится фиолетовым в темноте | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Массовое число | [247] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кюрий в таблице Менделеева | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный номер ( Z ) | 96 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Группа | группы f-блоков (без номера) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Период | период 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Блокировать | f-блок | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электронная конфигурация | [ Рн ] 5f 7 6д 1 7 с 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электроны на оболочку | 2, 8, 18, 32, 25, 9, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физические свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фаза в СТП | твердый | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура плавления | 1613 К (1340 °С, 2444 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка кипения | 3383 К (3110 °С, 5630 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плотность (около комнатной температуры ) | 13,51 г/см 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота плавления | 13,85 кДж/моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Давление пара
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомные свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стадии окисления | +3 , +4, +5, [1] +6 [2] ( амфотерный оксид) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электроотрицательность | Шкала Полинга: 1,3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Энергии ионизации |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный радиус | эмпирический: 174 вечера | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 169±15:00 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Другие объекты недвижимости | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Естественное явление | синтетический | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристаллическая структура | двойной шестиугольный плотноупакованный (dhcp) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электрическое сопротивление | 1.25 µΩ⋅m [3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнитный заказ | переход антиферромагнит-парамагнитный при 52 К [3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Номер CAS | 7440-51-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| История | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мы | имени Марии Склодовской-Кюри и Пьера Кюри | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Открытие | Гленн Т. Сиборг , Ральф А. Джеймс , Альберт Гиорсо (1944) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Изотопы кюрия | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Кюрий — синтетический химический элемент ; он имеет символ Cm и атомный номер 96. Этот трансурановый актинидный элемент был назван в честь выдающихся ученых Марии и Пьера Кюри , известных своими исследованиями радиоактивности . Впервые кюрий был намеренно создан командой Гленна Т. Сиборга , Ральфа А. Джеймса и Альберта Гиорсо в 1944 году с использованием циклотрона в Беркли . Они бомбардировали недавно открытый элемент плутоний (изотоп 239 Pu ) с альфа-частицами . Затем его отправили в Металлургическую лабораторию Чикагского университета , где в конечном итоге был выделен и идентифицирован крошечный образец кюрия. Открытие держалось в секрете до окончания Второй мировой войны . Эта новость была обнародована в ноябре 1947 года. Большая часть кюрия производится путем бомбардировки урана или плутония нейтронами в ядерных реакторах – одна тонна отработанного ядерного топлива содержит около 20 граммов кюрия.
Кюрий — твердый, плотный, серебристый металл с высокой температурой плавления и кипения для актинида. Он парамагнитен в условиях окружающей среды , но при охлаждении становится антиферромагнитным , а во многих соединениях кюрия наблюдаются и другие магнитные переходы. В соединениях кюрий обычно имеет валентность +3, а иногда и +4; в растворах преобладает валентность +3. Кюрий легко окисляется, и его оксиды являются доминирующей формой этого элемента. Он образует сильно флуоресцентные комплексы с различными органическими соединениями, но нет никаких доказательств его включения в бактерии и археи . Попадая в организм человека, кюрий накапливается в костях, легких и печени, где способствует развитию рака .
Все известные изотопы кюрия радиоактивны и имеют малую критическую массу для цепной ядерной реакции . Самый стабильный изотоп, 247 См, имеет период полураспада 15,6 млн лет; самые долгоживущие изотопы кюрия испускают преимущественно альфа-частицы . Радиоизотопные термоэлектрические генераторы могут использовать тепло этого процесса, но этому препятствуют редкость и высокая стоимость кюрия. Кюрий используется для получения более тяжелых актинидов и 238 Pu Радионуклид для источников питания в искусственных кардиостимуляторах и РИТЭГах для космических аппаратов. Он служил источником α-излучения в рентгеновских спектрометрах альфа-частиц нескольких космических зондов, в том числе Sojourner , Spirit , Opportunity и Curiosity марсоходов , а также спускаемого аппарата Philae на комете 67P/Чурюмова-Герасименко , для анализа состава и структуры. поверхности.
История [ править ]


Хотя кюрий, вероятно, производился в предыдущих ядерных экспериментах, а также в естественном ядерном реакторе деления в Окло, Габон, он был впервые намеренно синтезирован , изолирован и идентифицирован в 1944 году в Калифорнийском университете в Беркли Гленном Т. Сиборгом , Ральфом А. Джеймс и Альберт Гиорсо . В своих экспериментах они использовали 60-дюймовый (150 см) циклотрон . [5]
Кюрий был химически идентифицирован в Металлургической лаборатории (ныне Аргоннская национальная лаборатория ) Чикагского университета . Это был третий трансурановый элемент, открытый хотя он и четвертый в серии — более легкий элемент америций все еще был неизвестен. [6] [7]
Образец готовили следующим образом: сначала раствор нитрата плутония наносили на платиновую фольгу толщиной ~0,5 см. 2 раствор упаривали и остаток превращали в оксид плутония(IV) (PuO 2 ) путем отжига . После циклотронного облучения оксида покрытие растворяли азотной кислотой и затем осаждали в виде гидроксида с использованием концентрированного водного раствора аммиака . Остаток растворяли в хлорной кислоте и дальнейшее разделение проводили ионным обменом с получением определенного изотопа кюрия. Разделение кюрия и америция было настолько кропотливым, что группа из Беркли первоначально назвала эти элементы столпотворением (от греческого « все демоны» или «ад» ) и бредом (от латинского « безумие » ). [8] [9]
Кюрий-242 был получен в июле – августе 1944 г. путем бомбардировки. 239 Pu с α-частицами для получения кюрия с выделением нейтрона :
Кюрий-242 был однозначно идентифицирован по характерной энергии α-частиц, испускаемых при распаде:
Период полураспада этого альфа-распада сначала был измерен как 150 дней, а затем скорректирован до 162,8 дней. [10]
Еще один изотоп 240 См был получен аналогичной реакцией в марте 1945 года:
Период полураспада α-распада 240 См правильно определили как 26,7 дней. [10]
Открытие кюрия и америция в 1944 году было тесно связано с Манхэттенским проектом , поэтому результаты были конфиденциальными и рассекречены только в 1945 году. Сиборг слил синтез элементов 95 и 96 в американское радиошоу для детей Quiz Kids , пять лет назад за несколько дней до официальной презентации на заседании Американского химического общества 11 ноября 1945 года, когда один из слушателей спросил, какой-либо новый трансурановый элемент, помимо плутония и нептуния . был ли во время войны открыт [8] Открытие кюрия ( 242 См и 240 Cm), его производство и его соединения были позже запатентованы, в качестве изобретателя был указан только Сиборг. [11]
Элемент был назван в честь Марии Кюри и ее мужа Пьера Кюри , которые известны открытием радия и своими работами в области радиоактивности . Это последовало примеру гадолиния , элемента -лантанида, расположенного выше кюрия в периодической таблице, который был назван в честь исследователя редкоземельных элементов Йохана Гадолина : [12]
В качестве названия элемента с атомным номером 96 мы хотели бы предложить «кюрий» с символом Cm. Факты указывают на то, что элемент 96 содержит семь 5f-электронов и, таким образом, аналогичен элементу гадолинию с семью 4f-электронами в регулярном ряду редкоземельных элементов. На этом основании элемент 96 назван в честь Кюри, аналогично названию гадолиния, которым был удостоен чести химик Гадолин. [6]
Первые образцы кюрия были едва заметны и идентифицировались по радиоактивности. Луи Вернер и Исадор Перлман получили первый существенный образец 30 мкг гидроксида кюрия-242 в Калифорнийском университете в Беркли в 1947 году путем бомбардировки америция -241 нейтронами. [13] [14] [15] Макроскопические количества фторида кюрия (III) были получены в 1950 году У. В. Крейном, Дж. К. Уоллманном и Б. Б. Каннингемом. Его магнитная восприимчивость была очень близка к таковой у GdF 3 , что стало первым экспериментальным доказательством валентности кюрия +3 в его соединениях. [13] году восстановлением CmF 3 барием Металлический кюрий был получен только в 1951 . [16] [17]
Характеристики [ править ]
Физический [ править ]


Синтетический радиоактивный элемент, кюрий — твердый, плотный металл серебристо-белого цвета, по физическим и химическим свойствам напоминающий гадолиний . Его температура плавления 1344 °С значительно выше, чем у предыдущих элементов нептуния (637 °С), плутония (639 °С) и америция (1176 °С). Для сравнения, гадолиний плавится при 1312 °C. Кюрий кипит при 3556°С. Плотностью 13,52 г/см. 3 , кюрий легче нептуния (20,45 г/см 3 ) и плутоний (19,8 г/см 3 ), но тяжелее большинства других металлов. Из двух кристаллических форм кюрия α-Cm более стабилен в условиях окружающей среды. Он имеет гексагональную симметрию, пространственную группу P6 3 /mmc, параметры решетки a = 365 пм и c = 1182 пм и четыре формульные единицы на элементарную ячейку . [18] Кристалл состоит из двойной гексагональной плотной упаковки с последовательностью слоев ABAC и поэтому изотипен α-лантану. При давлении >23 ГПа и комнатной температуре α-Cm превращается в β-Cm, который имеет гранецентрированную кубическую симметрию, пространственную группу Fm 3 m и постоянную решетки a = 493 пм. [18] При дальнейшем сжатии до 43 ГПа кюрий приобретает ромбическую структуру γ-Cm, аналогичную α-урану, при этом до 52 ГПа дальнейшие переходы не наблюдаются. Эти три фазы кюрия также называются Cm I, II и III. [19] [20]
Кюрий обладает своеобразными магнитными свойствами. Соседний элемент америций не обнаруживает отклонения от Кюри-Вейсса парамагнетизма во всем диапазоне температур, но α-Cm переходит в антиферромагнитное состояние: при охлаждении до 65–52 К [21] [22] и β-Cm демонстрирует ферримагнитный переход при ~ 205 К. Пниктиды кюрия демонстрируют ферромагнитные переходы при охлаждении: 244 СмН и 244 CmAs при 109 К, 248 ЦПМ при 73 К и 248 CmSb при 162 К. Лантанидный аналог кюрия, гадолиний и его пниктиды также демонстрируют магнитные переходы при охлаждении, но характер перехода несколько иной: Gd и GdN становятся ферромагнитными, а GdP, GdAs и GdSb проявляют антиферромагнитное упорядочение. [23]
Согласно магнитным данным, электросопротивление кюрия увеличивается с температурой – примерно в два раза между 4 и 60 К – и затем почти постоянно до комнатной температуры. Происходит значительное увеличение удельного сопротивления с течением времени (~ 10 мкОм·см/ч ) из-за самоповреждения кристаллической решетки в результате альфа-распада. Это делает неопределенным истинное удельное сопротивление кюрия (~ 125 мкОм·см ). Удельное сопротивление кюрия аналогично сопротивлению гадолиния, а также актинидов плутония и нептуния, но значительно выше, чем у америция, урана, полония и тория . [3] [24]
При ультрафиолетовом освещении ионы кюрия(III) проявляют сильную и стабильную желто-оранжевую флуоресценцию с максимумом в диапазоне 590–640 нм в зависимости от окружения. [25] Флуоресценция возникает в результате переходов из первого возбужденного состояния 6 D 7/2 и основное состояние 8 С 7/2 . Анализ этой флуоресценции позволяет отслеживать взаимодействие ионов Cm(III) в органических и неорганических комплексах. [26]
Химический [ править ]

Ион кюрия в растворе почти всегда имеет степень окисления +3 , наиболее стабильную степень окисления кюрия. [27] Степень окисления +4 наблюдается в основном в некоторых твердых фазах, таких как CmO 2 и CmF 4 . [28] [29] Водный кюрий(IV) известен только в присутствии сильных окислителей, таких как персульфат калия , и легко восстанавливается до кюрия(III) радиолизом и даже самой водой. [30] Химическое поведение кюрия отличается от актинидов тория и урана и похоже на америций и многие лантаноиды . В водном растворе Cm 3+ ион от бесцветного до бледно-зеленого; [31] См 4+ ион бледно-желтый. [32] Оптическое поглощение Cm 3+ Ион содержит три острых пика при 375,4, 381,2 и 396,5 нм, и их силу можно напрямую преобразовать в концентрацию ионов. [33] О степени окисления +6 сообщалось только один раз в растворе в 1978 году, когда курильный ион ( CmO 2+
2 ): он был получен в результате бета-распада америция -242 в ионе америция (V). 242
АмО +
2 . [2] Неспособность получить Cm(VI) при окислении Cm(III) и Cm(IV) может быть связана с высоким содержанием Cm. 4+ /См 3+ потенциал ионизации и нестабильность Cm(V). [30]
Ионы кюрия представляют собой жесткие кислоты Льюиса и поэтому образуют наиболее устойчивые комплексы с жесткими основаниями. [34] Связь преимущественно ионная с небольшой ковалентной составляющей. [35] Кюрий в своих комплексах обычно демонстрирует 9-кратное координационное окружение с трехглавой тригонально-призматической молекулярной геометрией . [36]
Изотопы [ править ]
Около 19 радиоизотопов и 7 ядерных изомеров , 233 См до 251 См, известны; ни один из них не является стабильным . Самый длинный период полураспада составляет 15,6 миллионов лет ( 247 см) и 348 000 лет ( 248 См). Другими долгоживущими являются 245 См (8500 лет), 250 См (8300 лет) и 246 См (4760 лет). Кюрий-250 необычен: он в основном (~86%) распадается путем спонтанного деления . Наиболее часто используемые изотопы: 242 См и 244 См с периодами полураспада 162,8 суток и 18,1 года соответственно. [10]
| тепловых нейтронов Сечения ( барны ) [37] | ||||||
|---|---|---|---|---|---|---|
| 242 См | 243 См | 244 См | 245 См | 246 См | 247 См | |
| Деление | 5 | 617 | 1.04 | 2145 | 0.14 | 81.90 |
| Захватывать | 16 | 130 | 15.20 | 369 | 1.22 | 57 |
| Соотношение C/F | 3.20 | 0.21 | 14.62 | 0.17 | 8.71 | 0.70 |
| НОУ отработанное ядерное топливо 53 МВт/кг через 20 лет после выгорания [38] | ||||||
| 3 распространенных изотопа | 51 | 3700 | 390 | |||
| реактора на быстрых нейтронах МОХ-топливо (в среднем 5 образцов, выгорание 66–120 ГВтсут/т) [39] | ||||||
| Общий кюрий 3,09 × 10 −3 % | 27.64% | 70.16% | 2.166% | 0.0376% | 0.000928% | |
| Изотоп | 242 См | 243 См | 244 См | 245 См | 246 См | 247 См | 248 См | 250 См |
| Критическая масса , кг | 25 | 7.5 | 33 | 6.8 | 39 | 7 | 40.4 | 23.5 |
Все изотопы от 242 См до 248 См, а также 250 См, подвергаются самоподдерживающейся цепной ядерной реакции и поэтому в принципе могут быть ядерным топливом в реакторе. Как и у большинства трансурановых элементов, сечение ядерного деления особенно велико для изотопов кюрия с нечетной массой. 243 См, 245 См и 247 См. Их можно использовать в реакторах на тепловых нейтронах , тогда как смесь изотопов кюрия подходит только для быстрых реакторов-размножителей, поскольку изотопы четной массы не делятся в тепловом реакторе и накапливаются по мере увеличения выгорания. [40] Смешанное оксидное (МОХ) топливо, которое будет использоваться в энергетических реакторах, должно содержать мало кюрия или вообще не содержать его, поскольку нейтронная активация 248 См создаст Калифорнию . Калифорний является сильным излучателем нейтронов и может загрязнить заднюю часть топливного цикла и увеличить дозу облучения персонала реактора. Следовательно, если второстепенные актиниды будут использоваться в качестве топлива в реакторе на тепловых нейтронах, кюрий следует исключить из топлива или поместить в специальные топливные стержни, где он является единственным присутствующим актинидом. [41]
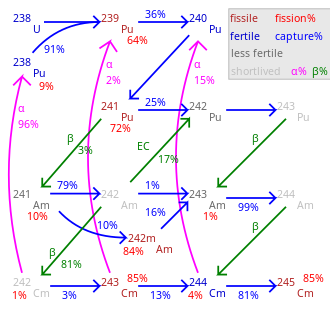
Процент деления равен 100 минус указанные проценты.
Общая скорость трансмутации сильно варьируется в зависимости от нуклида.
245 См- 248 Cm долгоживущие с незначительным распадом.
В соседней таблице указаны критические массы изотопов кюрия для сферы без замедлителя или отражателя. При металлическом отражателе (30 см стали) критические массы нечетных изотопов составляют около 3–4 кг. При использовании воды (толщиной ~20–30 см) в качестве отражателя критическая масса может составлять всего 59 граммов для 245 См, 155 грамм для 243 см и 1550 грамм для 247 См. Существует значительная неопределенность в этих значениях критической массы. Хотя обычно она составляет порядка 20%, значения для 242 См и 246 Некоторые исследовательские группы указали, что см составляет 371 кг и 70,1 кг соответственно. [40] [43]
Кюрий в настоящее время не используется в качестве ядерного топлива из-за его низкой доступности и высокой цены. [44] 245 См и 247 См имеет очень небольшую критическую массу и поэтому может быть использован в тактическом ядерном оружии , но, как известно, ни одно из них не было создано. Кюрий-243 для этого не подходит из-за его короткого периода полураспада и сильного α-излучения, которое может вызвать чрезмерное нагревание. [45] Кюрий-247 был бы очень подходящим из-за его длительного периода полураспада, который в 647 раз больше, чем у плутония-239 (используемого во многих существующих ядерных вооружениях ).
Происшествие [ править ]

Самый долгоживущий изотоп, 247 См, имеет период полураспада 15,6 млн лет; поэтому любой изначальный кюрий, то есть присутствовавший на Земле при ее формировании, к настоящему времени должен был уже распасться. Его прошлое присутствие в качестве вымершего радионуклида можно обнаружить как избыток его изначальной, долгоживущей дочери. 235 В. [46] Следы 242 Cm может встречаться в природе в урановых минералах из-за захвата нейтронов и бета-распада ( 238 В → 239 Пу → 240 Пу → 241 утра → 242 См), хотя количества были бы крошечными, и это не подтверждено: даже при «чрезвычайно щедрых» оценках возможностей поглощения нейтронов количество 242 См присутствует в 1 × 10 8 кг 18-процентной урановой смолки не будет даже одним атомом. [47] [48] [49] Следы 247 См также, вероятно, приносится на Землю с космическими лучами , но это опять-таки не подтверждено. [47] Также существует возможность 244 См образуется как дочь двойного бета-распада природного 244 Мог. [47] [50]
Кюрий производится искусственно в небольших количествах для исследовательских целей. Он также встречается в качестве одного из отходов отработанного ядерного топлива . [51] [52] Кюрий присутствует в природе в некоторых областях, используемых для испытаний ядерного оружия . [53] Анализ обломков на полигоне США первого термоядерного оружия , Айви Майк (1 ноября 1952, атолл Эниветак ), кроме эйнштейния , фермия , плутония и америция, выявил также изотопы берклия, калифорния и кюрия, в частности 245 См, 246 см и меньшие количества 247 См, 248 См и 249 См. [54]
Атмосферные соединения кюрия плохо растворимы в обычных растворителях и в основном прилипают к частицам почвы. Анализ почвы показал, что концентрация кюрия в песчаных частицах почвы примерно в 4000 раз выше, чем в воде, присутствующей в порах почвы. Еще более высокое соотношение (около 18 000) было зафиксировано в суглинистых почвах. [55]
Трансурановые элементы от америция до фермия, включая кюрий, естественным образом возникли в естественном ядерном реакторе в Окло , но больше не встречаются. [56]
Предполагается, что кюрий и другие непервичные актиниды существуют в спектре Звезды Пшибыльского . [57]
Синтез [ править ]
Подготовка изотопов [ править ]
Кюрий производится в небольших количествах в ядерных реакторах , и к настоящему времени всего лишь килограммы 242 См и 244 Накоплены см, а для более тяжелых изотопов – граммы и даже миллиграммы. Отсюда и высокая цена кюрия, которая оценивается в 160–185 долларов США за миллиграмм. [13] по более поздним оценкам, 2000 долларов США за г 242 см и 170 долларов США/г за 244 См. [58] В ядерных реакторах кюрий образуется из 238 U в серии ядерных реакций. В первой цепочке 238 U захватывает нейтрон и превращается в 239 U, который через β − распад превращается в 239 Нп и 239 Мог.
| (время полураспада ) . | ( 1 ) |
Дальнейший захват нейтронов с последующим β − -распад дает америций ( 241 Am), что в дальнейшем становится 242 См:
| . | ( 2 ) |
Для исследовательских целей кюрий получают облучением не урана, а плутония, который в больших количествах имеется в отработавшем ядерном топливе. Для облучения используется гораздо более высокий поток нейтронов, что приводит к другой цепочке реакций и образованию 244 См: [7]
| ( 3 ) |
Кюрий-244 альфа распадается до 240 Pu, но он также поглощает нейтроны, следовательно, небольшое количество более тяжелых изотопов кюрия. Из них 247 См и 248 См популярны в научных исследованиях из-за длительного периода полураспада. Но темпы производства 247 См в реакторах на тепловых нейтронах низок, поскольку он склонен к делению из-за тепловых нейтронов. [59] Синтез 250 Cm путем захвата нейтронов маловероятен из-за короткого периода полураспада промежуточного соединения. 249 См (64 мин), что β − распадается на берклия изотоп 249 Бк. [59]
| ( 4 ) |
Вышеупомянутый каскад реакций (n,γ) дает смесь различных изотопов кюрия. Их разделение после синтеза затруднительно, поэтому желателен селективный синтез. Кюрий-248 предпочтителен для исследовательских целей из-за его длительного периода полураспада. Наиболее эффективный способ получения этого изотопа - α-распад калифорния . изотопа 252 Cf, который доступен в относительно больших количествах из-за его длительного периода полураспада (2,65 года). Около 35–50 мг 248 См производится таким образом в год. Сопутствующая реакция приводит к 248 См с изотопной чистотой 97%. [59]
| ( 5 ) |
Еще один изотоп 245 См, можно получить для исследования из α-распада 249 См.; последний изотоп производится в небольших количествах из β − -распад 249 Бк .
| ( 6 ) |
Подготовка металла [ править ]

Большинство процедур синтеза дают смесь изотопов актинидов в виде оксидов , из которых необходимо отделить определенный изотоп кюрия. Примером процедуры может быть растворение отработанного реакторного топлива (например, МОХ-топлива ) в азотной кислоте и удаление основной массы урана и плутония с использованием PUREX ( плутониевый – UR- аниевый экстракт экстракции типа ) с трибутилфосфатом в углеводороде. Затем лантаноиды и оставшиеся актиниды отделяют от водного остатка ( рафината ) экстракцией на основе диамида, получая после отгонки смесь трехвалентных актинидов и лантаноидов. Затем соединение кюрия селективно экстрагируют с использованием методов многоступенчатой хроматографии и центрифугирования с соответствующим реагентом. [60] бис -триазинилбипиридиновый комплекс. В качестве такого реагента, обладающего высокой селективностью по отношению к кюрию, недавно был предложен [61] Отделение кюрия от очень похожего по химическому составу америция также можно осуществить путем обработки суспензии их гидроксидов в водном бикарбонате натрия при озоном повышенной температуре. И америций, и кюрий присутствуют в растворах преимущественно в валентном состоянии +3; америций окисляется до растворимых комплексов Am(IV), но кюрий остается неизменным, поэтому его можно выделить повторным центрифугированием. [62]
Металлический кюрий получают восстановлением его соединений. Первоначально для этой цели использовался фторид кюрия(III). Реакцию проводили в среде, свободной от воды и кислорода, в аппарате из тантала и вольфрама элементарный барий или литий . , используя в качестве восстановителей [7] [16] [63] [64] [65]
Другая возможность - восстановление оксида кюрия(IV) с использованием магниево-цинкового сплава в расплаве хлорида магния и фторида магния . [66]
Соединения и реакции [ править ]
Оксиды [ править ]
Кюрий легко реагирует с кислородом, образуя преимущественно Cm 2 O 3 и CmO 2 , оксиды [53] но известен также двухвалентный оксид CmO. [67] Черный CmO 2 можно получить сжиганием оксалата кюрия ( Cm
2 (С
22О
4 )
3 ), нитрат ( Cm(NO
3 )
3 ) или гидроксид в чистом кислороде. [29] [68] При нагревании в вакууме до 600–650 °С (около 0,01 Па ) он превращается в беловатый Cm 2 O 3 : [29] [69]
- .
Или Cm 2 O 3 можно получить восстановлением CmO 2 молекулярным водородом : [70]
Также известен ряд тройных оксидов типа M(II)CmO 3 , где М означает двухвалентный металл, например барий. [71]
термическое окисление следовых количеств гидрида кюрия (CmH 2–3 Сообщалось, что ) дает летучую форму CmO 2 и летучий триоксид CmO 3 , один из двух известных примеров очень редкого состояния +6 для кюрия. [2] Сообщалось, что другой наблюдаемый вид вел себя аналогично предполагаемому четырехокисью плутония и был предварительно охарактеризован как CmO 4 , с кюрием в чрезвычайно редком состоянии +8; [72] но новые эксперименты, кажется, указывают на то, что CmO 4 не существует, и поставили под сомнение существование PuO 4 также. [73]
Галогениды [ править ]
Бесцветный фторид кюрия(III) (CmF 3 ) можно получить добавлением ионов фторида в растворы, содержащие кюрий(III). С другой стороны, коричневый четырехвалентный фторид кюрия(IV) (CmF 4 ) получается только путем реакции фторида кюрия(III) с молекулярным фтором : [7]
Известен ряд тройных фторидов формы A 7 Cm 6 F 31 (А = щелочной металл ). [74]
Бесцветный хлорид кюрия(III) (CmCl 3 ) получают путем взаимодействия гидроксида кюрия (Cm(OH) 3 ) с безводным газообразным хлористым водородом . В дальнейшем его можно превратить в другие галогениды, такие как бромид кюрия (III) (от бесцветного до светло-зеленого) и йодид кюрия (III) (бесцветный), путем реакции его с аммиачной солью соответствующего галогенида при температурах ~ 400–450 °. С: [75]
Или можно нагреть оксид кюрия до ~ 600 ° C с помощью соответствующей кислоты (например, бромистоводородной для бромида кюрия). [76] [77] Парофазный гидролиз хлорида кюрия (III) дает оксихлорид кюрия: [78]
Халькогениды и пниктиды [ править ]
Сульфиды, селениды и теллуриды кюрия были получены обработкой кюрия газообразной серой , селеном или теллуром в вакууме при повышенной температуре. [79] [80] кюрия Пниктиды типа CmX известны по азоту , фосфору , мышьяку и сурьме . [7] Их можно получить путем взаимодействия гидрида кюрия(III) (CmH 3 ) или металлического кюрия с этими элементами при повышенной температуре. [81]
соединения и аспекты биологические Курийорганические

Металлоорганические комплексы, аналогичные ураноцену, известны и для других актинидов, например тория, протактиния, нептуния, плутония и америция. Теория молекулярных орбиталей предсказывает стабильный «куроценовый» комплекс (η 8 -C 8 H 8 ) 2 Cm, но экспериментально это пока не обнаружено. [82] [83]
Образование комплексов типа Cm(nC
3 H
7 -БТП)
3 (БТР = 2,6-ди(1,2,4-триазин-3-ил)пиридин), в растворах, содержащих nC 3 H 7 -BTP и Cm 3+ ионов было подтверждено EXAFS . Некоторые из этих комплексов типа BTP избирательно взаимодействуют с кюрием и, таким образом, полезны для отделения его от лантаноидов и других актинидов. [25] [84] Растворенный см 3+ ионы связываются со многими органическими соединениями, такими как гидроксамовая кислота , [85] мочевина , [86] флуоресцеин [87] и аденозинтрифосфат . [88] Многие из этих соединений связаны с биологической активностью различных микроорганизмов . Полученные комплексы демонстрируют сильное желто-оранжевое свечение при возбуждении УФ-светом, что удобно не только для их обнаружения, но и для изучения взаимодействий между Cm 3+ иона и лигандов за счет изменения периода полураспада (порядка ~0,1 мс) и спектра флуоресценции. [26] [85] [86] [87] [88]
Кюрий не имеет биологического значения. [89] Имеются единичные сообщения о биосорбции Cm. 3+ бактериями , но и археями нет доказательств включения в них кюрия. [90] [91]
Приложения [ править ]
Радионуклиды [ править ]

Кюрий — один из наиболее радиоактивных изолируемых элементов. Два его наиболее распространенных изотопа 242 См и 244 Cm – сильные альфа-излучатели (энергия 6 МэВ); они имеют довольно короткий период полураспада — 162,8 дня и 18,1 года и дают до 120 Вт/г и 3 Вт/г тепла соответственно. [13] [92] [93] Следовательно, кюрий в его обычной оксидной форме можно использовать в радиоизотопных термоэлектрических генераторах, например, в космических кораблях. Это приложение было изучено для 244 изотоп Cm, в то время как 242 От Cm отказались из-за его непомерно высокой цены, около 2000 долларов США/г. 243 См с периодом полураспада ~30 лет и хорошим энергетическим выходом ~1,6 Вт/г мог бы быть подходящим топливом, но он дает значительное количество вредных гамма- и бета -лучей из продуктов радиоактивного распада. Будучи α-излучателем, 244 См нуждается в гораздо меньшей радиационной защите, но у него высокая скорость спонтанного деления и, следовательно, много нейтронного и гамма-излучения. По сравнению с конкурирующим изотопом термоэлектрического генератора, таким как 238 Мог, 244 См испускает в 500 раз больше нейтронов, а его более высокое гамма-излучение требует защиты в 20 раз толще — 2 дюйма (51 мм) свинца для источника мощностью 1 кВт по сравнению с 0,1 дюйма (2,5 мм) для источника 238 Пу. Поэтому такое использование кюрия в настоящее время считается непрактичным. [58]
Более перспективное использование 242 См для изготовления 238 Pu — лучший радиоизотоп для термоэлектрических генераторов, например кардиостимуляторов. Альтернативные маршруты в 238 Pu используют реакцию (n,γ) 237 Np, или дейтронами , хотя обе реакции всегда приводят к бомбардировка урана 236 Pu как нежелательный побочный продукт, поскольку последний распадается до 232 U с сильным гамма-излучением. [94] Кюрий является распространенным исходным материалом для создания высших трансурановых и сверхтяжелых элементов . Таким образом, бомбардировка 248 См с неоном ( 22 Ne), magnesium ( 26 Mg) или кальций ( 48 Ca ) дает изотопы сиборгия ( 265 Сг), хассий ( 269 Хс и 270 Hs) и ливерморий ( 292 Лев, 293 Лев, и, возможно, 294 Льв). [95] Калифорний был открыт, когда мишень из кюрия-242 размером в микрограмм была облучена альфа-частицами с энергией 35 МэВ с помощью 60-дюймового (150 см) циклотрона в Беркли:
- 242
96 см
+ 4
2 Он
→ 245
98 См.
+ 1
0 н
В этом эксперименте было получено всего около 5000 атомов калифорния. [96]
Изотопы кюрия нечетной массы 243 См, 245 См, и 247 Все Cm высоко делящиеся и могут выделять дополнительную энергию в ядерном реакторе теплового спектра . Все изотопы кюрия расщепляются в реакторах на быстрых нейтронах. Это один из мотивов разделения и трансмутации минорных актинидов в ядерном топливном цикле , помогающий снизить долгосрочную радиотоксичность отработанного или отработанного ядерного топлива .

Рентгеновский спектрометр [ править ]
Самое практичное применение 244 См, хотя и довольно ограниченный по общему объему, используется в качестве источника альфа-частиц в рентгеновских спектрометрах альфа-частиц (APXS). Эти приборы были установлены на марсоходах Sojourner , Mars , Mars 96 , Mars Exploration Rovers и спускаемом аппарате Philae . [97] а также Марсианскую научную лабораторию для анализа состава и структуры горных пород на поверхности планеты Марс . [98] APXS также использовался в лунных зондах Surveyor 5–7, но с 242 Источник см. [55] [99] [100]
Сложная установка APXS имеет сенсорную головку, содержащую шесть источников кюрия с общей скоростью распада в несколько десятков милликюри (примерно один гигабеккерель ). Источники коллимируются на образце и анализируются энергетические спектры рассеянных из образца альфа-частиц и протонов (протонный анализ проводится только в некоторых спектрометрах). Эти спектры содержат количественную информацию обо всех основных элементах образца, за исключением водорода, гелия и лития. [101]
Безопасность [ править ]
Из-за своей радиоактивности кюрий и его соединения должны обрабатываться в соответствующих лабораториях по специальным правилам. Хотя сам кюрий в основном испускает α-частицы, которые поглощаются тонкими слоями обычных материалов, некоторые продукты его распада испускают значительную часть бета- и гамма-лучей, которые требуют более сложной защиты. [53] При употреблении кюрий выводится из организма в течение нескольких дней и только 0,05% всасывается в кровь. Отсюда ~45% поступает в печень , 45% — в кости, а оставшиеся 10% выводятся из организма. В костях кюрий накапливается на внутренней стороне границ с костным мозгом и со временем существенно не перераспределяется; его излучение разрушает костный мозг и, таким образом, останавливает образование эритроцитов . Биологический период полураспада кюрия составляет около 20 лет в печени и 50 лет в костях. [53] [55] Кюрий значительно сильнее всасывается в организме при вдыхании, и разрешенная общая доза 244 См в растворимой форме составляет 0,3 мкм Ки . [13] Внутривенное введение 242 См- и 244 Растворы, содержащие Cm, у крыс увеличивали частоту возникновения опухолей костей , а вдыхание способствовало легких и раку печени . [53]
Изотопы кюрия неизбежно присутствуют в отработавшем ядерном топливе (около 20 г/т). [102] Изотопы 245 См- 248 Время распада Cm составляет тысячи лет, и его необходимо удалить, чтобы нейтрализовать топливо для утилизации. [103] Такая процедура включает в себя несколько этапов: сначала кюрий отделяется, а затем посредством нейтронной бомбардировки в специальных реакторах преобразуется в короткоживущие нуклиды. Эта процедура, ядерная трансмутация , хотя и хорошо документирована для других элементов, все еще разрабатывается для кюрия. [25]
Ссылки [ править ]
- ^ Ковач, Аттила; Дау, Фуонг Д.; Марсало, Хоаким; Гибсон, Джон К. (2018). «Пятивалентный кюрий, берклий и калифорний в нитратных комплексах: расширение химии актинидов и состояний окисления». Неорг. Хим . 57 (15). Американское химическое общество: 9453–9467. doi : 10.1021/acs.inorgchem.8b01450 . ОСТИ 1631597 . ПМИД 30040397 . S2CID 51717837 .
- ^ Jump up to: Перейти обратно: а б с Доманов, вице-президент; Лобанов, Ю. В. (октябрь 2011 г.). «Образование летучего триоксида кюрия(VI) CmO 3 ». Радиохимия . 53 (5). СП МАИК Наука/Интерпериодика: 453–6. дои : 10.1134/S1066362211050018 . S2CID 98052484 .
- ^ Jump up to: Перейти обратно: а б с Шенкель, Р. (1977). «Удельное электросопротивление металла 244Cm». Твердотельные коммуникации . 23 (6): 389. Бибкод : 1977SSCom..23..389S . дои : 10.1016/0038-1098(77)90239-3 .
- ^ Кондев, ФГ; Ван, М.; Хуанг, WJ; Наими, С.; Ауди, Г. (2021). «Оценка ядерных свойств NUBASE2020» (PDF) . Китайская физика C . 45 (3): 030001. doi : 10.1088/1674-1137/abddae .
- ^ Холл, Нина (2000). Новая химия: демонстрация современной химии и ее приложений . Издательство Кембриджского университета. стр. 8–9 . ISBN 978-0-521-45224-3 .
- ^ Jump up to: Перейти обратно: а б Сиборг, Гленн Т.; Джеймс, РА; Гиорсо, А. (1949). «Новый элемент Кюрий (атомный номер 96)» (PDF) . NNES PPR (Национальная серия по ядерной энергетике, Отчет о плутониевом проекте) . Трансурановые элементы: научные статьи, статья № 22.2. 14 Б . ОСТИ 4421946 . Архивировано из оригинала (PDF) 12 октября 2007 года.
- ^ Jump up to: Перейти обратно: а б с д и Морсс, ЛР; Эдельштейн Н.М. и Фугере Дж. (редакторы): Химия актинидных элементов и трансактинидов , том 3, Springer-Verlag, Дордрехт, 2006 г., ISBN 1-4020-3555-1 .
- ^ Jump up to: Перейти обратно: а б Пеплинг, Рэйчел Шеремета (2003). «Новости химии и техники: это элементарно: периодическая таблица — америций» . Проверено 7 декабря 2008 г.
- ^ Кребс, Роберт Э. История и использование химических элементов на нашей Земле: справочное руководство , Greenwood Publishing Group, 2006, ISBN 0-313-33438-2 стр. 322
- ^ Jump up to: Перейти обратно: а б с Ауди, Жорж; Берсильон, Оливье; Блашо, Жан; Вапстра, Аалдерт Хендрик (1997). «Оценка N UBASE свойств ядра и распада» (PDF) . Ядерная физика А . 624 (1): 1–124. Бибкод : 1997НуФА.624....1А . дои : 10.1016/S0375-9474(97)00482-X . Архивировано из оригинала (PDF) 23 сентября 2008 г.
- ^ Сиборг, GT, патент США 3 161 462 «Элемент», дата подачи: 7 февраля 1949 г., дата выдачи: декабрь 1964 г.
- ^ Гринвуд, с. 1252
- ^ Jump up to: Перейти обратно: а б с д и Хаммонд Ч.Р. «Элементы» в Лиде, Д.Р., изд. (2005). Справочник CRC по химии и физике (86-е изд.). Бока-Ратон (Флорида): CRC Press. ISBN 0-8493-0486-5 .
- ^ Л. Б. Вернер, И. Перлман: «Изоляция кюрия», NNES PPR ( Национальная серия по ядерной энергии, Отчет о плутониевом проекте ), Vol. 14 B, Трансурановые элементы: научные статьи , статья № 22.5, McGraw-Hill Book Co., Inc., Нью-Йорк, 1949.
- ^ «Национальная академия наук. Айседор Перлман 1915–1991» . Нап.еду . Проверено 25 марта 2011 г.
- ^ Jump up to: Перейти обратно: а б Валлманн, Дж. К.; Крейн, ОСВ; Каннингем, BB (1951). «Получение и некоторые свойства металлического кюрия» (PDF) . Журнал Американского химического общества . 73 (1): 493–494. дои : 10.1021/ja01145a537 . hdl : 2027/mdp.39015086479790 .
- ^ Вернер, Л.Б.; Перлман, И. (1951). «Первое выделение кюрия». Журнал Американского химического общества . 73 (1): 5215–5217. дои : 10.1021/ja01155a063 . S2CID 95799539 .
- ^ Jump up to: Перейти обратно: а б Мильман, В.; Винклер, Б.; Пикард, CJ (2003). «Кристаллические структуры соединений кюрия: исследование ab initio». Журнал ядерных материалов . 322 (2–3): 165. Бибкод : 2003JNuM..322..165M . дои : 10.1016/S0022-3115(03)00321-0 .
- ^ Янг, Д.А. Фазовые диаграммы элементов , University of California Press, 1991, ISBN 0-520-07483-1 , с. 227
- ^ Хайре, Р.; Петерсон, Дж.; Бенедикт, У.; Дюфур, К.; Ити, Дж. (1985). «Рентгеновская дифракция металлического кюрия-248 при давлении до 52 ГПа». Журнал менее распространенных металлов . 109 (1): 71. дои : 10.1016/0022-5088(85)90108-0 .
- ^ Канеллакопулос, Б.; Блез, А.; Фурнье, Ж.М.; Мюллер, В. (1975). «Магнитная восприимчивость америция и металлического кюрия». Твердотельные коммуникации . 17 (6): 713. Бибкод : 1975SSCom..17..713K . дои : 10.1016/0038-1098(75)90392-0 .
- ^ Фурнье, Ж.; Блез, А.; Мюллер, В.; Спирле, Ж.-К. (1977). «Кюрий: новый магнитный элемент». Физика B+C . 86–88: 30. Бибкод : 1977PhyBC..86...30F . дои : 10.1016/0378-4363(77)90214-5 .
- ^ Неф, ЮВ; Хурай, П.Г.; Петерсон Дж. Р. и Дэмиен Д. А. Магнитная восприимчивость пниктидов кюрия , Национальная лаборатория Ок-Ридж
- ^ Шенкель, Р. (1977). «Удельное электросопротивление металла 244Cm». Твердотельные коммуникации . 23 (6): 389. Бибкод : 1977SSCom..23..389S . дои : 10.1016/0038-1098(77)90239-3 .
- ^ Jump up to: Перейти обратно: а б с Денеке, Мелисса А.; Россберг, Андре; Панак, Петра Дж.; Вейгль, Майкл; Шиммельпфенниг, Бернд; Гейст, Андреас (2005). «Характеристика и сравнение комплексов Cm(III) и Eu(III) с 2,6-ди(5,6-дипропил-1,2,4-триазин-3-ил)пиридином с использованием EXAFS, TRFLS и квантово-химических методов. Методы». Неорганическая химия . 44 (23): 8418–8425. дои : 10.1021/ic0511726 . ПМИД 16270980 .
- ^ Jump up to: Перейти обратно: а б Бюнцли, Ж.-К.Г. и Чоппин, Г.Р. Лантанидные зонды в жизни, химии и науках о Земле: теория и практика , Elsevier, Амстердам, 1989 г. ISBN 0-444-88199-9
- ^ Пеннеман, с. 24
- ^ Кинан, Томас К. (1961). «Первое наблюдение водного четырехвалентного кюрия». Журнал Американского химического общества . 83 (17): 3719. doi : 10.1021/ja01478a039 .
- ^ Jump up to: Перейти обратно: а б с Эспри, LB; Эллингер, Ф.Х.; Фрид, С.; Захариасен, WH (1955). «Доказательства четырехвалентного кюрия: рентгеновские данные по оксидам кюрия1». Журнал Американского химического общества . 77 (6): 1707. doi : 10.1021/ja01611a108 .
- ^ Jump up to: Перейти обратно: а б Грегг Дж., Люметта; Томпсон, майор К.; Пеннеман, Роберт А.; Эллер, П. Гэри (2006). «Курий». В Морссе, Лестер Р.; Эдельштейн, Норман М.; Фугер, Жан (ред.). Химия актинидных и трансактинидных элементов (PDF) . Том. 3 (3-е изд.). Дордрехт, Нидерланды: Springer. стр. 1397–1443. дои : 10.1007/1-4020-3598-5_9 . ISBN 978-1-4020-3555-5 . Архивировано из оригинала (PDF) 17 января 2018 г. Проверено 18 октября 2013 г.
- ^ Гринвуд, с. 1265
- ^ Холлеман, с. 1956 год
- ^ Пеннеман, стр. 25–26.
- ^ Дженсен, Марк П.; Бонд, Эндрю Х. (2002). «Сравнение ковалентности в комплексах трехвалентных катионов актинидов и лантаноидов» . Журнал Американского химического общества . 124 (33): 9870–9877. дои : 10.1021/ja0178620 . ПМИД 12175247 .
- ^ Сиборг, Гленн Т. (1993). «Обзор актинидов и лантаноидов ( f ) элементов». Радиохимика Акта . 61 (3–4): 115–122. дои : 10.1524/ract.1993.61.34.115 . S2CID 99634366 .
- ^ Гринвуд, с. 1267
- ^ Пфенниг, Г.; Клеве-Небениус Х. и Зельман Эггеберт В. (ред.): Нуклид Карлсруэ , 6-е изд. 1998 год
- ^ Кан, Чонмин; Фон Хиппель, Франк (2005). «Ограниченные преимущества в плане устойчивости к распространению от переработки неразделенных трансурановых соединений и лантаноидов из отработанного топлива легководных реакторов» (PDF) . Наука и глобальная безопасность . 13 (3): 169. Бибкод : 2005S&GS...13..169K . дои : 10.1080/08929880500357682 . S2CID 123552796 . Архивировано (PDF) из оригинала 28 ноября 2011 г.
- ^ Осака, М.; и др. (2001). «Анализ изотопов кюрия в смешанном оксидном топливе, облученном в реакторе на быстрых нейтронах» . Журнал ядерной науки и технологий . 38 (10): 912–914. дои : 10.3327/jnst.38.912 .
- ^ Jump up to: Перейти обратно: а б Институт радиационной защиты и ядерной безопасности: «Оценка безопасности ядерной критичности. Данные и пределы для актинидов при транспортировке». Архивировано 19 мая 2011 г., в Wayback Machine , стр. 16
- ^ Национальный исследовательский совет (США). Комитет по технологиям разделения и системам трансмутации (1996). Ядерные отходы: технологии разделения и трансмутации . Пресса национальных академий. стр. 231–. ISBN 978-0-309-05226-9 . Проверено 19 апреля 2011 г.
- ^ Сасахара, Акихиро; Мацумура, Тецуо; Николау, Гиоргос; Папайоанну, Дмитрий (2004). «Оценка источников нейтронов и гамма-излучения отработанного топлива LWR с высоким уровнем выгорания UO2 и МОКС» (PDF) . Журнал ядерной науки и технологий . 41 (4): 448–456. дои : 10.3327/jnst.41.448 . Архивировано (PDF) из оригинала 3 сентября 2015 г.
- ^ Окундо, Х. и Кавасаки, Х. (2002). «Расчеты критической и докритической массы от кюрия-243 до -247 на основе JENDL-3.2 для пересмотра ANSI/ANS-8.15» . Журнал ядерной науки и технологий . 39 (10): 1072–1085. дои : 10.3327/jnst.39.1072 .
- ^ § 2 Определения (Закон об атомной энергии) (на немецком языке)
- ^ Юкка Лехто; Сяолинь Хоу (2 февраля 2011 г.). Химия и анализ радионуклидов: лабораторные методы и методология . Вайли-ВЧ. стр. 303–. ISBN 978-3-527-32658-7 . Проверено 19 апреля 2011 г.
- ^ «Космохимики нашли доказательства присутствия нестабильного тяжелого элемента при формировании Солнечной системы» . физ.орг . Чикагский университет. 2016 . Проверено 6 июня 2022 г.
- ^ Jump up to: Перейти обратно: а б с Торнтон, Бретт Ф.; Бердетт, Шон К. (2019). «Нейтронная звездная пыль и элементы Земли» . Природная химия . 11 (1): 4–10. Бибкод : 2019НатЧ..11....4Т . дои : 10.1038/s41557-018-0190-9 . ПМИД 30552435 . S2CID 54632815 . Проверено 19 февраля 2022 г.
- ^ Earth, Live Science Staff 24T2013-09-21:44:13Z Planet (24 сентября 2013 г.). «Факты о курии» . www.livscience.com . Проверено 10 августа 2019 г.
{{cite web}}: CS1 maint: числовые имена: список авторов ( ссылка ) - ^ «Кюрий - Информация об элементе, свойства и использование | Периодическая таблица» . www.rsc.org . Проверено 10 августа 2019 г.
- ^ Третьяк, В.И.; Здесенко, Ю.Г. (2002). «Таблицы данных двойного бета-распада — обновление». В. Данные Нукл. Таблицы данных . 80 (1): 83–116. Бибкод : 2002ADNDT..80...83T . дои : 10.1006/доп.2001.0873 .
- ^ Чаплин Дж., Уорвик П., Канди А., Бочуд Ф., Фруадево П. (25 августа 2021 г.). «Новые конфигурации DGT для оценки биодоступного плутония, америция и урана в морской и пресноводной среде» . Аналитическая химия . 93 (35): 11937–11945. дои : 10.1021/acs.analchem.1c01342 . ПМИД 34432435 . S2CID 237307309 .
- ^ Чаплин Дж., Кристл М., Штрауб М., Бочуд Ф., Фруадево П. (2 июня 2022 г.). «Инструмент пассивного отбора проб актинидов в бассейнах отработавшего ядерного топлива» . АСУ Омега . 7 (23): 20053–20058. дои : 10.1021/acsomega.2c01884 . hdl : 20.500.11850/554631 . ПМЦ 9202248 . ПМИД 35722008 .
- ^ Jump up to: Перейти обратно: а б с д и Суд (на немецком языке)
- ^ Филдс, PR; Студиер, МХ; Даймонд, Х.; и др. (1956). «Трансплутониевые элементы в обломках термоядерных испытаний». Физический обзор . 102 (1): 180–182. Бибкод : 1956PhRv..102..180F . дои : 10.1103/PhysRev.102.180 .
- ^ Jump up to: Перейти обратно: а б с Информационный бюллетень о здоровье человека по кюрию, заархивированный 18 февраля 2006 г. в Wayback Machine , Национальная лаборатория Лос-Аламоса.
- ^ Эмсли, Джон (2011). Строительные блоки природы: Путеводитель по элементам от Аризоны (новое издание). Нью-Йорк, штат Нью-Йорк: Издательство Оксфордского университета. ISBN 978-0-19-960563-7 .
- ^ Гопка, В.Ф.; Ющенко А.В.; Ющенко В.А.; Панов, ИВ; Ким, Ч. (15 мая 2008 г.). «Идентификация линий поглощения актинидов с коротким периодом полураспада в спектре звезды Пшибыльского (HD 101065)». Кинематика и физика небесных тел . 24 (2): 89–98. Бибкод : 2008KPCB...24...89G . дои : 10.3103/S0884591308020049 . S2CID 120526363 .
- ^ Jump up to: Перейти обратно: а б Основные элементы статических ритэгов. Архивировано 15 февраля 2013 г. в Wayback Machine , Г. Л. Кульчински, конспекты курса NEEP 602 (весна 2000 г.), Ядерная энергетика в космосе, Институт термоядерных технологий Университета Висконсина (см. последнюю страницу).
- ^ Jump up to: Перейти обратно: а б с Люметта, Грегг Дж.; Томпсон, майор К.; Пеннеман, Роберт А.; Эллер, П. Гэри (2006). «Кюрий» (PDF) . В Морссе; Эдельштейн, Норман М.; Фугер, Жан (ред.). Химия актинидных и трансактинидных элементов (3-е изд.). Дордрехт, Нидерланды: Springer Science+Business Media . п. 1401. ИСБН 978-1-4020-3555-5 . Архивировано из оригинала (PDF) 17 июля 2010 г.
- ^ Пеннеман, стр. 34–48.
- ^ Магнуссон Д; Кристиансен Б; Бригадир МРС; Гейст А; Глатц Дж.П.; Мальмбек Р; Модоло Г; Серрано-Пуррой Д. и Сорел С. (2009). «Демонстрация процесса SANEX в центробежных контакторах с использованием молекулы CyMe4-BTBP в растворе настоящего топлива» . Сольвентная экстракция и ионный обмен . 27 (2): 97. дои : 10.1080/07366290802672204 . S2CID 94720457 .
- ^ Пеннеман, с. 25
- ^ Каннингем, BB; Воллманн, Дж. К. (1964). «Кристаллическая структура и температура плавления металлического кюрия». Журнал неорганической и ядерной химии . 26 (2): 271. doi : 10.1016/0022-1902(64)80069-5 . ОСТИ 4667421 .
- ^ Стивенсон, Дж.; Петерсон, Дж. (1979). «Получение и структурные исследования элементарного кюрия-248 и нитридов кюрия-248 и берклия-249». Журнал менее распространенных металлов . 66 (2): 201. doi : 10.1016/0022-5088(79)90229-7 .
- ^ Справочник Гмелина по неорганической химии , Система № 71, Том 7 а, трансураны, Часть B 1, стр. 67–68.
- ^ Юбэнкс, И.; Томпсон, MC (1969). «Приготовление металлического кюрия». Письма по неорганической и ядерной химии . 5 (3): 187. дои : 10.1016/0020-1650(69)80221-7 .
- ^ Холлеман, с. 1972 год
- ^ Гринвуд, с. 1268
- ^ Ноэ, М.; Фугер, Дж. (1971). «Влияние самоизлучения на параметр решетки 244CmO2». Письма по неорганической и ядерной химии . 7 (5): 421. дои : 10.1016/0020-1650(71)80177-0 .
- ^ Хауг, Х. (1967). «Полуторный оксид кюрия Cm2O3». Журнал неорганической и ядерной химии . 29 (11): 2753. doi : 10.1016/0022-1902(67)80014-9 .
- ^ Фугер, Дж.; Хайре, Р.; Петерсон, Дж. (1993). «Молярные энтальпии образования BaCmO3 и BaCfO3» . Журнал сплавов и соединений . 200 (1–2): 181. doi : 10.1016/0925-8388(93)90491-5 .
- ^ Доманов, В.П. (январь 2013 г.). «Возможность генерации восьмивалентного кюрия в газовой фазе в виде летучего тетраоксида CmO 4 ». Радиохимия . 55 (1): 46–51. дои : 10.1134/S1066362213010098 . S2CID 98076989 .
- ^ Зайцевский, Андрей; Шварц, WH Eugen (апрель 2014 г.). «Структура и стабильность изомеров AnO4, An = Pu, Am и Cm: исследование релятивистского функционала плотности». Физическая химия Химическая физика . 2014 (16): 8997–9001. Бибкод : 2014PCCP...16.8997Z . дои : 10.1039/c4cp00235k . ПМИД 24695756 .
- ^ Кинан, Т. (1967). «Тенденции констант решетки K7Cm6F31 в ряду щелочной металл-актинид (IV) 1:1 и 7:6». Письма по неорганической и ядерной химии . 3 (10): 391. дои : 10.1016/0020-1650(67)80092-8 .
- ^ Эспри, LB; Кинан, ТК; Крузе, Ф.Х. (1965). «Кристаллические структуры трифторидов, трихлоридов, трибромидов и трииодидов америция и кюрия» . Неорганическая химия . 4 (7): 985. дои : 10.1021/ic50029a013 . S2CID 96551460 .
- ^ Бернс, Дж.; Петерсон-младший; Стивенсон, Дж. Н. (1975). «Кристаллографические исследования некоторых трансурановых тригалогенидов: 239PuCl3, 244CmBr3, 249BkBr3 и 249CfBr3». Журнал неорганической и ядерной химии . 37 (3): 743. doi : 10.1016/0022-1902(75)80532-X .
- ^ Валлманн, Дж.; Фугер, Дж.; Петерсон-младший; Грин, Дж.Л. (1967). «Кристаллическая структура и параметры решетки трихлорида кюрия». Журнал неорганической и ядерной химии . 29 (11): 2745. doi : 10.1016/0022-1902(67)80013-7 . S2CID 97334114 .
- ^ Вейгель, Ф.; Вишневский В.; Хауске, Х. (1977). «Парофазный гидролиз PuCl3 и CmCl3: теплоты образования PuOC1 и CmOCl». Журнал менее распространенных металлов . 56 (1): 113. дои : 10.1016/0022-5088(77)90224-7 .
- ^ Трок, Р. Монохалькогениды актинидов, Том 27 , Springer, 2009 г. ISBN 3-540-29177-6 , с. 4
- ^ Дэмиен, Д.; Шарвилла, Япония; Мюллер, В. (1975). «Получение и параметры решетки сульфидов и селенидов кюрия». Письма по неорганической и ядерной химии . 11 (7–8): 451. doi : 10.1016/0020-1650(75)80017-1 .
- ^ Люметта, Дж.Дж.; Томпсон, MC; Пеннеман, РА; Эллер, П.Г. Курий. Архивировано 17 июля 2010 г. в Wayback Machine , Глава девятая в Радиоаналитической химии , Springer, 2004, стр. 1420–1421. ISBN 0387341226 , ISBN 978-0387 341224
- ^ Эльшенбройх, Ч. Металлоорганическая химия, 6-е издание, Висбаден, 2008 г., ISBN 978-3-8351-0167-8 , с. 589
- ^ Керридж, Эндрю; Кальцояннис, Николас (2009). «Являются ли основные состояния поздних актиноценов мультиконфигурационными? Полностью электронные спин-орбитальные расчеты CASPT2 для An (η8-C8H8)2 (An = Th, U, Pu, Cm)» . Журнал физической химии А. 113 (30): 8737–8745. Бибкод : 2009JPCA..113.8737K . дои : 10.1021/jp903912q . ПМИД 19719318 .
- ^ Гирт, Дениз; Роски, Питер В.; Гейст, Андреас; Рафф, Кристиан М.; Панак, Петра Дж.; Денеке, Мелисса А. (2010). «6-(3,5-Диметил-1H-пиразол-1-ил)-2,2'-бипиридин как лиганд для разделения актинида (III)/лантанида (III)». Неорганическая химия . 49 (20): 9627–9635. дои : 10.1021/ic101309j . ПМИД 20849125 . S2CID 978265 .
- ^ Jump up to: Перейти обратно: а б Глориус, М.; Молл, Х.; Бернхард, Г. (2008). «Комплексообразование кюрия (III) с гидроксамовыми кислотами, исследованное с помощью лазерно-индуцированной флуоресцентной спектроскопии с временным разрешением». Многогранник . 27 (9–10): 2113. doi : 10.1016/j.poly.2008.04.002 .
- ^ Jump up to: Перейти обратно: а б Хеллер, Энн; Барклейт, Астрид; Бернхард, Герт; Акерманн, Йорг-Уве (2009). «Исследование комплексообразования европия (III) и кюрия (III) с мочевиной в водном растворе, исследованное методом лазерно-индуцированной флуоресцентной спектроскопии с временным разрешением». Неорганика Химика Акта . 362 (4): 1215. doi : 10.1016/j.ica.2008.06.016 .
- ^ Jump up to: Перейти обратно: а б Молл, Генри; Джонсон, Анна; Шефер, Матиас; Педерсен, Карстен; Будзикевич, Герберт; Бернхард, Герт (2007). «Комплексообразование курия (III) с пиовердинами, секретируемыми штаммом Pseudomonas fluorescens из грунтовых вод». Биометаллы . 21 (2): 219–228. дои : 10.1007/s10534-007-9111-x . ПМИД 17653625 . S2CID 24565144 .
- ^ Jump up to: Перейти обратно: а б Молл, Генри; Гейпель, Герхард; Бернхард, Герт (2005). «Комплексообразование кюрия (III) с аденозин-5'-трифосфатом (АТФ): исследование лазерно-индуцированной флуоресцентной спектроскопии (TRLFS) с временным разрешением». Неорганика Химика Акта . 358 (7): 2275. doi : 10.1016/j.ica.2004.12.055 .
- ^ «Биохимическая таблица Менделеева – Кюрий» . УМББД. 08.06.2007 . Проверено 25 марта 2011 г.
- ^ Молл, Х.; Штумпф, Т.; Меррун, М.; Россберг, А.; Селенска-Побелл, С.; Бернхард, Г. (2004). «Исследование лазерной флуоресцентной спектроскопии с временным разрешением по взаимодействию кюрия (III) с Desulfovibrio äspöensis DSM 10631T». Экологические науки и технологии . 38 (5): 1455–1459. Бибкод : 2004EnST...38.1455M . дои : 10.1021/es0301166 . ПМИД 15046347 .
- ^ Одзаки, Т.; и др. (2002). «Ассоциация Eu(III) и Cm(III) с Bacillus subtilis и Halobacterium salinarium» . Журнал ядерной науки и технологий . Доп. 3: 950–953. Бибкод : 2002JNST...39S.950O . дои : 10.1080/00223131.2002.10875626 . S2CID 98319565 . Архивировано из оригинала 25 февраля 2009 г.
- ^ Биндер, Гарри Х.: Лексикон химических элементов , С. Хирзель Верлаг, Штутгарт, 1999, ISBN 3-7776-0736-3 , стр. 174–178.
- ^ Справочник Гмелина по неорганической химии , Система № 71, Том 7а, трансураны, Часть A2, с. 289
- ↑ Кроненберг, Андреас , Plutonium-Batterien. Архивировано 26 декабря 2013 г. в Wayback Machine (на немецком языке). «Архивная копия» . Архивировано из оригинала 21 февраля 2011 года . Проверено 28 апреля 2011 г.
{{cite web}}: CS1 maint: архивная копия в качестве заголовка ( ссылка ) CS1 maint: бот: статус исходного URL-адреса неизвестен ( ссылка ) - ^ Холлеман, стр. 1980–1981.
- ^ Сиборг, Гленн Т. (1996). Адлофф, JP (ред.). Сто лет после открытия радиоактивности . Ольденбургский Wissenschaftsverlag. п. 82. ИСБН 978-3-486-64252-0 .
- ^ «Розетта Лендер Филе» . Bernd-leitenberger.de. 01 июля 2003 г. Проверено 25 марта 2011 г.
- ^ Ридер, Р.; Ванке, Х.; Эконому, Т. (сентябрь 1996 г.). «Альфа-протонный рентгеновский спектрометр для Марса-96 и Mars Pathfinder». Бюллетень Американского астрономического общества . 28 : 1062. Бибкод : 1996ДПС....28.0221Р .
- ^ Лейтенбергер, Бернд Космические зонды Surveyor (на немецком языке)
- ^ Никс, Оран (1985). «Гл. 9. Основы геодезиста» . SP-480 Дальние путешественники: исследовательские машины . НАСА.
- ^ Рентгеновский спектрометр альфа-частиц (APXS) , Корнельский университет
- ^ Хоффманн, К. Можете ли вы сделать золото? Мошенники, жонглёры и учёные. Из истории химических элементов (Можете ли вы сделать золото? Мошенники, клоуны и ученые. Из истории химических элементов), Urania-Verlag, Лейпциг, Йена, Берлин, 1979, без ISBN, стр. 233
- ↑ Бэтсле, Л.Х. Применение разделения/трансмутации радиоактивных материалов при обращении с радиоактивными отходами. Архивировано 26 апреля 2005 г. в Wayback Machine , Центр ядерных исследований Бельгии Sck/Cen, Мол, Бельгия, сентябрь 2001 г.
Библиография [ править ]
- Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- Холлеман, Арнольд Ф. и Виберг, Учебник по неорганической химии Нильса , 102-е издание, де Грюйтер, Берлин, 2007 г., ISBN 978-3-11-017770-1 .
- Пеннеман Р.А. и Кинан Т.К. Радиохимия америция и кюрия , Калифорнийский университет, Лос-Аламос, Калифорния, 1960 г.
Внешние ссылки [ править ]
- Курий в Периодической таблице видео (Ноттингемский университет)
- Банк данных NLM по опасным веществам – кюрий, радиоактивный






![{\displaystyle {\ce {^{238}_{92}U->[{\ce {(n,\gamma)}}]{^{239}_{92}U}->[\beta ^{ -}][23.5\ {\ce {min}}]_{93}^{239}Np->[\beta ^{-}][2.3565\ {\ce {d}}]_{94}^{ 239}Пу}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c30c60d3b829e92822267f24b94337ce0d267d38)
![{\displaystyle {\ce {^{239}_{94}Pu->[{\ce {2(n,\gamma)}}]_{94}^{241}Pu->[\beta ^{- }][14.35\ {\ce {yr}}]{^{241}_{95}Am}->[{\ce {(n,\gamma )}}]_{95}^{242}Am- >[\beta ^{-}][16.02{\ce {h}}]_{96}^{242}См}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ee8c743c87eab605b6f80f80388eeb9f462b4086)
![{\displaystyle {\ce {^{239}_{94}Pu->[{\ce {4(n,\gamma)}}]_{94}^{243}Pu->[\beta ^{- }][4.956\ {\ce {h}}]_{95}^{243}Am->[({\ce {n}},\gamma )]_{95}^{244}Am->[ \beta ^{-}][10.1{\ce {h}}]_{96}^{244}Cm->[\alpha ][18.11\ {\ce {yr}}]_{94}^{240 }Помещать}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e202c162172b717f887b5f0bd06d3e01057ae924)

![{\displaystyle {\begin{matrix}{}\\{\ce {^{252}_{98}Cf ->[\alpha][2.645\ {\ce {yr}}] ^{248}_{96 }Cm}}\\{}\end{матрица}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c6cc4394eb604706a66a7112cda30cf38f857380)
![{\displaystyle {\ce {^{249}_{97}Bk ->[\beta^-][330\ {\ce {d}}] ^{249}_{98}Cf ->[\alpha] [351\ {\ce {год}}] ^{245}_{96}См}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7ccddd548852fda4a6af794bec61eda1293ebdd8)

![{\displaystyle {\ce {4CmO2 ->[\Delta T] 2Cm2O3 + O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d347ad5669ad313e0453be3c15f15e400c2d5ef8)



