Гидроксамовая кислота
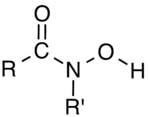
В органической химии гидроксамовые кислоты — класс органических соединений, имеющих общую формулу. R- C(=O) -N(-OH)-R', несущий функциональную группу - C (= O )- N (-OH ) - , где R и R' обычно представляют собой органильные группы (например, алкил или арил ) или водород . Это амиды ( R-C(=O)-NH-R' ), где атом азота имеет гидроксил ( -OH ) заместитель . Их часто используют в качестве металлов хелаторов . [1]
Распространенным примером гидроксамовой кислоты является ацето -N -метилгидроксамовая кислота ( H 3 C-C(=O)-N(-OH)-CH 3 ). Некоторыми необычными примерами гидроксамовых кислот являются формо -N -хлоргидроксамовая кислота ( H-C(=O)-N(-OH)-Cl ) и хлороформо- N -метилгидроксамовая кислота ( Cl-C(=O)-N(-OH)-CH 3 ).
Синтез и реакции
[ редактировать ]Гидроксамовые кислоты обычно получают из сложных эфиров или хлорангидридов реакцией с солями гидроксиламина . Для синтеза бензогидроксамовой кислоты ( C 6 H 5 -C(=O)-NH-OH или Ph-C(=O)-NH-OH , где Ph — фенильная группа ), общее уравнение: [2]
- C 6 H 5 −C(=O)−O−CH 3 + NH 2 OH → C 6 H 5 −C(=O)−NH−OH + CH 3 OH
Гидроксамовые кислоты также можно синтезировать из альдегидов и N -сульфонилгидроксиламина по реакции Анджели-Римини . [3] Альтернативно, дипероксид оксида молибдена окисляет триметилсилированные амиды до гидроксамовых кислот, хотя выходы составляют всего около 50%. [4] В вариации реакции Нефа , первичные нитросоединения хранящиеся в кислом растворе (чтобы свести к минимуму количество нитронатного таутомера ), гидролизуются до гидроксамовой кислоты. [5]
Хорошо известной реакцией эфиров гидроксамовой кислоты является перегруппировка Лоссена . [6]
Координационная химия и биохимия
[ редактировать ]- Пример галереи
-
Комплекс Fe(III) триацетилфузаринина [7]
Сопряженное основание гидроксамовой кислоты называется гидроксаматом . Депротонирование происходит при -N(-OH)- Группа водорода с удаленным атомом , в результате чего образуется гидроксамат- анион. R−C(=O)−N(−O − )−R' . Полученное в результате сопряженное основание представляет собой металл с анионным сопряженным О , О- хелатирующим лигандом . Многие гидроксамовые кислоты и многие гидроксаматы железа были выделены из природных источников. [8]
Они действуют как лиганды , обычно железа. [9] как железосвязывающие соединения ( сидерофоры Природа создала семейства гидроксамовых кислот, которые функционируют в бактериях ) . Они извлекают железо(III) из нерастворимых источников ( ржавчина , минералы и т. д.). Образующиеся комплексы транспортируются в клетку, где железо экстрагируется и утилизируется метаболически. [10]
Лиганды, полученные из гидроксамовой кислоты и тиогидроксамовой кислоты (гидроксамовая кислота, в которой один или оба атома кислорода находятся в Функциональная группа −C(=O)−N(−OH)− замещается серой ) также образует прочные комплексы со свинцом (II). [11]
Другое использование и случаи
[ редактировать ]Гидроксамовые кислоты широко применяются при флотации редкоземельных минералов при обогащении и извлечении руд для дальнейшей переработки. [12] [13]
Некоторые гидроксамовые кислоты (например , вориностат , белиностат , панобиностат и трихостатин А ) являются ингибиторами HDAC с противораковыми свойствами. Фосмидомицин является природным ингибитором гидроксамовой кислоты 1-дезокси -D- ксилулозо-5-фосфатредуктоизомеразы ( DXP-редуктоизомеразы ). Гидроксамовые кислоты также исследовались для переработки облученного топлива. [ нужна ссылка ]
Ссылки
[ редактировать ]- ^ Мансон, Джеймс В. (1992). «Гидроксамовые кислоты». В С. Патаи (ред.). Производные кислот (1992), Том 2 . Химия функциональных групп ПАТАИ. стр. 849–873. дои : 10.1002/9780470772508.ch15 . ISBN 9780470772508 .
- ^ Ч.Р. Хаузер; У. Б. Ренфроу-младший (1939). «Безогидроксамовая кислота». Орг. Синтез . 19:15 . дои : 10.15227/orgsyn.019.0015 .
- ^ Ли, Цзе Джек (2003). Реакции названий: сборник подробных механизмов реакций (2-е изд.). Берлин, Гейдельберг, Нью-Йорк: Springer. п. 9. ISBN 978-3-662-05338-6 .
- ^ Мэтлин, Стивен А.; Сэммс, Питер Г.; Аптон, Роджер М. (1979). «Окисление триметилсилилированных амидов до гидроксамовых кислот». Журнал Химического общества, Perkin Transactions I : 2481–2487 – через CiteSeerX.
- ^ Смит (2020), Органическая химия марта , rxn. 16-3.
- ^ Ван, Зеронг (2010). Комплексные органические реакции и реагенты . John Wiley & Sons, Inc., стр. 1772–1776. ISBN 9780471704508 .
- ^ Хоссейн, МБ; Энг-Уилмот, Д.Л.; Логри, РА; ан дер Хельм, Д. (1980). «Круговой дихроизм, кристаллическая структура и абсолютная конфигурация сидерофора Ferric N,N',N»-триацетилфузаринин, FeC 39 H 57 N 6 O 15 ». Журнал Американского химического общества . 102 (18): 5766–5773. дои : 10.1021/ja00538a012 .
- ^ Авраам Шанзер, Клиффорд Э. Фелдер, Янив Барда (2008). «Природные и биомиметические сидерофоры на основе гидроксамовой кислоты». В Цви Раппопорте, Джоэл Ф. Либман (ред.). Химия гидроксиламинов, оксимов и гидроксамовых кислот . Химия функциональных групп ПАТАИ. стр. 751–815. дои : 10.1002/9780470741962.ch16 . ISBN 9780470512616 .
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Агравал, Ю.К. (1979). «Гидроксамовые кислоты и их металлокомплексы». Российское химическое обозрение . 48 (10): 948–963. Бибкод : 1979RuCRv..48..948A . дои : 10.1070/RC1979v048n10ABEH002422 . S2CID 250857281 .
- ^ Миллер, Марвин Дж. (ноябрь 1989 г.). «Синтез и терапевтический потенциал сидерофоров и аналогов на основе гидроксамовой кислоты». Химические обзоры . 89 (7): 1563–1579. дои : 10.1021/cr00097a011 .
- ^ Фаркас, Этелка; Бульо, Питер (2017). «Глава 8. Комплексы свинца (II) аминокислот, пептидов и других родственных лигандов, представляющих биологический интерес». В Астрид, С.; Хельмут, С.; Сигел, RKO (ред.). Свинец: его влияние на окружающую среду и здоровье . Ионы металлов в науках о жизни. Том. 17. де Грюйтер. стр. 201–240. дои : 10.1515/9783110434330-008 . ISBN 9783110434330 . ПМИД 28731301 .
- ^ Мэрион, Кристофер; Йорденс, Адам; Ли, Ронхао; Рудольф, Мартин; Уотерс, Кристиан Э. (август 2017 г.). «Оценка гидроксаматных собирателей для флотации малахита». Технология разделения и очистки . 183 : 258–269. дои : 10.1016/j.seppur.2017.02.056 .
- ^ Йорденс, Адам; Ченг, Ин Пин; Уотерс, Кристиан Э. (февраль 2013 г.). «Обзор обогащения минералов, содержащих редкоземельные элементы». Минеральное машиностроение . 41 : 97–114. Бибкод : 2013MiEng..41...97J . дои : 10.1016/j.mineng.2012.10.017 .
Дальнейшее чтение
[ редактировать ]- Фуше, К.Ф.; Х. Ж. ле Ру; Ф. Филлипс (июнь 1970 г.). «Комплексообразование Zr(IV) и Hf(IV) с гидроксамовыми кислотами в кислых растворах» . Журнал неорганической и ядерной химии . 32 (6): 1949–1962. дои : 10.1016/0022-1902(70)80604-2 . ISSN 0022-1902 . Архивировано из оригинала 4 января 2013 г. Проверено 24 апреля 2009 г.
- Барокас, А.; Ф. Барончелли; ГБ Бионди; Г. Гросси (декабрь 1966 г.). «Комплексообразующая способность гидроксамовых кислот и ее влияние на поведение органических экстрагентов при переработке облученного топлива - II: Комплексы бензогидроксамовой кислоты с торием, ураном (IV) и плутонием (IV)» . Журнал неорганической и ядерной химии . 28 (12): 2961–2967. дои : 10.1016/0022-1902(66)80023-4 . ISSN 0022-1902 . Архивировано из оригинала 4 января 2013 г. Проверено 24 апреля 2009 г.
- Барончелли, Ф.; Г. Гросси (май 1965 г.). «Комплексообразующая способность гидроксамовых кислот и ее влияние на поведение органических экстрагентов при переработке облученного топлива - комплексы бензогидроксамовой кислоты с цирконием, железом (III) и ураном (VI)» . Журнал неорганической и ядерной химии . 27 (5): 1085–1092. дои : 10.1016/0022-1902(65)80420-1 . ISSN 0022-1902 . Архивировано из оригинала 4 января 2013 г. Проверено 24 апреля 2009 г.
- Аль-Джарра, Р.Х.; А.Р. Аль-Карагули; СА Аль-Ассаф; Н. Х. Шамон (1981). «Сольвентная экстракция ионов урана и некоторых других металлов 2-N-бутил-2-этилоктаногидроксамовой кислотой» . Журнал неорганической и ядерной химии . 43 (11): 2971–2973. дои : 10.1016/0022-1902(81)80652-5 . ISSN 0022-1902 . Архивировано из оригинала 4 января 2013 г. Проверено 24 апреля 2009 г.
- Гопалан, Аравамудан С.; Винсент Дж. Хубер; Орхан Зинциркулиоглу; Пол Х. Смит (1992). «Новые тетрагидроксаматные хелаторы комплексообразования актинидов: исследования синтеза и связывания» . Журнал Химического общества, Химические коммуникации (17): 1266–1268. дои : 10.1039/C39920001266 .
- Кошти, Нирмал; Винсент Хубер; Пол Смит; Аравамудан С. Гопалан (28 февраля 1994 г.). «Разработка и синтез хелаторов, специфичных для актинидов: синтез новых хелаторов циклама тетрагидроксамата (CYTROX) и циклама тетраацетонилацетона (CYTAC)» . Тетраэдр . 50 (9): 2657–2664. дои : 10.1016/S0040-4020(01)86981-7 . ISSN 0040-4020 .


![Комплекс Fe(III) триацетилфузаринина[7]](http://upload.wikimedia.org/wikipedia/commons/thumb/5/5b/Fe%28hydroxamate%293.svg/125px-Fe%28hydroxamate%293.svg.png)