Неф реакция
| Неф реакция | |
|---|---|
| Назван в честь | Джон Ульрик Неф |
| Тип реакции | Реакция замещения |
| Идентификаторы | |
| Портал органической химии | неф-реакция |
| RSC Идентификатор онтологии | RXNO: 0000157 |
В органической химии Нефа — органическая реакция, описывающая кислотный гидролиз соли реакция первичного или вторичного нитроалкана ( R-NO 2 ) до альдегида ( R-CH=O ) или кетон ( R 2 C=O ) и закись азота ( Н 2 О ). Реакция была предметом нескольких обзоров литературы. [1] [2] [3]

1. Salt of a nitroalkane
3. Ketone
4. Nitrous oxide
О реакции сообщил в 1894 году химик Джон Ульрик Неф . [4] который обработал натриевую соль нитроэтана получив серной кислотой, выход закиси азота 85–89% и выход ацетальдегида не менее 70% . Однако годом ранее, в 1893 году, реакция была впервые предложена Коноваловым. [5] который превратил калиевую соль 1-фенилнитроэтана серной кислотой в ацетофенон .
Механизм реакции
[ редактировать ]Механизм реакции , начинающийся с нитронатной соли в виде резонансных структур 1a и 1b, изображен ниже:
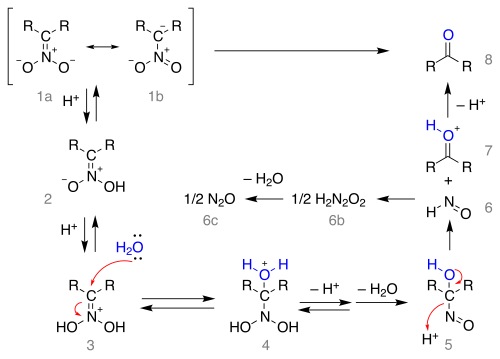
Соль протонируется с образованием нитроновой кислоты 2 (в некоторых случаях эти нитронаты выделены) и еще раз до иминиевого иона 3 . Это промежуточное соединение подвергается воздействию воды в результате нуклеофильного присоединения, образуя соединение 4 , которое теряет протон, а затем воду с образованием 1- нитрозоалканола который 5, , как полагают, ответственен за темно-синий цвет реакционной смеси во многих реакциях Нефа. Это промежуточное соединение перегруппировывается в гипоазотистую кислоту 6 (образуя закись азота 6c - 6b ) и ион оксония 7 , который теряет протон с образованием карбонильного соединения.
Обратите внимание, что для образования нитронатной соли из нитросоединения требуется альфа-атом водорода , и поэтому реакция с третичными нитросоединениями невозможна.
Объем
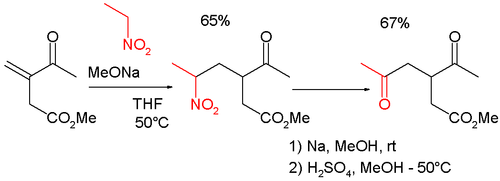
[ редактировать ]Реакции типа Нефа часто встречаются в органическом синтезе , поскольку они превращают реакцию Генри в удобный метод функционализации в положениях β и γ. [6] Так, например, реакция сочетается с реакцией Михаэля при синтезе γ -кето-карбонилметил -3-ацетил-5-оксогексаноата , который сам по себе является промежуточным циклопентеноном : [7] [8]
В химии углеводов они представляют собой метод удлинения цепи для альдоз , как при изотопной маркировке C. 14 - D ‑ манноза и С 14 - D ‑ глюкоза из D ‑ арабинозы и С 14 — нитрометан (первая стадия здесь — реакция Генри ):

Противоположная реакция – деградация Воля .
Варианты
[ редактировать ]Первоначальный протокол Нефа с использованием концентрированной серной кислоты был описан как «жестокий». [9] Сильнокислотный гидролиз без промежуточной солевой стадии приводит к образованию солей карбоновых кислот и гидроксиламина . [ нужна ссылка ] но кислоты Льюиса, такие как хлорид олова (IV) [10] и хлорид железа(III) [11] дать чистый гидролиз. Альтернативно, сильные окислители , такие как оксон , [12] озон или перманганаты расщепляют таутомер нитроната по двойной связи с образованием карбонила и нитрата . Оксофильные восстановители, такие как соли титана , восстанавливают нитронат до гидролизуемого имина , но менее селективные восстановители вместо этого дают амин. [9]
Ссылки
[ редактировать ]- ^ Ноланд, Вэйланд Э. (1955). «Реакция НЭФ». Химические обзоры . 55 (1): 137–155. дои : 10.1021/cr50001a003 .
- ^ Пинник, Гарольд В. (1990). «Реакция Нефа». В Пакетте, Лео А. (ред.). Органические реакции, том 38 (1-е изд.). Нью-Йорк: Уайли. стр. 655–792. дои : 10.1002/0471264180.или038.03 . ISBN 9780471515944 .
- ^ Грирсон, Дэвид С.; Юссон, Анри-Филипп (1991). «4.7 - Реакции типа Полоновского и Паммерера и реакция Нефа». В Тросте, Барри; Флеминг, Ян (ред.). Комплексный органический синтез: селективность, стратегия и эффективность в современном органическом синтезе, Том 6 (1-е изд.). Нью-Йорк: Пергамон. стр. 909–947. дои : 10.1016/B978-0-08-052349-1.00175-X . ISBN 9780080359298 .
- ^ Неф, Джон Ульрик (1894). «О строении солей нитропарафинов» . «Анналы химии» Юстуса Либиха . 280 (2–3): 263–291. дои : 10.1002/jlac.18942800209 .
- ^ Konovalov.,: J. Russ. Phys. Chem. Soc. 2 1893 , 6(I) , 509.
- ^ Уоррен и Вятт 2008 , с. 161.
- ^ Удобный синтез γ-функционализированных циклопентенонов Нур Лахмар, Тайсир Бен Айед, Монсеф Беллассуед и Хассен Амри Бейльштейн Журнал органической химии 2005 , 1:11 дои : 10.1186/1860-5397-1-11
- ^ Макмерри, Джон Э.; Мелтон, Джек (1977). «Превращение нитро в карбонил путем озонолиза нитронатов: 2,5-гептандион». Органические синтезы . 56:36 . дои : 10.15227/orgsyn.056.0036 .
- ^ Перейти обратно: а б Уоррен, Стюарт; Вятт, Пол (2008). Органический синтез: подход к отключению (2-е изд.). Уайли. стр. 161–164.
- ^ Мияшита, Масааки; Янами, Тецудзи; Ёсикоши, Акира (1981). «Синтез 1,4-дикетонов из эфиров силиленолов и нитроолефинов: 2-(2-оксопропил)циклогексанон». Органические синтезы . 60 : 117. дои : 10.15227/orgsyn.060.0117 .
- ^ Хайнцельман, Р.В. (1955). «о-Метоксифенилацетон». Органические синтезы . 35 : 74. дои : 10.15227/orgsyn.035.0074 .
- ^ Чекерелли, Паоло; Куриния, Массимо; Маркотуллиоа, Мария Карла; Эпифаноа, Франческо; Розация, Орнелио (1998). «Оксон способствует реакции Nef. Простое преобразование нитрогруппы в карбонил». Синтетические коммуникации . 28 (16): 3057–3064. дои : 10.1080/00397919808004885 .