Кислоты и основания Льюиса

Кислота Льюиса (названная в честь американского физико-химика Гилберта Н. Льюиса ) представляет собой химическую разновидность, содержащую пустую орбиталь , которая способна принимать электронную пару Льюиса от основания Льюиса с образованием аддукта . Таким образом, основание Льюиса — это любой вид, который имеет заполненную орбиталь, содержащую электронную пару, которая не участвует в связывании , но может образовывать дативную связь с кислотой Льюиса с образованием аддукта Льюиса. Например, NH 3 является основанием Льюиса, поскольку может отдавать свою неподеленную пару электронов. Триметилборан ( ) является кислотой Льюиса, поскольку способна присоединять неподеленную пару. В аддукте Льюиса кислота и основание Льюиса имеют общую электронную пару, обеспечиваемую основанием Льюиса, образуя дативную связь. [1] В контексте специфической химической реакции между NH 3 и Me 3 B неподеленная пара NH 3 образует дативную связь с пустой орбиталью Me 3 B с образованием аддукта NH 3 •BMe 3 . Терминология относится к вкладу Гилберта Н. Льюиса . [2]
Термины нуклеофил и электрофил иногда взаимозаменяемы с основанием Льюиса и кислотой Льюиса соответственно. Эти термины, особенно их абстрактные существительные формы нуклеофильность и электрофильность , подчеркивают кинетический аспект реакционной способности, в то время как основность Льюиса и кислотность Льюиса подчеркивают термодинамический аспект образования аддукта Льюиса. [3]
аддуктов Изображение
Во многих случаях взаимодействие между основанием Льюиса и кислотой Льюиса в комплексе обозначается стрелкой, указывающей основание Льюиса, отдающее электроны кислоте Льюиса, с использованием обозначения дативной связи - например, Me 3 B ← НХ 3 . В некоторых источниках основание Льюиса указывается парой точек (явно отданные электроны), что позволяет последовательно представить переход от самого основания к комплексу с кислотой:
- Me 3 B + :NH 3 → Me 3 B :NH 3
Центральная точка также может использоваться для обозначения аддукта Льюиса, например Ме 3 B·NH 3 . Другой пример — диэтилэфират трифторида бора . BF 3 · 2 O. Et В немного другом использовании центральная точка также используется для обозначения координации гидратов в различных кристаллах, как в MgSO 4 ·7H 2 O для гидратированного сульфата магния , независимо от того, образует ли вода дативную связь с металлом.
Хотя были попытки использовать вычислительные и экспериментальные энергетические критерии, чтобы отличить дативную связь от недативной ковалентной связи, [4] по большей части это различие просто указывает на источник электронной пары, и однажды образовавшиеся дативные связи ведут себя так же, как и другие ковалентные связи, хотя обычно они имеют значительный полярный характер. Более того, в некоторых случаях (например, сульфоксиды и оксиды аминов, как R 2 S → О и R 3 N → O ), использование дательной стрелки — это просто удобство обозначения, позволяющее избежать предъявления формальных обвинений. Однако в целом донорно-акцепторная связь рассматривается как нечто среднее между идеализированной ковалентной связью и ионной связью . [5]
Кислоты Льюиса [ править ]
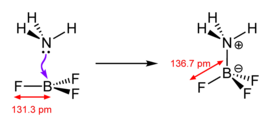
Кислоты Льюиса разнообразны, и этот термин используется широко. Простейшими являются те, которые реагируют непосредственно с основанием Льюиса, например тригалогениды бора и пентагалогениды фосфора, мышьяка и сурьмы.
В том же духе, CH + 3 можно рассматривать как кислоту Льюиса в реакциях метилирования. Однако метил-катион никогда не встречается в свободном виде в конденсированной фазе, а реакции метилирования реагентами типа CH 3 I протекают посредством одновременного образования связи нуклеофила с углеродом и разрыва связи между углеродом и йодом ( S N 2 реакция). Учебники по этому поводу расходятся во мнениях: некоторые утверждают, что алкилгалогениды являются электрофилами, а не кислотами Льюиса. [6] в то время как другие описывают алкилгалогениды (например, CH 3 Br) как разновидность кислоты Льюиса. [7] ИЮПАК утверждает , что кислоты Льюиса и основания Льюиса реагируют с образованием аддуктов Льюиса. [1] и определяет электрофилы как кислоты Льюиса. [8]
Простые кислоты Льюиса [ править ]
Некоторыми из наиболее изученных примеров таких кислот Льюиса являются тригалогениды бора и органобораны : [9]
- БФ 3 + Ф − → БФ − 4
В этом аддукте все четыре фторидных центра (точнее, лиганды ) эквивалентны.
- БФ 3 + ОМе 2 → БФ 3 ОМе 2
Оба БФ 4 − и BF 3 OMe 2 представляют собой аддукты основания Льюиса с трифторидом бора.
Многие аддукты нарушают правило октетов , например, трииодид- анион:
- я 2 + я − → я − 3
Изменчивость окраски растворов йода отражает переменную способность растворителя образовывать аддукты с кислотой Льюиса I 2 .
Некоторые кислоты Льюиса связываются с двумя основаниями Льюиса, известным примером является образование гексафторосиликата :
- СиФ 4 + 2 Ф − → СиФ 2− 6
Льюиса Комплексные кислоты
Большинство соединений, считающихся кислотами Льюиса, требуют стадии активации перед образованием аддукта с основанием Льюиса. Комплексные соединения, такие как Et 3 Al 2 Cl 3 и AlCl 3, рассматриваются как тригональные плоские кислоты Льюиса, но существуют в виде агрегатов и полимеров, которые должны разлагаться под действием основания Льюиса. [10] Более простой случай — образование аддуктов борана. Мономерного BH 3 в заметном количестве не существует, поэтому аддукты борана образуются при деградации диборана:
- Б 2 Ч 6 + 2 Ч − → 2 ЧД − 4
В этом случае промежуточный B 2 H − 7 можно выделить.
Многие комплексы металлов служат кислотами Льюиса, но обычно только после диссоциации более слабо связанного основания Льюиса, часто воды.
- [Мг(Н 2 О) 6 ] 2+ + 6 NH 3 → [Mg(NH 3 ) 6 ] 2+ + 6 Н 2 О
ЧАС + как Льюиса кислота
Протон ( H + ) [11] одна из самых сильных, но также и одна из самых сложных кислот Льюиса. Принято игнорировать тот факт, что протон сильно сольватирован (связан с растворителем). Учитывая это упрощение, кислотно-основные реакции можно рассматривать как образование аддуктов:
- ЧАС + + NH 3 → НХ + 4
- ЧАС + + ОН − → Н 2 О
кислот Применение Льюиса
Типичным примером действия кислоты Льюиса является реакция алкилирования Фриделя-Крафтса . [5] Ключевым этапом является принятие AlCl 3 неподеленной пары хлорид-иона, образуя AlCl - 4 и создает сильнокислотный, то есть электрофильный ион карбония.
- RCl +AlCl 3 → Р + + AlCl − 4
Льюиса Базы
Основание Льюиса — это атомная или молекулярная разновидность, у которой высшая занятая молекулярная орбиталь (ВЗМО) сильно локализована. Типичными основаниями Льюиса являются обычные амины, такие как аммиак и алкиламины . Другие распространенные основания Льюиса включают пиридин и его производные. Некоторые из основных классов оснований Льюиса:
- амины формулы NH 3- x R x где R = алкил или арил . С ними связаны пиридин и его производные.
- фосфины формулы PR 3− x Ar x .
- соединения O, S, Se и Te в степени окисления -2, включая воду, эфиры , кетоны
Наиболее распространенными основаниями Льюиса являются анионы. Сила основности Льюиса коррелирует с pK pK исходной кислоты: кислоты с высоким a дают хорошие основания Льюиса. Как обычно, более слабая кислота имеет более сильное сопряженное основание .
- Примеры оснований Льюиса, основанные на общем определении донора электронной пары, включают:
Силу оснований Льюиса оценивали для различных кислот Льюиса, таких как I 2 , SbCl 5 и BF 3 . [12]
| База Льюиса | Донорный атом | Энтальпия комплексообразования (кДж/моль) |
|---|---|---|
| хинуклидин | Н | 150 |
| И 3 Н | Н | 135 |
| Пиридин | Н | 128 |
| Ацетонитрил | Н | 60 |
| прямой доступ к памяти | ТО | 112 |
| ДМСО | ТО | 105 |
| ТГФ | ТО | 90.4 |
| Эт 2 О | ТО | 78.8 |
| Ацетон | ТО | 76.0 |
| ЭтОАк | ТО | 75.5 |
| Триметилфосфин | П | 97.3 |
| Тетрагидротиофен | С | 51.6 |
базисов Применение Льюиса
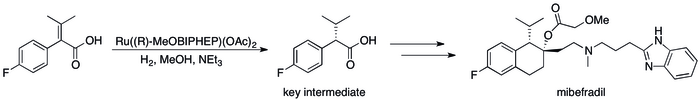
Почти все доноры электронных пар, образующие соединения путем связывания переходных элементов, можно рассматривать как лиганды . Таким образом, основания Льюиса широко применяются для изменения активности и селективности металлических катализаторов . Хиральные основания Льюиса, обычно мультидентатные , придают хиральность катализатору , обеспечивая асимметричный катализ , который полезен для производства фармацевтических препаратов . в промышленном синтезе антигипертензивного препарата мибефрадил используется хиральное основание Льюиса ( R -MeOBIPHEP). Например, [13]
Жесткая и мягкая классификация [ править ]
Кислоты и основания Льюиса обычно классифицируются в зависимости от их твердости или мягкости. В этом контексте «жесткий» означает маленькие и неполяризуемые, а «мягкий» указывает на более крупные атомы, которые более поляризуемы.
- типичные жесткие кислоты: H + , катионы щелочных/щелочноземельных металлов, бораны, Zn 2+
- типичные мягкие кислоты: Ag + , Мо(0), Ni(0), Pt 2+
- типичные твердые основания: аммиак и амины, вода, карбоксилаты, фториды и хлориды.
- типичные мягкие основания: органофосфины, тиоэфиры, окись углерода, йодид.
Например, амин вытеснит фосфин из аддукта с кислотой BF 3 . Таким же образом можно классифицировать базы. Например, основания, отдающие неподеленную пару от атома кислорода, тверже, чем основания, отдающие неподеленную пару от атома азота. Хотя классификация так и не была определена количественно, она оказалась очень полезной для прогнозирования силы образования аддукта с использованием ключевых концепций, согласно которым взаимодействия твердая кислота-жесткое основание и мягкая кислота-мягкое основание сильнее, чем взаимодействия твердая кислота-мягкое основание или мягкая кислота-жесткое основание. базовые взаимодействия. Более позднее исследование термодинамики взаимодействия показало, что взаимодействия «жесткий-жесткий» предпочтительнее с точки зрения энтальпии , тогда как «мягкий-мягкий» - с точки зрения энтропии . [ нужна ссылка ]
кислотности по определение Количественное Льюису
Было разработано множество методов для оценки и прогнозирования кислотности Льюиса. Многие из них основаны на спектроскопических признаках, таких как сдвиги сигналов ЯМР или ИК-диапазонов, например метод Гутмана-Беккета и метод Чайлдса. [14] метод.
Модель ECW представляет собой количественную модель, которая описывает и прогнозирует силу кислотно-основных взаимодействий Льюиса, -ΔH. Модель присвоила параметры E и C многим кислотам и основаниям Льюиса. характеризуется E A и CA. Каждая кислота Каждое основание также характеризуется своими собственными E B и C B . Параметры E и C относятся соответственно к электростатическому и ковалентному вкладу в прочность связей, которые образуют кислота и основание. Уравнение
- −ΔH = E A E B + C A C B + W
Термин W представляет собой постоянный вклад энергии в кислотно-основную реакцию, такую как расщепление димерной кислоты или основания. Уравнение предсказывает изменение силы кислот и оснований. Графическое представление уравнения показывает, что не существует единого порядка силы оснований Льюиса или силы кислоты Льюиса. [15] [16] и что шкалы отдельных свойств ограничены меньшим диапазоном кислот или оснований.
История [ править ]
Эта концепция возникла у Гилберта Н. Льюиса, который изучал химическую связь . В 1923 году Льюис написал: «Кислотное вещество — это вещество, которое может использовать неподеленную пару электронов другой молекулы для формирования стабильной группы одного из своих собственных атомов». [2] [17] кислотно-основная теория Брёнстеда -Лоури В том же году была опубликована . Эти две теории различны, но дополняют друг друга. Основание Льюиса также является основанием Бренстеда-Лоури, но кислота Льюиса не обязательно должна быть кислотой Бренстеда-Лоури. Классификация на жесткие и мягкие кислоты и основания ( теория HSAB ) последовала в 1963 году. Сила кислотно-основных взаимодействий Льюиса, измеряемая стандартной энтальпией образования аддукта, может быть предсказана с помощью двухпараметрического уравнения Драго-Вейланда.
теории Переформулировка Льюиса
В 1916 году Льюис предположил, что два атома удерживаются вместе в химической связи за счет общей пары электронов. [18] называется Когда каждый атом вносит в связь один электрон, такая связь ковалентной . Когда оба электрона исходят от одного из атомов, это называется дативной ковалентной связью или координатной связью . Различие не очень четкое. Например, при образовании иона аммония из аммиака и водорода молекула аммиака пару электронов отдает протону ; [11] идентичность электронов теряется аммония В образующемся ионе . Тем не менее Льюис предложил классифицировать донор электронной пары как основание, а акцептор электронной пары - как кислоту.
Более современное определение кислоты Льюиса — это атомная или молекулярная разновидность с локализованной пустой атомной или молекулярной орбиталью низкой энергии. Эта молекулярная орбиталь с самой низкой энергией ( LUMO ) может вместить пару электронов.
с теорией Брёнстеда Лоури Сравнение -
Основание Льюиса часто является основанием Бренстеда-Лоури, поскольку оно может отдавать пару электронов H. + ; [11] Протон является кислотой Льюиса, поскольку он может принять пару электронов. Сопряженное основание кислоты Бренстеда-Лоури также является основанием Льюиса, поскольку теряется H. + из кислоты уходят те электроны, которые использовались для связи А—Н в виде неподеленной пары на сопряженном основании. Однако основание Льюиса может быть очень трудно протонировать , но все же вступать в реакцию с кислотой Льюиса. Например, окись углерода является очень слабым основанием Бренстеда-Лоури, но образует сильный аддукт с BF 3 .
В другом сравнении кислотности Льюиса и Бренстеда-Лоури, проведенном Брауном и Каннером, [19] 2,6-ди- т -бутилпиридин реагирует с HCl с образованием гидрохлоридной соли, но не реагирует с BF 3 . Этот пример демонстрирует, что стерические факторы, помимо факторов электронной конфигурации, играют роль в определении силы взаимодействия между объемистым ди- т -бутилпиридином и крошечным протоном.
См. также [ править ]
- Кислота
- База (химия)
- Кислотно-основная реакция
- Кислотно-основная теория Бренстеда – Лоури
- Хиральная кислота Льюиса
- Разочарованная пара Льюиса
- Метод Гутмана – Беккета
- Модель ECW
- Философия химии
Ссылки [ править ]
- ↑ Перейти обратно: Перейти обратно: а б ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Кислота Льюиса ». дои : 10.1351/goldbook.L03508
- ↑ Перейти обратно: Перейти обратно: а б Льюис, Гилберт Ньютон (1923). Валентность и строение атомов и молекул . Американское химическое общество. Серия монографий. Нью-Йорк, Нью-Йорк, США: Компания по химическому каталогу. п. 142. ИСБН 9780598985408 . Из стр. 142: «Мы склонны думать о веществах как обладающих кислотными или основными свойствами, не имея в виду конкретный растворитель. Мне кажется, что с полной общностью мы можем сказать, что основное вещество — это такое вещество, которое имеет неподеленную пару электронов, которая может быть использован для завершения стабильной группы другого атома , и что кислотное вещество — это вещество, которое может использовать неподеленную пару из другой молекулы для завершения стабильной группы одного из своих собственных атомов. Другими словами, основное вещество образует пару. электронов для химической связи, кислотное вещество принимает такую пару».
- ^ Анслин, Эрик В. (2006). Современная физическая органическая химия . Догерти, Деннис А., 1952-. Саусалито, Калифорния: Университетская наука. ISBN 1891389319 . OCLC 55600610 . [ нужна страница ]
- ^ Лепети, Кристина; Мараваль, Валери; Канак, Ив; Шовен, Реми (2016). «О природе дативной связи: координация с металлами и за ее пределами. Случай углерода». Обзоры координационной химии . 308 : 59–75. дои : 10.1016/j.ccr.2015.07.018 .
- ↑ Перейти обратно: Перейти обратно: а б Марч, Дж. «Передовая органическая химия», 4-е изд. Дж. Уайли и сыновья, 1992: Нью-Йорк. ISBN 0-471-60180-2 . [ нужна страница ]
- ^ Воллхардт, К. Питер К. (2018). Органическая химия: строение и функции . Нил Эрик Шор (8-е изд.). Нью-Йорк. п. 73. ИСБН 978-1-319-07945-1 . OCLC 1007924903 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Кэри, Фрэнсис А. (2003). Органическая химия (5-е изд.). Бостон: МакГроу-Хилл. п. 46. ИСБН 0-07-242458-3 . OCLC 48850987 .
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Электрофил (Электрофил) ». doi : 10.1351/goldbook.E02020
- ^ Роуселл, Брайан Д.; Гиллеспи, Рональд Дж.; Херд, Джордж Л. (1999). «Плотная упаковка лигандов и кислотность Льюиса BF3 и BCl3». Неорганическая химия . 38 (21): 4659–4662. дои : 10.1021/ic990713m . ПМИД 11671188 .
- ^ Гринвуд, Нью-Йорк; и Эрншоу, А. (1997). Химия элементов (2-е изд.), Оксфорд: Баттерворт-Хайнеманн. ISBN 0-7506-3365-4 . [ нужна страница ]
- ↑ Перейти обратно: Перейти обратно: а б с Традиционно, но не совсем, H + ионы называются « протонами ». См. ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Гидрон ». doi : 10.1351/goldbook.H02904
- ^ Кристиан Лоуренс и Жан-Франсуа Галь «Шкалы основности и сродства Льюиса: данные и измерения»Уайли, 2009. ISBN 978-0-470-74957-9 . [ нужна страница ]
- ^ Якобсен, Э.Н.; Пфальц, Андреас; Ямамато, Х., ред. (1999). Комплексный асимметричный катализ . Берлин; Нью-Йорк: Спрингер. стр. 1443–1445. ISBN 978-3-540-64336-4 .
- ^ Чайлдс, РФ; Малхолланд, ДЛ; Никсон, А. (1982). «Аддукты кислот Льюиса α,β-ненасыщенных карбонильных и нитрильных соединений. Исследование ядерного магнитного резонанса» . Может. Дж. Чем . 60 (6): 801–808. дои : 10.1139/v82-117 .
- ^ Фогель, Гленн К.; Драго, Рассел С. (1996). «Модель ECW». Журнал химического образования . 73 (8): 701. Бибкод : 1996ЖЧЭд..73..701В . дои : 10.1021/ed073p701 .
- ^ Крамер, Роджер Э.; Бопп, Томас Т. (1977). «Отличный график e и C. Графическое отображение энтальпий образования аддуктов кислот и оснований Льюиса». Журнал химического образования . 54 (10): 612. Бибкод : 1977ЖЧЭд..54..612С . дои : 10.1021/ed054p612 .
- ^ Мисслер, Л.М., Тар, Д.А., (1991) с. 166 - В Таблице открытий датой публикации / выпуска теории Льюиса указан 1923 год.
- ^ Льюис, Гилберт Н. (апрель 1916 г.). «Атом и молекула» . Журнал Американского химического общества . 38 (4): 762–785. дои : 10.1021/ja02261a002 . S2CID 95865413 .
- ^ Браун, Герберт С.; Каннер, Бернард (1966). «Получение и реакции 2,6-ди-т-бутилпиридина и родственных ему затрудненных оснований. Случай стерического препятствия на пути к протону». Журнал Американского химического общества . 88 (5): 986–992. дои : 10.1021/ja00957a023 .
Дальнейшее чтение [ править ]
- Дженсен, ВБ (1980). Кислотно-основные концепции Льюиса: обзор . Нью-Йорк: Уайли. ISBN 0-471-03902-0 .
- Ямамото, Хисаши (1999). Реагенты кислоты Льюиса: практический подход . Нью-Йорк: Издательство Оксфордского университета. ISBN 0-19-850099-8 .

