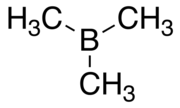
Триметилборан
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК Триметилборан [1] | |||
| Другие имена Триметилборин Триметилбор | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.008.926 | ||
| Номер ЕС |
| ||
ПабХим CID | |||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| С 3 Ч 9 Б | |||
| Молярная масса | 55.92 g/mol | ||
| Появление | Бесцветный газ или жидкость | ||
| Плотность | 0,625 г/см 3 при −100 °С [3] | ||
| Температура плавления | -161,5 ° C (-258,7 ° F; 111,6 К) | ||
| Точка кипения | -20,2 ° C (-4,4 ° F; 253,0 К) | ||
| Слабый, очень реактивный | |||
| Структура | |||
| Д | |||
| Опасности | |||
| Безопасность и гигиена труда (OHS/OSH): | |||
Основные опасности | Самовозгорается на воздухе; вызывает ожоги | ||
| СГС Маркировка : | |||
   | |||
| Опасность | |||
| Х220 , Х250 , Х280 , Х314 | |||
| P210 , P222 , P260 , P264 , P280 , P301+P330+P331 , P302+P334 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P310 , P321 , P363 , P370+ П378 , П377 , П381 , П403 , П405 , П410+П403 , П422 , П501 | |||
| точка возгорания | Неприменимо, пирофорный газ | ||
| -40 ° C (-40 ° F; 233 К) [4] | |||
| Паспорт безопасности (SDS) | Паспорт безопасности от Voltaix | ||
| Родственные соединения | |||
Родственные соединения | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Триметилборан (ТМБ) представляет собой токсичный пирофорный газ с формулой B(CH 3 ) 3 (которую также можно записать как Me 3 B, где Me представляет собой метил ).
Характеристики
[ редактировать ]В жидком виде он бесцветен. Самая сильная линия инфракрасного спектра находится на длине волны 1330 см. −1 за которыми следуют линии на высоте 3010 см. −1 и 1185 см −1 .
Его температура плавления составляет -161,5 °С, а температура кипения -20,2 °С.
Давление пара определяется выражением log P = 6,1385 + 1,75 log T - 1393,3/ T - 0,007735 T , где T — температура в кельвинах . [5] Молекулярный вес 55,914. Теплота парообразования составляет 25,6 кДж/моль. [4]
Подготовка
[ редактировать ]Триметилборан был впервые описан в 1862 году Эдвардом Франкландом . [6] который также упомянул его аддукт с аммиаком. [7] Из-за своей опасной природы соединение больше не изучалось до 1921 года, когда Альфред Шток и Фридрих Цейдлер воспользовались реакцией между газообразным трихлоридом бора и диметилцинком . [8] Хотя вещество можно приготовить с использованием реактивов Гриньяра, выход загрязняется нежелательными продуктами растворителя. Триметилборан можно получить в небольших масштабах с выходом 98% путем взаимодействия триметилалюминия в гексане с трибромидом бора в дибутиловом эфире в качестве растворителя. [5] Другие методы включают взаимодействие трибутилбората с хлоридом триметилалюминия или тетрафторбората калия с триметилалюминием. [9] или добавление трифторида бора в эфире к иодиду метилмагния . [10]
Реакции
[ редактировать ]Триметилборан самопроизвольно воспламеняется на воздухе, если его концентрация достаточно высока. Он горит зеленым пламенем, образуя копоть. [11] Более медленное окисление кислородом в растворителе или в газовой фазе может привести к образованию диметилтриоксадиборалана, содержащего кольцо из двух атомов бора и трех атомов кислорода. Однако основным продуктом является диметилборилметилпероксид, который быстро разлагается до диметоксиметилборана. [12]
Триметилборан – сильная кислота Льюиса . B(CH 3 ) 3 может образовывать аддукт с аммиаком : (NH 3 ):B(CH 3 ) 3 . [13] а также другие базы Льюиса. Кислотные свойства Льюиса B(CH 3 ) 3 были проанализированы с помощью модели ECW, что дало E A = 2,90 и CA = 3,60. Когда триметилборан образует аддукт с триметиламином , возникает стерическое отталкивание между метильными группами B и N. Модель ECW может обеспечить измерение этого стерического эффекта.
Триметилборан реагирует с водой и хлором при комнатной температуре. Он также реагирует с жиром, но не с тефлоном или стеклом. [5]
Триметилборан реагирует с дибораном с образованием диспропорционата с образованием метилдиборана и диметилдиборана : (CH 3 )BH 2 .BH 3 и (CH 3 ) 2 BH.BH 3 .
Он реагирует в виде газа с триметилфосфином с образованием твердой соли Льюиса с теплотой образования -41 ккал на моль. Этот аддукт имеет теплоту сублимации -24,6 ккал/моль. Никакой реакции с триметиларсином или триметилстибином не происходит . [10]
Реакция метиллития с триметилбораном дает соль тетраметилбората: LiB(CH 3 ) 4 . [14] Ион тетраметилбората имеет отрицательный заряд и изоэлектронен неопентану тетраметилсилану , . и тетраметиламмония катиону
Использовать
[ редактировать ]Триметилборан использовался в качестве счетчика нейтронов. [15] Для этого использования он должен быть очень чистым. [13] Он также используется при химическом осаждении из паровой фазы , когда бор и углерод необходимо осаждать вместе.
Ссылки
[ редактировать ]- ^ Отдел химической номенклатуры и представления структуры ИЮПАК (2013). «П-6». В Фавре, Анри А.; Пауэлл, Уоррен Х. (ред.). Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 . ИЮПАК – РСК . ISBN 978-0-85404-182-4 . . п. 974.
- ^ Гранер, Г.; Хирота Э.; Иидзима Т.; Кучицу К.; Рамзи, Д.А.; Фогт, Дж.; Фогт, Н. (2001). «C 3 H 9 B Триметилборан». C3H9B Триметилборан . Молекулы и радикалы . Ландольт-Бёрнштайн - Группа II. Том. 25C: Молекулы, содержащие три или четыре атома углерода. п. 1370. дои : 10.1007/10688787_381 . ISBN 978-3-540-66774-2 .
- ^ См. Паспорт безопасности материалов.
- ^ Jump up to: а б «Триметилборан» (2009) в Интернет-химическом словаре . Архивировано 16 марта 2012 г. в Wayback Machine .
- ^ Jump up to: а б с Рис, Уильям С. младший; и др. (1990). Гинзберг, Элвин П. (ред.). Триметилборан . Неорганические синтезы. Том. 27. с. 339.
- ^ Франкленд, Эдвард (1862). «О новом ряду органических соединений, содержащих бор». «Анн» Юстуса Либиха. Хим . 124 : 129–157. дои : 10.1002/jlac.18621240102 .
- ^ Нисиябу Р.; Кубо Ю.; Джеймс, Т.Д.; Фосси, Дж. С. (2011). «Строительные блоки бороновой кислоты: инструменты для самостоятельной сборки». хим. Коммун . 47 (4): 1124–1150. дои : 10.1039/C0CC02921A . ПМИД 21113558 .
- ^ Сток, А.; Зейдлер, Ф. (1921). «О знаниях о борметиловом и борэтиловом» . Бер. Немецкий. Хим. А/Б . 54 (3): 531–541. дои : 10.1002/cber.19210540321 .
- ^ Кестер, Роланд; Бингер, Пол; Дальхофф, Вильгельм В. (1973). «Удобное получение триметилборана и триэтилборана». Синтез и реакционная способность в неорганической и металлоорганической химии . 3 (4): 359–367. дои : 10.1080/00945717308057281 .
- ^ Jump up to: а б Менте, Дональд Чарльз (май 1975 г.). Реакции оснований Льюиса триметильной группы Va с простыми борными кислотами Льюиса (PDF) (кандидатская диссертация). Техасский технологический институт . Архивировано из оригинала (PDF) 15 августа 2011 г. Проверено 23 сентября 2010 г.
- ^ Эллерн, Герберт (1968). Военная и гражданская пиротехника . Химическое издательство. п. 24 . CiteSeerX 10.1.1.137.1104 . ISBN 978-0-8206-0364-3 .
- ^ Бартон, Лоуренс; Крамп, Джон М.; Уитли, Джеффри Б. (июнь 1974 г.). «Триоксадибороланы от окисления метилдиборана». Журнал металлоорганической химии . 72 (1): С1–С3. дои : 10.1016/s0022-328x(00)82027-6 .
- ^ Jump up to: а б Росс, Гейлон С.; и др. (2 октября 1961 г.). «Приготовление триметилборана высокой чистоты» (PDF) . Журнал исследований Национального бюро стандартов . Раздел A. 66 (1). Архивировано из оригинала (PDF) 19 октября 2011 года . Проверено 22 сентября 2010 г.
- ^ Георг Виттиг в 1958 году.
- ^ Фергюсон, Джорджия младший; Яблонски, FE (29 декабря 2004 г.). «Подвижность электронов в триметилборе» . Обзор научных инструментов . 28 (11): 893. дои : 10.1063/1.1715757 . ISSN 0034-6748 .