Сульфид бора
 | |
| Имена | |
|---|---|
| Название ИЮПАК Сульфид бора | |
| Другие имена Полуторный сульфид бора, трисульфид дибора | |
| Идентификаторы | |
3D model ( JSmol ) | |
| Информационная карта ECHA | 100.031.355 |
| Номер ЕС |
|
ПабХим CID | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| Б 2 С 3 | |
| Молярная масса | 117.80 g/mol |
| Появление | бесцветные кристаллы |
| Плотность | 1,55 г/см 3 , твердый |
| Температура плавления | 563 ° C (1045 ° F; 836 К) |
| Точка кипения | разлагается при высоких T |
| разлагается | |
| Растворимость | растворим в аммиаке |
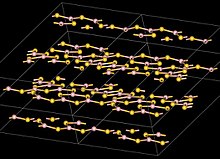
| Структура | |
| моноклинная , mP40 , SpaceGroup = P2 1 /c, № 14 | |
| B: плоский, сп 2 | |
| Термохимия | |
Теплоемкость ( С ) | 111,7 Дж/моль К |
Стандартный моляр энтропия ( S ⦵ 298 ) | 327 Дж/моль К |
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | -240,6 кДж/моль |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | источник H 2 S |
| СГС Маркировка : | |
   | |
| Опасность | |
| Х225 , Х260 , Х301 , Х311 , Х315 , Х318 , Х335 | |
| P210 , P223 , P231+P232 , P280 , P302+P352 , P303+P361+P353 , P305+P351+P338 , P312 , P402+P404 , P405 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | 18°С (64,4°Ф) |
| Паспорт безопасности (SDS) | trc-canada.com |
| Родственные соединения | |
Родственные соединения | БСl 3 реактив Ловессона |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Сульфид бора – соединение формулы 2 B химическое S 3 . Это белое, чувствительное к влаге твердое вещество. Имеет полимерную структуру. Материал представляет интерес как компонент «высокотехнологичных» стекол и как реагент для получения сераорганических соединений.
Реакции
[ редактировать ]Подобно сульфидам кремния и фосфора, B 2 S 3 реагирует со следами воды, в том числе с атмосферной влагой, с H 2 S. выделением Этот гидролиз описывается следующим идеализированным уравнением:
- Б 2 С 3 + 3 Ч 2 О → Б 2 О 3 + 3 Ч 2 С
B 2 S 3 легко образует стекла при смешивании с другими сульфидами, такими как P 4 S 10 . Такие стекла не поглощают средние частоты инфракрасной энергии по сравнению с обычными боросиликатными стеклами. Некоторые из этих тройных фаз являются проводниками быстрых ионов. [2]
B 2 S 3 превращает кетоны в соответствующие тионы . Например, превращение бензофенона в его тион происходит следующим образом:
- B 2 S 3 + 3 (C 6 H 5 ) 2 C=O → B 2 O 3 + 3 (C 6 H 5 ) 2 C=S
На практике B 2 S 3 будет использоваться в избытке. [3]
Синтез
[ редактировать ]Ранний синтез включал реакцию боридов железа и марганца с сероводородом при температуре 300 ° C. Преобразование моноборидов показано в следующем идеализированном уравнении: [4]
- 2 FeB + 4 H 2 S → B 2 S 3 + FeS + 4 H 2
Первый синтез был осуществлен Йонсом Якобом Берцелиусом в 1824 году путем прямой реакции аморфного бора с парами серы . [5]
- 2 Б + 3 С → Б 2 С 3
был одобрен Фридрихом Вёлером и Анри Этьеном Сент-Клер Девиль Другой синтез, впервые опубликованный в 1858 году, , начиная с бора и сероводорода . [6] [7]
- 2 Б + 3 Ч 2 С → Б 2 С 3 + 3 Ч 2
Структура
[ редактировать ]Атомы бора в B 2 S 3 тригонально-планарные и расположены в кольцах B 3 S 3 и B 2 S 2 с мостиковыми атомами S, образующими слоистую структуру с межслоевым расстоянием 355 мкм. Это отличается от триоксида бора , который имеет трехмерную структуру. [8] Молекулярная мономерная форма B 2 S 3 имеет плоскую V-образную форму с центральным углом BSB примерно 120°. [8]
Ссылки
[ редактировать ]- ^ Паспорт безопасности материала , VWR, 2010 г. , получено 11 ноября 2023 г.
- ^ Кинс, Джозеф; Мартин, Стив В. (1996). «Неаррениусовская проводимость в стекле: эффекты насыщения подвижности и проводимости» . Письма о физических отзывах . 76 (1): 70–73. Бибкод : 1996PhRvL..76...70K . дои : 10.1103/physrevlett.76.70 . ПМИД 10060436 .
- ^ Сато, Р. (2004). «Трисульфид бора». В Л. Пакетте (ред.). Энциклопедия реагентов для органического синтеза . Нью-Йорк: Дж. Уайли и сыновья. дои : 10.1002/047084289X.rb255 . ISBN 0471936235 .
- ^ Хоффманн, Дж. (1908). «Синтез сульфида бора из ферро- и марганцевого бора» . Журнал неорганической химии . 59 (1): 127–135. дои : 10.1002/zaac.19080590116 .
- ^ Берцелиус, Дж. (1824 г.). «Исследование плавиковой кислоты и ее наиболее примечательных соединений». Труды Королевской академии наук . 12 : 46–98.
Перепечатано на немецком языке как:
Берцелиус, Дж. Дж. (1824 г.). «Исследование фтороспатовой кислоты и ее наиболее замечательных соединений» . Анналы физики и химии . 78 (10): 113–150. Бибкод : 1824АнП....78..113Б . дои : 10.1002/andp.18240781002 . особенно см. стр. 145–147. - ^ Вёлер, Ф .; Девиль, HES-C. (1858). «Новые наблюдения относительно бора и некоторых его соединений». «Анналы химии и фармации» Либиха . 105 (1): 67–73. дои : 10.1002/jlac.18581050109 .
- ^ Вёлер, Ф .; Девиль, HES-C. (1858). «Бор» . Анналы химии и физики . 52 :62–93.
- ^ Jump up to: а б Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
