Трисульфид сурьмы
 | |
 | |
| Имена | |
|---|---|
| ИЮПАК имена Сурьма(III) сульфид Трисульфид дисурьмы | |
Другие имена
| |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.014.285 |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| Sb2SСб2С3 | |
| Молярная масса | 339.70 g·mol −1 |
| Появление | Серые или черные ромбические кристаллы (стибнит) |
| Плотность | 4,562 г см −3 (стибнит) [1] |
| Температура плавления | 550 ° C (1022 ° F, 823 К) (стибнит) [1] |
| Точка кипения | 1150 ° C (2100 ° F; 1420 К) |
| 0,00017 г/(100 мл) (18 °С) | |
| −86.0·10 −6 см 3 /моль | |
Показатель преломления ( n D ) | 4.046 |
| Термохимия | |
Теплоемкость ( С ) | 123,32 Дж/(моль·К) |
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | −157,8 кДж/моль |
| Опасности | |
| NFPA 704 (огненный алмаз) | |
| Летальная доза или концентрация (LD, LC): | |
ЛД 50 ( средняя доза ) | > 2000 мг/кг (крыса, перорально) |
| NIOSH (пределы воздействия на здоровье в США): | |
МЕХ (Допускается) | СВВ 0,5 мг/м 3 (как Сб) [2] |
РЕЛ (рекомендуется) | СВВ 0,5 мг/м 3 (как Сб) [2] |
| Родственные соединения | |
Другие анионы | |
Другие катионы | Трисульфид мышьяка Сульфид висмута(III) |
Родственные соединения | Пентасульфид сурьмы |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Трисульфид сурьмы ( Sb 2 S 3 ) встречается в природе как кристаллический минерал антимонит и аморфный красный минерал (фактически минералоид). [3] метастибнит. [4] Он производится для использования в безопасных спичках , военных боеприпасах, взрывчатых веществах и фейерверках. Он также используется при производстве стекла рубинового цвета и пластмасс в качестве антипирена. [5] Исторически антимонитовая форма использовалась в качестве серого пигмента в картинах 16 века. [6] В 1817 году химик по краскам и тканям Джон Мерсер открыл нестехиометрическое соединение сурьма оранжевая (приблизительная формула Sb 2 S 3 ·Sb 2 O 3 ), первый хороший оранжевый пигмент, доступный для печати на хлопчатобумажных тканях. [7]
Трисульфид сурьмы также использовался в качестве чувствительного к изображению фотопроводника в видакон трубках видеокамер . Это полупроводник с прямой запрещенной зоной 1,8–2,5 эВ. [ нужна ссылка ] При соответствующем легировании p- и n-типа . можно получить материалы [8]
Препарат и реакции
[ редактировать ]Sb 2 S 3 можно получить из элементов при температуре 500–900 °С: [5]
- 2 Сб + 3 С → Сб 2 С 3
Sb 2 S 3 выделяется при H 2 S пропускают через подкисленный раствор Sb(III). [9] Эту реакцию использовали в качестве гравиметрического метода определения сурьмы, барботирования H 2 S при растворении соединения Sb(III) в горячей HCl выделяет оранжевую форму Sb 2 S 3 , который в условиях реакции чернеет. [10]
Sb 2 S 3 легко окисляется, бурно реагируя с окислителями. [5] Горит на воздухе синим пламенем. Реагирует при накаливании с хлоратами кадмия, магния и цинка. Смеси Sb 2 S 3 и хлораты могут взрываться. [11]
При добыче сурьмы из сурьмяных руд применяют щелочно-сульфидный процесс, при котором Sb 2 S 3 реагирует с образованием солей тиоантимонат(III) (также называемых тиоантимонитом): [12]
- 3 Na 2 S + Sb 2 S 3 → 2 Na 3 SbS 3
Ряд солей, содержащих различные ионы тиоантимонат(III), можно получить из Сб 2 С 3 . К ним относятся: [13]
- [СбС 3 ] 3− , [СбС 2 ] − , [Sb 2 S 5 ] 4− , [Сб 4 С 9 ] 6− , [Сб 4 С 7 ] 2− и [Sb 8 S 17 ] 10−
соль Шлиппе , Na 3 SbS 4 ·9H 2 O , соль тиоантимонат(V) образуется при Sb 2 S 3 кипятят с серой и гидроксидом натрия. Реакцию можно представить как: [9]
- Сбн 2 С 3 + 3 С 2− + 2 S → 2 [SbS 4 ] 3−
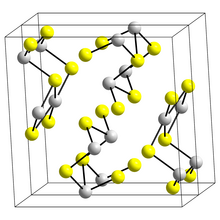
Структура
[ редактировать ]Строение черной игольчатой формы. Sb 2 S 3 , антимонит , состоит из связанных лент, в которых атомы сурьмы находятся в двух разных координационных окружениях: тригонально-пирамидальном и квадратно-пирамидальном. [9] Подобные ленты встречаются в Би 2 С 3 и Sb2Se3 Se3. [14] Красная форма, метастибнит, аморфна. Недавние работы показывают, что существует ряд тесно связанных температурно-зависимых структур антимонита, которые были названы антимонитом (I) - высокотемпературной формой, идентифицированной ранее, антимонитом (II) и антимонитом (III). [15] Другая статья показывает, что фактические координационные многогранники сурьмы на самом деле являются SbS 7 , с координацией (3+4) в узле М1 и (5+2) в узле М2. [ нужны разъяснения ] Эти координации учитывают наличие вторичных связей. Некоторые из вторичных связей придают сцепление и связаны с упаковкой. [16]
Ссылки
[ редактировать ]- ^ Jump up to: а б Хейнс, WM, изд. (2014). Справочник CRC по химии и физике (95-е изд.). Бока-Ратон, Флорида: CRC Press. стр. 4–48. ISBN 978-1-4822-0867-2 .
- ^ Jump up to: а б Карманный справочник NIOSH по химическим опасностям. «#0036» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ «Метастибнит» .
- ^ СУПЕРГЕННЫЙ МЕТАСТИБНИТ ИЗ МИНЫ АЛАКРАН, ПАМПА ЛАРГА, КОПИАПО, ЧИЛИ, Алан Х. Кларк, АМЕРИКАНСКИЙ МИНЕРАЛОГ. ОБЪЕМ. 55., 1970 г.
- ^ Jump up to: а б с Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . стр. 581–582. ISBN 978-0-08-037941-8 .
- ^ Исто, Николас (2004). Справочник по пигментам: словарь исторических пигментов . Баттерворт-Хайнеманн . п. 359. ИСБН 978-0-7506-5749-5 .
- ^ Парнелл, Эдвард А. (1886). Жизнь и труды Джона Мерсера . Лондон: Longmans, Green & Co. 23.
- ^ Электрохимия халькогенидов металлов, Миртат Бурушян, Springer, 2010.
- ^ Jump up to: а б с Холлеман, Арнольд Фредерик; Виберг, Эгон (2001), Виберг, Нильс (ред.), Неорганическая химия , перевод Иглсона, Мэри; Брюэр, Уильям, Сан-Диего/Берлин: Academic Press/De Gruyter, стр. 765-766, ISBN 0-12-352651-5
- ^ А.И. Фогель, (1951), Количественный неорганический анализ, (2-е издание), Longmans Green and Co.
- ^ Руководство по утилизации опасных лабораторных химикатов, третье издание, CRC Press, 2003, Маргарет-Энн Армор , ISBN 9781566705677
- ^ Андерсон, Корби Г. (2012). «Металлургия сурьмы». Chemie der Erde — Геохимия . 72 : 3–8. Бибкод : 2012ЧЭГ...72....3А . doi : 10.1016/j.chemer.2012.04.001 . ISSN 0009-2819 .
- ^ Неорганические реакции и методы, Образование связей с элементами VIB группы (O, S, Se, Te, Po) (Часть 1) (Том 5) Изд. AP, Хаген, 1991, Wiley-VCH, ISBN 0-471-18658-9
- ^ Уэллс А.Ф. (1984) Структурная неорганическая химия, 5-е издание Oxford Science Publications ISBN 0-19-855370-6
- ^ Кузе С., Дю Буле Д., Исидзава Н., Сайки А., Принг А.; (2004), Рентгеноструктурные данные о моноклинной форме антимонита Sb2S3 ниже 290K; Американский минералог, 9 (89), 1022–1025.
- ^ Кёно, А.; Кимата, М.; Мацухиса, М.; Мияшита, Ю.; Окамото, К. (2002). «Низкотемпературные кристаллические структуры антимонита, предполагающие перекрытие орбиталей инертной пары электронов Sb 5s 2». Физика и химия минералов . 29 (4): 254–260. Бибкод : 2002PCM....29..254K . дои : 10.1007/s00269-001-0227-1 . S2CID 95067785 .
