Аммиак боран
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Аммониотригидроборат | |
| Другие имена | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.170.890 |
| Номер ЕС |
|
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| H3NBHH3NBH3 | |
| Молярная масса | 30.87 g·mol −1 |
| Появление | Бесцветные кристаллы |
| Плотность | 0,78 г/см 3 |
| Температура плавления | 104 ° С (219 ° F; 377 К) |
| Структура | |
| I4мм, четырехугольный | |
| Тетрагональный в точках B и N | |
| Тетраэдр в точках B и N | |
| 5,2 Д | |
| Опасности [4] | |
| СГС Маркировка : | |
  | |
| Опасность | |
| Х228 , Х302 , Х315 , Х319 , Х332 , Х335 | |
| P210 , P240 , P241 , P261 , P264 , P264+P265 , P270 , P271 , P280 , P301+P317 , P302+P352 , P304+P340 , P305+P351+P338 , P317 , P319 , П330 1 , П332 , +П317 , П337+П317 , П362+П364 , П370+П378 , П403+П233 , П405 , П501 | |
| Родственные соединения | |
Родственные соединения | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
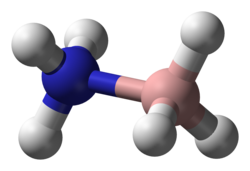
Боран аммиака (также систематически называемый аммониотригидроборат [ нужна ссылка ] ), также называемый боразаном , представляет собой химическое соединение с формулой Х 3 НБХ 3 . Бесцветное или белое твердое вещество представляет собой простейшее молекулярное соединение бора , азота и гидрида . Он привлек внимание как источник водородного топлива, но в остальном представляет прежде всего академический интерес.
Синтез
[ редактировать ]Реакция диборана с аммиаком дает преимущественно диаммониатную соль. [Н 2 В(NH 3 ) 2 ] + [Ч 4 ] − (диаммониодигидроборония тетрагидроборат). Боран аммиака является основным продуктом, когда аддукт борана: вместо диборана используется [5]
- BH 3 ( ТГФ ) + NH 3 → BH 3 NH 3 + ТГФ
Его также можно синтезировать из борогидрида натрия . [6] [7] [8]
Свойства и структура
[ редактировать ]Молекула принимает структуру, подобную структуре этана , с которой она изоэлектронна . Расстояние B-N составляет 1,58(2) Å. Расстояния B-H и N-H составляют 1,15 и 0,96 Å соответственно. Его сходство с этаном незначительно, поскольку аммиачный боран представляет собой твердое вещество, а этан — газ: их температуры плавления различаются на 284 ° C. Это различие согласуется с высокополярной природой аммиач-борана. Атомы H, присоединенные к бору, являются гидридными (отрицательно заряженными), а атомы, присоединенные к азоту, — кислотными (положительно заряженными). [9]

Строение твердого тела указывает на тесную связь N H и B H. центров Ближайшее расстояние H-H составляет 1,990 Å, что можно сравнить с расстоянием связи H-H 0,74 Å. Это взаимодействие называется диводородной связью . [10] [11] Первоначальный кристаллографический анализ этого соединения поменял местами назначения B и N. Обновленная структура была получена на основе улучшенных данных с использованием метода дифракции нейтронов , который позволил локализовать атомы водорода с большей точностью.
![Часть кристаллической структуры борана аммиака[10]](http://upload.wikimedia.org/wikipedia/commons/thumb/9/93/Ammonia-borane-xtal-3D-balls.png/300px-Ammonia-borane-xtal-3D-balls.png)
| Молекула | Аммиак боран [12] | Аминоборан [13] | иминоборан [14] |
|---|---|---|---|
| Формула | БНХ 6 | БНХ 4 | БНХ 2 |
| Сорт | аминобораны | аминоборан | иминоборан |
| Аналог углеводорода | этан | этилен | ацетилен |
| Аналогичный класс углеводородов | алкан | алкен | алкин |
| Структура |  | ||
| Шаровидная модель |  |  | |
| Гибридизация бора и азота | сп 3 | сп 2 | сп |
| Длина облигации BN | 1,658 Å | 1,391 Å | 1,238 Å |
| Доля одинарных облигаций BN | 100% | 84% | 75% |
| Метод определения структуры | микроволновая спектроскопия | микроволновая спектроскопия | инфракрасная спектроскопия |
Использование
[ редактировать ]Аммиако-боран был предложен в качестве носителя для хранения водорода , например, когда газ используется для заправки автомобилей. Его можно заставить выделять водород при нагревании, предварительно полимеризовав (NH 2 BH 2 ) n , то (NHBH) н , [15] который в конечном итоге разлагается до нитрида бора (BN) при температуре выше 1000 °C. [16] Он более плотный, чем жидкий водород, а также способен существовать при нормальных температурах и давлениях. [17]
Боран аммиака находит применение в органическом синтезе как устойчивое на воздухе производное диборана. [18] Его можно использовать в качестве восстановителя в реакциях трансферного гидрирования , часто в присутствии катализатора на основе переходного металла . [19]
Аналогичные аминобораны
[ редактировать ]Многие аналоги получены из первичных, вторичных и даже третичных аминов :
- Трет-бутиламин борана ( (CH 3 ) 3 C−NH 2 →BH 3 )
- Боран триметиламин ( (СН 3 ) 3 N→BH 3 )
- Боран изопропиламин ( (СН 3 ) 2 СН-NH 2 →BH 3 )
Первый аминный аддукт борана был получен из триметиламина . Комплекс трет-бутиламина борана получают реакцией боргидрида натрия с хлоридом трет-бутиламмония. Обычно аддукты более устойчивы к большему количеству основных аминов. Возможны вариации и по борной составляющей, хотя первичные и вторичные бораны встречаются реже. [8]
См. также
[ редактировать ]- Трет-бутиламин боран ( t BuNH 2 →BH 3 )
- Фосфин-боран ( R 3 P→BH 3 )
- Диметилсульфид борана ( (СН 3 ) 2 S→BH 3 )
- Боран-тетрагидрофуран ( THF→BH 3 )
Ссылки
[ редактировать ]- ^ https://patents.google.com/patent/WO2015177483A1/en.
- ^ Умэмото, Хиронобу; Мията, Ацуши (2015). «Процессы разложения диборана и боразана (аммиачно-боранового комплекса) на поверхности горячей проволоки». Тонкие твердые пленки . 8-я Международная конференция по процессам CVD с горячей проволокой (Cat-CVD) (HWCVD 8). 595 : 231–234. Бибкод : 2015TSF...595..231U . дои : 10.1016/j.tsf.2015.04.084 . hdl : 10297/10128 .
- ^ https://www.sigmaaldrich.com/GB/en/search/borazane?focus=products&page=1&perpage=30&sort=relevance&term=borazane&type=product
- ^ https://pubchem.ncbi.nlm.nih.gov/compound/Аммиак-боран
- ^ Шор, СГ; Боддекер, К.В. (1964). «Крупномасштабный синтез H 2 B(NH 3 ) 2 + ДН 4 − и H 3 NBH 3 ". Неорганическая химия . 3 (6): 914–915. doi : 10.1021/ic50016a038 .
- ^ Ху, МГ; Ван Паасшен, JM; Геанангель, РА (январь 1977 г.). «Новые синтетические подходы к аммиакборану и его дейтерированным производным». Журнал неорганической и ядерной химии . 39 (12): 2147–2150. дои : 10.1016/0022-1902(77)80383-7 .
- ^ Рамачандран, П. Вирарагаван; Мистри, Хитеш; Кулкарни, Амея С.; Гагаре, Правин Д. (2014). «Крупномасштабный синтез аммиач-борана с помощью аммиака». Далтон Транс . 43 (44): 16580–16583. дои : 10.1039/C4DT02467B . ПМИД 25274135 .
- ^ Jump up to: а б Штаубиц, Энн; Робертсон, премьер-министр Аласдер; Маннерс, Ян (2010). «Аммиак-боран и родственные соединения как источники диводорода». Химические обзоры . 110 (7): 4079–4124. дои : 10.1021/cr100088b . ПМИД 20672860 .
- ^ Боуден, Марк Э.; Гейнсфорд, Грэм Дж.; Робинсон, Уорд Т. (2007). «Структура аммиач-борана при комнатной температуре». Австралийский химический журнал . 60 (3): 149. дои : 10.1071/ch06442 . ISSN 0004-9425 .
- ^ Jump up to: а б Клоостер, WT; Кетцле, Т.Ф.; Зигбан, PEM; Ричардсон, ТБ; Крэбтри, Р.Х. (1999). «Исследование диводородной связи N-H···H-B, включая кристаллическую структуру BH 3 NH 3 , методом нейтронографии». Журнал Американского химического общества . 121 (27): 6337–6343. дои : 10.1021/ja9825332 .
- ^ Бозе, Р.; Нидерпрум, Н.; Блазер, Д. (1992). Максич, ЗБ; Эккерт-Масик, М. (ред.). Молекулы в естествознании и медицине . Чичестер, Англия: Эллис Хорвуд. ISBN 978-0135615980 .
- ^ Торн, ЛР; Суенрам, РД; Ловас, Ф.Дж. (1983). «Микроволновой спектр, торсионный барьер и структура BH 3 NH 3 ». Дж. Хим. Физ. 78 (1): 167–171. Бибкод : 1983ЖЧФ..78..167Т . дои : 10.1063/1.444528 .
- ^ Суги, Масааки; Такео, Харутоши; Мацумура, Чи (1987). «Микроволновой спектр и молекулярная структура аминоборана, BH 2 NH 2 ». Дж. Мол. Спектроск. 123 (2): 286–292. Бибкод : 1987JMoSp.123..286S . дои : 10.1016/0022-2852(87)90279-7 .
- ^ Кавасима, Ёсиюки (1987). «Обнаружение HBNH с помощью инфракрасной диодной лазерной спектроскопии». Дж. Хим. Физ. 87 (11): 6331–6333. Бибкод : 1987ЖЧФ..87.6331К . дои : 10.1063/1.453462 .
- ^ Гутовски, М.; Отри, Т. (2006). «Особенности: Водород попадает на борт» . Химический мир . 3 (3).
- ^ Фруэ, С.; Келлетт, Р.; Мэллери, К.; Молтер; Т.; Уиллис, штат Вашингтон; Кинг'онду, К.; Суиб, СЛ (2011). «Пиролитическое разложение борана аммиака до нитрида бора». Неорганическая химия . 50 (3): 783–792. дои : 10.1021/ic101020k . ПМИД 21182274 .
- ^ Стивенс, Ф.Х.; Понс, В.; Бейкер, RT (2007). источник водорода «Аммиак-боран: превосходный ?». Транзакции Далтона . 2007 (25): 2613–2626. дои : 10.1039/b703053c . ПМИД 17576485 .
- ^ Эндрюс, Гленн С.; Ниламкавил, Сантош Ф. (2008). «Боран–Аммиак». В Пакетте, Лео А. (ред.). Энциклопедия реагентов для органического синтеза . Нью-Йорк : Джон Уайли и сыновья . дои : 10.1002/047084289X.rb238.pub2 . ISBN 978-0471936237 .
- ^ Чжао, Вэньфэн; Ли, Ху; Чжан, Хэн; Ян, Сун; Рийзагер, Андерс (август 2023 г.). «Процессы переноса водорода с использованием аммиакборана: понимание каталитических стратегий и механизмов» . Зеленая энергетика и окружающая среда . 8 (4): 948–971. Бибкод : 2023GrEE....8..948Z . дои : 10.1016/j.gee.2022.03.011 .