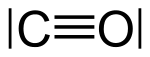изоэлектронность
Изоэлектронность — это явление, наблюдаемое, когда две или более молекулы имеют одинаковую структуру (положения и связи между атомами ) и одинаковые электронные конфигурации , но различаются тем, какие конкретные элементы находятся в определенных местах структуры. Например, CO , NO +
и Н
2 изоэлектронны, а CH
3 КОЧ
3 и СН
3Н = НЧ
3 нет. [1]
Это определение иногда называют валентной изоэлектронностью . Определения иногда могут быть не такими строгими, иногда требующими идентичности общего количества электронов , а вместе с ним и всей электронной конфигурации . [2] Чаще всего определения шире и могут включать разное количество атомов в видах . сравниваемых [3]
Важность концепции заключается в выявлении значительно родственных видов как пар или серий. Можно ожидать, что изоэлектронные виды будут демонстрировать полезную согласованность и предсказуемость своих свойств, поэтому идентификация соединения как изоэлектронного с уже охарактеризованным соединением дает ключ к разгадке возможных свойств и реакций. Различия в свойствах, таких как электроотрицательность атомов в изоэлектронных частицах, могут влиять на реакционную способность.
В квантовой механике водородоподобные атомы представляют собой ионы только с одним электроном, такие как Li. 2+
. Эти ионы можно было бы описать как изоэлектронные с водородом .
Примеры
[ редактировать ]Атом N и O +
Ионы изоэлектронны, поскольку каждый из них имеет пять валентных электронов или, точнее, электронную конфигурацию [He] 2s. 2 2р 3 .
Аналогично катионы K +
, Как 2+
и Sc 3+
и анионы Cl −
, С 2−
и П 3−
все изоэлектронны атому Ar .
Колорадо , Китай −
, Н
2 и НЕТ +
изоэлектронны, поскольку каждый из них состоит из двух атомов, связанных тройной связью, и из-за заряда имеют аналогичные электронные конфигурации ( N −
По электронной конфигурации идентичен O , поэтому CO в электронном виде идентичен CN. −
).
Молекулярные орбитальные диаграммы лучше всего иллюстрируют изоэлектронность в двухатомных молекулах, показывая, как смешение атомных орбиталей в изоэлектронных соединениях приводит к идентичной комбинации орбиталей и, следовательно, к образованию связей.
Более сложные молекулы также могут быть многоатомными. Например, аминокислоты серин , цистеин и селеноцистеин изоэлектронны друг другу. Они различаются тем, какой конкретный халькоген присутствует в одном месте боковой цепи.
СН
3 КОЧ
3 ( ацетон ) и CH
3 Н
2 СН
3 ( азометан ) не изоэлектронны. У них одинаковое количество электронов, но разная структура.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Онлайн исправленная версия: (2006–) « Изоэлектронный ». дои : 10.1351/goldbook.I03276
- ^ Изоэлектронные конфигурации. Архивировано 17 июля 2017 г. на Wayback Machine iun.edu.
- ^ А. А. Аради и Т. П. Фельнер, «Изоэлектронные металлоорганические молекулы», в FGA Stone & Robert West (ред.) « Достижения в металлоорганической химии», том. 30 (1990), Глава 5 (на стр. 190), ссылка на книги Google