Селеноцистеин
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Селеноцистеин | |
| Систематическое название ИЮПАК 3-Селанил -L -аланин (полусистематическое название) 2-амино-3-селанилпропановая кислота (полностью систематическое название) | |
| Другие имена L -селеноцистеин; Селен-цистеин | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЭБИ | |
| ЧЕМБЛ | |
| ХимическийПаук | |
| Лекарственный Банк | |
| Информационная карта ECHA | 100.236.386 |
| КЕГГ | |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| С 3 Н 7 Н О 2 Се | |
| Молярная масса | 168.065 g·mol −1 |
| Характеристики | |
| Кислотность ( pKa ) | 5.24, [2] 5.43 [3] |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
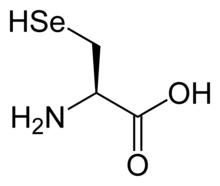
Селеноцистеин (символ Sec или U , [4] в старых публикациях также как Se-Cys ) [5] является 21-й протеиногенной аминокислотой . Селенопротеины содержат остатки селеноцистеина. Селеноцистеин является аналогом более распространенного цистеина с селеном вместо серы .
Селеноцистеин присутствует в нескольких ферментах (например , глутатионпероксидазах , тетрайодтиронин-5'-дейодиназах , тиоредоксинредуктазах , формиатдегидрогеназах , глицинредуктазах , селенофосфатсинтетазе 2 , метионин -R -сульфоксидредуктазе B1 ( SEPX1 ) и некоторых гидрогеназах ). Это происходит во всех трех сферах жизни , включая важные ферменты (перечисленные выше), присутствующие в организме человека. [6]
Селеноцистеин был открыт в 1974 году. [7] биохимик Тресса Штадтман из Национального института здравоохранения . [8]
Химия [ править ]
Селеноцистеин является Se-аналогом цистеина. Его редко можно встретить вне живых тканей (и он недоступен в продаже), поскольку он очень чувствителен к окислению воздухом. Более распространенным является окисленное производное селеноцистина , имеющее связь Se-Se. [9] И селеноцистеин, и селеноцистин представляют собой белые твердые вещества. Группа Se-H более кислая ( p K a = 5,43 [3] ), чем тиоловая группа; таким образом, он депротонируется при физиологическом pH . [10]
Структура [ править ]
Селеноцистеин имеет ту же структуру, что и цистеин , но с атомом селена, заменяющим обычную серу. Имеет селенольную группу. Как и другие природные протеиногенные аминокислоты, цистеин и селеноцистеин имеют L- хиральность в более старых обозначениях D / L, основанных на гомологии с D- и L - глицеральдегидом . В новой системе обозначения хиральности R / S , основанной на атомных номерах атомов рядом с асимметричным углеродом, они имеют R- хиральность из-за присутствия серы или селена в качестве второго соседа асимметричного углерода. Остальные хиральные аминокислоты, имеющие в этом положении только более легкие атомы, имеют S- хиральность.)
Белки, содержащие остаток селеноцистеина, называются селенопротеинами . Большинство селенопротеинов содержат один остаток селеноцистеина. Селенопротеины, проявляющие каталитическую активность, называются селеноферментами. [11]
Биология [ править ]
Селеноцистеин имеет более низкий потенциал восстановления , чем цистеин. Эти свойства делают его очень подходящим для белков, участвующих в антиоксидантной активности. [12]
Хотя он встречается во всех трех сферах жизни , он не универсален для всех организмов. [13] В отличие от других аминокислот, присутствующих в биологических белках , селеноцистеин не кодируется непосредственно в генетическом коде . [14] Вместо этого он особым образом кодируется кодоном UGA , который обычно является «опаловым» стоп-кодоном . Такой механизм называется трансляционным перекодированием. [15] и его эффективность зависит от синтезируемого селенопротеина и факторов инициации трансляции . [16] Когда клетки выращиваются в отсутствие селена, трансляция селенопротеинов прекращается на кодоне UGA, что приводит к усеченному нефункциональному ферменту. Кодон UGA предназначен для кодирования селеноцистеина благодаря наличию последовательности вставки селеноцистеина (SECIS) в мРНК . Элемент SECIS определяется характерными нуклеотидными последовательностями и закономерностями спаривания оснований вторичной структуры. У бактерий элемент SECIS обычно расположен сразу после кодона UGA в рамке считывания селенопротеина. [17] У архей и эукариот элемент SECIS находится в 3'-нетранслируемой области (3'-UTR) мРНК и может направлять несколько кодонов UGA для кодирования остатков селеноцистеина. [18]
В отличие от других аминокислот, в клетке не существует свободного пула селеноцистеина. Его высокая реакционная способность может привести к повреждению клеток. [19] Вместо этого клетки хранят селен в менее реакционноспособной окисленной форме селеноцистина или в метилированной форме селенометионина. Синтез селеноцистеина происходит на специализированной тРНК , которая также включает его в образующиеся полипептиды.
Первичная и вторичная структура селеноцистеинспецифической тРНК, тРНК. сек. , отличаются от таковых стандартных тРНК в нескольких отношениях, в первую очередь наличием пары оснований из 8 (бактерии) или пары оснований из 10 (эукариоты). [ Архея? ] акцепторный стебель, длинное плечо вариабельной области и замены в нескольких хорошо консервативных положениях оснований. Селеноцистеиновые тРНК первоначально заряжаются серином с помощью лигазы серил-тРНК , но образующаяся Сер-тРНК сек. не используется для трансляции, поскольку не распознается нормальным фактором элонгации трансляции ( EF-Tu у бактерий, eEF1A у эукариот). [ Архея? ]
Скорее, связанный с тРНК серильный остаток превращается в остаток селеноцистеина с помощью пиридоксальфосфатсодержащего фермента селеноцистеинсинтазы . У эукариот и архей для превращения связанного с тРНК серильного остатка в селеноцистеинильный остаток тРНК необходимы два фермента: PSTK ( O -фосфосерил-тРНК[Ser]Sec киназа) и селеноцистеинсинтаза. [20] [21] Наконец, полученная Sec-тРНК сек. специфически связан с альтернативным фактором элонгации трансляции (SelB или mSelB (или eEFSec)), который целенаправленно доставляет его к рибосомам, транслирующим мРНК селенопротеинов. Специфичность этого механизма доставки обусловлена наличием дополнительного белкового домена (у бактерий SelB) или дополнительной субъединицы ( SBP2 для эукариотического mSelB/eEFSec). [ Архея? ] которые связываются с соответствующими вторичными структурами РНК, образованными элементами SECIS в мРНК селенопротеинов.
Селеноцистеин разлагается ферментом селеноцистеинлиазой на L - аланин и селенид. [22]
По состоянию на 2021 год [update]Известно, что 136 белков человека (в 37 семействах) содержат селеноцистеин (селенопротеины). [23]
Производные селеноцистеина γ-глутамил- Se -метилселеноцистеин и Se -метилселеноцистеин встречаются в природе в растениях родов Allium и Brassica . [24]
Приложения [ править ]
Биотехнологические применения селеноцистеина включают использование 73 Se-меченный Sec (период полураспада 73 Se = 7,2 часа) в исследованиях позитронно-эмиссионной томографии (ПЭТ) и 75 Se-меченный Sec (период полураспада 75 Se = 118,5 дней) при специфическом радиоактивном мечении , облегчении определения фазы с помощью многоволновой аномальной дифракции в рентгеновской кристаллографии белков путем введения Sec отдельно или Sec вместе с селенометионином (SeMet) и включения стабильного 77 Изотоп Se, имеющий ядерный спин 1/2 ЯМР и может использоваться, среди прочего, для высокого разрешения . [6]
См. также [ править ]
- Пирролизин , еще одна аминокислота, отсутствующая в базовом наборе из 20.
- Селенометионин , еще одна селенсодержащая аминокислота, которая случайным образом заменяет метионин.
Ссылки [ править ]
- ^ Индекс Merck , 12-е издание, 8584.
- ^ Хубер Р.Э., Криддл Р.С. (1 октября 1967 г.). «Сравнение химических свойств селеноцистеина и селеноцистина с их серными аналогами» . Архив биохимии и биофизики . 122 (1): 164–173. дои : 10.1016/0003-9861(67)90136-1 . ISSN 0003-9861 . ПМИД 6076213 .
- ^ Jump up to: Перейти обратно: а б Тапа Б., Шлегель Х.Б. (10 ноября 2016 г.). «Теоретический расчет p K a селенолов в водном растворе с использованием модели неявной сольватации и явных молекул воды» . Журнал физической химии А. 120 (44): 8916–8922. Бибкод : 2016JPCA..120.8916T . дои : 10.1021/acs.jpca.6b09520 . ISSN 1089-5639 . ПМИД 27748600 .
- ^ «Номенклатура и символика аминокислот и пептидов» . Совместная комиссия IUPAC-IUB по биохимической номенклатуре. 1983. Архивировано из оригинала 9 октября 2008 года . Проверено 5 марта 2018 г.
- ^ «Объединенная комиссия IUPAC-IUBMB по биохимической номенклатуре (JCBN) и номенклатурный комитет IUBMB (NC-IUBMB)». Европейский журнал биохимии . 264 (2): 607–609. 17 августа 1999 г. doi : 10.1046/j.1432-1327.1999.news99.x .
- ^ Jump up to: Перейти обратно: а б Йоханссон Л., Гафвелин Г., Арнер Э.С. (октябрь 2005 г.). «Селеноцистеин в белках - свойства и биотехнологическое использование». Biochimica et Biophysical Acta (BBA) – Общие предметы . 1726 (1): 1–13. дои : 10.1016/j.bbagen.2005.05.010 . hdl : 10616/39311 . ПМИД 15967579 .
- ^ «Штадтман, пионер биохимии селена - Управление истории НИЗ и Музей Штеттена» . History.nih.gov . Проверено 06 апреля 2023 г.
- ^ Штадтман ТК (март 1974 г.). «Биохимия селена». Наука . 183 (4128): 915–22. Бибкод : 1974Sci...183..915S . дои : 10.1126/science.183.4128.915 . ПМИД 4605100 . S2CID 84982102 .
- ^ Гёрбиц Ч., Левченко В., Семенов Ю., Шариф М.Ю. (2015). «Кристаллическая структура селено-L-цистина дигидрохлорида» . Акта Кристаллогр. Э. 71 (6): 726–729. Бибкод : 2015AcCrE..71..726G . дои : 10.1107/S205698901501021X . ПМЦ 4459342 . ПМИД 26090162 .
- ^ Райх Х.Дж., Хондал Р.Дж. (апрель 2016 г.). «Почему природа выбрала селен». АКС Химическая биология . 11 (4): 821–841. doi : 10.1021/acschembio.6b00031 . ПМИД 26949981 .
- ^ Рой Дж., Сарма Б.К., Фаднис П.П., Мугеш Г. (2005). «Селенсодержащие ферменты у млекопитающих: химические перспективы» (PDF) . Журнал химических наук . 117 (4): 287–303. дои : 10.1007/BF02708441 . S2CID 32351033 .
- ^ Бён Б.Дж., Кан Ю.К. (май 2011 г.). «Конформационные предпочтения и значение pK (a) остатка селеноцистеина». Биополимеры . 95 (5): 345–53. дои : 10.1002/bip.21581 . ПМИД 21213257 . S2CID 11002236 .
- ^ Лонгтин Р. (апрель 2004 г.). «Забытый спор: является ли селеноцистеин 21-й аминокислотой?» . Журнал Национального института рака . 96 (7): 504–5. дои : 10.1093/jnci/96.7.504 . ПМИД 15069108 .
- ^ Бёк А., Форххаммер К., Хайдер Дж., Барон С. (декабрь 1991 г.). «Синтез селенопротеинов: расширение генетического кода». Тенденции биохимических наук . 16 (12): 463–7. дои : 10.1016/0968-0004(91)90180-4 . ПМИД 1838215 .
- ^ Баранов П.В., Гестеланд РФ, Аткинс Дж.Ф. (март 2002 г.). «Перекодирование: трансляционные бифуркации в экспрессии генов». Джин . 286 (2): 187–201. дои : 10.1016/S0378-1119(02)00423-7 . ПМИД 11943474 . S2CID 976337 .
- ^ Донован Дж., Коупленд PR (июль 2010 г.). «Эффективность включения селеноцистеина регулируется факторами инициации трансляции» . Журнал молекулярной биологии . 400 (4): 659–64. дои : 10.1016/j.jmb.2010.05.026 . ПМЦ 3721751 . ПМИД 20488192 .
- ^ Аткинс, Дж. Ф. (2009). Перекодирование: расширение правил декодирования обогащает экспрессию генов . Спрингер. п. 31. ISBN 978-0-387-89381-5 .
- ^ Берри М.Дж., Бану Л., Харни Дж.В., Ларсен П.Р. (август 1993 г.). «Функциональная характеристика эукариотических элементов SECIS, которые направляют вставку селеноцистеина в кодоны UGA» . Журнал ЭМБО . 12 (8): 3315–22. дои : 10.1002/j.1460-2075.1993.tb06001.x . ПМК 413599 . ПМИД 8344267 .
- ^ Спалхольц Дж. Э. (июль 1994 г.). «О природе токсичности и канцеростатической активности селена» . Свободнорадикальная биология и медицина . 17 (1): 45–64. дои : 10.1016/0891-5849(94)90007-8 . ПМИД 7959166 .
- ^ Сюй XM, Карлсон Б.А., Микс Х, Чжан Ю, Сайра К, Гласс Р.С., Берри М.Дж., Гладышев В.Н., Хэтфилд Д.Л. (январь 2007 г.). «Биосинтез селеноцистеина на его тРНК у эукариот» . ПЛОС Биология . 5 (1): e4. doi : 10.1371/journal.pbio.0050004 . ПМК 1717018 . ПМИД 17194211 .
- ^ Юань Дж., Палиура С., Салазар Дж.К., Су Д., О'Донохью П., Хон М.Дж., Кардосо А.М., Уитмен В.Б., Сёлль Д. (декабрь 2006 г.). «РНК-зависимое превращение фосфосерина в селеноцистеин у эукариот и архей» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (50): 18923–7. Бибкод : 2006PNAS..10318923Y . дои : 10.1073/pnas.0609703104 . ПМК 1748153 . ПМИД 17142313 .
- ^ Лабунский В.М., Хэтфилд Д.Л., Гладышев В.Н. (июль 2014 г.). «Селенопротеины: молекулярные пути и физиологическая роль» . Физиологические обзоры . 94 (3): 739–77. doi : 10.1152/physrev.00039.2013 . ПМК 4101630 . ПМИД 24987004 .
- ^ Романье Ф, Сантесмасс Д, Уайт Л, Саранги ГК, Мариотти М, Хюблер Р, Вейманн А, Парра Г, Гладышев ВН, Гиго Р, Кастеллано С (январь 2014 г.). «SelenoDB 2.0: аннотация генов селенопротеинов у животных и их генетическое разнообразие у человека» . Исследования нуклеиновых кислот . 42 (Проблема с базой данных): D437-43. дои : 10.1093/нар/gkt1045 . ПМК 3965025 . ПМИД 24194593 . [1]
- ^ Блок, Э. (2010). Чеснок и другие луки: знания и наука . Королевское химическое общество. ISBN 978-0-85404-190-9 .
Дальнейшее чтение [ править ]
- Зинони Ф, Биркманн А, Штадтман ТК, Бёк А (июль 1986 г.). «Нуклеотидная последовательность и экспрессия селеноцистеинсодержащего полипептида формиатдегидрогеназы (связанной с формиат-гидрогенлиазой) из Escherichia coli» . Труды Национальной академии наук Соединенных Штатов Америки . 83 (13): 4650–4. Бибкод : 1986PNAS...83.4650Z . дои : 10.1073/pnas.83.13.4650 . ПМЦ 323799 . ПМИД 2941757 .
- Зинони Ф., Биркманн А., Лейнфельдер В., Бёк А. (май 1987 г.). «Котрансляционная вставка селеноцистеина в формиатдегидрогеназу Escherichia coli, управляемая кодоном UGA» . Труды Национальной академии наук Соединенных Штатов Америки . 84 (10): 3156–60. Бибкод : 1987PNAS...84.3156Z . дои : 10.1073/pnas.84.10.3156 . ПМК 304827 . ПМИД 3033637 .
- Конус Дж.Э., Дель Рио Р.М., Дэвис Дж.Н., Штадтман Т.К. (август 1976 г.). «Химическая характеристика селенопротеинового компонента клостридиальной глицинредуктазы: идентификация селеноцистеина как селенорганического фрагмента» . Труды Национальной академии наук Соединенных Штатов Америки . 73 (8): 2659–63. Бибкод : 1976PNAS...73.2659C . дои : 10.1073/pnas.73.8.2659 . ПМК 430707 . ПМИД 1066676 .
- Феньё Д., Бивис RC (февраль 2016 г.). «Селеноцистеин: зачем ты?». Журнал исследований протеома . 15 (2): 677–8. doi : 10.1021/acs.jproteome.5b01028 . ПМИД 26680273 .
Внешние ссылки [ править ]
- Уругвайский ученый впервые обнаружил селеноцистеин в грибах. Архивировано 22 февраля 2019 г. в Wayback Machine (на испанском языке).
