Цвиттерион
В химии ( цвиттер-ион / ˈ t s v ɪ t ə ˌ r aɪ ə n / TSVIT -ə -rye-ən ; от немецкого Zwitter [ˈtsvɪtɐ] ' гермафродит '), также называемый внутренней солью или диполярным ионом , [1] Молекула , содержащая равное количество положительно и отрицательно заряженных функциональных групп . [2] в случае аминокислот Например, химическое равновесие в растворе между «родительской» молекулой и цвиттер-ионом устанавливается .
Бетаины представляют собой цвиттер-ионы, которые не могут изомеризоваться в полностью нейтральную форму, например, когда положительный заряд расположен на четвертичной аммониевой группе. Точно так же молекула, содержащая фосфониевую группу и карбоксилатную группу, не может изомеризоваться.
Аминокислоты [ править ]

Таутомерия аминокислот соответствует этой стехиометрии:
- RCH(NH 2 )CO 2 H ⇌ RCH(N + Н 3 )CO - 2
Соотношение концентраций двух видов в растворе не зависит от pH .
На основе теоретического анализа было высказано предположение, что цвиттер-ион стабилизируется в водном растворе за счет водородных связей с молекулами воды-растворителя. [3] Анализ нейтронографии данных глицина показал, что в твердом состоянии он находится в цвиттер-ионной форме, и подтвердил наличие водородных связей. [4] С помощью теоретических расчетов показано, что цвиттер-ионы могут присутствовать в газовой фазе и в некоторых случаях, отличных от простого переноса карбоновой кислоты в амин. [5]
p ± K a Значения для депротонирования обычных аминокислот охватывают приблизительный 2,15 диапазон 0,2 . Это также согласуется с тем, что цвиттер-ион является преобладающим изомером, присутствующим в водном растворе. Для сравнения: простая карбоновая кислота – пропионовая кислота ( CH 3 CH 2 CO 2 H ) имеет значение ap 4,88 K .
Другие соединения [ править ]
- Структура H 4 ЭДТА
Сульфаминовая кислота кристаллизуется в форме цвиттер-иона. [6]
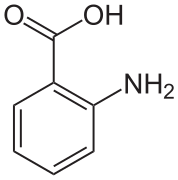
В кристаллах антраниловой кислоты находятся две молекулы в элементарной ячейке . Одна молекула находится в цвиттер-ионной форме, другая — нет. [7]
В твердом состоянии H 4 EDTA представляет собой цвиттер-ион, в котором два протона перенесены от групп карбоновой кислоты к атомам азота. [8]
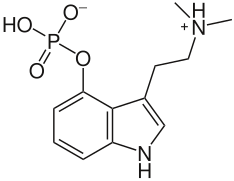
В псилоцибине протон диметиламиногруппы лабилен и может перейти на фосфатную группу, образуя соединение, не являющееся цвиттер-ионом.
исследования Теоретические

Понимание равновесия в растворе можно получить из результатов теоретических расчетов. пиридоксальфосфат, форма витамина B 6 , в водном растворе имеет равновесие, благоприятствующее таутомерной форме, в которой протон переносится от фенольной группы -OH к атому азота. Например, прогнозируется, что [9]
Поскольку таутомеры представляют собой разные соединения, иногда они имеют настолько разную структуру, что их можно обнаружить независимо в смеси. Это позволяет провести экспериментальный анализ равновесия. [10]
Бетаины и подобные соединения [ править ]
Соединение триметилглицин , выделенное из сахарной свеклы , было названо «бетаином». Позже были открыты и другие соединения, содержащие тот же структурный мотив — четвертичный атом азота с карбоксилатной присоединенной к нему через связь –CH 2 – группой . В настоящее время все соединения, в структуру которых входит этот мотив, известны как бетаины. Бетаины не изомеризуются, поскольку химические группы, присоединенные к атому азота, нелабильны . Эти соединения можно классифицировать как постоянные цвиттер-ионы, поскольку изомеризация в молекулу без электрических зарядов не происходит или происходит очень медленно. [11]
Другие примеры постоянных цвиттер-ионов включают фосфатидилхолины, которые также содержат четвертичный атом азота, но с отрицательно заряженной фосфатной группой вместо карбоксилатной группы; сульфобетаины , содержащие четвертичный атом азота и отрицательно заряженную сульфонатную группу; [12] и легочные поверхностно-активные вещества, такие как дипальмитоилфосфатидилхолин . Лаурамидопропилбетаин является основным компонентом кокамидопропилбетаина.
- Триметилглицин (тривиальное название бетаин)
- Пример фосфатидилхолина
Сопряженные цвиттерионы [ править ]
Сильно поляризованные сопряженные соединения (сопряженные цвиттер-ионы) обычно очень реакционноспособны, имеют бирадикальный характер, активируют сильные связи и небольшие молекулы и служат временными промежуточными соединениями в катализе. [13] Донорно-акцепторные образования широко используются в фотохимии ( фотоиндуцированный перенос электронов ), органической электронике , коммутации и зондировании .
См. также [ править ]
Ссылки [ править ]
- ^ «Цвиттерион» . Химия LibreTexts . 03.11.2015. Архивировано из оригинала 21 июня 2023 г. Проверено 11 февраля 2022 г.
- ^ Скуг, Дуглас А.; Уэст, Дональд М.; Холлер, Ф. Джеймс; Крауч, Стэнли Р. (2004). Основы аналитической химии (8-е изд.). Томсон/Брукс/Коул. стр. 231, 385, 419, 460. ISBN. 0-03-035523-0 .
- Основы аналитической химии (9-е изд.). 2013. С. 415–416. ISBN 978-1-285-60719-1 .
- ^ Дженсен, Ян Х.; Гордон, Марк С. (1995). «О количестве молекул воды, необходимом для стабилизации глицина цвиттериона» . Журнал Американского химического общества . 117 (31): 8159–8170. дои : 10.1021/ja00136a013 . Архивировано из оригинала 2 декабря 2020 г. Проверено 28 августа 2020 г.
- ^ Йонссон, П.-Г.; Квик, О. (1972). «Прецизионное нейтронографическое определение структуры компонентов белка и нуклеиновых кислот. III. Кристаллическая и молекулярная структура аминокислоты α-глицина» (PDF) . Acta Crystallographica Раздел B. 28 (6): 1827–1833. дои : 10.1107/S0567740872005096 . Архивировано (PDF) из оригинала 14 марта 2020 г. Проверено 3 сентября 2019 г.
- ^ Прайс, Уильям Д.; Йокуш, Ребекка А.; Уильямс, Эван Р. (1997). «Является ли аргинин цвиттерионом в газовой фазе?» . Журнал Американского химического общества . 119 (49): 11988–11989. дои : 10.1021/ja9711627 . ПМК 1364450 . ПМИД 16479267 .
- ^ Сасс, РЛ (1960). «Нейтронографическое исследование кристаллической структуры сульфаминовой кислоты» . Акта Кристаллографика . 13 (4): 320–324. дои : 10.1107/S0365110X60000789 .
- ^ Браун, CJ; Эренберг, М. (1985). «Антраниловая кислота, C 7 H 7 NO 2 , методом нейтронографии». Акта Кристаллографика C. 41 (3): 441–443. дои : 10.1107/S0108270185004206 .
- ^ Котрейт, Мишель (1972). «Кристаллическая структура этилендиаминтетрауксусной кислоты, ЭДТА». Акта Кристаллографика Б. 28 (3): 781–785. дои : 10.1107/S056774087200319X .
- ^ Кируба, GSM; Мин, Ва Вонг (2003). «Таутомерные равновесия пиридоксаль-5'-фосфата и производных 3-гидроксипиридина: теоретическое исследование эффектов сольватации». Журнал органической химии . 68 (7): 2874–2881. дои : 10.1021/jo0266792 . ПМИД 12662064 .
- ^ Надь, Петр I .; Такач-Новак, Кристина (1997). «Теоретические и экспериментальные исследования равновесия цвиттериона ⇌ нейтральной формы амфолитов в чистых растворителях и смесях». Дж. Ам. хим. Соц . 119 (21): 4999–5006. дои : 10.1021/ja963512f .
- ^ Нельсон, Д.Л.; Кокс, ММ (2000). Ленинджер, Принципы биохимии (3-е изд.). Нью-Йорк: Стоит публикации. ISBN 1-57259-153-6 .
- ^ Гоненн, Амнон; Эрнст, Роберт (15 июня 1978 г.). «Солюбилизация мембранных белков сульфобетаинами, новыми цвиттер-ионными поверхностно-активными веществами» . Аналитическая биохимия . 87 (1): 28–38. дои : 10.1016/0003-2697(78)90565-1 . ISSN 0003-2697 . ПМИД 677454 .
- ^ Мунц, Доминик; Карстен, Мейер (2021). «Разрушение заряда в дизайне лигандов и переносе функциональных групп». Нат. Преподобный Хим . 5 (6): 422–439. дои : 10.1038/s41570-021-00276-3 . S2CID 235220781 .