Равновесная химия
Равновесная химия занимается системами, находящимися в химическом равновесии . Объединяющий принцип заключается в том, что свободная энергия системы, находящейся в равновесии, минимально возможна, так что наклон свободной энергии по отношению к координате реакции равен нулю. [1] [2] Этот принцип, примененный к равновесным смесям, дает определение константы равновесия . Приложения включают кислотно-щелочной анализ , анализ «хозяин-гость» , металл-комплекс , растворимость , распределение , хроматографию и окислительно-восстановительное равновесие.
Термодинамическое равновесие [ править ]
Говорят, что химическая система находится в равновесии, когда количества входящих в нее химических веществ не изменяются и не могут изменяться во времени без применения внешнего воздействия. В этом смысле система, находящаяся в химическом равновесии, находится в устойчивом состоянии. Система, находящаяся в химическом равновесии, будет иметь постоянную температуру, давление или объем и состав. Она будет изолирована от теплообмена с окружающей средой, то есть представляет собой закрытую систему . Изменение температуры, давления (или объема) представляет собой внешнее воздействие, и в результате такого изменения равновесные количества изменятся. Если существует вероятность изменения состава, но скорость изменений пренебрежимо мала, говорят, что система находится в метастабильном состоянии. Уравнение химического равновесия можно символически выразить как
- реагент(ы) ⇌ продукт(ы)
Знак ⇌ означает «находятся в равновесии». Это определение относится к макроскопическим свойствам. Изменения действительно происходят на микроскопическом уровне атомов и молекул, но в такой незначительной степени, что их невозможно измерить, и они происходят сбалансированным образом, так что макроскопические величины не изменяются. Химическое равновесие — это динамическое состояние, при котором прямые и обратные реакции протекают с такой скоростью, что макроскопический состав смеси постоянен. Таким образом, знак равновесия ⇌ символизирует тот факт, что реакции протекают как в прямом, так и в прямом направлении. и назад направления.
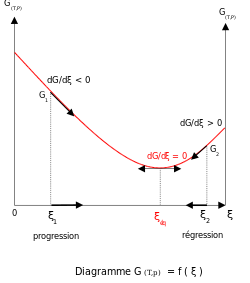
смысле . С другой стороны, устойчивое состояние не обязательно является состоянием равновесия в химическом Например, в цепочке радиоактивного распада концентрации промежуточных изотопов постоянны, поскольку скорость образования равна скорости распада. Это не химическое равновесие, поскольку процесс распада происходит только в одном направлении.
Термодинамическое равновесие характеризуется тем, что свободная энергия для всей (замкнутой) системы минимальна. Для систем с постоянным объемом свободная энергия Гельмгольца минимальна, а для систем с постоянным давлением свободная энергия Гиббса минимальна. [3] Таким образом, метастабильное состояние — это состояние, в котором изменение свободной энергии между реагентами и продуктами не минимально, даже если состав не меняется во времени. [4]
Существование этого минимума обусловлено тем, что свободная энергия смешения реагентов и продуктов всегда отрицательна. [5] Для идеальных растворов энтальпия энтропия смешивания равна нулю, поэтому существует минимум, поскольку смешивания всегда положительна. [6] [7] Наклон свободной энергии реакции δ G r относительно реакции координаты ξ равен нулю, когда свободная энергия находится на минимальном значении.
Константа равновесия [ править ]
Химический потенциал – это частичная молярная свободная энергия. Потенциал µ i i -го вещества в химической реакции представляет собой частную производную свободной энергии по отношению к числу молей этого вида N i :
Общее химическое равновесие можно записать как [примечание 1]
n j — стехиометрические коэффициенты реагентов в уравнении равновесия, m j — коэффициенты продуктов. Величина δ G r для этих реакций является функцией химических потенциалов всех видов.
Химический потенциал µ i i -го вида можно рассчитать через активность его a i .
м тот
i — стандартный химический потенциал вида, R — газовая постоянная , а T — температура. Полагая сумму реагентов j равной сумме продуктов k , так что δ G r (Eq) = 0:
Перестановка терминов,
Это связано со стандартным изменением свободной энергии Гиббса, Δ G тот к константе равновесия K значений , коэффициенту реакции активности в состоянии равновесия.
Отсюда следует, что любое равновесие такого типа можно характеризовать либо стандартным изменением свободной энергии, либо константой равновесия. На практике концентрация более полезна, чем деятельность. Активность можно рассчитать по концентрациям, если известен коэффициент активности , но это бывает редко. Иногда коэффициенты активности можно рассчитать, используя, например, уравнения Питцера или теорию удельного взаимодействия ионов . В противном случае условия необходимо скорректировать так, чтобы коэффициенты активности не сильно менялись. Для ионных растворов это достигается использованием фоновой ионной среды с высокой концентрацией по сравнению с концентрациями веществ в равновесии.
Если коэффициенты активности неизвестны, их можно включить в константу равновесия, которая становится коэффициентом концентрации. [8] Предполагается, что каждая активность a i является произведением концентрации [A i ] и коэффициента активности γ i :
Это выражение активности помещается в выражение, определяющее константу равновесия. [9]
Полагая частное коэффициентов активности Γ равным единице, [примечание 2] константа равновесия определяется как частное от концентраций.
В более привычных обозначениях для общего равновесия
- α А + β В ... ⇌ σ S + τ Т ...
Это определение гораздо более практично, но константа равновесия, определяемая через концентрации, зависит от условий. В частности, константы равновесия веществ в водном растворе зависят от ионной силы , поскольку коэффициенты активности варьируются в зависимости от ионной силы раствора.
Значения стандартного изменения свободной энергии и константы равновесия зависят от температуры. В первом приближении уравнение Ван-т-Гоффа можно использовать .
Это показывает, что когда реакция экзотермическая (Δ H тот , стандартное изменение энтальпии , отрицательно), то K уменьшается с ростом температуры в соответствии с принципом Ле Шателье . Используемое приближение состоит в том, что стандартное изменение энтальпии Δ H тот , не зависит от температуры, что является хорошим приближением только в небольшом диапазоне температур. Термодинамические аргументы можно использовать, чтобы показать, что
где C p – теплоемкость при постоянном давлении. [10]
Равновесия с участием газов [ править ]
При работе с газами фугитивность , f используется а не активность. Однако, если деятельность безразмерна , то летучесть имеет размерность давления . Следствием этого является то, что химический потенциал должен определяться через стандартное давление p. тот : [11]
По соглашению р тот обычно принимается равным 1 бар .Летучесть может быть выражена как произведение парциального давления p и коэффициента летучести Φ :
Коэффициенты фугитивности безразмерны и могут быть получены экспериментально при определенной температуре и давлении путем измерений отклонений от поведения идеального газа . Константы равновесия определяются через летучесть. Если газы находятся при достаточно низком давлении и ведут себя как идеальные газы, константу равновесия можно определить как частное парциальных давлений.
Примером газофазного равновесия может служить –Боша Габера процесс синтеза аммиака .
- Н 2 + 3 Н 2 ⇌ 2 NH 3 ;
Эта реакция сильно экзотермична , поэтому константа равновесия уменьшается с температурой. Однако для достижения разумной скорости реакции с доступными в настоящее время катализаторами необходима температура около 400 °C . Образованию аммиака также способствует высокое давление, так как при протекании реакции объем уменьшается. Такая же реакция, азотфиксация , происходит при температуре окружающей среды в природе, когда катализатором является такой фермент , как нитрогеназа . Первоначально требуется много энергии, чтобы разорвать тройную связь азот-азот, даже если в целом реакция является экзотермической.
Газофазные равновесия возникают при горении и изучались еще в 1943 году в связи с разработкой Фау-2 ракетного двигателя . [12]
Расчет состава для газового равновесия при постоянном давлении часто выполняется с использованием значений ΔG, а не констант равновесия. [13] [14]
Множественные равновесия [ править ]
Одновременно могут существовать два и более равновесий. В этом случае константы равновесия можно приписать отдельным равновесиям, но они не всегда уникальны. Например, для двухосновной кислоты H 2 A можно определить три константы равновесия. [15] [примечание 3]
- А 2− + Ч + ⇌ ХА − ;
- ХА − + Ч + ⇌ Н 2 А;
- А 2− + 2 ч. + ⇌ Н 2 А;
Эти три константы не являются независимыми друг от друга, и легко видеть, что β 2 = K 1 K 2 . Константы K 1 и K 2 являются ступенчатыми константами, а β является примером общей константы.
Видообразование [ править ]

Равновесные концентрации видов обычно рассчитываются в предположении, что коэффициенты активности либо известны, либо ими можно пренебречь. В этом случае каждую константу равновесия образования комплекса в множестве множественных равновесий можно определить следующим образом:
- α A + β B ... ⇌ A α B β ...?
Концентрации веществ, содержащих реагент А, ограничены условием массового баланса , то есть общая (или аналитическая) концентрация, которая представляет собой сумму концентраций всех видов, должна быть постоянной. Для каждого реагента типа существует одно уравнение массового баланса
Существует столько уравнений массового баланса, сколько реагентов, A, B..., поэтому, если значения константы равновесия известны, существует n уравнений массового баланса с n неизвестными, [A], [B]... , так называемые концентрации свободных реагентов. Решение этих уравнений дает всю информацию, необходимую для расчета концентраций всех видов. [16]
Таким образом, важность констант равновесия заключается в том, что, как только их значения будут определены экспериментально, их можно использовать для расчета концентраций, известных как видообразование , смесей, содержащих соответствующие виды.
Определение [ править ]
Существует пять основных типов экспериментальных данных, которые используются для определения констант равновесия растворов. Потенциометрические данные, полученные с помощью стеклянного электрода , наиболее широко используются для водных растворов. Остальные — спектрофотометрические измерения , измерения флуоресценции (люминесценции) и ЯМР ; химического сдвига измерения [8] [17] Одновременное измерение K и Δ H для аддуктов 1:1 в биологических системах обычно проводится с использованием изотермической титровальной калориметрии .
Экспериментальные данные будут включать набор точек данных. В i-й точке данных аналитические концентрации реагентов TA ( i ) , TB ( i ) и т. д. будут экспериментально известными величинами, и будет одна или несколько измеренных величин y i , которые зависят от некоторых образом от аналитических концентраций и констант равновесия. Общая вычислительная процедура состоит из трех основных компонентов.
- Определение химической модели равновесий. Модель состоит из списка реагентов A, B и т. д. и образованных из них комплексов со стехиометрией A p B q ... Необходимо указать известные или расчетные значения констант равновесия для образования всех комплексов.
- Расчет концентрации всех химических веществ в каждом растворе. Свободные концентрации рассчитываются путем решения уравнений массового баланса, а концентрации комплексов рассчитываются с использованием определений константы равновесия. Затем количество, соответствующее наблюдаемому количеству, можно рассчитать с использованием физических принципов, таких как потенциал Нернста или закон Бера-Ламберта , которые связывают рассчитанное количество с концентрацией видов.
- Уточнение констант равновесия. Обычно нелинейная процедура наименьших квадратов используется . Взвешенная сумма квадратов U минимизируется. Веса w i и величины y могут быть векторами. Значения констант равновесия уточняются итерационной процедурой. [16]
Кислотно-основное равновесие [ править ]
Брёнстед и Лоури охарактеризовали кислотно-щелочное равновесие как включающее реакцию протонного обмена: [18] [19] [20]
- кислота + основание ⇌ сопряженное основание + сопряженная кислота.
Кислота является донором протонов; протон переносится на основание, акцептор протона, создавая сопряженную кислоту. Для водных растворов кислой ГК основанием является вода; сопряженное основание - A − и сопряженная кислота представляет собой сольватированный ион водорода. В химии растворов обычно используют H + как сокращение для сольватированного иона водорода, независимо от растворителя. В водном растворе H + обозначает сольватированный ион гидроксония . [21] [22] [примечание 4]
Определение Бренстеда-Лоури применимо и к другим растворителям, таким как диметилсульфоксид : растворитель S действует как основание, принимая протон и образуя сопряженную кислоту SH. + . Более широкое определение диссоциации кислоты включает гидролиз , при котором протоны образуются в результате расщепления молекул воды. Например, борная кислота , B(OH)
3 , действует как слабая кислота, хотя и не является донором протонов из-за гидролизного равновесия
- Б(ОН)
3 + Ч
2 О ⇌ В(ОН) −
4 + Ч + .
Точно так же гидролиз ионов металлов приводит к образованию таких ионов, как [Al(H
2О )
6 ] 3+
вести себя как слабые кислоты: [23]
- [Ал(H
2О )
6 ] 3+
⇌ [Ал(H
2О )
5 (ОН)] 2+
+ Ч +
.
Кислотно-основное равновесие важно в очень широком диапазоне приложений , таких как кислотно-основной гомеостаз , закисление океана , фармакология и аналитическая химия .
хозяином и между Равновесие гостем
Комплекс хозяин-гость, также известный как донорно-акцепторный комплекс, может быть образован из основания Льюиса B и кислоты Льюиса A. Хозяин может быть либо донором, либо акцептором. В биохимии комплексы «хозяин-гость» известны как рецептор комплексы -лиганд; они образуются преимущественно за счет нековалентной связи . Многие комплексы хозяин-гость имеют стехиометрию 1:1, но многие другие имеют более сложную структуру. Общее равновесие можно записать как
- p A + q B ⇌ A p B q
Изучение этих комплексов важно для супрамолекулярной химии. [24] [25] и молекулярное распознавание . Целью этих исследований часто является поиск систем с высокой селективностью связывания хозяина (рецептора) с конкретной целевой молекулой или ионом, гостем или лигандом. Область применения — разработка химических сенсоров . [26] Поиск препарата, который либо блокирует рецептор ( антагониста , образующего прочный комплекс с рецептором), либо активирует его ( агониста ), является важным путем к открытию лекарств . [27]
Комплексы металлов [ править ]
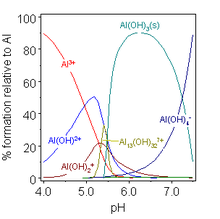
Образование комплекса между ионом металла М и лигандом L на самом деле обычно представляет собой реакцию замещения. Например, в водных растворах ионы металлов будут присутствовать в виде аква-ионов , поэтому реакцию образования первого комплекса можно записать как [примечание 5]
- [M(H 2 O) n ] + L ⇌ [M(H 2 O) n −1 L] + H 2 O
Однако, поскольку вода находится в огромном избытке, концентрация воды обычно считается постоянной и не учитывается в выражениях константы равновесия. Часто металл и лиганд конкурируют за протоны. [примечание 4] Для равновесия
- p M + q L + r H ⇌ M p L q H r
Константу устойчивости можно определить следующим образом: [28] [29]
Это определение можно легко расширить, включив в него любое количество реагентов. Он включает гидроксидные комплексы, поскольку концентрация гидроксид-ионов связана с концентрацией ионов водорода за счет самоионизации воды.
Константы устойчивости, определенные таким образом, являются ассоциации константами . Это может привести к некоторой путанице, поскольку p K a значения являются константами диссоциации . В компьютерных программах общего назначения все константы принято определять как константы ассоциации. Связь между двумя типами констант дается в константах ассоциации и диссоциации .
В биохимии молекула кислорода может связываться с атомом железа (II) в гема простетической группе в гемоглобине . Равновесие обычно записывают, обозначая гемоглобин через Hb, как
- Hb + O 2 ⇌ HbO 2
но это представление является неполным, поскольку эффект Бора показывает, что равновесные концентрации зависят от pH. Лучшим представлением было бы
- [ХбХ] + + О 2 ⇌ HbO 2 + Н +
поскольку это показывает, что при увеличении концентрации ионов водорода равновесие смещается влево в соответствии с принципом Ле Шателье . Концентрацию ионов водорода можно увеличить за счет присутствия углекислого газа, который ведет себя как слабая кислота.
- Н 2 О + СО 2 ⇌ HCO −
3 + Ч +
Атом железа также может связываться с другими молекулами, такими как окись углерода . Сигаретный дым содержит некоторое количество угарного газа, поэтому равновесие
- HbO 2 + CO ⇌ Hb(CO) + O 2
устанавливается в крови курильщиков сигарет.
Хелатирующая терапия основана на принципе использования хелатирующих лигандов с высокой селективностью связывания определенного металла для удаления этого металла из организма человека.
Комплексы с полиаминокарбоновыми кислотами находят широкий спектр применения. ЭДТА, в частности, широко используется.
Редокс-равновесие [ править ]
Равновесие восстановления-окисления ( окислительно-восстановительное ) можно поддерживать точно так же, как и любое другое химическое равновесие. Например,
- Фе 2+ + Это 4+ ⇌ Фе 3+ + Это 3+ ;
Однако в случае окислительно-восстановительных реакций удобно разделить всю реакцию на две полуреакции. В этом примере
- Фе 3+ + и − ⇌ Фе 2+
- Этот 4+ + и − ⇌ Это 3+
Стандартное изменение свободной энергии, которое связано с константой равновесия соотношением
можно разделить на две составляющие,
Концентрация свободных электронов фактически равна нулю, поскольку электроны передаются непосредственно от восстановителя к окислителю. Стандартный электродный потенциал , E 0 для каждой полуреакции связано со стандартным изменением свободной энергии соотношением [30]
где n — количество переданных электронов, а F — постоянная Фарадея . Теперь свободная энергия для реальной реакции определяется выражением
где R — газовая постоянная , а Q — коэффициент реакции . Строго говоря, Q — это частное активности, но вместо активностей обычно используют концентрации. Поэтому:
Для любой полуреакции окислительно-восстановительный потенциал реальной смеси определяется обобщенным выражением [примечание 6]
Это пример уравнения Нернста . Потенциал известен как потенциал восстановления. Стандартные электродные потенциалы доступны в таблице значений . Используя эти значения, можно рассчитать фактический электродный потенциал окислительно-восстановительной пары как функцию соотношения концентраций.
Равновесный потенциал для общей окислительно-восстановительной полуреакции ( #Константа равновесия пояснения к символам см. выше в разделе ).
- α A + β B... + n e − ⇌ σ S + τ Т...
дается [31]
Использование этого выражения допускает эффект частиц, не участвующих в окислительно-восстановительной реакции, таких как ион водорода в полуреакции, такой как
- MnO −
4 + 8 ч + + 5 и − ⇌ Мн 2+ + 4 Н 2 О
быть принятым во внимание.
Константу равновесия для полной окислительно-восстановительной реакции можно получить из стандартных окислительно-восстановительных потенциалов составляющих полуреакций. В состоянии равновесия потенциалы двух полуреакций должны быть равны друг другу и, конечно, число обмениваемых электронов должно быть одинаковым в обеих полуреакциях. [32]
Окислительно-восстановительное равновесие играет важную роль в цепи переноса электронов . Различные цитохромы в цепи имеют разные стандартные окислительно-восстановительные потенциалы, каждый из которых адаптирован для определенной окислительно-восстановительной реакции. Это позволяет, например, атмосферного кислорода уменьшать содержание при фотосинтезе . Отдельное семейство цитохромов, цитохромоксидазы P450 , участвует в стероидогенезе и детоксикации .
Растворимость [ править ]
Когда растворенное вещество образует насыщенный раствор в растворителе , концентрация растворенного вещества при данной температуре определяется константой равновесия при этой температуре. [33]
Активность чистого вещества в твердом состоянии по определению едина, поэтому выражение упрощается до
Если растворенное вещество не диссоциирует, сумма заменяется одним членом, но если происходит диссоциация, как в случае с ионными веществами.
Например, для Na 2 SO 4 поэтому m 1 = 2 и m 2 = 1, произведение растворимости записывается как
Вместо активности обычно используются концентрации, обозначаемые [...], но активность необходимо учитывать наличие другой соли, не имеющей общих ионов, так называемый солевой эффект. Когда присутствует другая соль, имеющая общий ион, вступает в действие эффект общего иона , снижающий растворимость основного растворенного вещества. [34]
Раздел [ править ]
Когда раствор вещества в одном растворителе приводится в равновесие со вторым растворителем, который несмешивается с первым растворителем, растворенное вещество можно разделить между двумя растворителями. Отношение концентраций двух растворителей известно как коэффициент распределения или коэффициент распределения . [примечание 7] Коэффициент распределения определяется как соотношение аналитических концентраций растворенного вещества в двух фазах. По соглашению значение указывается в логарифмической форме.
Коэффициент распределения определяется при заданной температуре и, если применимо, pH водной фазы. Коэффициенты распределения очень важны в фармакологии, поскольку они определяют степень, в которой вещество может пройти из крови (водного раствора) через клеточную стенку, подобную органическому растворителю. Их обычно измеряют с использованием воды и октанола в качестве двух растворителей, что дает так называемый коэффициент распределения октанол-вода . Многие фармацевтические соединения представляют собой слабые кислоты или слабые основания . Такое соединение может существовать с различной степенью протонирования в зависимости от рН и константы диссоциации кислоты . Поскольку органическая фаза имеет низкую диэлектрическую проницаемость, частицы, не имеющие электрического заряда, с наибольшей вероятностью перейдут из водной фазы в органическую фазу. Даже при pH 7–7,2, диапазоне биологических значений pH, водная фаза может поддерживать равновесие между более чем одной протонированной формой. log p определяют по аналитической концентрации вещества в водной фазе, то есть сумме концентраций различных частиц в равновесии.
Экстракция растворителем широко используется в процессах разделения и очистки. В простейшей форме реакция проводится в органическом растворителе, а нежелательные побочные продукты удаляются путем экстракции в воду при определенном pH.
Ион металла можно экстрагировать из водной фазы в органическую фазу, в которой соль не растворима, путем добавления лиганда . Лиганд, L а — , образует комплекс с ионом металла M б + , [МЛ х ] ( б - топор )+ который имеет сильно гидрофобную внешнюю поверхность. Если комплекс не имеет электрического заряда, он относительно легко экстрагируется в органическую фазу. Если комплекс заряжен, он извлекается в виде ионной пары . Дополнительный лиганд не всегда требуется. Например, нитрат уранила UO 2 (NO 3 ) 2 растворим в диэтиловом эфире , поскольку сам растворитель действует как лиганд. Это свойство использовалось в прошлом для отделения урана от других металлов, соли которых не растворяются в эфире. экстракция керосином В настоящее время предпочтительна с использованием такого лиганда, как три -н -бутилфосфат , ТБФ. В процессе PUREX , который обычно используется при ядерной переработке , уран(VI) извлекается из сильной азотной кислоты в виде электронейтрального комплекса [UO 2 (TBP) 2 (NO 3 ) 2 ]. Сильная азотная кислота обеспечивает высокую концентрацию нитрат-ионов, что сдвигает равновесие в пользу слабого нитратокомплекса. Уран извлекают путем обратной экстракции (очистки) в слабую азотную кислоту. Плутоний (IV) образует аналогичный комплекс [PuO 2 (TBP) 2 (NO 3 ) 2 ] и плутоний в этом комплексе можно восстановить, чтобы отделить его от урана.
Другим важным применением экстракции растворителем является разделение лантаноидов . В этом процессе также используется ТБФ, а комплексы экстрагируются керосином. Разделение достигается за счет того, что константа устойчивости образования комплекса ТБФ увеличивается с уменьшением размера иона лантаноида.
Примером экстракции ионных пар является использование лиганда для окисления перманганатом калия KMnO 4 в органическом растворителе. KMnO 4 не растворяется в органических растворителях. Когда лиганд, такой как краун-эфир, добавляется к водному раствору KMnO 4 , он образует гидрофобный комплекс с катионом калия, который позволяет незаряженной ионной паре [KL] + [МnО 4 ] − экстрагировать органическим растворителем. См. также: Фазовый катализ .
Более сложные проблемы разделения (т.е. наличие 3 или более фаз) иногда можно решить с помощью подхода, основанного на фугитивной емкости .
Хроматография [ править ]
В хроматографии вещества разделяются перегородкой между неподвижной и подвижной фазами. Аналит растворяется в подвижной фазе и переходит в неподвижную фазу. Разделение происходит из-за разного сродства аналитов к стационарной фазе. Константу распределения K d можно определить как
где a s и am — равновесные активности в стационарной и подвижной фазах соответственно. Можно показать, что скорость миграции ν связана с константой распределения соотношением
f — коэффициент, зависящий от объемов двух фаз. [35] Таким образом, чем выше сродство растворенного вещества к неподвижной фазе, тем медленнее скорость миграции.
Существует большое разнообразие хроматографических методов в зависимости от природы неподвижной и подвижной фаз. Когда неподвижная фаза твердая, аналит может образовывать с ней комплекс. Умягчитель воды действует путем селективного комплексообразования с сульфонат- ионообменной смолой . Ионы натрия образуют со смолой относительно слабые комплексы. Когда через смолу пропускают жесткую воду , двухвалентные ионы магния и кальция вытесняют ионы натрия и удерживаются на смоле R.
- РНК + М 2+ ⇌ РМ + + Уже +
Вода, выходящая из колонны, относительно богата ионами натрия. [примечание 8] и беден кальцием и магнием, которые задерживаются на колонке. Колонку регенерируют, пропуская через нее крепкий раствор хлорида натрия, в результате чего на колонке вновь образуется комплекс смолы с натрием. В ионообменной хроматографии используется смола, такая как хелекс 100 , в которой иминодиацетатные остатки, прикрепленные к основной цепи полимера, образуют хелатные комплексы разной силы с ионами разных металлов, позволяя ионам, таким как Cu 2+ и Ни 2+ разделять хроматографически.
Другим примером комплексообразования является хиральная хроматография отделяются , в которой энантиомеры друг от друга. Стационарная фаза сама по себе является хиральной и избирательно образует комплексы с энантиомерами. В других типах хроматографии с твердой неподвижной фазой, таких как тонкослойная хроматография, аналит избирательно адсорбируется на твердом веществе.
В газожидкостной хроматографии (ГЖХ) неподвижная фаза представляет собой жидкость, такую как полидиметилсилоксан , нанесенную на стеклянную трубку. Разделение достигается за счет того, что различные компоненты газа имеют разную растворимость в неподвижной фазе. ГЖХ можно использовать для разделения буквально сотен компонентов газовой смеси, таких как сигаретный дым или эфирные масла , например лавандовое масло .
См. также [ править ]
Примечания [ править ]
- ^ Это общее выражение нечасто используется в химии. Чтобы лучше понять обозначения, рассмотрим равновесие
- Н 2 SO 4 + 2 ОН − ⇌ ТАК 2−
4 + 2 Н 2 О
4 и Продукт 2 = H 2 O. - Н 2 SO 4 + 2 ОН − ⇌ ТАК 2−
- ^ Это эквивалентно определению новой константы равновесия как КГ
- ^ Приведенные определения являются константами ассоциации . Константа диссоциации является обратной константой ассоциации.
- ^ Jump up to: Перейти обратно: а б Голый протон не существует в водном растворе. Это очень сильная кислота, которая объединяет основание, воду, с образованием иона гидроксония.
- ЧАС + + Н 2 О → Н 3 О +
- ^ Электрические заряды в таких выражениях опущены, поскольку лиганд L может нести, а может и не нести электрический заряд.
- ^ Альтернативное выражение иногда используется, как в уравнении Нернста .
- ^ Различие между коэффициентом распределения и коэффициентом распределения имеет только историческое значение.
- ^ Кормление младенцев молочной смесью, состоящей из воды, богатой натрием, может привести к гипернатриемии .
Внешние ссылки [ править ]
- Химическое равновесие Книга для скачивания
Ссылки [ править ]
- Аткинс, П.В.; Де Паула, Дж. (2006). Физическая химия (8-е изд.). Издательство Оксфордского университета. ISBN 0-19-870072-5 .
- Денбей, К. (1981). Принципы химического равновесия (4-е изд.). Кембридж, Великобритания: Издательство Кембриджского университета. ISBN 0-521-28150-4 . Классическая книга, последний раз переизданная в 1997 году.
- Мендхэм, Дж.; Денни, RC; Барнс, доктор медицинских наук; Томас, MJK (2000), Количественный химический анализ Фогеля (6-е изд.), Нью-Йорк: Прентис Холл, ISBN 0-582-22628-7
- ^ Денбей, К. (1981). Принципы химического равновесия (4-е изд.). Кембридж, Великобритания: Издательство Кембриджского университета. ISBN 0-521-28150-4 .
- ^ Де Неверс, Н. (2002). Физическое и химическое равновесие для инженеров-химиков . ISBN 978-0-471-07170-9 .
- ^ Денби, Глава 4
- ^ Денби, Глава 5
- ^ Аткинс, с. 203
- ^ Аткинс, с. 149
- ^ Шульц, MJ (1999). «Почему равновесие? Понимание роли энтропии смешения». Дж. Хим. Образование . 76 (10): 1391. Бибкод : 1999JChEd..76.1391S . дои : 10.1021/ed076p1391 .
- ^ Jump up to: Перейти обратно: а б Россотти, FJC; Россотти, Х. (1961). Определение констант устойчивости . МакГроу-Хилл. Глава 2. Коэффициенты активности и концентрации
- ^ Аткинс, с. 208
- ^ Бландамер, MJ (1992). Химические равновесия в растворах: зависимость констант скорости и равновесия от температуры и давления . Нью-Йорк: Эллис Хорвуд / PTR Prentice Hall. ISBN 0-13-131731-8 .
- ^ Аткинс, с. 111
- ^ Дамкелер, Г.; Эдсе, Р. (1943). «Состав диссоциирующих дымовых газов и расчет одновременных равновесий». З. Электрохим . 49 : 178–802.
- ^ Ван Зеггерен, Ф.; Стори, С.Х. (1970). Расчет химического равновесия . Лондон: Издательство Кембриджского университета. ISBN 0-521-07630-7 .
- ^ Смит, WR; Миссен, RW (1991). Анализ равновесия химических реакций: теория и алгоритмы . Малабар, Флорида: Кригер. ISBN 0-89464-584-6 .
- ^ Хартли, Франция; Берджесс, К.; Алкок, Р.М. (1980). Равновесия решений . Нью-Йорк (Halsted Press): Эллис Хорвуд. ISBN 0-470-26880-8 .
- ^ Jump up to: Перейти обратно: а б Леггетт, диджей, изд. (1985). Вычислительные методы определения констант образования . Нью-Йорк: Пленум Пресс. ISBN 0-306-41957-2 .
- ^ Мартелл, А.Е.; Мотекайтис, Р.Дж. (1992). Определение и использование констант устойчивости (2-е изд.). Нью-Йорк: Издательство VCH. ISBN 1-56081-516-7 .
- ^ Белл, Р.П. (1973). Протон в химии (2-е изд.). Лондон: Чепмен и Холл. ISBN 0-8014-0803-2 . Включает обсуждение многих органических кислот Бренстеда.
- ^ Шрайвер, DF; Аткинс, PW (1999). Неорганическая химия (3-е изд.). Оксфорд: Издательство Оксфордского университета. ISBN 0-19-850331-8 . Глава 5: Кислоты и основания
- ^ Хаускрофт, CE; Шарп, AG (2008). Неорганическая химия (3-е изд.). Прентис Холл. ISBN 978-0-13-175553-6 . Глава 6: Кислоты, основания и ионы в водном растворе
- ^ Хедрик, Дж. М.; Дикен, Э.Г.; Уолтерс, РС; Хаммер, Н.И.; Кристи, А.; Кюи, Дж.; Мышакин Е.М.; Дункан, Массачусетс; Джонсон, Массачусетс; Джордан, К.Д. (2005). «Спектральные характеристики колебаний гидратированных протонов в кластерах воды». Наука . 308 (5729): 1765–69. Бибкод : 2005Sci...308.1765H . дои : 10.1126/science.1113094 . ПМИД 15961665 . S2CID 40852810 .
- ^ Смеховский, М.; Стангрет, Дж. (2006). «Гидратация протонов в водном растворе: инфракрасные исследования спектров HDO с преобразованием Фурье». Дж. Хим. Физ . 125 (20): 204508–204522. Бибкод : 2006JChPh.125t4508S . дои : 10.1063/1.2374891 . ПМИД 17144716 .
- ^ Берджесс, Дж. (1978). Ионы металлов в растворе . Эллис Хорвуд. ISBN 0-85312-027-7 . В разделе 9.1 «Кислотность сольватированных катионов» перечислено множество значений p K a .
- ^ Лен, Ж.-М. (1995). Супрамолекулярная химия . Вайли-ВЧ. ISBN 978-3-527-29311-7 .
- ^ Стид, Дж.В.; Этвуд, ЖЖ (2000). Супрамолекулярная химия . Уайли. ISBN 0-471-98831-6 .
- ^ Кэтролл, RW (1997). Химические датчики . Издательство Оксфордского университета. ISBN 0-19-850090-4 .
- ^ «Открытие лекарств сегодня» . Проверено 23 марта 2010 г.
- ^ Бек, Монтана; Надьпал, И. (1990). Химия комплексных равновесий . Хорвуд. ISBN 0-85312-143-5 . Раздел 2.2. Типы комплексных констант равновесия
- ^ Хартли, Франция; Берджесс, К.; Алкок, Р.М. (1980). Равновесия решений . Нью-Йорк (Halsted Press): Эллис Хорвуд. ISBN 0-470-26880-8 .
- ^ Аткинс, Глава 7, раздел «Равновесная электрохимия»
- ^ Мендхэм, стр. 59–64
- ^ Мендхэм, раздел 2.33, с. 63 подробнее
- ^ Хефтер, GT; Томкинс, RPT, ред. (2003). Экспериментальное определение растворимости . Уайли. ISBN 0-471-49708-8 .
- ^ Мендхэм, стр. 37–45
- ^ Скуг, Д.А.; Уэст, DM; Холлер, Дж. Ф.; Крауч, СР (2004). Основы аналитической химии (8-е изд.). Томсон Брукс/Коул. ISBN 0-03-035523-0 . Раздел 30Е, Хроматографическое разделение
Внешние ссылки [ править ]
 СМИ, связанные с равновесной химией, на Викискладе?
СМИ, связанные с равновесной химией, на Викискладе?












![{\displaystyle a_{i}=[\mathrm {A} _{i}]\gamma _{i}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/379843cbc2ab336a96494817622e017bf71227c8)
![{\displaystyle K={\frac {\prod _{k}{a_{k}}^{m_{k}}}{\prod _{j}{a_{j}}^{n_{j}}} }={\frac {\prod _{k}\left([\mathrm {A} _{k}]\gamma _{k}\right)^{m_{k}}}{\prod _{j} \left([\mathrm {A} _{j}]\gamma _{j}\right)^{n_{j}}}}={\frac {\prod _{k}[\mathrm {A} _ {k}]^{m_{k}}}{\prod _{j}[\mathrm {A} _{j}]^{n_{j}}}}\times {\frac {\prod _{k }{\gamma _{k}}^{m_{k}}}{\prod _{j}{\gamma _{j}}^{n_{j}}}}={\frac {\prod _{ k}[\mathrm {A} _{k}]^{m_{k}}}{\prod _{j}[\mathrm {A} _{j}]^{n_{j}}}}\times \Гамма }](https://wikimedia.org/api/rest_v1/media/math/render/svg/6dd6376011cb38551f36701caa14b6a1507f22b6)
![{\displaystyle K={\frac {\prod _{k}[\mathrm {A} _{k}]^{m_{k}}}{\prod _{j}[\mathrm {A} _{j }]^{n_{j}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6635cbfab04ff5f3c01879d12cf4985aa28eeaba)
![{\displaystyle K={\frac {[\mathrm {S} ]^{\sigma }[\mathrm {T} ]^{\tau }...}{[\mathrm {A} ]^{\alpha } [\mathrm {B} ]^{\beta }...}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a4742b7a1c6c820a51d80d307d52560eea1dbbe0)





![{\displaystyle K_{1}={\frac {[{\ce {HA-}}]}{[{\ce {H+}}][{\ce {A^2-}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/04969fca0ead36cfbbe0b051de8b65cd631e8ef6)
![{\displaystyle K_{2}={\frac {[{\ce {H2A}}]}{[{\ce {H+}}][{\ce {HA-}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/56c128c6ab8ee73e4942b4f468c1690c41c1279a)
![{\displaystyle \beta _{2}={\frac {[{\ce {H2A}}]}{[{\ce {H+}}]^{2}[{\ce {A^2-}}] }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2de0405541fa63df492bcecbd87f3bf596a07104)
![{\displaystyle K_{\alpha \beta \ldots }={\frac {[\mathrm {A} _{\alpha }\mathrm {B} _{\beta }\ldots ]}{[\mathrm {A} ] ^{\alpha }[\mathrm {B} ]^{\beta }\ldots }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6e0b23c8700067003f168eff133b0c77ad6d8ee5)
![{\displaystyle T_{\mathrm {A} }=[\mathrm {A} ]+\sum [\mathrm {A} _{\alpha}\mathrm {B} _{\beta }\ldots ]=[\mathrm {A} ]+\sum \left(\alpha K_{\alpha \beta }\ldots [\mathrm {A} ]^{\alpha }[\mathrm {B} ]^{\beta }\ldots \right) }](https://wikimedia.org/api/rest_v1/media/math/render/svg/531440648fcc0172c471fa1ea3407fdd37575c66)

![{\displaystyle \beta _{pqr}={\frac {[\mathrm {M} _{p}\mathrm {L} _{q}\mathrm {H} _{r}]}{[\mathrm {M } ]^{p}[\mathrm {L} ]^{q}[\mathrm {H} ]^{r}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7211b1998b28a60259b2d88ace92ef3ecf9957cb)
![{\displaystyle [{\ce {OH-}}]={\frac {K_ {\mathrm {w} }}{[{\ce {H+}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2304693857ffeea7daa98b6276ea85313f566c2d)
![{\displaystyle K={\frac {[{\ce {Fe^3+}}][{\ce {Ce^3+}}]}{[{\ce {Fe^2+}}][{\ что {Что^4+}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bb6f02b6d961f0f84ef7ac4c328ccef58b0bfb09)




![{\displaystyle E_{{\ce {Fe}}}=E_{{\ce {Fe}}}^{0}+{\frac {RT}{nF}}\ln {\frac {[{\ce { Fe^3+}}]}{[{\ce {Fe^2+}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/93fa1a3bd15095282f118bc8e51cae996049f126)
![{\displaystyle E=E^{0}+{\frac {RT}{nF}}\ln {\frac {[{\text{окисленные виды}}]}{[{\text{восстановленные виды}}]} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c443233bbcc4ead5ada0f7802c1e937f79efa01d)




![{\displaystyle K_{\mathrm {SP} }=[\mathrm {Na^{+}} ]^{2}[\mathrm {SO_{4}^{2-}} ]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2b38a2d91ad0f0206934346c679099db801f09b4)
![{\displaystyle \log p=\log {\frac {[\mathrm {раствор} ]_{\mathrm {органическая\;фаза} }}{[\mathrm {раствор} ]_{\mathrm {водная\;фаза} }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cb9676ed1d0e0470c2eefaa023c1ca10908b161e)


![{\displaystyle E=E^{0}-{\frac {RT}{nF}}\ln {\frac {[{\text{восстановленные виды}}]}{[{\text{окисленные виды}}]} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/895c50424795ac33e837902de294e469fc5fb915)