Константы устойчивости комплексов
Эта статья предоставляет недостаточный контекст для тех, кто не знаком с предметом . ( февраль 2015 г. ) |
В координационной химии константа стабильности (также называемая константой образования или константой связывания ) является константой равновесия для образования комплекса в растворе. Это мера силы взаимодействия между реагентами, которые объединяются, образуя комплекс . Существует два основных вида комплексов: соединения, образующиеся при взаимодействии иона металла с лигандом, и супрамолекулярные комплексы, такие как комплексы «хозяин-гость» и комплексы анионов. Константа(ы) стабильности предоставляет(ют) информацию, необходимую для расчета концентрации(й) комплекса(ов) в растворе. Существует множество областей применения в химии, биологии и медицине.
История
[ редактировать ]Янник Бьеррум (сын Нильса Бьеррума ) разработал первый общий метод определения констант устойчивости металл-амминных комплексов в 1941 году. [1] Причины, по которым это произошло так поздно, почти через 50 лет после того, как Альфред Вернер предложил правильную структуру координационных комплексов, были резюмированы Беком и Надьпалом. [2] Ключом к методу Бьеррума было использование недавно разработанного стеклянного электрода и pH-метра для определения концентрации ионов водорода в растворе. Бьеррум признал, что образование комплекса металла с лигандом представляет собой своего рода кислотно-основное равновесие : за лиганд L существует конкуренция между ионами металла M. п+ и ион водорода H + . Это означает, что необходимо учитывать два одновременных равновесия. Далее электрические заряды для общности опущены. Два равновесия
Следовательно, следя за концентрацией ионов водорода во время титрования смеси М и HL основанием и зная константу кислотной диссоциации HL, можно определить константу устойчивости образования ML. Бьеррум определил константы устойчивости систем, в которых может образовываться множество комплексов.
В последующие двадцать лет произошел настоящий взрыв в количестве определенных констант устойчивости. связи, подобные серии Ирвинга-Уильямса Были обнаружены . Расчеты проводились вручную с использованием так называемых графических методов. Математика, лежащая в основе методов, использовавшихся в этот период, обобщена Россотти и Россотти. [3] Следующим ключевым событием стало использование компьютерной программы LETAGROP. [4] [5] сделать расчеты. Это позволило исследовать системы, слишком сложные для оценки посредством ручных вычислений. Впоследствии были созданы компьютерные программы, способные вообще обрабатывать сложные состояния равновесия, такие как SCOGS. [6] и МИНИКВАД [7] были разработаны так, что сегодня определение констант устойчивости стало практически «рутинной» операцией. Значения тысяч констант устойчивости можно найти в двух коммерческих базах данных. [8] [9]
Теория
[ редактировать ]Образование комплекса между ионом металла М и лигандом L на самом деле обычно представляет собой реакцию замещения. Например, в водных растворах ионы металлов будут присутствовать в виде акваионов , поэтому реакцию образования первого комплекса можно записать как
Константа равновесия для этой реакции определяется выражением
[L] следует читать как «концентрацию L», как и для других терминов в квадратных скобках. Выражение можно значительно упростить, удалив те члены, которые являются постоянными. Число молекул воды, присоединенных к каждому иону металла, постоянно. В разбавленных растворах концентрация воды практически постоянна. Выражение становится
Следуя этому упрощению, можно дать общее определение общего равновесия.
Это определение можно легко расширить, включив в него любое количество реагентов. Реагенты не обязательно должны быть металлом и лигандом, но могут представлять собой любые соединения, образующие комплекс. Константы устойчивости, определенные таким образом, являются ассоциации константами . Это может привести к некоторой путанице, поскольку p K a значения являются константами диссоциации . В компьютерных программах общего назначения все константы принято определять как константы ассоциации. Связь между двумя типами констант дается в константах ассоциации и диссоциации .
Ступенчатые и кумулятивные константы
[ редактировать ]Кумулятивная или общая константа, обозначаемая символом β , представляет собой константу образования комплекса из реагентов. Например, кумулятивная константа образования ML 2 определяется выражением
- ;
Ступенчатые константы K 1 и K 2 относятся к образованию комплексов по одному этапу за раз.
- ;
- ;
Отсюда следует, что
Кумулятивную константу всегда можно выразить как произведение ступенчатых констант. И наоборот, любая ступенчатая константа может быть выражена как частное двух или более общих констант. Не существует общепринятого обозначения ступенчатых констант, хотя такой символ, как K л
МЛ иногда встречается в литературе. Хорошей практикой является явное указание каждой константы устойчивости, как показано выше.
Продукты гидролиза
[ редактировать ]Образование гидроксокомплекса является типичным примером реакции гидролиза. Реакция гидролиза — это реакция, при которой субстрат реагирует с водой, расщепляя молекулу воды на ионы гидроксида и водорода. В этом случае гидроксид-ион образует комплекс с субстратом.
- ;
В воде концентрация гидроксида связана с концентрацией ионов водорода самоионизации константой K w .
Выражение для концентрации гидроксида подставляется в выражение константы образования
В общем, по реакции
В более старой литературе значение log K обычно указывается в качестве константы гидролиза. Лог β * Значение обычно указывается для гидролизованного комплекса с общей химической формулой M p L q (OH) r .
Кислотно-основные комплексы
[ редактировать ]Можно считать, что кислота Льюиса A и основание Льюиса B образуют комплекс AB.
Существуют три основные теории, касающиеся силы кислот и оснований Льюиса и взаимодействия между ними.
- Твердая и мягкая кислотно-основная теория ( HSAB ). [10] Используется в основном для качественных целей.
- Драго и Вэйланд предложили двухпараметрическое уравнение, которое довольно точно предсказывает стандартную энтальпию образования очень большого количества аддуктов. −Δ Н ⊖ (А - B) знак равно E А E B + C А C B . значения параметров E и C. Доступны [11]
- Гуттмана Донорные числа : для оснований число получается из энтальпии реакции основания с пентахлоридом сурьмы в 1,2-дихлорэтане в качестве растворителя. Для кислот акцепторное число определяется энтальпией реакции кислоты с оксидом трифенилфосфина . [12]
Подробнее см.: Кислотно-основная реакция , Кислотный катализ , Экстракция (химия).
Термодинамика
[ редактировать ]Термодинамика образования комплексов ионов металлов дает много важной информации. [13] В частности, это полезно для различения энтальпийных и энтропийных эффектов. Энтальпийные эффекты зависят от силы связи, а энтропийные эффекты связаны с изменениями порядка/беспорядка раствора в целом. Хелатный эффект, описанный ниже, лучше всего объясняется с точки зрения термодинамики.
Константа равновесия связана со стандартным изменением свободной энергии Гиббса для реакции
R — газовая постоянная , а T — абсолютная температура . C ΔG При 25 ° ⊖ = (−5,708 кДж моль −1 ) ⋅ журнал β . Свободная энергия состоит из энтальпийного и энтропийного членов.
Стандартное изменение энтальпии можно определить калориметрически или с помощью уравнения Ван-т-Гоффа , хотя калориметрический метод предпочтительнее. Когда определены как стандартное изменение энтальпии, так и константа стабильности, стандартное изменение энтропии легко рассчитать по приведенному выше уравнению.
Тот факт, что константы образования комплексов типа ML n ступенчато уменьшаются по величине с увеличением n , отчасти можно объяснить энтропийным фактором. Возьмем случай образования октаэдрических комплексов.
Для первого шага m = 6, n = 1 и лиганд может перейти в один из 6 сайтов. Для второго шага m = 5 и второй лиганд может войти только в один из 5 сайтов. Это означает, что на первом этапе больше случайности, чем на втором; Δ С ⊖ более положителен, поэтому ∆ G ⊖ является более негативным и . На этой основе можно рассчитать соотношение ступенчатых констант устойчивости, но экспериментальные соотношения не совсем одинаковы, поскольку Δ H ⊖ не обязательно одинаков на каждом этапе. [14] Исключения из этого правила обсуждаются ниже, в разделах #Хелатный эффект и #Геометрические факторы .
Зависимость ионной силы
[ редактировать ]Константа термодинамического равновесия, K ⊖ , для равновесия
можно определить [15] как
где {ML} — активность химического соединения ML и т. д . K ⊖ безразмерен , поскольку деятельность безразмерна. В числителе стоят активности продуктов, в знаменателе – активности реагирующих веществ. См. коэффициент активности для получения этого выражения.
Поскольку активность является продуктом концентрации и коэффициента активности ( γ ), определение также можно записать как
где [ML] представляет собой концентрацию ML, а Γ представляет собой частное коэффициентов активности. Это выражение можно обобщить как

Во избежание осложнений при использовании активностей константы устойчивости определяют , где это возможно, в среде, состоящей из раствора фонового электролита при высокой ионной силе , т. е. в условиях, в которых Г можно считать всегда постоянной. [15] Например, среда может представлять собой раствор 0,1 моль дм. −3 нитрат натрия или 3 моль дм −3 перхлорат натрия . Когда Γ постоянна, ею можно пренебречь и получить общее теоретическое выражение, приведенное выше.
Все опубликованные значения констант стабильности относятся к конкретной ионной среде, использованной при их определении, и разные значения получены в разных условиях, как показано для комплекса CuL (L = глицинат ). Кроме того, значения константы стабильности зависят от конкретного используемого электролита, поскольку значение Γ различно для разных электролитов даже при одинаковой ионной силе . Не обязательно должно быть какое-либо химическое взаимодействие между частицами, находящимися в равновесии, и фоновым электролитом, но такие взаимодействия могут иметь место в определенных случаях. Например, фосфаты образуют слабые комплексы с щелочными металлами , поэтому при определении констант устойчивости с участием фосфатов, таких как АТФ , в качестве фонового электролита будет использоваться, например, соль тетралкиламмония . Другой пример касается железа (III), которое образует слабые комплексы с галогенидами и другими анионами, но не с перхлорат- ионами.
Когда опубликованные константы относятся к ионной силе, отличной от той, которая требуется для конкретного применения, они могут быть скорректированы с помощью теории конкретных ионов (SIT) и других теорий. [17]
Температурная зависимость
[ редактировать ]Все константы равновесия изменяются с температурой согласно уравнению Ван 'т-Гоффа. [18]
Альтернативно
R — газовая постоянная , а T — термодинамическая температура. Таким образом, для экзотермических реакций, в которых стандартное изменение энтальпии , Δ H ⊖ , отрицательно, K уменьшается с температурой, но для эндотермических реакций, где Δ H ⊖ положителен, K увеличивается с температурой.
Факторы, влияющие на константы устойчивости комплексов
[ редактировать ]Хелатный эффект
[ редактировать ]
Рассмотрим два равновесия в водном растворе между ионом меди (II) Cu 2+ и этилендиамин (эн) с одной стороны и метиламин , MeNH 2 с другой.
В первой реакции бидентатный лиганд этилендиамин образует хелатный комплекс с ионом меди. Хелатирование приводит к образованию пятичленного кольца. Во второй реакции бидентатный лиганд заменяется двумя монодентатными метиламиновыми лигандами примерно одинаковой донорной силы, а это означает, что энтальпия образования связей Cu–N примерно одинакова в обеих реакциях. В условиях равных концентраций меди и когда концентрация метиламина в два раза превышает концентрацию этилендиамина, концентрация бидентатного комплекса будет больше концентрации комплекса с двумя монодентатными лигандами. Эффект усиливается с увеличением количества хелатных колец, поэтому концентрация комплекса ЭДТА , имеющего шесть хелатных колец, значительно выше, чем соответствующего комплекса с двумя монодентатными лигандами-донорами азота и четырьмя монодентатными карбоксилатными лигандами. Таким образом, явление хелатного эффекта является твердо установленным эмпирическим фактом: в сравнимых условиях концентрация хелатного комплекса будет выше, чем концентрация аналогичного комплекса с монодентатными лигандами.
Термодинамический подход к объяснению хелатного эффекта учитывает константу равновесия реакции: чем больше константа равновесия, тем выше концентрация комплекса.
Когда аналитическая концентрация метиламина в два раза превышает концентрацию этилендиамина, а концентрация меди одинакова в обеих реакциях, концентрация [Cu(en)] 2+ значительно превышает концентрацию [Cu(MeNH 2 ) 2 ] 2+ потому что β 11 ≫ β 12 .
Разница между двумя константами устойчивости в основном связана с разницей в стандартном изменении энтропии Δ S ⊖ . В реакции с хелатирующим лигандом две частицы слева и одна справа, тогда как в уравнении с монодентатным лигандом слева три частицы и одна справа. Это означает, что при образовании хелатного комплекса теряется меньшая энтропия беспорядка , чем при образовании комплекса с монодентатными лигандами. Это один из факторов, способствующих разнице энтропии. Другие факторы включают изменения сольватации и образование колец. Некоторые экспериментальные данные, иллюстрирующие эффект, показаны в следующей таблице. [19]
Равновесие журнал β ΔΔG ⊖ /кДж моль −1 Δ Н ⊖ /кДж моль −1 − Т Δ С ⊖ /кДж моль −1 компакт-диск 2+ + 4 MeNH 2 ⇌ Cd(MeNH
2 ) 2+
46.55 −37.4 −57.3 19.9 компакт-диск 2+ + 2 и ⇌ компакт-диска(ов) 2+
210.62 −60.67 −56.48 −4.19

Эти данные показывают, что стандартные изменения энтальпии действительно примерно равны для двух реакций и что основная причина, по которой хелатный комплекс настолько более стабилен, заключается в том, что стандартный энтропийный член гораздо менее неблагоприятен, более того, в данном случае он даже благоприятен. В общем, трудно точно объяснить термодинамические величины с точки зрения изменений раствора на молекулярном уровне, но ясно, что хелатный эффект является преимущественно эффектом энтропии. Другие объяснения, в том числе объяснения Шварценбаха, [20] обсуждаются в Гринвуде и Эрншоу. [19]

Хелатный эффект усиливается по мере увеличения количества хелатных колец. Например, комплекс [Ni(dien) 2 )] 2+ более стабилен, чем комплекс [Ni(en) 3 )] 2+ ; оба комплекса октаэдрические с шестью атомами азота вокруг иона никеля, но диен ( диэтилентриамин , 1,4,7-триазагептан) представляет собой тридентатный лиганд, а ен - бидентатный. Число хелатных колец на единицу меньше числа донорных атомов в лиганде. ЭДТА (этилендиаминтетрацетиновая кислота) имеет шесть донорных атомов, поэтому образует очень прочные комплексы с пятью хелатными кольцами. Лиганды, такие как DTPA , имеющие восемь донорных атомов, используются для образования комплексов с большими ионами металлов, такими как ионы лантаноидов или актинидов , которые обычно образуют 8- или 9-координационные комплексы.Пятичленные и шестичленные хелатные кольца дают наиболее устойчивые комплексы. 4-членные кольца подвержены внутренним напряжениям из-за небольшого угла между связями в кольце. Хелатный эффект также снижается при использовании 7- и 8-членных колец, поскольку более крупные кольца менее жесткие, поэтому при их образовании теряется меньше энтропии.
Депротонирование алифатических групп –OH
[ редактировать ]

Отщепление протона от алифатической группы –ОН в водном растворе трудно осуществить, поскольку энергия, необходимая для этого процесса, достаточно велика. Таким образом, ионизация алифатических групп –ОН в водном растворе происходит лишь в особых случаях. Одно из таких обстоятельств обнаружено у соединений, содержащих субструктуру H 2 N–C–C–OH. Например, соединения, содержащие субструктуру 2-аминоэтанола, могут образовывать металл-хелатные комплексы с депротонированной формой H 2 N–C–C–O. − . Хелатный эффект обеспечивает дополнительную энергию, необходимую для разрыва связи O–H.
Важный пример происходит с молекулой трис . Эту молекулу следует использовать с осторожностью в качестве буферного агента , поскольку она образует хелатные комплексы с такими ионами, как Fe. 3+ и Cu 2+ .
Макроциклический эффект
[ редактировать ]Установлено, что стабильность комплекса меди(II) с макроциклическим лигандом цикламом (1,4,8,11-тетраазациклотетрадекан) оказалась значительно выше ожидаемой по сравнению со стабильностью комплекса с соответствующим амином с открытой цепью. . [21] Это явление было названо макроциклическим эффектом и интерпретировано также как энтропийный эффект. Однако более поздние исследования показали, что здесь задействованы как энтальпийные, так и энтропийные факторы. [22]
Важным различием между макроциклическими лигандами и лигандами с открытой цепью (хелатирующими) является то, что они обладают селективностью в отношении ионов металлов, основанной на размере полости, в которую ион металла внедряется при образовании комплекса. Например, краун-эфир 18-краун-6 образует гораздо более прочные комплексы с ионом калия K. + чем с меньшим ионом натрия Na + . [23]
В гемоглобине ион железа(II) образует комплекс с макроциклическим порфириновым кольцом. В статье «Гемоглобин» неверно указано, что оксигемоглогин содержит железо (III). Сейчас известно, что железо(II) в гемоглобине представляет собой низкоспиновый комплекс , тогда как в оксигемоглобине — высокоспиновый комплекс. Низкоспиновое Fe 2+ Ион плотно прилегает к полости порфиринового кольца, но высокоспиновое железо(II) имеет значительно больший размер и атом железа вытесняется из плоскости макроциклического лиганда. [24] Этому эффекту способствует способность гемоглобина обратимо связывать кислород в биологических условиях. В витамине B12 ион кобальта(II) удерживается в корриновом кольце . Хлорофилл представляет собой макроциклический комплекс магния(II).
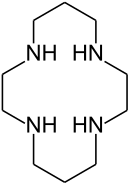 |  |
| Циклам | Порфин , простейший порфирин . |
 |
| Структуры обычных краун-эфиров : 12-краун-4 , 15-краун-5 , 18-краун-6 , дибензо-18-краун-6 и аза-краун-эфир. |
Геометрические факторы
[ редактировать ]Последовательные ступенчатые константы формирования K n в ряду типа ML n ( n = 1, 2, ...) обычно уменьшаются по мере увеличения n . Исключения из этого правила возникают, когда геометрия комплексов ML n не одинакова для всех членов ряда. Классическим примером является образование комплекса диамминсеребра(I) [Ag(NH 3 ) 2 ]. + в водном растворе.
В этом случае К 2 > К 1 . Причина этого в том, что в водном растворе ион, записанный как Ag + на самом деле существует в виде четырехкоординатной тетраэдрической формы воды [Ag(H 2 O) 4 ] + . Тогда первым шагом является реакция замещения, включающая замещение связанной молекулы воды аммиаком с образованием тетраэдрического комплекса [Ag(NH 3 )(H 2 O) 3 ] + . На втором этапе все аквалиганды теряются и образуется линейный двухкоординатный продукт [H 3 N–Ag–NH 3 ] + формируется. Исследование термодинамических данных [25] показывает, что разница в изменении энтропии вносит основной вклад в разницу в константах устойчивости двух реакций комплексообразования.
| равновесие | Δ Н ⊖ /кДж моль −1 | ΔΔS ⊖ /Дж К. −1 моль −1 |
|---|---|---|
| В + + NH 3 ⇌ [Ag(NH 3 )] + | −21.4 | 8.66 |
| [Ag(NH 3 )] + + NH 3 ⇌ [Ag(NH 3 ) 2 ] + | −35.2 | −61.26 |
Существуют и другие примеры изменения октаэдра на тетраэдр, как при образовании [CoCl 4 ] 2− из [Co(H 2 O) 6 ] 2+ .
Классификация ионов металлов
[ редактировать ]Арланд, Чатт и Дэвис предположили, что ионы металлов можно отнести к классу А, если они образуют более прочные комплексы с лигандами, донорными атомами которых являются азот , кислород или фтор, чем к лигандам, донорными атомами которых являются фосфор , сера или хлор, и к классу В, если наоборот. истинный. [26] Например, Ни 2+ образует с аминами более прочные комплексы, чем с фосфинами , но Pd 2+ образует более прочные комплексы с фосфинами, чем с аминами. Позднее Пирсон предложил теорию твердых и мягких кислот и оснований (теорию HSAB). [27] В этой классификации металлы класса А относятся к жестким кислотам, а металлы класса В — к мягким кислотам. Некоторые ионы, такие как медь(I), классифицируются как пограничные. Жесткие кислоты образуют более прочные комплексы с твердыми основаниями, чем с мягкими основаниями. В общих чертах, взаимодействия «жесткое-жесткое» имеют преимущественно электростатический характер, тогда как взаимодействия «мягкое-мягкое» имеют преимущественно ковалентную природу. Теория HSAB, хотя и полезна, но носит лишь полуколичественный характер. [28]
Твердость иона металла увеличивается со степенью окисления. Примером этого эффекта является тот факт, что Fe 2+ имеет тенденцию образовывать более прочные комплексы с N -донорными лигандами, чем с O -донорными лигандами, но для Fe верно обратное. 3+ .
Влияние ионного радиуса
[ редактировать ]Ряд Ирвинга-Вильямса относится к высокоспиновому октаэдрическому иону двухвалентного металла первой переходной серии. Он расставляет устойчивости комплексов в порядок
- Mn < Fe < Co < Ni < Cu > Zn
Было обнаружено, что этот порядок сохраняется для широкого спектра лигандов. [29] В объяснении сериала есть три направления.
- уменьшаться . Ожидается, что ионный радиус Mn будет регулярно 2+ к Зн 2+ . Это было бы нормальной периодической тенденцией и объясняло бы общее повышение стабильности.
- Энергия стабилизации кристаллического поля (CFSE) увеличивается от нуля для марганца(II) до максимума для никеля(II). Это делает комплексы все более устойчивыми. CFSE возвращается к нулю для цинка(II).
- Хотя CFSE для меди(II) меньше, чем для никеля(II), октаэдрические комплексы меди(II) подвержены эффекту Яна-Теллера , в результате чего комплекс приобретает дополнительную стабильность.
Другой пример влияния ионного радиуса - устойчивое увеличение устойчивости комплексов с данным лигандом по ряду трехвалентных ионов лантаноидов - эффект известного сжатия лантаноидов .
Приложения
[ редактировать ]Значения констант стабильности используются в самых разных приложениях. Хелатная терапия используется при лечении различных заболеваний, связанных с металлами, таких как перегрузка железом у больных β- талассемией , которым переливали кровь. Идеальный лиганд связывается с ионом целевого металла, а не с другими, но такой степени селективности достичь очень трудно. Синтетический препарат деферипрон достигает селективности за счет наличия двух донорных атомов кислорода, поэтому он связывается с Fe. 3+ предпочтение перед любыми другими двухвалентными ионами, присутствующими в организме человека, такими как Mg 2+ , Как 2+ и цинк 2+ . Лечение отравления ионами, такими как Pb 2+ и компакт-диск 2+ гораздо сложнее, поскольку оба эти иона являются двухвалентными и селективность обеспечить труднее. [30] Избыток меди при болезни Вильсона можно удалить пеницилламином или триэтилентетрамином (ТЭТА). DTPA одобрило Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США для лечения отравления плутонием .
DTPA также используется в качестве комплексообразователя гадолиния при МРТ при усилении контрастности . Требование в этом случае состоит в том, чтобы комплекс был очень сильным, так как Б-г 3+ очень токсичен. Большая константа стабильности октадентатного лиганда обеспечивает концентрацию свободного Gd 3+ практически незначителен и определенно значительно ниже порога токсичности. [31] Кроме того, лиганд занимает только 8 из 9 координационных мест иона гадолиния. Девятый участок занимает молекула воды, которая быстро обменивается с окружающей ее жидкостью, и именно этот механизм превращает парамагнитный комплекс в контрастный реагент.
ЭДТА образует настолько прочные комплексы с большинством двухвалентных катионов, что находит множество применений . Например, он часто присутствует в стиральном порошке и действует как смягчитель воды, связывая ионы кальция и магния.
Селективность макроциклических лигандов может быть использована в качестве основы для создания ионоселективного электрода . Например, доступны калийселективные электроды , в которых используется встречающийся в природе макроциклический антибиотик валиномицин .
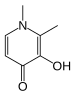 |  |  | |
| Деферипрон | пеницилламин | триэтилентетрамин , ТЭТА | Этилендиаминтетрауксусная кислота , ЭДТА |
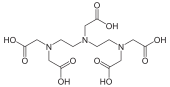 |  |  | |
| Диэтилентриаминпентауксусная кислота , DTPA | валиномицин | Три -н -бутилфосфат |
Ионообменная смола, такая как хелекс 100 , которая содержит хелатирующие лиганды, связанные с полимером , может использоваться в умягчителях воды и в хроматографического методах разделения. При экстракции растворителями образование электронейтральных комплексов позволяет экстрагировать катионы в органические растворители. Например 3 , при переработке ядерного топлива уран (VI) и плутоний (VI) экстрагируются в керосин в виде комплексов [МО 2 (ТБФ) 2 (NO ) 2 ] (ТБФ = три -н -бутилфосфат ). При межфазном катализе вещество, нерастворимое в органическом растворителе, можно сделать растворимым путем добавления подходящего лиганда. Например, окисления перманганата калия можно добиться, добавляя к водной реакционной смеси каталитическое количество краун-эфира и небольшое количество органического растворителя, так что реакция окисления происходит в органической фазе.
Во всех этих примерах лиганд выбирают исходя из констант устойчивости образующихся комплексов. Например, ТБФ используется при переработке ядерного топлива , поскольку (помимо других причин) он образует комплекс, достаточно прочный для экстракции растворителем, но достаточно слабый, чтобы этот комплекс мог быть разрушен азотной кислотой с выделением уранил- катиона в виде нитратокомплексов . например [UO 2 (NO 3 ) 4 ] 2− обратно в водную фазу.
Супрамолекулярные комплексы
[ редактировать ]Супрамолекулярные комплексы удерживаются вместе за счет водородных связей, гидрофобных сил, сил Ван-дер-Ваальса, π-π-взаимодействий и электростатических эффектов, которые можно описать как нековалентные связи . Приложения включают молекулярное распознавание , химию «гость-хозяин» и датчики анионов .
Типичное применение в молекулярном распознавании включало определение констант образования комплексов, образующихся между триподально замещенной молекулой мочевины и различными сахаридами . [32] Исследование проводилось с использованием неводного растворителя и измерений химического сдвига ЯМР . Целью было исследование селективности в отношении сахаридов.
Примером использования супрамолекулярных комплексов при разработке хемосенсоров является использование ансамблей переходных металлов для восприятия АТФ . [33]
Комплексообразование анионов может быть достигнуто путем инкапсулирования аниона в подходящую клетку. Селективность можно обеспечить путем разработки формы клетки. Например, дикарбоксилат-анионы могут быть инкапсулированы в эллипсоидальной полости в большую макроциклическую структуру, содержащую два иона металла. [34]
Экспериментальные методы
[ редактировать ]Метод, разработанный Бьеррумом, по-прежнему остается основным методом, используемым сегодня, хотя точность измерений значительно возросла. Чаще всего раствор, содержащий ион металла и лиганд в среде с высокой ионной силой , сначала подкисляют до такой степени, что лиганд полностью протонируется . Затем этот раствор титруют , часто с помощью автотитратора с компьютерным управлением, раствором основания, не содержащего CO 2 . Концентрацию или активность ионов водорода контролируют с помощью стеклянного электрода. Набор данных, используемый для расчета, состоит из трех компонентов: заявление, определяющее природу присутствующих химических веществ, называемое моделью системы, подробности, касающиеся концентраций реагентов, используемых при титровании, и, наконец, экспериментальные измерения в вид пар титр и рН (или ЭДС ).
другие ионоселективные электроды Могут использоваться (ИСЭ). Например, фторидный электрод может быть использован при определении устойчивости комплексов фторокомплексов иона металла.
Не всегда возможно использовать ISE. В этом случае титрование можно контролировать с помощью других типов измерений. Ультрафиолетово-видимая спектроскопия , флуоресцентная спектроскопия и ЯМР-спектроскопия являются наиболее часто используемыми альтернативами. Текущая практика заключается в проведении измерений поглощения или флуоресценции в диапазоне длин волн и одновременной обработке этих данных. Различные химические сдвиги ЯМР также можно соединить вместе.
протонирования лиганда, которые будут определены в отдельных экспериментах, значение log Kw Химическая модель будет включать значения констант и оценки неизвестных констант устойчивости образующихся комплексов. Эти оценки необходимы, поскольку в расчете используется нелинейный алгоритм наименьших квадратов. Оценки обычно получают по отношению к химически аналогичной системе. Базы данных констант устойчивости [8] [9] может быть очень полезным при поиске опубликованных значений констант стабильности для родственных комплексов.
В некоторых простых случаях расчеты можно выполнить в электронной таблице. [35] В противном случае расчеты выполняются с помощью универсальных компьютерных программ. Наиболее часто используемые программы:
- Потенциометрические и/или спектрофотометрические данные: PSEQUAD. [36]
- Потенциометрические данные: HYPERQUAD , [37] ЛУЧШИЙ, [38] ReactLab pH PRO
- Спектрофотометрические данные: HypSpec , SQUAD, [39] СПЕЦИФИТ, [40] [41] ReactLab РАВНОВЕСИЕ . [42]
- Данные ЯМР HypNMR , [43] WINEQNMR2. Архивировано 14 июля 2019 г. на Wayback Machine. [44]
В биохимии константы образования аддуктов можно получить с помощью измерений изотермической титровальной калориметрии (ИТК). Этот метод дает как константу устойчивости, так и стандартное изменение энтальпии для равновесия. [45] Из-за наличия программного обеспечения он в основном ограничивается комплексами стехиометрии 1:1.
Критически оцененные данные
[ редактировать ]Следующие ссылки предназначены для критических обзоров опубликованных констант стабильности для различных классов лигандов. Все эти обзоры публикуются ИЮПАК , а полный текст доступен бесплатно в формате pdf.
- этилендиамин (en) [46]
- Нитрилотриуксусная кислота (НТК) [47]
- аминополикарбоновые кислоты (комплексоны) [48]
- Альфа-гидроксикислоты и другие гидроксикарбоновые кислоты [49] [50]
- аминокислоты с полярными боковыми цепями [55]
- общий [58]
- Химическое образование экологически значимых тяжелых металлов с неорганическими лигандами. Часть 1: Ртуть 2+ –Cl − , ОЙ − , Колорадо 2−
3 , ТАК 2−
4 и ПО 3−
4 системы. [59] - Химическое образование экологически значимых металлов с неорганическими лигандами. Часть 2: Cu 2+ -ОЙ − , кл − , Колорадо 2−
3 , ТАК 2−
4 и ПО 3−
4 водные системы [60] - Химическое образование экологически значимых металлов с неорганическими лигандами. Часть 3: Pb 2+ -ОЙ − , кл − , Колорадо 2−
3 , ТАК 2−
4 и ПО 3−
4 системы [61] - Химическое образование экологически значимых металлов с неорганическими лигандами. Часть 4: Компакт-диск 2+ -ОЙ − , кл − , Колорадо 2−
3 , ТАК 2−
4 и ПО 3−
4 системы [62]
Базы данных
[ редактировать ]- База данных Ki — это общедоступная база данных опубликованных данных о сродстве связывания (Ki) лекарств и химических соединений с рецепторами, переносчиками нейромедиаторов, ионными каналами и ферментами.
- BindingDB — это общедоступная база данных измеренных аффинностей связывания, в которой основное внимание уделяется взаимодействиям белка, считающегося мишенью лекарства, с небольшими молекулами, подобными лекарству.
Ссылки
[ редактировать ]- ^ Бьеррум, Дж. (1941). Образование металламинов в водном растворе . Копенгаген: Хаазе.
- ^ Бек, Монтана; Надьпал, И. (1990). «Глава 1». Химия комплексных равновесий . Хорвуд. ISBN 0-85312-143-5 .
- ^ Россотти, FJC; Россотти, Х. (1961). Определение констант устойчивости . МакГроу-Хилл.
- ^ Дирссен, Д.; Ингри, Н.; Силлен, Л.Г. (1961). «Картирование ям - общий подход к компьютерному уточнению констант устойчивости» . Акта Хим. Скан . 15 : 694–696. doi : 10.3891/acta.chem.scand.15-0694 .
- ^ Ингри, Н.; Силлен, Л.Г. (1964). «Высокоскоростные компьютеры как дополнение к графическим методам, IV. Алгол-версия LETAGROP-VRID». Архив для Кеми . 23 : 97–121.
- ^ Сэйс, И.Г. (1968). «Компьютерные расчеты констант равновесия веществ, присутствующих в смесях ионов металлов и комплексообразователей». Таланта . 15 (12): 1397–1421. дои : 10.1016/0039-9140(68)80200-0 . ПМИД 18960446 .
- ^ Сабатини, А.; Вакка, А.; Ганс, П. (1974). «МИНИКВАД - Общая компьютерная программа для расчета констант устойчивости». Таланта . 21 (1): 53–77. дои : 10.1016/0039-9140(74)80063-9 . ПМИД 18961420 .
- ^ Jump up to: а б База данных IUPAC SC Полная база данных опубликованных данных по константам равновесия металлокомплексов и лигандов.
- ^ Jump up to: а б Стандартная справочная база данных NIST 46 Критически выбранные константы устойчивости металлокомплексов NIST: версия 8.0 (Поддержка этой базы данных прекращена.)
- ^ Пирсон, Р.Г. (1997). Химическая твердость: применение от молекул к твердым веществам . Спрингер-ВЧ. ISBN 3-527-29482-1 .
- ^ Драго, РС; Вонг, Н.; Билгриен, К.; Фогель, К. (1987). « Параметры E и C из констант заместителей Гаммета и использование E и C для понимания энергий связи кобальт-углерод». Неорг. Хим . 26 (1): 9–14. дои : 10.1021/ic00248a003 .
- ^ Гутманн, В. (1978). Донорно-акцепторный подход к молекулярным взаимодействиям . Спрингер. ISBN 0-306-31064-3 .
- ^ Россотти, FJC (1960). «Термодинамика образования комплексов ионов металлов в растворе». В Льюисе, Дж.; Р.Г., Уилкинс (ред.). Современная координационная химия . Нью-Йорк: Межнаучный.
- ^ Бек, Монтана; Надьпал, И. (1990). Химия комплексных равновесий . Хорвуд. ISBN 0-85312-143-5 . разделы 3.5.1.2, 6.6.1 и 6.6.2
- ^ Jump up to: а б Россотти, FJC; Россотти, Х. (1961). «Глава 2: Коэффициенты активности и концентрации». Определение констант устойчивости . МакГроу-Хилл.
- ^ Гергели, А.; Надьпал, И.; Э., Вольф (1974). «ЯМР-исследование процесса протонного обмена в водных растворах материнских комплексов медь(II)-аминокислота». Венгерский химический журнал . 80 : 545–549.
- ^ «Проект: поправки ионной силы для констант устойчивости» . ИЮПАК . Архивировано из оригинала 29 октября 2008 г. Проверено 23 ноября 2008 г.
- ^ Аткинс, П.В.; Де Паула, Дж. (2006). «Раздел 7.4: Реакция равновесия на температуру». Физическая химия . Издательство Оксфордского университета. ISBN 0-19-870072-5 .
- ^ Jump up to: а б Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 . п. 910
- ^ Шварценбах, Г. (1952). «Хелатный эффект» Хелв. Акта . 35 (7): 2344–2359. дои : 10.1002/hlca.19520350721 .
- ^ Кабина, ДК; Маргерум, Д.В. (1969). «Макроциклическое влияние на стабильность тетраминовых комплексов меди (II)». Дж. Ам. хим. Соц . 91 (23): 6540–6541. дои : 10.1021/ja01051a091 .
- ^ Линдой, Л.Ф. (1990). «Глава 6: Термодинамические соображения». Химия макроциклических лигандных комплексов . Издательство Кембриджского университета. ISBN 0-521-40985-3 .
- ^ Педерсен, CJ (1967). «Циклические полиэфиры и их комплексы с солями металлов». Дж. Ам. хим. Соц . 89 (26): 7017–7036. дои : 10.1021/ja01002a035 .
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 . п. 1100, рисунок 25.7
- ^ Ландин, М.; Хьюгус, ZZ (1992). «Колориметрическое исследование равновесия комплексообразования некоторых ионов металлов». Термохим. Акта . 196 (1): 93–103. дои : 10.1016/0040-6031(92)85009-К .
- ^ Арланд, С.; Чатт, Дж.; Дэвис, НР (1958). «Относительное сродство атомов лигандов к молекулам-акцепторам и ионам». Кварта. Преподобный . 12 (3): 265–276. дои : 10.1039/QR9581200265 .
- ^ Пирсон, Р.Г. (1963). «Твердые и мягкие кислоты и основания». Дж. Ам. хим. Соц . 85 (22): 3533–3539. дои : 10.1021/ja00905a001 .
- ^ Бек, Монтана; Надьпал, И. (1990). Химия комплексных равновесий . Хорвуд. п. 354. ИСБН 0-85312-143-5 .
- ^ Ирвинг, HMNH; Уильямс, RJP (1953). «Устойчивость комплексов переходных металлов». Дж. Хим. Соц. : 3192–3210. дои : 10.1039/JR9530003192 .
- ^ Арена, Г.; Контино, А.; Лонго, Э.; Скиотто, Д.; Спото, Г. (2001). «Селективное комплексообразование мягкого Pb 2+ и ртуть 2+ с помощью нового тиоамидного каликс[4]арена с аллильной функциональностью в 1,3-альтернативной конформации: исследование УФ-видимой и ЯМР H-1 спектроскопии». J. Chem. Soc., Perkin Trans . 2 (12): 2287–2291 .дои 10.1039 : /b107025h .
- ^ Рунге, В.М.; Скотт, С. (1998). Клиническая магнитно-резонансная томография с контрастированием . Университетское издательство Кентукки. ISBN 0-8131-1944-8 .
- ^ Вакка, А.; Нативи, К.; Каччарини, М.; Перголи, Р.; Роленс, С. (2004). «Новый триподальный рецептор для молекулярного распознавания моносахаридов. Парадигма оценки сродства и селективности связывания гликозидов с помощью 1 H ЯМР-спектроскопия». J. Am. Chem. Soc . 126 (50): 16456–16465. doi : 10.1021/ja045813s . PMID 15600348 .
- ^ Маркотт, Н.; Тальетти, А. (2003). «Хемосенсорные ансамбли на основе переходных металлов: детектирование АТФ в физиологических условиях». Супрамол. Хим . 15 (7): 617–717. дои : 10.1080/10610270310001605205 . S2CID 96018200 .
- ^ Бойокки, М.; Бониццони, М.; Фаббриззи, Л.; Пиовани, Г.; Тальетти, А. (2004). «Диметаллическая клетка с длинной эллипсоидной полостью для флуоресцентного обнаружения дикарбоксилат-анионов в воде». Энджью. хим. Межд. Эд . 43 (29): 3847–3852. дои : 10.1002/anie.200460036 . ПМИД 15258953 .
- ^ Билло, Э.Дж. (1997). «Глава 22» . Excel для химиков: подробное руководство (2-е изд.). Вайли-ВЧ. ISBN 0-471-18896-4 .
- ^ Зекани, Л.; Надьпал, И. (1985). «Глава 8: PSEQUAD: комплексная программа для оценки данных потенциометрического и / или спектрофотометрического равновесия с использованием аналитических производных». В Леггетте (ред.). Вычислительные методы определения констант образования . Пленум. ISBN 0-306-41957-2 .
- ^ Ганс, П.; Сабатини, А.; Вакка, А. (1996). «Исследование равновесий в растворах. Определение констант равновесия с помощью комплекса программ HYPERQUAD». Таланта . 43 (10): 1739–1753. дои : 10.1016/0039-9140(96)01958-3 . ПМИД 18966661 .
- ^ Мартелл, А.Е.; Мотекайтис, Р.Дж. (1992). Определение и использование констант устойчивости . Вайли-ВЧ.
- ^ Леггетт, Д. (1985). «Глава 6: SQUAD: Коэффициенты стабильности на основе данных об поглощении». В Леггетте (ред.). Вычислительные методы определения констант образования . Пленум. ISBN 0-306-41957-2 .
- ^ Гамп, М.; Медер, М.; Майер, CJ; Цубербюлер, AD (1985). «Расчет констант равновесия по данным многоволновой спектроскопии - I: Математические соображения». Таланта . 32 (2): 95–101. дои : 10.1016/0039-9140(85)80035-7 . ПМИД 18963802 .
- ^ Гамп, М.; Медер, М.; Майер, CJ; Цубербюлер, AD (1985). «Расчет констант равновесия по данным многоволновой спектроскопии - II1: Specfit: две удобные программы на базовом и стандартном Фортране 77». Таланта . 32 (4): 251–264. дои : 10.1016/0039-9140(85)80077-1 . ПМИД 18963840 .
- ^ Jplus Consulting Pty Ltd
- ^ Фрассинети, К.; Альдериги, Л.; Ганс, П.; Сабатини, А.; Вакка, А.; Гелли, С. (2003). «Определение констант протонирования некоторых фторированных полиаминов методом 13 Данные ЯМР С обработаны с помощью новой компьютерной программы HypNMR2000. Последовательность протонирования в полиаминах». Anal. Bioanal. Chem . 376 (7): 1041–1052. : 10.1007 /s00216-003-2020-0 . PMID 12845401. doi S2CID 14533024 .
- ^ Хайнс, MJ (1993). «EQNMR: компьютерная программа для расчета констант стабильности на основе данных о химическом сдвиге ядерного магнитного резонанса». Дж. Хим. Soc., Далтон Транс. (2): 311–312. дои : 10.1039/DT9930000311 .
- ^ О'Брайен, Р.; Ледбери, Дж. Э.; Чоудри, БЗ (2000). «Глава 10». В Хардинге, SE; Чоудри, Б.З. (ред.). Белково-лигандные взаимодействия: гидродинамика и калориметрия . Издательство Оксфордского университета. ISBN 0-19-963749-0 .
- ^ Паолетти, П. (1984). «Образование комплексов металлов с этилендиамином: критический обзор констант равновесия, значений энтальпии и энтропии» (PDF) . Чистое приложение. Хим . 56 (4): 491–522. дои : 10.1351/pac198456040491 . S2CID 5600085 .
- ^ Андерегг, Г. (1982). «Критический обзор констант устойчивости комплексов НТА» (PDF) . Чистое приложение. Хим . 54 (12): 2693–2758. дои : 10.1351/pac198254122693 . S2CID 44040841 .
- ^ Андерегг, Г; Арно-Нё, Ф.; Дельгадо, Р.; Фелкман, Дж.; Попов, К. (2003). «Критическая оценка констант стабильности металлокомплексов комплексонов для биомедицинских и экологических применений (Технический отчет IUPAC)» (PDF) . Чистое приложение. Хим . 77 (8): 1445–95. дои : 10.1351/pac200577081445 . S2CID 94957415 .
- ^ Лаюнен, LHJ; Портанова Р.; Пииспанен, Дж.; Толацци, М. (1997). «Критическая оценка констант стабильности комплексов альфа-гидроксикарбоновой кислоты с протонами и ионами металлов и сопутствующих изменений энтальпии. Часть I: Ароматические ортогидроксикарбоновые кислоты (технический отчет)» (PDF) . Чистое приложение. Хим . 69 (2): 329–382. дои : 10.1351/pac199769020329 . S2CID 100224661 .
- ^ Портанова Р.; Лаюнен, LHJ; Толацци, М.; Пииспанен, Дж. (2003). «Критическая оценка констант устойчивости комплексов альфа-гидроксикарбоновой кислоты с протонами и ионами металлов и сопутствующих изменений энтальпии. Часть II. Алифатические 2-гидроксикарбоновые кислоты (Технический отчет IUPAC)» (PDF) . Чистое приложение. Хим . 75 (4): 495–540. дои : 10.1351/pac200375040495 . S2CID 97662244 .
- ^ Арно-Нё, Ф.; Дельгадо, Р.; Чавес, С. (2003). «Критическая оценка констант стабильности и термодинамических функций металлокомплексов краун-эфиров (Технический отчет IUPAC)» (PDF) . Чистое приложение. Хим . 75 (1): 71–102. дои : 10.1351/pac200375010071 . S2CID 97549495 .
- ^ Попов, К.; Ренккёмяки, Х.; Лаюнен, LHJ (2001). «Критическая оценка констант стабильности фосфоновых кислот (Технический отчет IUPAC)» (PDF) . Чистое приложение. Хим . 73 (11): 1641–1677. дои : 10.1351/pac200173101641 . S2CID 98158286 .
- ^ Попов, К.; Ренккёмяки, Х.; Лаюнен, LHJ (2002). «Ошибки» (PDF) . Чистое приложение. Хим . 74 (11): 2227. doi : 10.1351/pac200274112227 . S2CID 195819226 .
- ^ Сьоберг, С. (1997). «Критическая оценка констант стабильности систем металл-имидазол и металл-гистамин (Технический отчет)» (PDF) . Чистое приложение. Хим . 69 (7): 1549–1570. дои : 10.1351/pac199769071549 . S2CID 98121760 .
- ^ Бертон, Г. (1995). «Критическая оценка констант устойчивости металлокомплексов аминокислот с полярными боковыми цепями (Технический отчет)» (PDF) . Чистое приложение. Хим . 67 (7): 1117–1240. дои : 10.1351/pac199567071117 . S2CID 95757342 .
- ^ Смит, Р.М.; Мартелл, А.Е.; Чен, Ю. (1991). «Критическая оценка констант стабильности нуклеотидных комплексов с протонами и ионами металлов и сопутствующих изменений энтальпии» (PDF) . Чистое приложение. Хим . 63 (7): 1015–1080. дои : 10.1351/pac199163071015 . S2CID 97422244 .
- ^ Старый, Дж.; Лильензин, Дж.О. (1982). «Критическая оценка констант равновесия с участием ацетилацетона и его хелатов металлов» (PDF) . Чистое приложение. Хим . 54 (12): 2557–2592. дои : 10.1351/pac198254122557 . S2CID 96848983 .
- ^ Бек, Монтана (1977). «Критическая оценка констант равновесия в растворе. Константы устойчивости металлокомплексов» (PDF) . Чистое приложение. Хим . 49 (1): 127–136. дои : 10.1351/pac197749010127 . S2CID 39693835 .
- ^ Пауэлл, Киптон, Дж.; Браун, Пол Л.; Бирн, Роберт Х.; Гайда, Тамаш; Хефтер, Гленн; Сьёберг, Стаффан; Ваннер, Ганс (2005). «Химическое образование экологически значимых тяжелых металлов с неорганическими лигандами. Часть 1: Hg 2+ –Cl − , ОЙ − , Колорадо 2−
3 , ТАК 2−
4 и ПО 3−
4 водных системы» (PDF) . Pure Appl. Chem . 77 (4): 739–800. doi : 10.1351/pac200577040739 . S2CID 93650787 .{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Пауэлл, Киптон Дж.; Браун, Пол Л.; Бирн, Роберт Х.; Гайда, Тамаш; Хефтер, Гленн; Сьёберг, Стаффан; Ваннер, Ганс (2007). «Химическое образование экологически значимых металлов с неорганическими лигандами. Часть 2: Cu 2+ -ОЙ − , кл − , Колорадо 2−
3 , ТАК 2−
4 и ПО 3−
4 системы» (PDF) . Pure Appl. Chem . 79 (5): 895–950. doi : 10.1351/pac200779050895 . S2CID 195819532 . - ^ Пауэлл, Киптон Дж.; Браун, Пол Л.; Бирн, Роберт Х.; Гайда, Тамаш; Хефтер, Гленн; Леуз, Анн-Катрин; Сьёберг, Стаффан; Ваннер, Ганс (2009). «Химическое образование экологически значимых металлов с неорганическими лигандами. Часть 3: Pb 2+ -ОЙ − , кл − , Колорадо 2−
3 , ТАК 2−
4 и ПО 3−
4 системы» (PDF) . Pure Appl. Chem . 81 (12): 2425–2476. doi : 10.1351/PAC-REP-09-03-05 . S2CID 93738375 . - ^ Пауэлл, Киптон Дж.; Браун, Пол Л.; Бирн, Роберт Х.; Гайда, Тамаш; Хефтер, Гленн; Леуз, Анн-Катрин; Сьёберг, Стаффан; Ваннер, Ганс (2011). «Химическое образование экологически значимых металлов с неорганическими лигандами. Часть 4: Cd 2+ -ОЙ − , кл − , Колорадо 2−
3 , ТАК 2−
4 и ПО 3−
4 системы» (PDF) . Pure Appl. Chem . 83 (5): 1163–1214. doi : 10.1351/PAC-REP-10-08-09 . S2CID 195819251 .
Дальнейшее чтение
[ редактировать ]Сигел, Роланд, нокаут; Скиландат, Мириам; Сигел, Астрид; Опершалл, Берт П.; Сигель, Хельмут (2013). «Глава 8. Комплексообразование кадмия с остатками сахаров , азотистыми основаниями , фосфатами , нуклеотидами и нуклеиновыми кислотами ». В Сигеле, Астрид; Сигель, Хельмут; Сигел, Роланд КО (ред.). Кадмий: от токсикологии к незаменимости (PDF) . Ионы металлов в науках о жизни. Том. 11. Спрингер. стр. 191–274. дои : 10.1007/978-94-007-5179-8_8 . ПМИД 23430775 .
Соваго, Имре; Варнадь, Каталин (2013). «Глава 9. Комплексы кадмия(II) аминокислот и пептидов». В Сигеле, Астрид; Сигель, Хельмут; Сигел, Роланд КО (ред.). Кадмий: от токсикологии к эссенциальности . Ионы металлов в науках о жизни. Том. 11. Спрингер. стр. 275–302. дои : 10.1007/978-94-007-5179-8_9 . ПМИД 23430776 .
Яцимирский Константин Борисович; Васильев, Владимир Павлович (1960). Константы неустойчивости сложных соединений . Перевод Паттерсона, DA OUP.
Внешние ссылки
[ редактировать ]- Веб-сайт констант стабильности : содержит информацию о компьютерных программах, приложениях, базах данных и оборудовании для экспериментального титрования.



![{\displaystyle \mathrm {[M(H_{2}O)} _{n}]+\mathrm {L} \leftrightharpoons \mathrm {[M(H_{2}O)} _{n-1}\mathrm {L} ]+\mathrm {H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/f6c90df793f368a962ab232a4d7445ea67cd553d)
![{\displaystyle \beta ^{'}={\frac {[\mathrm {M(H_{2}O)} _ {n-1}\mathrm {L} ][\mathrm {H_{2}O} ] }{[\mathrm {M(H_{2}O)} _{n}][\mathrm {L} ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cb903e0c6849446ba718798c09f77751851f266c)
![{\displaystyle \beta =\mathrm {\frac {[ML]}{[M][L]}} .}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f6dbc7aecca141447456d84685c3544a3abf8308)

![{\displaystyle \beta _{pq...}={\frac {[\mathrm {M} _{p}\mathrm {L} _{q}...]}{[\mathrm {M} ]^ {p}[\mathrm {L} ]^{q}...}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c9b5cb845f8efec1e7800490f0c4d0e5cd90a76e)

![{\displaystyle \beta _{1,2}=\mathrm {\frac {[ML_{2}]}{[M][L]^{2}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/cd0600d0b3496515a3e2b2ee1f26e7f6c0c7e0a6)

![{\displaystyle K_{1}=\mathrm {\frac {[ML]}{[M][L]}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/abf3c8b4381157f0280c84e2286d574f3bf7f0dc)

![{\displaystyle K_{2}=\mathrm {\frac {[ML_{2}]}{[ML][L]}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/7d69161b913579794614dbb05851b4cc739a3086)


![{\displaystyle K=\mathrm {\frac {[M(OH)]}{[M][OH]}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/33c23271b9152d2329b562befa69300b63a0124c)
![{\displaystyle K_{w}=\mathrm {[H]} ^{+}\mathrm {[OH]} ^{-}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8dab8030c3e55177ae21c52af1702d35a48e9004)
![{\displaystyle K={\frac {[\mathrm {M} (\mathrm {OH})]}{[\mathrm {M} ]K_ {\mathrm {w} }[\mathrm {H} ]^{- 1}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/15c00635c0c40ce1c98b65ad70c173b71abeedf3)
![{\displaystyle \beta _{1,-1}^{*}=KK_{\mathrm {w} }={\frac {[\mathrm {M} (\mathrm {OH})]}{[\mathrm { M} ][\mathrm {H} ]^{-1}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7fadb3fd4aca5c5dc7ac61db7e320417f3b128b3)



![{\displaystyle ,K=\mathrm {\frac {[AB]}{[A][B]}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/47949aaef3e5223551aade26d942897e76d70387)





![{\displaystyle K^{\ominus }=\mathrm {\frac {[ML]}{[M][L]}} \times {\frac {\gamma _ {\mathrm {ML} }}{\gamma _ {\mathrm {M} }\gamma _ {\mathrm {L} }}}=\mathrm {\frac {[ML]}{[M][L]}} \times \Gamma }](https://wikimedia.org/api/rest_v1/media/math/render/svg/73bd77587e27db8a47d8bf7dd244d05f84917022)
![{\displaystyle \beta _{pq...}^{\ominus }={\frac {[\mathrm {M} _{p}\mathrm {L} _{q}...]}{[\mathrm {M} ]^{p}[\mathrm {L} ]^{q}...}}\times \Gamma }](https://wikimedia.org/api/rest_v1/media/math/render/svg/07fcbbe22a4e6a23444c531c7ae018239b2f481d)


![{\displaystyle \mathrm {Cu^{2+}+en\rightleftharpoons [Cu(en)]^{2+}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/537a54fd90a52ed8cba49c5a78741e88fceedbda)
![{\displaystyle Cu^{2+}+2MeNH_{2}\rightleftharpoons [Cu(MeNH_{2})_{2}]^{2+}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6078135f5afd5f03b40d01435a5ea40e9d2dee1d)
![{\displaystyle \mathrm {[Cu(en)]=\beta _{11}[Cu][en]|} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/e626081c150da6b692dd1bb8e07bec7e42b436c5)
![{\displaystyle \mathrm {[Cu(MeNH_{2})_{2}]=\beta _{12}[Cu][MeNH_{2}]} ^{2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/547473860966f88d473b83875f9a68480bc65010)
![{\displaystyle \mathrm {Ag^{+}+NH_{3}\rightleftharpoons [Ag(NH_{3})]^{+};K_{1}={\frac {[Ag(NH_{3})] }{[Ag][NH_{3}]}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/0dde96e275d8d65b5467ef70aa8c99178407a943)
![{\displaystyle \mathrm {Ag(NH_{3})^{+}+NH_{3}\rightleftharpoons [Ag(NH_{3})_{2}]^{+};K_{2}={\frac {[Ag(NH_{3})_{2}]}{[Ag(NH_{3}][NH_{3}]}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/f461e352164a1f5a3ed55eb58b7b415c4b53e261)
