Ацетилацетон
| |||
| |||
| |||
| Имена | |||
|---|---|---|---|
| ИЮПАК имена
(3Z)-4-Гидрокси-3-пентен-2-он (енольная форма)
Пентан-2,4-дион (кето-форма) | |||
Другие имена
| |||
| Идентификаторы | |||
3D model ( JSmol )
|
|||
| 741937 | |||
| КЭБ | |||
| ХЭМБЛ | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.004.214 | ||
| Номер ЕС |
| ||
| 2537 | |||
| КЕГГ | |||
ПабХим CID
|
|||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ | |||
| Число | 2310 | ||
Панель управления CompTox ( EPA )
|
|||
| Характеристики | |||
| С 5 Н 8 О 2 | |||
| Молярная масса | 100.117 g·mol −1 | ||
| Появление | Бесцветная жидкость | ||
| Плотность | 0,975 г/мл [ 1 ] | ||
| Температура плавления | -23 ° C (-9 ° F; 250 К) | ||
| Точка кипения | 140 ° С (284 ° F; 413 К) | ||
| 16 г/(100 мл) | |||
| −54.88·10 −6 см 3 /моль | |||
| Опасности | |||
| СГС Маркировка : | |||
   
| |||
| Опасность | |||
| Х226 , Х302 , Х311 , Х320 , Х331 , Х335 , Х341 , Х370 , Х412 | |||
| P201 , P202 , P210 , P233 , P240 , P241 , P242 , P243 , P260 , P261 , P264 , P270 , P271 , P273 , P280 , P281 , P301+P312 , P302+P352 , P303+ П361+П353 , П304+П340 , P305+P351+P338 , P307+P311 , , P308+P313 P311 , P312 , P321 , P322 , P330 , P337 +P313 , P361 , P363 , P370+P378 , P403+P233 , P403+P235 , П405 , П501 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | 34 ° С (93 ° F; 307 К) | ||
| 340 ° С (644 ° F; 613 К) | |||
| Взрывоопасные пределы | 2.4–11.6% | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |||
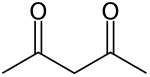
Ацетилацетон — органическое соединение с химической формулой СН 3 -С(=О)-СН 2 -С(=О)-СН 3 . Его классифицируют как 1,3- дикетон . Он существует в равновесии с таутомером СН 3 -С(=О)-СН=С(-ОН)-СН 3 . Смесь представляет собой бесцветную жидкость. Эти таутомеры в большинстве случаев взаимопревращаются так быстро, что в большинстве случаев их рассматривают как одно соединение. [ 2 ] Ацетилацетон является строительным блоком для синтеза многих координационных комплексов , а также гетероциклических соединений .
Характеристики
[ редактировать ]Таутомерия
[ редактировать ]| Растворитель | K keto→enol |
|---|---|
| Газовая фаза | 11.7 |
| Циклогексан | 42 |
| Толуол | 10 |
| ТГФ | 7.2 |
| CDCl 3 [ 3 ] | 5.7 |
| ДМСО | 2 |
| Вода | 0.23 |
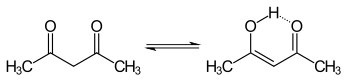
Кето- и енольные таутомеры ацетилацетона сосуществуют в растворе. Енольная форма имеет C2v симметрию , что означает, что атом водорода поровну разделен между двумя атомами кислорода. [ 4 ] В газовой фазе равновесия константа K кето→енол равна 11,7, что соответствует енольной форме. Две таутомерные формы можно различить с помощью ЯМР-спектроскопии , ИК-спектроскопии и других методов. [ 5 ] [ 6 ]
Константа равновесия имеет тенденцию быть высокой в неполярных растворителях; когда K кето→енол равен или больше 1, енольная форма является предпочтительной. Кето-форма становится более предпочтительной в полярных растворителях с водородными связями, таких как вода. [ 7 ] Енольная форма является винилологичным аналогом карбоновой кислоты . [ нужна ссылка ]
Кислотно-основные свойства
[ редактировать ]| Растворитель | Т/°С | п К а [ 8 ] |
|---|---|---|
| 40% этанол /вода | 30 | 9.8 |
| 70% диоксан /вода | 28 | 12.5 |
| 80% ДМСО /вода | 25 | 10.16 |
| ДМСО | 25 | 13.41 |
Ацетилацетон — слабая кислота . Образует ацетилацетонат- анион C 5 H 7 O - 2 (обычно сокращенно акак − ):
- С 5 ЧАС 8 О 2 ⇌ С 5 ЧАС 7 О - 2 + ЧАС +

В ацетилацетонат-анионе обе связи С - О эквивалентны. Обе центральные связи CC также эквивалентны: один атом водорода связан с центральным атомом углерода ( атомом C3 ). Эти две эквивалентности обусловлены тем, что существует резонанс между четырьмя связями в связи O-C2-C3-C4-O в ацетилацетонат-анионе, где порядок этих четырех связей составляет около 1,5. Оба атома кислорода в равной степени разделяют отрицательный заряд . Ацетилацетонат-анион является бидентатным лигандом .
ИЮПАК Рекомендуемые для значения pKa . этого равновесия в водном растворе при 25 °C составляют 8,99 ± 0,04 ( I = 0), 8,83 ± 0,02 ( I = 0,1 М) NaClO 4 ) и 9,00 ± 0,03 ( I = 1,0 М NaClO 4 ; I = ионная сила ). [ 9 ] Доступны значения для смешанных растворителей. Очень сильные основания , такие как литийорганические соединения, дважды депротонируют ацетилацетон. Полученные виды дилития затем можно алкилировать по атому углерода в положении 1 .
Подготовка
[ редактировать ]Ацетилацетон получают в промышленности термической перегруппировкой изопропенилацетата . [ 10 ]
Лабораторные пути получения ацетилацетона также начинаются с ацетона . Ацетон и уксусный ангидрид ( (CH 3 C(O)) 2 O ) при добавлении трифторида бора ( БФ 3 ) катализатор: [ 11 ]
- (CH 3 C(O)) 2 O + CH 3 C(O)CH 3 → CH 3 C(O)CH 2 C(O)CH 3
Второй синтез включает конденсацию, катализируемую основаниями (например, этоксидом натрия) . СН 3 СН 2 О − Уже + ) ацетона и этилацетата с последующим подкислением ацетилацетоната натрия (например, хлористым водородом HCl): [ 11 ]
- СН 3 СН 2 О − Уже + + CH 3 C(O)OCH 2 CH 3 + CH 3 C(O)CH 3 → Na + [CH 3 C(O)CHC(O − )СН 3 ] + 2 СН 3 СН 2 ОН
- Уже + [CH 3 C(O)CHC(O − )CH 3 ] + HCl → CH 3 C(O)CH 2 C(O)CH 3 + NaCl
Из-за простоты такого синтеза известно множество аналогов ацетилацетонатов. Некоторые примеры: бензоилацетон , дибензоилметан (dbaH). [ нужны разъяснения ] и трет- бутильный аналог 2,2,6,6-тетраметил-3,5-гептандион . Трифторацетилацетон и гексафторацетилацетонат также используются для образования летучих комплексов металлов .
Реакции
[ редактировать ]Конденсаты
[ редактировать ]Ацетилацетон является универсальным бифункциональным предшественником гетероциклов, поскольку обе кетогруппы могут подвергаться конденсации . Например, конденсация с гидразином дает пиразолы , а конденсация с мочевиной дает пиримидины . Конденсация с двумя арил- или алкиламинами дает NacNacs , в котором атомы кислорода в ацетилацетоне заменены на NR (R = арил, алкил).
Координационная химия
[ редактировать ]
Ацетилацетонат натрия Na(acac) является предшественником многих ацетилацетонатных комплексов . Общий метод синтеза заключается в обработке соли металла ацетилацетоном в присутствии основания : [ 12 ]
- MB z + z Hacac ⇌ M(acac) z + z BH
Оба атома кислорода связываются с металлом, образуя шестичленное хелатное кольцо. В некоторых случаях хелатный эффект настолько силен, что для образования комплекса не требуется добавление основания.
Биодеградация
[ редактировать ]Фермент ацетилацетондиоксигеназа расщепляет углерод-углеродную связь ацетилацетона с образованием ацетата и 2-оксопропаналя . Фермент является железо(II) -зависимым, но доказано, что он связывается с цинком также . Деградация ацетилацетона была охарактеризована у бактерии Acinetobacter johnsonii . [ 13 ]
- C 5 H 8 O 2 + O 2 → C 2 H 4 O 2 + C 3 H 4 O 2
Ссылки
[ редактировать ]- ^ «05581: Ацетилацетон» . Сигма-Олдрич .
- ^ Томас М. Харрис (2001). «2,4-Пентандион». Электронная энциклопедия реагентов для органического синтеза EROS . дои : 10.1002/047084289X.rp030 . ISBN 0471936235 .
- ^ Смит, Кайл Т.; Янг, Шерри С.; ДеБлазио, Джеймс В.; Хаманн, Кристиан С. (12 апреля 2016 г.). «Измерение структурного и электронного воздействия на кето-енольное равновесие в 1,3-дикарбонильных соединениях». Журнал химического образования . 93 (4): 790–794. doi : 10.1021/acs.jchemed.5b00170 .
- ^ Каминати, В.; Грабов, Ж.-Ю. (2006). «Структура C 2v енольного ацетилацетона». Журнал Американского химического общества . 128 (3): 854–857. дои : 10.1021/ja055333g . ПМИД 16417375 .
- ^ Манбек, Кимберли А.; Боаз, Николас К.; Баир, Натаниэль К.; Сандерс, Алликс М.С.; Марш, Андерсон Л. (2011). «Влияние заместителей на кето-енольное равновесие с использованием ЯМР-спектроскопии». Журнал химического образования . 88 (10): 1444–1445. Бибкод : 2011ЖЧЭд..88.1444М . дои : 10.1021/ed1010932 .
- ^ Ёсида, З.; Огоши, Х.; Токумицу, Т. (1970). «Внутримолекулярная водородная связь в енольной форме 3-замещенного-2,4-пентандиона». Тетраэдр . 26 (24): 5691–5697. дои : 10.1016/0040-4020(70)80005-9 .
- ^ Райхардт, Кристиан (2003). Растворители и эффекты растворителей в органической химии (3-е изд.). Вайли-ВЧ. ISBN 3-527-30618-8 .
- ^ База данных IUPAC SC. Архивировано 19 июня 2017 г. в Wayback Machine. Полная база данных опубликованных данных о константах равновесия металлокомплексов и лигандов.
- ^ Старый, Дж.; Лильензин, Дж.О. (1982). «Критическая оценка констант равновесия с участием ацетилацетона и его хелатов металлов» (PDF) . Чистая и прикладная химия . 54 (12): 2557–2592. дои : 10.1351/pac198254122557 . S2CID 96848983 .
- ^ Сигел, Хардо; Эггерсдорфер, Манфред (2002). «Кетоны». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a15_077 . ISBN 9783527306732 .
- ^ Jump up to: а б Денун, CE младший; Адкинс, Гомер; Рейни, Джеймс Л. (1940). «Ацетилацетон». Органические синтезы . 20 :6. дои : 10.15227/orgsyn.020.0006 .
- ^ О'Брайен, Брайан. «Раздаточный материал Co(tfa) 3 и Co(acac) 3 » (PDF) . Колледж Густава Адольфа.
- ^ Страганц, Джорджия; Глидер, А.; Брекер, Л.; Ленты, ДВ; Штайнер, В. (2003). «Фермент Dke1, расщепляющий ацетилацетон: новый фермент, расщепляющий связи C – C, из Acinetobacter johnsonii » . Биохимический журнал . 369 (3): 573–581. дои : 10.1042/BJ20021047 . ПМЦ 1223103 . ПМИД 12379146 .





