Пиразол
| |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК
1 H -пиразол [ 1 ] | |||
| Систематическое название ИЮПАК
1,2-Диазациклопента-2,4-диен | |||
| Другие имена
1,2-диазол
| |||
| Идентификаторы | |||
3D model ( JSmol )
|
|||
| 103775 | |||
| КЭБ | |||
| ХЭМБЛ | |||
| ХимическийПаук | |||
| Лекарственный Банк | |||
| Информационная карта ECHA | 100.005.471 | ||
| Номер ЕС |
| ||
| 1360 | |||
| КЕГГ | |||
ПабХим CID
|
|||
| НЕКОТОРЫЙ | |||
Панель управления CompTox ( EPA )
|
|||
| Характеристики | |||
| C3H4NC3H4N2 | |||
| Молярная масса | 68.079 g·mol −1 | ||
| Температура плавления | От 66 до 70 ° C (от 151 до 158 ° F; от 339 до 343 К) | ||
| Точка кипения | От 186 до 188 ° C (от 367 до 370 ° F; от 459 до 461 К) | ||
| Основность (p K b ) | 11.5 | ||
| Опасности | |||
| СГС Маркировка : [ 2 ] | |||
   
| |||
| Опасность | |||
| Х302 , Х311 , Х315 , Х318 , Х319 , Х335 , Х372 , Х412 | |||
| P260 , P261 , P262 , P264 , P264+P265 , P270 , P271 , P273 , P280 , P301+P317 , P302+P352 , P304+P340 , P305+P351+P338 , P305+P354+P338 , P316 , P317 , P319 , P321 , P330 , P332+P317 , P337+P317 , P361+P364 , P362+P364 , P403+P233 , P405 , P501 | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |||
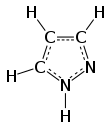
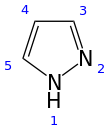
Пиразол представляет собой органическое соединение азольной группы с формулой C 3 H 3 N 2 H. Это гетероцикл, характеризующийся 5-членным кольцом из трех атомов углерода и двух соседних атомов азота, находящихся в орто-замещении . Пиразол является слабым основанием с p K b 11,5 (p K a сопряженной кислоты 2,49 при 25 ° C). [ 3 ] Пиразолы также представляют собой класс соединений, имеющих кольцо C 3 N 2 с соседними атомами азота. [ 4 ] Известными препаратами, содержащими пиразольное кольцо, являются целекоксиб (целебрекс) и анаболический стероид станозолол .
Препарат и реакции
[ редактировать ]Пиразолы синтезируют реакцией α,β-ненасыщенных альдегидов с гидразином и последующим дегидрированием : [ 5 ]
Замещенные пиразолы получают конденсацией 1,3- дикетонов с гидразином ( реакции типа Кнорра ). [ 6 ] Например, ацетилацетон и гидразин дают 3,5-диметилпиразол: [ 7 ]
- CH 3 C(O)CH 2 C(O)CH 3 + N 2 H 4 → (CH 3 ) 2 C 3 HN 2 H + 2 H 2 O
Можно получить самые разнообразные пиразолы: [ 6 ]
История
[ редактировать ]Термин пиразол был дан этому классу соединений немецким химиком Людвигом Кнорром в 1883 году. [ 8 ] По классическому методу, разработанному немецким химиком Гансом фон Пехманом в 1898 году, пиразол был синтезирован из ацетилена и диазометана . [ 9 ]
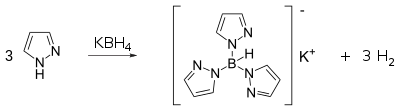
Превращение в скорпионов
[ редактировать ]Пиразолы реагируют с боргидридом калия с образованием класса лигандов, известных как скорпионаты . Сам пиразол реагирует с боргидридом калия при высоких температурах (~ 200 ° C) с образованием тридентатного лиганда, известного как Tp-лиганд :
3,5-Дифенил-1H - пиразол
[ редактировать ]3,5-Дифенил- 1H- пиразол получают при ( E )-1,3-дифенилпроп-2-ен-1-она взаимодействии с гидразингидратом в присутствии элементарной серы. [ 10 ] или персульфат натрия , [ 11 ] или с использованием гидразона, и в этом случае азин . в качестве побочного продукта образуется [ 12 ]
Возникновение и использование
[ редактировать ]
первый природный пиразол — 1-пиразолилаланин был выделен В 1959 году из семян арбузов . [ 13 ] [ 14 ]
В медицине широко используются производные пиразола. [ 15 ] включая целекоксиб и аналогичные ингибиторы ЦОГ-2 , залеплон , бетазол и CDPPB . [ 16 ] Пиразольное кольцо содержится в различных пестицидах, таких как фунгициды, инсектициды и гербициды. [ 15 ] включая фенпироксимат , фипронил , тебуфенпирад и толфенпирад . [ 17 ] Фрагменты пиразола включены в список широко используемых кольцевых систем для низкомолекулярных лекарств FDA США. [ 18 ]
3-(Дифторметил)-1-метил-1Н-пиразол-4-карбоновая кислота используется в производстве шести коммерческих фунгицидов, которые являются ингибиторами сукцинатдегидрогеназы . [ 19 ] [ 20 ]
См. также
[ редактировать ]- 3,5-диметилпиразол
- Пиразолидин , полностью насыщенный аналог
- имидазол , структурный аналог пиразола с двумя несмежными атомами азота.
- изоксазол , еще один аналог, атом азота в положении 1 заменен на кислород.
Ссылки
[ редактировать ]- ^ «Фронт материи». Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга) . Кембридж: Королевское химическое общество . 2014. с. 141. doi : 10.1039/9781849733069-FP001 (неактивен 12 апреля 2024 г.). ISBN 978-0-85404-182-4 .
{{cite book}}: CS1 maint: DOI неактивен по состоянию на апрель 2024 г. ( ссылка ) - ^ «Пиразол» . pubchem.ncbi.nlm.nih.gov . Проверено 17 февраля 2024 г.
- ^ «Константы диссоциации органических кислот и оснований» (PDF) . Архивировано (PDF) из оригинала 12 июля 2017 года.
- ^ Эйхер, Т.; Гауптманн, С. (2003). Химия гетероциклов: структура, реакции, синтез и применение (2-е изд.). Вайли-ВЧ. ISBN 3-527-30720-6 .
- ^ Шмидт, Андреас; Дрегер, Андрей (2011). «Последние достижения в химии пиразолов. Свойства, биологическая активность и синтез». Курс. Орг. хим. 15 (9): 1423–1463. дои : 10.2174/138527211795378263 .
- ^ Jump up to: а б Нозари, М., Аддисон, А., Ривз, Г.Т., Зеллер, М., Ясински, Дж.П., Каур, М., Гилберт, Дж.Г., Гамильтон, Ч.Р., Попович, Дж.М., Вольф, Л.М., Крист, Л.Е., Бастида, Н., (2018) Журнал гетероциклической химии 55, 6, 1291-1307. https://doi.org/10.1002/jhet.3155 .
- ^ Джонсон, Уильям С.; Хайет, Роберт Дж. (1963). «3,5-Диметилпиразол» . Органические синтезы ; Сборник томов , т. 4, с. 351 .
- ^ Норр, Л. (1883). «Действие этилацетоацетата на фенилгидразин. I» . Химические отчеты . 16 :2597-2599. дои : 10.1002/cber.188301602194 .
- ^ Пехманн, Ганс (1898). «Пиразол из ацетилена и диазометана» . Отчеты Немецкого химического общества (на немецком языке). 31 (3): 2950–2951. дои : 10.1002/cber.18980310363 .
- ^ Оутирите, Моха; Лебрини, Муним; Лагрене, Мишель; Бентисс, Фуад (2008). «Новый одностадийный синтез 3,5-дизамещенных пиразолов при микроволновом облучении и классическом нагревании». Журнал гетероциклической химии . 45 (2): 503–505. дои : 10.1002/jhet.5570450231 .
- ^ Чжан, Цзе; Тан, Я-Джун; Ван, Чунь-Шань; Ву, Хао-Хао (2014). «Однореакторный синтез 3,5-дифенил-1 H -пиразолов из халконов и гидразина при механохимическом измельчении в шарах». Гетероциклы . 89 (1): 103–112. doi : 10.3987/COM-13-12867 (неактивен 17 февраля 2024 г.).
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на февраль 2024 г. ( ссылка ) - ^ Ласри, Джамал; Исмаил, Али И. (2018). «Безметалловый и FeCl3 - катализируемый синтез азинов и 3,5-дифенил-1H - пиразола из гидразонов и/или кетонов под контролем ESI высокого разрешения. + -MS» . Индийский химический журнал, раздел B. 57B ( 3): 362–373.
- ^ Фауден; Что-нибудь; Верховая езда; Белый (1959). Учеб. хим. Соц. : 131.
{{cite journal}}: Отсутствует или пусто|title=( помощь ) - ^ Ноэ, ФФ; Фауден, Л.; Ричмонд, ПТ (1959). «Альфа-амино-бета-(пиразолил-N) пропионовая кислота: новая аминокислота из Citrullus vulgaris (арбуз)» . Природа . 184 (4688): 69–70. Бибкод : 1959Natur.184...69B . дои : 10.1038/184069a0 . ПМИД 13804343 . S2CID 37499048 .
- ^ Jump up to: а б Каби, Аруп К.; Шравани, Сатту; Гуджараппа, Рагурам; и др. (2022). «Обзор биологической активности производных пиразола». Наноструктурированные биоматериалы . Горизонты материалов: от природы к наноматериалам. стр. 229–306. дои : 10.1007/978-981-16-8399-2_7 . ISBN 978-981-16-8398-5 .
- ^ ФАРИЯ, Джессика Венансия; Веги, Персилен Фазолин; Мигита, Ана Габриэлла Карвалью; ДОС САНТОС, Маурисио Силва; Боечат, Нубия; Бернардино, Алиса Мария Ролим (1 ноября 2017 г.). «Недавняя биологическая активность соединений пиразола». Биоорганическая и медицинская химия . 25 (21): 5891–5903. дои : 10.1016/j.bmc.2017.09.035 . ISSN 0968-0896 . ПМИД 28988624 .
- ^ ФАО
- ^ Тейлор, РД; Маккосс, М.; Лоусон, ADG J Med Chem 2014, 57, 5845.
- ^ Уолтер, Харальд (2016). «Фунгицидные карбоксамиды, ингибирующие сукцинатдегидрогеназу». В Ламберте, Клеменс; Дингес, Юрген (ред.). Классы биоактивных карбоновых соединений: фармацевтика и агрохимия . Уайли. стр. 405–425. дои : 10.1002/9783527693931.ch31 . ISBN 9783527339471 .
- ^ Йешке, Питер (2021). «Современные тенденции в разработке фторсодержащих агрохимикатов». В Сабо, Кальман; Селандер, Никлас (ред.). Фторорганическая химия . Уайли. стр. 363–395. дои : 10.1002/9783527825158.ch11 . ISBN 9783527347117 . S2CID 234149806 .
Дальнейшее чтение
[ редактировать ]А. Шмидт; А. Дрегер (2011). «Последние достижения в химии пиразолов. Часть 2. Реакции и N-гетероциклические карбены пиразола». Курс. Орг. Хим . 15 (16): 2897–2970. дои : 10.2174/138527211796378497 .