Синтез пиррола Кнорра
| Синтез пиррола Кнорра | |
|---|---|
| Назван в честь | Людвиг Кнорр |
| Тип реакции | Реакция образования кольца |
| Идентификаторы | |
| RSC Идентификатор онтологии | RXNO: 0000497 |
Синтез пиррола Кнорра — широко используемая химическая реакция , в ходе которой синтезируются замещенные пирролы (3) . [1] [2] [3] Этот метод включает реакцию α аминокетона - карбонильной (1) и соединения, содержащего электроноакцепторную группу (например, сложного эфира, как показано) α с группой (2) . [4]

Метод
[ редактировать ]Для этого механизма в качестве катализаторов требуются цинк и уксусная кислота. Это будет происходить при комнатной температуре.Поскольку α-аминокетоны очень легко самоконденсируются, их необходимо получать in situ . Обычный способ сделать это - из соответствующего оксима посредством перегруппировки Небера . [5] [6]
В первоначальном синтезе Кнорра использовались два эквивалента этилацетоацетата , один из которых был превращен в этил-2-оксиминоацетоацетат путем растворения его в ледяной уксусной кислоте и медленного добавления одного эквивалента насыщенного водного нитрита натрия при внешнем охлаждении. цинковую Затем добавляли пыль, восстанавливая оксимную группу до амина. При этом восстановлении потребляются два эквивалента цинка и четыре эквивалента уксусной кислоты.
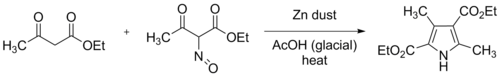
Современная практика заключается в постепенном добавлении раствора оксима, образующегося в результате нитрозирования, и цинковой пыли к хорошо перемешанному раствору этилацетоацетата в ледяной уксусной кислоте. Реакция экзотермическая , и смесь может достигать температуры кипения, если не применять внешнее охлаждение. Полученный продукт, диэтил-3,5-диметилпиррол-2,4-дикарбоксилат, с тех пор называют пирролом Кнорра . На схеме выше R 2 = COOEt и R 1 = R 3 = Me представляют эту исходную реакцию.
Пиррол Кнорра можно получить различными способами. Один эквивалент гидроксида натрия избирательно омылит 2-эфир. Растворение пиррола Кнорра в концентрированной серной кислоте и последующее выливание полученного раствора в воду приведет к селективному гидролизу 4-эфирной группы. 5-метильную группу можно по-разному окислить до хлорметильной, альдегидной или карбоновой кислоты с помощью стехиометрического сульфурилхлорида в ледяной уксусной кислоте. [7] Альтернативно атом азота может быть алкилирован. Два положения сложного эфира можно более плавно дифференцировать путем включения бензильных или трет -бутильных групп через соответствующие сложные эфиры ацетоацетата. Бензильные группы можно удалить каталитическим гидрогенолизом над палладием на угле , а третичные бутильные группы можно удалить обработкой трифторуксусной кислотой или кипячением водного раствора уксусной кислоты. R 1 и R 3 (а также R 2 и «Et») можно варьировать путем применения соответствующих β-кетоэфиров, которые легко получить путем синтеза из хлорангидридов , кислоты Мелдрама и спирта по выбору. Таким образом легко получаются этиловые и бензиловые эфиры, и реакция примечательна тем, что даже сильно затрудненный трет -бутиловый спирт дает в этом синтезе очень высокие выходы. [8]
Леви и Занетти расширили синтез Кнорра в 1894 году, включив в реакцию ацетилацетона (2,4-пентандиона) с этил-2-оксиминоацетоацетатом. В результате получился этил-4-ацетил-3,5-диметилпиррол-2-карбоксилат, где «OEt» = R 1 = R 3 = Me, а R 2 = COOEt. [9] 4-ацетильную группу можно легко превратить в 4-этильную группу восстановлением Вольфа-Кишнера (гидразин и щелочь, нагретые); гидрогенолиз или использование диборана . Бензил- или трет -бутилацетоацетаты также хорошо работают в этой системе, а при строгом контроле температуры трет -бутиловая система дает очень высокий выход (около 80%). [10] N , N -диалкилпиррол-2- и/или 4-карбоксамиды можно получить, используя N , N в синтезе -диалкилацетоацетамиды. С помощью этого метода были успешно получены даже тиоэфиры. [11] Что касается нитрозации β-кетоэфиров, несмотря на многочисленные литературные описания жесткого контроля температуры при нитрозировании, реакция ведет себя почти как титрование, и смеси можно позволить достичь даже 40 ° C без существенного влияния на конечный выход.
Механизм синтеза пиррола Кнорра начинается с конденсации амина и кетона с образованием имина. Затем имин таутомеризуется до енамина с последующей циклизацией, отщеплением воды и изомеризацией до пиррола.

Связанный синтез
[ редактировать ]Существует ряд важных синтезов пирролов, которые осуществляются по принципу синтеза Кнорра, несмотря на наличие механизмов совершенно разных связей между исходными материалами и пиррольным продуктом.
Ханс Фишер и Эмми Финк обнаружили, что синтез Занетти из 2,4-пентандиона и этил-2-оксиминоацетоацетата дал этил-3,5-диметилпиррол-2-карбоксилат в качестве следового побочного продукта. Аналогичным образом, диэтилацеталь 3-кетобутиральдегида привел к образованию этил-5-метилпиррол-2-карбоксилата. Оба этих продукта возникли в результате потери ацетильной группы предполагаемого промежуточного этил-2-аминоацетоацетата. Важным продуктом синтеза Фишера-Финка был этил-4,5-диметилпиррол-2-карбоксилат, полученный из этил-2-оксиминоацетоацетата и 2-метил-3-оксобутаналя, в свою очередь полученного конденсацией 2 Кляйзена -бутанона с этилформиатом. . [12]
Джордж Кляйнспен сообщил, что связь Фишера-Финка может возникнуть исключительно за счет использования диэтилоксиминомалоната в синтезе с 2,4-пентандионом или его 3-алкилзамещенными производными. Выход был высоким, около 60%, и этот синтез в конечном итоге стал одним из самых важных в реперториуме. [13] Выходы были значительно улучшены за счет использования предварительно полученного диэтиламиномалоната (полученного гидрогенолизом диэтилоксиминомалоната в этаноле над Pd/C) и добавления смеси диэтиламиномалоната и β-дикетона к активно кипящей ледяной уксусной кислоте. [14]
Тем временем Джонсон расширил синтез Фишера-Финка путем взаимодействия 2-оксиминоацетоацетатных эфиров (этилового, бензилового или трет-бутилового) с 3-алкилзамещенными 2,4-пентандионами. [15] Синтез Кляйнспена был расширен под руководством Дэвида Долфина за счет использования несимметричных β-дикетонов (таких как 3-алкилзамещенные 2,4-гександионы), которые первоначально вступали в реакцию преимущественно по менее затрудненной ацетильной группе и давали соответствующий 5-метилпиррол-2- карбоксилатные эфиры. Было также обнаружено, что N , N -диалкил-2-оксиминоацетоацетамиды образуют пирролы при взаимодействии в условиях Кнорра с 3-замещенными-2,4-пентандионами с выходами, сравнимыми с выходами соответствующих эфиров (около 45%). Однако при использовании несимметричных дикетонов было обнаружено, что ацетильная группа ацетоацетамида сохраняется в продукте, а одна из ацильных групп дикетона теряется. [16] Тот же самый механизм в незначительной степени встречается в системах эфиров ацетоацетата и ранее был обнаружен радиохимически Харбаком и Рапопортом . [17] Большинство описанных выше синтезов находят применение при синтезе порфиринов, желчных пигментов и дипирринов.
Ссылки
[ редактировать ]- ^ Кнорр, Людвиг (1884). «Синтез производных пиррола » (PDF) . Отчеты Немецкого химического общества (на немецком языке). 17 (2): 1635–1642. дои : 10.1002/cber.18840170220 .
- ^ Кнорр, Людвиг (1886). «Синтетические опыты с эфиром ацетоуксусной кислоты». Анналы химии (на немецком языке). 236 (3): 290–332. дои : 10.1002/jlac.18862360303 .
- ^ Норр, Л .; Ланге, Х. (1902). «Об образовании производных пиррола из изонитросокетонов» ( PDF) . Отчеты Немецкого химического общества (на немецком языке). 35 (3): 2998–3008. дои : 10.1002/cber.19020350392 .
- ^ Корвин, Алсоф Генри (1950). «Химия пиррола и его производных». В Элдерфилде, Роберт Кули (ред.). Гетероциклические соединения . Том. 1. Нью-Йорк: Уайли . стр. 287 и далее.
- ^ Фишер, Ганс (1935). «2,4-Диметил-3,5-дикарбетоксипиррол (2,4-пирроледикарбоновая кислота, 3,5-диметил-,диэтиловый эфир)» . Органические синтезы . 15 : 17. дои : 10.15227/orgsyn.015.0017 ; Сборник томов , т. 2, с. 202 .
- ^ Фишер, Ганс (1941). «Криптопиррол (Пиррол, 2,4-диметил-3-этил)» . Органические синтезы . 21 : 67. дои : 10.15227/orgsyn.021.0067 ; Сборник томов , т. 3, с. 513 .
- ^ Корвин, Алсоф Х.; Бейли, Уильям А.; Виол, Пауль (1942). «Структурные исследования замещенного дипиррилметана. Необычная связь между температурой плавления и симметрией». Журнал Американского химического общества . 64 (6): 1267–1273. дои : 10.1021/ja01258a007 .
- ^ Оикава, Юдзи; Сугано, Киёси; Ёнемицу, Осаму (1978). «Кислота Мелдрама в органическом синтезе. 2. Общий и универсальный синтез β-кетоэфиров». Журнал органической химии . 43 (10): 2087–2088. дои : 10.1021/jo00404a066 .
- ^ Дзанетти, CU; Леви, Э. (1894). «Синтез пиррольных соединений из нитросокетонов» . La Gazzetta Chimica Italiana (на итальянском языке). 24 (1): 546–554.
- ^ Трейбс, Альфред ; Хинтермайер, Карл (1954). « трет -бутиловые эфиры пирролкарбоновых кислот». Химические отчеты (на немецком языке). 87 (8): 1167–1174. дои : 10.1002/cber.19540870818 .
- ^ Буллок, Э.; Чен, ТС; Погрузчик, CE (1966). «Получение и реакции некоторых эфиров пиррилтиола» . Канадский химический журнал . 44 (9): 1007–1111. дои : 10.1139/v66-149 .
- ^ Фишер, Ганс ; Финк, Эмми (1948). «О новом синтезе пирролов». Журнал физиологической химии (на немецком языке). 283 (3–4): 152–161. дои : 10.1515/bchm2.1948.283.3-4.152 .
- ^ Кляйнспен, Джордж Г. (1955). «Новый путь к некоторым эфирам 2-пирролкарбоновых кислот и нитрилам». Журнал Американского химического общества . 77 (6): 1546–1548. дои : 10.1021/ja01611a043 .
- ^ Пейн, Джон Б.; Дельфин, Дэвид (1985). «Химия пиррола. Улучшенный синтез эфиров этилпиррол-2-карбоксилата из диэтиламиномалоната». Журнал органической химии . 50 (26): 5598–5604. дои : 10.1021/jo00350a033 .
- ^ Буллок, Э.; Джонсон, AW; Маркхэм, Э.; Шоу, КБ (1958). «287. Синтез копропорфирина III». Журнал Химического общества (возобновленный) : 1430–1440. дои : 10.1039/JR9580001430 .
- ^ Пейн, Джон Б.; Бро, Джонатан Р.; Буллер, Кэти К.; Эриксон, Эрика Э.; Дельфин, Д. (1987). «Механизм образования N , N -диалкил-2-пирролкарбоксамидов из 1,3-дикетонов и N , N -диалкилоксиминоацетоацетамидов». Журнал органической химии . 52 (18): 3993–3997. дои : 10.1021/jo00227a010 .
- ^ Рапопорт, Генри ; Харбукт, Джон В. (1971). «Механизм модифицированной пиррольной конденсации Кнорра». Журнал органической химии . 36 (6): 853–855. дои : 10.1021/jo00805a030 .