Сульфурилхлорид
 | |
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Сульфурилхлорид | |
| Другие имена Сульфонилхлорид Хлорид серы Диоксид серы диоксид | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЭБИ | |
| ЧЕМБЛ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.029.314 |
| Номер ЕС |
|
| 2256 | |
ПабХим CID | |
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
| Число | 1834 |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| ТАК 2 Cl 2 | |
| Молярная масса | 134.9698 g mol −1 |
| Появление | Бесцветная жидкость с резким запахом. Желтые при стоянии. |
| Плотность | 1,67 г см −3 (20 °С) |
| Температура плавления | -54,1 ° C (-65,4 ° F; 219,1 К) |
| Точка кипения | 69,4 ° С (156,9 ° F; 342,5 К) |
| гидролизует | |
| Растворимость | смешивается с бензолом , толуолом , хлороформом , CCl 4 , ледяной уксусной кислотой. |
Показатель преломления ( n D ) | 1,4437 (20 °С) [1] |
| Опасности | |
| СГС Маркировка : | |
  | |
| Опасность | |
| Х314 , Х335 | |
| P260 , P261 , P264 , P271 , P280 , P301+P330+P331 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P310 , P312 , P321 , P363 , P403+P233 , П405 , П501 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Не воспламеняющийся |
| Родственные соединения | |
Родственные сульфурилгалогениды | Сульфурил фторид |
Родственные соединения | Тионилхлорид Хлоросульфоновая кислота Серная кислота |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Сульфурилхлорид представляет собой неорганическое соединение формулы SO 2 Cl 2 . При комнатной температуре представляет собой бесцветную жидкость с резким запахом. Сульфурилхлорид не встречается в природе, о чем можно судить по его быстрому гидролизу .
Сульфурилхлорид обычно путают тионилхлоридом SOCl2 с . Свойства этих двух оксихлоридов серы совершенно различны: сульфурилхлорид является источником хлора, тогда как тионилхлорид является источником хлорид- ионов. Альтернативное название ИЮПАК — сульфурилдихлорид .
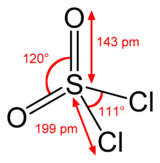
Структура
[ редактировать ]Сера тетраэдрическая в SO 2 Cl 2 и степень окисления атома серы +6, как и в серной кислоте .
Синтез
[ редактировать ]SO 2 Cl 2 получают реакцией диоксида серы и хлора в присутствии катализатора , например активированного угля . [2]
- SO 2 + Cl 2 → SO 2 Cl 2
Продукт можно очистить фракционной перегонкой .
Устаревшие маршруты
[ редактировать ]Сульфурилхлорид был впервые получен в 1838 году французским химиком Анри Виктором Реньо . [3]
Устаревшие пути включают окисление тионилхлорида:
- SOCl 2 + HgO → ClSSCl + HgCl 2 + SO 2 Cl 2
- 2 SOCl 2 + MnO 2 → SO 2 + MnCl 2 + SO 2 Cl 2
Реакции
[ редактировать ]Сульфурилхлорид реагирует с водой с выделением газообразного хлороводорода и серной кислоты :
- 2 H 2 O + SO 2 Cl 2 → 2 HCl + H 2 SO 4
Для сульфурилхлорида это происходит при комнатной температуре, но родственный сульфурилфторид не гидролизуется при температуре до 150 °С.
SO 2 Cl 2 также разлагается при нагревании до 100 °C или выше, что примерно на 30 °C выше точки кипения.
При стоянии SO 2 Cl 2 разлагается на диоксид серы и хлор , что придает более старым образцам слегка желтоватый цвет. [2]
SO 2 Cl 2 может использоваться в качестве источника хлора при хлорировании алканов, инициируемом химическими веществами (обычно перекисью) или светом: [4]
- CH 4 + SO 2 Cl 2 → CH 3 Cl + SO 2 + HCl
Использование
[ редактировать ]В качестве источника Cl 2 используется сульфурилхлорид . Поскольку это текучая жидкость, ее считается более удобным, чем Cl 2 дозирование . Он используется в качестве реагента при превращении CH в C-Cl рядом с активирующими заместителями, такими как карбонилы и сульфоксиды. Он также хлорирует алканы , алкены , алкины , ароматические соединения , простые эфиры (такие как тетрагидрофуран ) и эпоксиды . Такие реакции происходят в свободнорадикальных условиях с использованием такого инициатора, как AIBN . Его также можно использовать для преобразования тиолов или дисульфидов в соответствующие им сульфенилхлориды , хотя сульфинилхлориды образуются из тиолов. в некоторых случаях [5] SO 2 Cl 2 также может превращать спирты в алкилхлориды . В промышленности сульфурилхлорид чаще всего используется при производстве пестицидов. Пентахлорид фосфора получают взаимодействием белого фосфора с сульфурилхлоридом.
Сульфурилхлорид также можно использовать для обработки шерсти, чтобы предотвратить ее усадку.
Меры предосторожности
[ редактировать ]Сульфурилхлорид токсичен, едок и действует как слезоточивое вещество . Он выделяет хлористый водород при контакте с водой, а также донорными растворителями, такими как диметилсульфоксид и диметилформамид .
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Патнаик, П. (2002). Справочник неорганических химикатов . МакГроу-Хилл. ISBN 978-0-07-049439-8 . [ нужна страница ]
- ^ Jump up to: а б Ф. Фехер (1963). «Сульфурилхлорид». В Г. Брауэре (ред.). Справочник по препаративной неорганической химии, 2-е изд . Том. 1. Нью-Йорк, Нью-Йорк: Академик Пресс. стр. 382–384.
- ^ Реньо, Виктор (1838). «О хлорсерной кислоте и сульфонамиде» [О сульфурилхлориде и сульфонамиде]. Анналы химии и физики . Серия 2 (на французском языке). 69 : 170–184.
- Перепечатано как: Реньо, Виктор (1839). «О сульфурилхлориде и сульфамиде» . Журнал практической химии (на немецком языке). 18 :93-104. дои : 10.1002/prac.18390180104 .
- ^ Робертс Джей Ди, Касерио MC. «Практическое галогенирование и проблемы селективности» . Основные принципы органической химии .
- ^ Страница, печатная плата; Уилкс, Р.Д.; Рейнольдс, Д. (1995). «Алкилхалькогениды: функциональные группы на основе серы» . В Лей, Стивен В. (ред.). Синтез: углерод с одним гетероатомом, связанным одинарной связью . Комплексные преобразования органических функциональных групп. Эльзевир . стр. 113–276 . ISBN 9780080423234 .
- «Сульфурилхлорид, номер CAS: 7791-25-5» (PDF) . ОЭСР МОСТРАГ . Публикации ЮНЕП. 2004. Архивировано из оригинала (PDF) 28 февраля 2007 г.
- Мейнард, Джорджия (2001). «Сульфурилхлорид» . Энциклопедия реагентов для органического синтеза . Джон Уайли и сыновья. дои : 10.1002/047084289X.rs140 . ISBN 978-0471936237 .
Дальнейшее чтение
[ редактировать ]- Лаутенс, М.; Бушен, Г. (2002). «[4+3]Циклоприсоединение в воде. Синтез 2,4- эндо , эндо -диметил-8-оксабицикло[3.2.1]окт-6-ен-3-она». Органические синтезы . 79 : 251. дои : 10.15227/orgsyn.079.0251 .
- Макки, Р.Х.; Саллс, CM (1924). «Сульфурилхлорид». Промышленная и инженерная химия . 16 (4): 351–353. дои : 10.1021/ie50172a008 .
- Мусса, В.Н. (2012). «Сульфурилхлорид: универсальная альтернатива хлору». Австралийский химический журнал . 65 (1): 95–96. дои : 10.1071/CH11367 .
- Норт, HB (1910). «Действие тионил- и сульфурилхлоридов на ртуть и оксид ртути» . Журнал Американского химического общества . 32 (2): 184–187. дои : 10.1021/ja01920a004 .
- Север, HB; Хагеман, АГ (1913). «Некоторые новые реакции с тионилхлоридом». Журнал Американского химического общества . 35 (5): 543–546. дои : 10.1021/ja02194a004 .
