Литийорганический реагент
В металлоорганической химии литийорганические реагенты — химические соединения , содержащие углерод — литий (C—Li) связи . Эти реагенты важны в органическом синтезе и часто используются для переноса органической группы или атома лития на субстраты на стадиях синтеза посредством нуклеофильного присоединения или простого депротонирования . [1] Литийорганические реагенты применяются в промышленности в качестве инициатора анионной полимеризации , приводящей к производству различных эластомеров . Они также нашли применение в асимметричном синтезе в фармацевтической промышленности. [2] Из-за большой разницы в электроотрицательности между атомом углерода и атомом лития связь C-Li является высокоионной . Благодаря полярной природе связи C-Li литийорганические реагенты являются хорошими нуклеофилами и сильными основаниями. Для лабораторного органического синтеза многие литийорганические реагенты коммерчески доступны в виде растворов. Эти реагенты высокореактивны, а иногда и пирофорны .


История и развитие
[ редактировать ]Исследования литийорганических реагентов начались в 1930-х годах и были впервые осуществлены Карлом Циглером , Георгом Виттигом и Генри Гилманом . По сравнению с реагентами Гриньяра (магний) , литийорганические реагенты часто могут проводить те же реакции с повышенной скоростью и более высокими выходами, например, в случае металлирования . [3] С тех пор литийорганические реагенты в обиходе обогнали реактивы Гриньяра. [4]
Структура
[ редактировать ]Хотя простые формы алкиллития часто представлены в виде мономера RLi, они существуют в виде агрегатов ( олигомеров ) или полимеров. [5] Степень агрегации зависит от органического заместителя и присутствия других лигандов. [6] [7] Эти структуры были выяснены различными методами, в частности 6 Что, 7 Ли и 13 1С Спектроскопия ЯМР и рентгеноструктурный анализ. [1] Вычислительная химия поддерживает эти задания. [5]
Природа связи углерод-литий
[ редактировать ]
Относительная электроотрицательность углерода и лития предполагает, что связь C-Li будет высокополярной. [8] [9] [10] Однако некоторые литийорганические соединения обладают такими свойствами, как растворимость в неполярных растворителях, которые усложняют проблему. [8] Хотя большинство данных показывают, что связь C-Li по существу ионная, ведутся споры о том, насколько в ней существует ковалентный характер. [9] [10] По одной из оценок, процент ионного характера соединений алкиллития составляет от 80 до 88%. [11]
В соединениях аллиллия катион лития координируется с поверхностью π-связи углерода в η 3 вместо локализованного карбанионного центра, таким образом, аллиллитий часто менее агрегирован, чем алкиллитий. [6] [12] В комплексах ариллития катион лития координируется с одним карбанионным центром посредством связи σ-типа Li–C. [6] [13]
Твердотельная структура
[ редактировать ]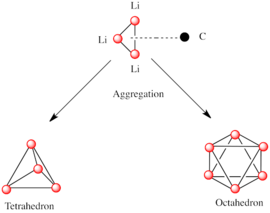
Как и другие виды, состоящие из полярных субъединиц, литийорганические виды агрегируют. [7] [14] На образование агрегатов влияют электростатические взаимодействия, координация между литием и окружающими молекулами растворителя или полярными добавками, а также стерические эффекты. [7]
Основным строительным блоком для построения более сложных структур является карбанионный центр, взаимодействующий с треугольником Li 3 в η 3 - мода. [5] В простых алкиллитиевых реагентах эти треугольники объединяются с образованием тетраэдрических или октаэдрических структур. Например, метиллитий , этиллитий и трет -бутиллитий существуют в тетрамере [RLi] 4 . Метиллитий существует в виде тетрамеров в кластере кубанового типа в твердом состоянии, с четырьмя литиевыми центрами, образующими тетраэдр. Каждый метанид в тетрамере в метиллитии может вступать в агостическое взаимодействие с катионами лития в соседних тетрамерах. [5] [7] С другой стороны, этиллитий и трет -бутиллитий не проявляют такого взаимодействия и, таким образом, растворимы в неполярных углеводородных растворителях. Другой класс алкиллития имеет гексамерные структуры, такие как н -бутиллитий , изопропиллитий и циклогексаниллитий. [5]
Обычные амиды лития, например бис(триметилсилил)амид лития и диизопропиламид лития , также подвержены агрегации. [15] Амиды лития принимают структуры типа полимерной лестницы в некоординационном растворителе в твердом состоянии и обычно существуют в виде димеров в эфирных растворителях. В присутствии сильнодонорных лигандов образуются три- или тетрамерные литиевые центры. [16] Например, ЛДА существует в основном в виде димеров в ТГФ. [15] Структуры обычных амидов лития, таких как диизопропиламид лития (LDA) и гексаметилдисилазид лития (LiHMDS), были тщательно изучены Коллумом и его коллегами с использованием ЯМР-спектроскопии . [17] Другой важный класс реагентов — силиллитии, широко используемые в синтезе металлоорганических комплексов и полисилановых дендримеров . [7] [18] В твердом состоянии, в отличие от алкиллитиевых реагентов, большинство силиллитий имеют тенденцию образовывать мономерные структуры, координированные с молекулами растворителя, такими как ТГФ, и лишь несколько силиллитий были охарактеризованы как высшие агрегаты. [7] Это различие может быть связано со способом получения силиллития, стерическими затруднениями, вызванными объемными алкильными заместителями на кремнии, а также менее поляризованной природой связей Si-Li. Добавление сильнодонорных лигандов, таких как TMEDA и (-)- спартеин , может вытеснять координирующие молекулы растворителя в силиллитии. [7]
Структура решения
[ редактировать ]Литийорганические реагенты могут иметь в растворе структуры, отличные от твердого состояния. [6] [19] ЯМР-спектроскопия стала мощным инструментом исследования литийорганических агрегатов в растворах. Для разновидностей алкиллития сочетание C-Li J часто можно использовать для определения количества лития, взаимодействующего с карбанионным центром, а также того, являются ли эти взаимодействия статическими или динамическими. [6] Отдельные сигналы ЯМР также могут отличать наличие нескольких агрегатов от общей мономерной единицы. [20]
Литийорганические соединения связывают основания Льюиса, такие как тетрагидрофуран (THF), диэтиловый эфир (Et 2 O), тетраметилэтилендиамин (TMEDA) или гексаметилфосфорамид (HMPA). [5] Метиллитий представляет собой особый случай: на его тетрамерную структуру не влияет эфир или даже HMPA. [7] С другой стороны, ТГФ деагрегирует гексамерный бутиллитий: тетрамер является основной разновидностью, а ΔG для взаимного превращения тетрамера и димера составляет около 11 ккал/моль. [21] TMEDA также может хелатировать катионы лития в н -бутиллитии и образовывать сольватированные димеры, такие как [(TMEDA) LiBu-n)] 2 . [5] [6] Было показано, что фениллитий существует в виде искаженного тетрамера в кристаллизованном эфирном сольвате и в виде смеси димера и тетрамера в эфирном растворе. [6]
| Алкильная группа | Растворитель | Структура |
|---|---|---|
| метил | ТГФ | тетрамер |
| эфир/ГМПА | тетрамер | |
| н- бутил | пентан | гексамер |
| эфир | тетрамер | |
| ТГФ | тетрамер-димер | |
| втор- бутил | пентан | гексамер-тетрамер |
| изопропил | пентан | гексамер-тетрамер |
| трет- бутил | пентан | тетрамер |
| ТГФ | мономер | |
| фенил | эфир | тетрамер-димер |
| эфир/ГМПА | димер |
Структура и реакционная способность
[ редактировать ]Поскольку структура литийорганических реагентов меняется в зависимости от их химического окружения, изменяются также их реакционная способность и селективность. [7] [22] Один из вопросов, касающихся взаимосвязи структура-реакционная способность, заключается в том, существует ли корреляция между степенью агрегации и реакционной способностью литийорганических реагентов. Первоначально предполагалось, что низшие агрегаты, такие как мономеры, более реакционноспособны по отношению к алкиллитию. [23] Однако также были обнаружены пути реакции, в которых реакционноспособными частицами являются димеры или другие олигомеры. [24] а для амидов лития, таких как LDA, обычными являются реакции на основе димеров. [25] Серия исследований кинетики растворения реакций, опосредованных LDA, показывает, что более низкие агрегаты енолятов не обязательно приводят к более высокой реакционной способности. [17]
Кроме того, некоторые основания Льюиса повышают реакционную способность литийорганических соединений. [26] [27] Однако не всегда ясно, действуют ли эти добавки как сильные хелатирующие лиганды и как наблюдаемое увеличение реакционной способности связано со структурными изменениями агрегатов, вызванными этими добавками. [26] [27] Например, TMEDA увеличивает скорость и эффективность многих реакций с участием литийорганических реагентов. [7] По отношению к алкиллитиевым реагентам ТМЕДА действует как донорный лиганд, снижает степень агрегации, [5] и увеличивает нуклеофильность этих видов. [28] Однако ТМЕДА не всегда действует как донорный лиганд катиона лития, особенно в присутствии анионных кислородных и азотных центров. Например, он лишь слабо взаимодействует с ЛДА и LiHMDS даже в углеводородных растворителях без конкурирующих донорных лигандов. [29] При иминном литиировании, хотя ТГФ действует как сильный донорный лиганд для LiHMDS, слабокоординирующий TMEDA легко диссоциирует от LiHMDS, что приводит к образованию димеров LiHMDS, которые являются более реакционноспособными видами. Таким образом, в случае LiHMDS TMEDA не увеличивает реакционную способность за счет снижения агрегатного состояния. [30] Кроме того, в отличие от простых соединений алкиллития, ТМЭДА не деагрегирует литиоацетофенолят в растворе ТГФ. [6] [31] Добавление HMPA к амидам лития, таким как LiHMDS и LDA, часто приводит к образованию смеси агрегатов димера и мономера в ТГФ. Однако соотношение видов димер/мономер не меняется с увеличением концентрации ГМПА, поэтому наблюдаемое увеличение реакционной способности не является результатом дезагрегации. Механизм повышения реакционной способности этих добавок все еще исследуется. [22]
Реактивность и приложения
[ редактировать ]Связь C–Li в литийорганических реагентах сильно поляризована. В результате углерод притягивает большую часть электронной плотности в связи и напоминает карбанион. Таким образом, литийорганические реагенты являются сильноосновными и нуклеофильными. Некоторые из наиболее распространенных применений литийорганических реагентов в синтезе включают их использование в качестве нуклеофилов, сильных оснований для депротонирования, инициатора полимеризации и исходного материала для получения других металлоорганических соединений.
Как нуклеофил
[ редактировать ]Реакции карболитирования
[ редактировать ]Будучи нуклеофилами, литийорганические реагенты подвергаются реакциям карболитирования, в ходе которых связь углерод-литий присоединяется к двойной или тройной связи углерод - углерод, образуя новые литийорганические виды. [32] Эта реакция является наиболее широко используемой реакцией литийорганических соединений. Карболитирование является ключевым моментом в процессах анионной полимеризации, а н -бутиллитий используется в качестве катализатора для инициирования полимеризации стирола , бутадиена или изопрена или их смесей. [33] [34]
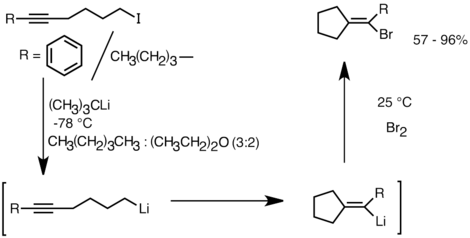
Другое применение, в котором используется эта реакционная способность, - это образование карбоциклических и гетероциклических соединений путем внутримолекулярного карболитирования. [32] Как форма анионной циклизации, реакции внутримолекулярного карболитирования имеют ряд преимуществ перед радикальной циклизацией . Во-первых, образующиеся циклические литийорганические соединения могут вступать в реакцию с электрофилами, тогда как уловить радикальный интермедиат соответствующей структуры часто бывает трудно. Во-вторых, анионные циклизации часто более регио- и стереоспецифичны, чем радикальная циклизация, особенно в случае 5-гексениллития. Внутримолекулярное карболитирование позволяет присоединить алкил-, виниллитий к тройным связям и моноалкилзамещенным двойным связям. Ариллитий также может подвергаться присоединению, если образуется 5-членное кольцо. Ограничения внутримолекулярного карболитирования включают трудность образования 3- или 4-членных колец, поскольку промежуточные циклические литийорганические виды часто имеют тенденцию подвергаться раскрытию кольца. [32] Ниже приведен пример реакции внутримолекулярного карболитирования. Разновидности лития, полученные в результате обмена литий-галоген, циклизуются с образованием виниллития посредством замыкания 5-экзо-триг-кольца. Виды виниллития далее реагируют с электрофилами и образуют функционализированные циклопентилиденовые соединения. [35]
Присоединение к карбонильным соединениям
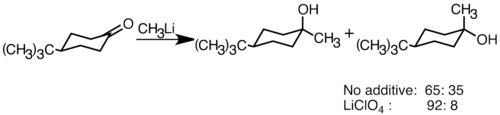
[ редактировать ]Нуклеофильные литийорганические реагенты могут присоединяться к электрофильным карбонильным двойным связям с образованием связей углерод - углерод. Они могут реагировать с альдегидами и кетонами с образованием спиртов . Присоединение происходит в основном посредством полярного присоединения, при котором нуклеофильные литийорганические соединения атакуют с экваториального направления и образуют аксиальный спирт. [36] Добавление солей лития, таких как LiClO 4, может улучшить стереоселективность реакции. [37]
Когда кетон стерически затруднен, использование реактивов Гриньяра часто приводит к восстановлению карбонильной группы вместо присоединения. [36] Однако алкиллитиевые реагенты с меньшей вероятностью восстанавливают кетон и могут быть использованы для синтеза замещенных спиртов. [38] Ниже приведен пример добавления этиллития к адамантону для получения третичного спирта. [39]
Литийорганические реагенты также превосходят реактивы Гриньяра по способности вступать в реакцию с карбоновыми кислотами с образованием кетонов. [36] Эту реакцию можно оптимизировать, тщательно контролируя количество добавляемого литийорганического реагента или используя триметилсилилхлорид для гашения избытка литиевого реагента. [40] Более распространенный способ синтеза кетонов — добавление литийорганических реагентов к амидам Вейнреба ( N -метокси- N -метиламиды). Эта реакция дает кетоны, когда литийорганические реагенты используются в избытке, из-за хелатирования иона лития между N -метоксикислородом и карбонильным кислородом, который образует тетраэдрический промежуточный продукт, который разрушается при кислотной обработке. [41]
Литийорганические реагенты также реагируют с диоксидом углерода с образованием после обработки карбоновых кислот . [42]
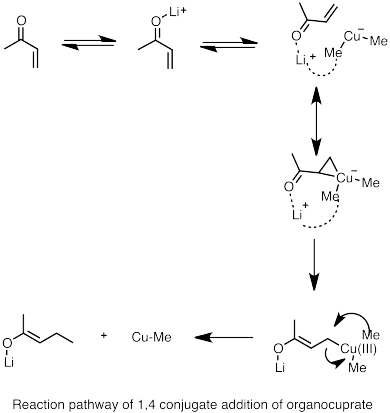
В случае еноновых субстратов, где возможны два центра нуклеофильного присоединения (1,2-присоединение к карбонильному углероду или 1,4- сопряженное присоединение к β-углероду), большинство высокореакционноспособных литийорганических форм благоприятствуют 1,2-присоединению, однако Существует несколько способов заставить литийорганические реагенты подвергнуться конъюгатному присоединению. Во-первых, поскольку 1,4-аддукт, вероятно, будет более термодинамически выгодным, присоединение конъюгата может быть достигнуто путем уравновешивания (изомеризации двух продуктов), особенно когда нуклеофил лития слабый и присоединение 1,2 обратимо. Во-вторых, добавление донорных лигандов в реакцию образует стабилизированные гетероатомами частицы лития, что способствует присоединению 1,4-конъюгата. В одном примере добавление небольшого количества HMPA к растворителю благоприятствует добавлению 1,4. В отсутствие донорного лиганда катион лития тесно координирован с атомом кислорода, однако при сольватации катиона лития ГМПА координация между карбонильным кислородом и ионом лития ослабляется. Этот метод, как правило, не может быть использован для воздействия на региоселективность алкил- и ариллитиевых реагентов. [43] [44]
Литийорганические реагенты также могут осуществлять энантиоселективное нуклеофильное присоединение к карбонилу и его производным, часто в присутствии хиральных лигандов. Эта реакционная способность широко применяется в промышленном синтезе фармацевтических соединений. Примером является синтез компанией Merck и Dupont эфавиренца , мощного ВИЧ ингибитора обратной транскриптазы . Ацетилид лития добавляют к прохиральному кетону с получением хирального спиртового продукта. Методами ЯМР-спектроскопии в растворенном состоянии и рентгеноструктурной кристаллографии твердого состояния установлено строение активного интермедиата реакции: кубический тетрамер 2:2. [45]
S N 2 Реакции типа
[ редактировать ]Литийорганические реагенты могут служить нуклеофилами и осуществлять реакции типа SN 2 с алкил- или аллилгалогенидами. [46] Хотя они считаются более реакционноспособными, чем реактивы Гриньяра при алкилировании, их использование все еще ограничено из-за конкурирующих побочных реакций, таких как радикальные реакции или обмен металл - галоген. Большинство литийорганических реагентов, используемых при алкилировании, более стабилизированы, менее основные и менее агрегированные, например, стабилизированные гетероатомом арил- или аллиллитиевые реагенты. [6] Было показано, что HMPA увеличивает скорость реакции и выход продуктов, а реакционная способность ариллитиевых реагентов часто повышается за счет добавления алкоксидов калия. [36] Литийорганические реагенты также могут осуществлять нуклеофильную атаку эпоксидов с образованием спиртов.
В качестве базы
[ редактировать ]Литийорганические реагенты обеспечивают широкий диапазон основности . Трет -Бутиллитий с тремя слабоэлектронодонорными алкильными группами является самым сильным коммерчески доступным основанием ( pKa = 53). В результате кислые протоны на -OH, -NH и -SH часто защищены в присутствии литийорганических реагентов. Некоторые обычно используемые литиевые основания представляют собой разновидности алкиллития, такие как н -бутиллитий и диалкиламиды лития (LiNR 2 ). Реагенты с объемистыми группами R, такие как диизопропиламид лития (LDA) и бис(триметилсилил)амид лития (LiHMDS), часто стерически затруднены для нуклеофильного присоединения и, следовательно, более селективны в отношении депротонирования. Диалкиламиды лития (LiNR 2 ) широко используются в образовании енолятов и альдольных реакциях. [47] На реакционную способность и селективность этих оснований также влияют растворители и другие противоионы.
Металлирование
[ редактировать ]Металлирование литийорганическими реагентами, также известное как литирование или литий-водородный обмен, достигается, когда литийорганический реагент, чаще всего алкиллитий, отрывает протон и образует новую литийорганическую разновидность.
| ( 1 ) |
Обычными реагентами металлирования являются бутиллитий. трет -бутиллитий и втор -бутиллитий обычно более реакционноспособны и обладают лучшей селективностью, чем н -бутиллитий, однако они также более дороги и с ними труднее обращаться. [47] Металлирование - распространенный способ приготовления универсальных литийорганических реагентов. Положение металлирования в основном контролируется кислотностью связи CH. Литиирование часто происходит в положении α электроноакцепторных групп, поскольку они хорошо стабилизируют электронную плотность аниона. Направляющие группы ароматических соединений и гетероциклов обеспечивают региоселективные центры металлирования; направленное орто-металлирование - важный класс реакций металлирования. Металлированные сульфоны, ацильные группы и α-металлированные амиды являются важными промежуточными соединениями в химическом синтезе. Металлирование аллилового эфира алкиллитием или LDA образует анион α по отношению к кислороду и может перейти к перегруппировке 2,3-Виттига . Добавление донорных лигандов, таких как TMEDA и HMPA, может увеличить скорость металлирования и расширить область применения субстратов. [48] Доступ к хиральным литийорганическим реагентам можно получить путем асимметричного металлирования. [49]
Направленное орто-металлирование является важным инструментом в синтезе региоспецифических замещенных ароматических соединений. Этот подход к литиированию и последующему охлаждению промежуточных частиц лития электрофилом часто оказывается лучше, чем электрофильное ароматическое замещение из-за его высокой региоселективности. Эта реакция протекает путем депротонирования литийорганическими реагентами в положениях α до группы прямого металлирования (ДМГ) ароматического кольца. DMG часто представляет собой функциональную группу, содержащую гетероатом , который является основным по Льюису и может координироваться с кислотным катионом лития по Льюису. Это создает комплексно-индуцированный эффект близости, который направляет депротонирование в α-положении с образованием разновидностей ариллития, которые могут в дальнейшем реагировать с электрофилами. Одними из наиболее эффективных DMG являются амиды, карбаматы , сульфоны и сульфонамиды . Это сильные электроноакцепторные группы, которые повышают кислотность альфа-протонов ароматического кольца. При наличии двух ДМГ металлирование часто происходит орто более сильной направляющей группы, хотя наблюдаются и смешанные продукты. Ряд гетероциклов, содержащих кислые протоны, также могут подвергаться орто-металлированию. Однако для бедных электронами гетероциклов обычно используются основания амида лития, такие как LDA, поскольку наблюдалось, что алкиллитий осуществляет присоединение к бедным электронами гетероциклам, а не депротонирование. В некоторых комплексах переходного металла с аренами, таких как ферроцен , переходный металл притягивает электронную плотность от арена, тем самым делая ароматические протоны более кислыми и готовыми к орто-металлированию. [50]
Супербазы
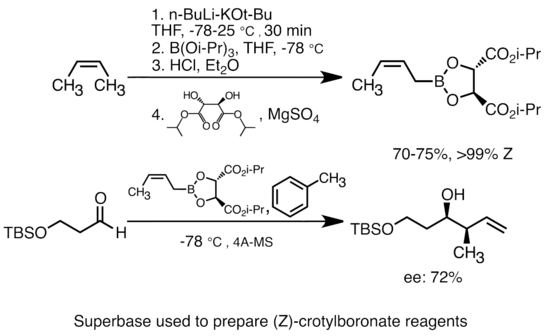
[ редактировать ]Добавление алкоксида калия к алкиллитию значительно увеличивает основность литийорганических соединений. [51] Наиболее распространенное «супероснование» может быть образовано добавлением KOtBu к бутиллитию, часто называемому реагентами «LiCKOR». Эти «супероснования» являются высокореактивными и часто стереоселективными реагентами. В приведенном ниже примере основание LiCKOR генерирует стереоспецифические разновидности кротилбороната посредством металлирования и последующего литий-металлоидного обмена. [52]
Асимметричное металлирование
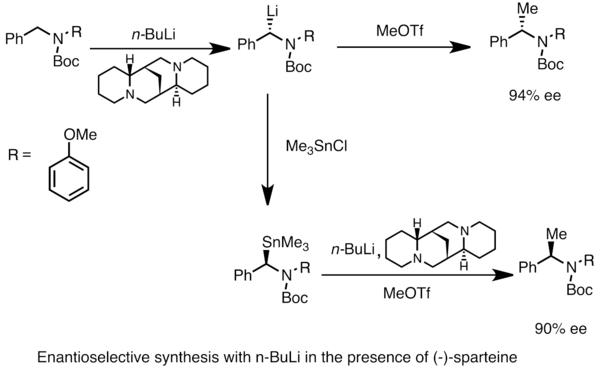
[ редактировать ]Энантиообогащенные литийорганические виды можно получить путем асимметричного металлирования прохиральных субстратов. Асимметричная индукция требует присутствия хирального лиганда, такого как (-)- спартеин . [49] На энантиомерное соотношение хиральных форм лития часто влияют различия в скорости депротонирования. В приведенном ниже примере обработка N -Boc- N -бензиламина н -бутиллитием в присутствии (-)-спартеина дает один энантиомер продукта с высоким энантиомерным избытком . Трансметаллирование триметилоловохлоридом дает противоположный энантиомер. [53]
Образование енолята
[ редактировать ]лития Еноляты образуются в результате депротонирования связи CH α с карбонильной группой литийорганическими соединениями. Еноляты лития широко используются в качестве нуклеофилов в реакциях образования углерод - углеродных связей, таких как альдольная конденсация и алкилирование. Они также являются важным промежуточным продуктом в образовании эфира силиленола .
Образование енолята лития можно обобщить как кислотно - основную реакцию, в которой относительно кислый протон α карбонильной группы (pK =20-28 в ДМСО) реагирует с литийорганическим основанием. Обычно используются сильные ненуклеофильные основания, особенно амиды лития, такие как LDA, LiHMDS и LiTMP. ТГФ и ДМСО являются обычными растворителями в реакциях енолята лития. [54]
Стереохимия и механизм образования енолятов вызвали большой интерес в химическом сообществе. На результат стереохимии енолята влияют многие факторы, такие как стерические эффекты, растворитель, полярные добавки и типы литийорганических оснований. Среди многих моделей, используемых для объяснения и прогнозирования селективности стереохимии енолятов лития, есть модель Ирландии. [55]
В этом предположении мономерный LDA реагирует с карбонильным субстратом и образует переходное состояние циклического типа Циммермана-Тракслера . (E)-енолят является предпочтительным из-за неблагоприятного взаимодействия синпентана в переходном состоянии (Z)-енолята. [54]
Добавление полярных добавок, таких как HMPA или DMPU, способствует образованию (Z)-енолятов. Модель Ирландии утверждает, что эти донорные лиганды координируются с катионами лития, в результате чего взаимодействие карбонильного кислорода и лития уменьшается, и переходное состояние не так прочно связано, как шестичленный стул. Процент енолятов (Z) также увеличивается при использовании литиевых оснований с более объемными боковыми цепями (таких как LiHMDS). [54] Однако механизм того, как эти добавки меняют стереоселективность, все еще обсуждается.
Модель Ирландии столкнулась с некоторыми проблемами, поскольку она изображает виды лития как мономеры в переходном состоянии. В действительности в растворах енолятов лития часто наблюдаются разнообразные агрегаты лития, и в зависимости от конкретного субстрата, растворителя и условий реакции может быть трудно определить, какой агрегат является фактическим химически активным веществом в растворе. [54]
Литий-галогенный обмен
[ редактировать ]Литий-галогеновый обмен включает обмен гетероатомами между галогенидами и литийорганическими соединениями.
| ( 2 ) |
Литий-галогеновый обмен очень полезен при получении новых литийорганических реагентов. Применение литий-галогенного обмена иллюстрируется циклизацией Пархема. [56]
Трансметаллация
[ редактировать ]Литийорганические реагенты часто используются для получения других металлоорганических соединений методом трансметаллирования. Медьорганические, оловоорганические , кремнийорганические, борорганические, фосфорорганические, церийорганические и серорганические соединения часто получают путем взаимодействия литийорганических реагентов с соответствующими электрофилами.
| ( 3 ) |
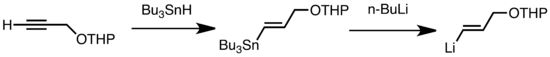
Общие типы трансметаллирования включают обмен Li/Sn, Li/Hg и Li/Te, который протекает быстро при низкой температуре. [47] Преимущество обмена Li/Sn заключается в том, что предшественники триалкилстаннана подвергаются небольшому количеству побочных реакций, поскольку образующиеся побочные продукты n-Bu 3 Sn нереакционноспособны по отношению к алкиллитиевым реагентам. [47] В следующем примере винилстаннан, полученный гидростаннилированием концевого алкина, образует виниллитий посредством трансметаллирования с n-BuLi. [57]
Литийорганический элемент также может быть использован для получения цинкорганических соединений путем трансметаллирования солями цинка. [58]
Диорганокупраты лития могут быть образованы путем реакции алкиллитиевых форм с галогенидом меди (I). Полученные органокупраты обычно менее реакционноспособны по отношению к альдегидам и кетонам, чем литийорганические реагенты или реактивы Гриньяра. [59]
Подготовка
[ редактировать ]Большинство простых алкиллитиевых реагентов и обычные амиды лития коммерчески доступны в различных растворителях и концентрациях. Литийорганические реагенты также можно приготовить в лаборатории. Ниже приведены некоторые распространенные методы приготовления литийорганических реагентов.
Реакция с металлическим литием
[ редактировать ]Восстановление алкилгалогенида металлическим литием может дать простые алкил- и ариллитийорганические реагенты. [36]
| ( 4 ) |
Промышленное получение литийорганических реагентов достигается обработкой алкилхлорида металлическим литием, содержащим 0,5–2 % натрия . Превращение является сильно экзотермическим . Натрий инициирует радикальный путь и увеличивает скорость. [60] Восстановление происходит по радикальному пути. Ниже приведен пример приготовления функционализированного литиевого реагента с использованием восстановления металлическим литием. [61] Иногда металлический литий в виде мелкодисперсных порошков используется в реакции с некоторыми катализаторами, такими как нафталин или 4,4'-ди-т-бутилбифенил (ДТББ). Другим субстратом, который можно восстановить металлическим литием для получения алкиллитиевых реагентов, являются сульфиды. Восстановление сульфидов полезно при образовании функционализированных литийорганических реагентов, таких как альфа-литиоэфиры, сульфиды и силаны. [62]
Металлирование
[ редактировать ]Второй метод приготовления литийорганических реагентов — металлирование (литий-водородный обмен). Относительная кислотность атомов водорода контролирует положение литиирования.
Это наиболее распространенный метод приготовления алкиниллитиевых реагентов, поскольку концевой водород, связанный с sp- углеродом, очень кислый и легко депротонируется. [36] Для ароматических соединений положение литиирования определяется также направляющим действием заместителей. [63] Одними из наиболее эффективных направляющих групп-заместителей являются алкокси, амидо, сульфоксид, сульфонил. Металлирование часто происходит в орто-положении к этим заместителям. В гетероароматических соединениях металлирование обычно происходит в орто-положении по отношению к гетероатому. [36] [63]
Литий-галогенный обмен
[ редактировать ]См. Обмен литий-галоген (в разделе «Реакционная способность и применение»).
Третий метод приготовления литийорганических реагентов - обмен лития на галоген.
трет- бутиллитий или н- бутиллитий являются наиболее часто используемыми реагентами для получения новых литийорганических соединений путем обмена лития на галоген. Литий-галогеновый обмен чаще всего используют для превращения арил- и алкенилиодидов и бромидов с атомами углерода sp2 в соответствующие литийорганические соединения. Реакция протекает чрезвычайно быстро и часто протекает при температуре от -60 до -120 ° C. [48]
Трансметаллация
[ редактировать ]Четвертый метод получения литийорганических реагентов — трансметаллирование. Этот метод можно использовать для получения виниллития.
Реакция Шапиро
[ редактировать ]В реакции Шапиро два эквивалента сильного алкиллитиевого основания реагируют с соединениями п-тозилгидразона с образованием виниллития или после гашения олефинового продукта.
Умение обращаться
[ редактировать ]Литийорганические соединения являются высокореактивными соединениями и требуют специальных методов обращения. Они часто коррозионны, легковоспламеняемы, а иногда и пирофорны (самопроизвольное возгорание при воздействии воздуха или влаги). [64] Алкиллитиевые реагенты также могут подвергаться термическому разложению с образованием соответствующих алкильных разновидностей и гидрида лития. [65] Литийорганические реагенты обычно хранятся при температуре ниже 10 °C. Реакции проводят безвоздушными методами . [64] Концентрацию алкиллитиевых реагентов часто определяют титрованием . [66] [67] [68]
Литийорганические реагенты реагируют, часто медленно, с простыми эфирами, которые, тем не менее, часто используются в качестве растворителей. [69]
| Растворитель | Температура | н-BuLi | с-БуЛи | т-БуЛи | Мели | CH 2 =C(OEt)-Li | CH 2 =C(SiMe 3 )-Li |
|---|---|---|---|---|---|---|---|
| ТГФ | −40 °С | 338 мин. | |||||
| ТГФ | −20 °С | 42 мин. | |||||
| ТГФ | 0 °С | 17 ч. | |||||
| ТГФ | 20 °С | 107 мин. | >15 часов | 17 ч. | |||
| ТГФ | 35 °С | 10 минут | |||||
| ТГФ/ТМЕДА | −20 °С | 55 ч. | |||||
| ТГФ/ТМЕДА | 0 °С | 340 мин. | |||||
| ТГФ/ТМЕДА | 20 °С | 40 мин. | |||||
| Эфир | −20 °С | 480 мин. | |||||
| Эфир | 0 °С | 61 мин. | |||||
| Эфир | 20 °С | 153 ч. | <30 мин. | 17 дней | |||
| Эфир | 35 °С | 31 час | |||||
| Эфир/ТМЕДА | 20 °С | 603 мин. | |||||
| ДМЕ | −70 °С | 120 мин. | 11 минут | ||||
| ДМЕ | −20 °С | 110 мин. | 2 мин. | ≪2 мин | |||
| ДМЕ | 0 °С | 6 мин |
См. также
[ редактировать ]Дальнейшее чтение
[ редактировать ]- Райх, HJ; Борст, JP; Дикстра, РР; Грин, П.Д. (1993). «Спектроскопический метод ядерного магнитного резонанса для характеристики парных структур ионов лития в растворах ТГФ и ТГФ/ГМПА». Дж. Ам. хим. Соц. 115 (19): 8728–8741. дои : 10.1021/ja00072a028 .
Ссылки
[ редактировать ]- ^ Jump up to: а б Забицкий, Джейкоб (2009). «Аналитические аспекты литийорганических соединений». Химия функциональных групп ПАТАИ . John Wiley & Sons, Ltd. doi : 10.1002/9780470682531.pat0304 . ISBN 9780470682531 .
- ^ Ву, Г.; Хуанг, М. (2006). «Литийорганические реагенты в фармацевтических асимметричных процессах». хим. Преподобный . 106 (7): 2596–2616. дои : 10.1021/cr040694k . ПМИД 16836294 .
- ^ Эйш, Джон Дж. (2002). «Генри Гилман: американский пионер в развитии металлоорганической химии в современной науке и технологиях †». Металлоорганические соединения . 21 (25): 5439–5463. дои : 10.1021/om0109408 . ISSN 0276-7333 .
- ^ Раппопорт З.; Марек И., ред. (2004). Химия литийорганических соединений (2 части) . Джон Вили и сыновья, ООО ISBN 978-0-470-84339-0 .
- ^ Jump up to: а б с д и ж г час я Стей, Томас; Сталке, Дитмар (2009). «Свинцовые структуры в литиевой органической химии». Химия функциональных групп ПАТАИ . John Wiley & Sons, Ltd. doi : 10.1002/9780470682531.pat0298 . ISBN 9780470682531 .
- ^ Jump up to: а б с д и ж г час я дж Райх, Ханс Дж. (2013). «Роль литийорганических агрегатов и смешанных агрегатов в литийорганических механизмах». Химические обзоры . 113 (9): 7130–7178. дои : 10.1021/cr400187u . ПМИД 23941648 .
- ^ Jump up to: а б с д и ж г час я дж Строманн, К; и др. (2009). «Принципы структурообразования и реакционная способность литийорганических соединений» (PDF) . хим. Евро. Дж . 15 (14): 3320–3334. дои : 10.1002/chem.200900041 . ПМИД 19260001 .
- ^ Jump up to: а б Джеммис, Эд; Гопакумар, Г. (2009). «Теоретические исследования по литийорганической химии». Химия функциональных групп ПАТАИ . John Wiley & Sons, Ltd. doi : 10.1002/9780470682531.pat0297 . ISBN 9780470682531 .
- ^ Jump up to: а б Штрейвизер, А. (2009). «Перспективы вычислительной органической химии» . Дж. Орг. Хим . 74 (12): 4433–4446. дои : 10.1021/jo900497s . ПМК 2728082 . ПМИД 19518150 .
- ^ Jump up to: а б Бикельхаупт, FM; и др. (2006). «Ковалентность в высокополярных связях. Структура и связь олигомеров метилщелочных металлов (CH3M)n (M = Li-Rb; n = 1, 4)». Дж. Хим. Теория вычислений . 2 (4): 965–980. дои : 10.1021/ct050333s . ПМИД 26633056 .
- ^ Вайс, Эрвин (ноябрь 1993 г.). «Структура щелочно-органических металлокомплексов и родственных соединений». Angewandte Chemie International Edition на английском языке . 32 (11): 1501–1523. дои : 10.1002/anie.199315013 . ISSN 0570-0833 .
- ^ Френкель, Г.; Цю, Фаян (1996). «Наблюдение частично делокализованного аллильного лития и динамики его 1,3-литиевого сигматропного сдвига». Дж. Ам. хим. Соц . 118 (24): 5828–5829. дои : 10.1021/ja960440j .
- ^ Френкель. Г; и др. (1995). «Связь углерод-литий в мономерном арллитии: динамика обмена, релаксации и вращения». Дж. Ам. хим. Соц . 117 (23): 6300–6307. дои : 10.1021/ja00128a020 .
- ^ Мощность, ПП; Хоуп Х. (1983). «Выделение и кристаллические структуры безгалогенидных и богатых галогенидами комплексов эфирата фениллития [(PhLi.Et2O)4] и [(PhLi.Et2O)3.LiBr]». Журнал Американского химического общества . 105 (16): 5320–5324. дои : 10.1021/ja00354a022 .
- ^ Jump up to: а б Уилльярд, PG; Сальвино, Дж. М. (1993). «Синтез, выделение и структура комплекса LDA-THF». Журнал органической химии . 58 (1): 1–3. дои : 10.1021/jo00053a001 .
- ^ Хильмерссон, Горан; Гранандер, Йохан (2009). «Структура и динамика хиральных амидов лития». Химия функциональных групп ПАТАИ . John Wiley & Sons, Ltd. doi : 10.1002/9780470682531.pat0342 . ISBN 9780470682531 .
- ^ Jump up to: а б Коллум, Д.Б.; и др. (2007). «Диизопропиламид лития: кинетика раствора и значение для органического синтеза». Энджью. хим. Межд. Эд . 49 (17): 3002–3017. дои : 10.1002/anie.200603038 . ПМИД 17387670 .
- ^ Секигути, Акира.; и др. (2000). «Литиосиланы и их применение для синтеза полисилановых дендримеров». Коорд. хим. Преподобный . 210 : 11–45. дои : 10.1016/S0010-8545(00)00315-5 .
- ^ Коллум, Д.Б.; и др. (2008). «Структуры растворов енолятов, фенолятов, карбоксилатов и алкоксидов лития в присутствии N,N,N',N'-тетраметилэтилендиамина: распространенность циклических димеров» . Дж. Орг. Хим . 73 (19): 7743–7747. дои : 10.1021/jo801532d . ПМЦ 2636848 . ПМИД 18781812 .
- ^ Райх, HJ; и др. (1998). «Агрегация и реакционная способность растворов фениллития». Дж. Ам. хим. Соц . 120 (29): 7201–7210. дои : 10.1021/ja980684z .
- ^ МакГаррити, Дж. Ф.; Огл, Калифорния (1985). «Исследование агрегации и комплексообразования н-бутиллития в тетрагидрофуране методом протонного ЯМР». Дж. Ам. хим. Соц . 107 (7): 1805–1810. дои : 10.1021/ja00293a001 .
- ^ Jump up to: а б Райх, HJ (2012). «Что происходит с этими литиевыми реагентами». Дж. Орг. Хим . 77 (13): 5471–5491. дои : 10.1021/jo3005155 . ПМИД 22594379 .
- ^ Уорделл, Дж.Л. (1982). «Глава 2». В Уилинсоне, Г.; Стоун, ФГА; Абель, Э.В. (ред.). Комплексная металлоорганическая химия, Vol. 1 (1-е изд.). Нью-Йорк: Пергамон. ISBN 978-0080406084 .
- ^ Строманн, К.; Гесснер, В.Х. (2008). «Кристаллические структуры аддуктов n-BuLi с (R,R)-TMCDA и последствия депротонирования бензола». Дж. Ам. хим. Соц . 130 (35): 11719–11725. дои : 10.1021/ja8017187 . ПМИД 18686951 .
- ^ Коллум, Д.Б.; и др. (2007). «Диизопропиламид лития: кинетика раствора и значение для органического синтеза». Энджью. хим. Межд. Эд . 46 (17): 3002–3017. дои : 10.1002/anie.200603038 . ПМИД 17387670 .
- ^ Jump up to: а б Мел, Эй Джей; Хугебум, Ти Джей (1968). «Кольцевое металлирование толуола бутиллитием в присутствии N,N,N',N'-тетраметилэтилендиамина». Дж. Органомет. Хим . 11 : 615–618. дои : 10.1016/0022-328x(68)80091-9 .
- ^ Jump up to: а б Райх, HJ; Грин, ДП (1989). «Спектроскопические и реакционные исследования комплексов литий-реагент - ГМПА». Журнал Американского химического общества . 111 (23): 8729–8731. дои : 10.1021/ja00205a030 .
- ^ Уилльярд, PG; Николс, Массачусетс (1993). «Твердотельные структуры комплексов н-бутиллитий-ТМЕДА, -ТГФ и -ДМЭ». Журнал Американского химического общества . 115 (4): 1568–1572. дои : 10.1021/ja00057a050 .
- ^ Коллум, Д.Б. (1992). «Является ли N,N,N,N-тетраметилэтилендиамин хорошим лигандом для лития?». Акк. хим. Рез . 25 (10): 448–454. дои : 10.1021/ar00022a003 .
- ^ Бернштейн, член парламента; Коллум, Д.Б. (1993). «Скорость металлирования имина диизопропиламидом лития, зависящая от растворителя и субстрата: понимание механизмов, лежащих в основе krel». Дж. Ам. хим. Соц . 115 (18): 8008–8010. дои : 10.1021/ja00071a011 .
- ^ Зеебах, Д. (1988). «Структура и реакционная способность енолятов лития. От пинаколона к селективному C-алкилированию пептидов. Трудности и возможности, предоставляемые сложными структурами» (PDF) . Энджью. хим. Межд. Эд . 27 (12): 1624–1654. дои : 10.1002/anie.198816241 .
- ^ Jump up to: а б с Фананас, Франциско; Санс, Роберто (2009). «Реакции внутримолекулярного карболитирования». Химия функциональных групп ПАТАИ . John Wiley & Sons, Ltd. doi : 10.1002/9780470682531.pat0341 . ISBN 9780470682531 .
- ^ Хайнц-Дитер Брандт, Вольфганг Нентвиг1, Никола Руни, Рональд Т. Лафлэр, Юте У. Вольф, Джон Даффи, Юдит Э. Пушкас, Габор Кашас, Марк Дрюитт, Стефан Гландер «Каучук, 5. Растворные каучуки» в Энциклопедии Ульмана Промышленная химия, 2011, Wiley-VCH, Вайнхайм. два : 10.1002/14356007.o23_o02
- ^ Баскаран, Д.; Мюллер, АХ (2010). «Анионная виниловая полимеризация». Контролируемая и живая полимеризация: от механизмов к применению . Вайнхайм, Германия: Wiley-VCH Verlag GmbH & Co. KGaA. дои : 10.1002/9783527629091.ch1 . ISBN 9783527629091 .
- ^ Бейли, ВФ; и др. (1989). «Получение и легкая циклизация 5-алкин-1-иллития». Тетраэдр Летт . 30 (30): 3901–3904. дои : 10.1016/S0040-4039(00)99279-7 .
- ^ Jump up to: а б с д и ж г Кэри, Фрэнсис А. (2007). «Металлоорганические соединения металлов I и II групп». Продвинутая органическая химия: реакция и синтез, часть. B (изд. Kindle). Спрингер. ISBN 978-0-387-44899-2 .
- ^ Эшби, ЕС; Нодинг, СР (1979). «Влияние добавленных солей на стереоселективность и скорость присоединения металлорганических соединений к кетонам». Дж. Орг. Хим . 44 (24): 4371–4377. дои : 10.1021/jo01338a026 .
- ^ Яматака, Хироши (2009). «Присоединение литийорганических реагентов к двойным связям». Химия функциональных групп ПАТАИ . John Wiley & Sons, Ltd. doi : 10.1002/9780470682531.pat0310 . ISBN 9780470682531 .
- ^ Ланда, С.; и др. (1967). «Об адамантане и его производных IX. Производные, замещенные во 2-м положении». Сборник Чехословацких химических сообщений . 72 (2): 570–575. дои : 10.1135/cccc19670570 .
- ^ Руботтом, генеральный директор; Ким, К. (1983). «Получение метилкетонов последовательной обработкой карбоновых кислот метиллитием и хлортриметилсиланом». Дж. Орг. Хим . 48 (9): 1550–1552. дои : 10.1021/jo00157a038 .
- ^ Задель, Г.; Брейтмайер, Э. (1992). «Однореакторный синтез кетонов и альдегидов из углекислого газа и литийорганических соединений». Энджью. хим. Межд. Эд . 31 (8): 1035–1036. дои : 10.1002/anie.199210351 .
- ^ Рональд, RC (1975). «Метоксиметиловые эфиры. Активирующая группа для быстрого и региоселективного металлирования». Тетраэдр Летт . 16 (46): 3973–3974. дои : 10.1016/S0040-4039(00)91212-7 .
- ^ Хант, Д.А. (1989). «Присоединение Майкла литийорганических соединений. Обзор». Орг. Подготов. Учеб. Межд . 21 (6): 705–749. дои : 10.1080/00304948909356219 .
- ^ Райх, HJ; Сикорский, WH (1999). «Региоселективность добавления литийорганических реагентов к енонам: роль ГМПА». Дж. Орг. Хим . 64 (1): 14–15. дои : 10.1021/jo981765g . ПМИД 11674078 .
- ^ Коллум, Д.Б.; и др. (2001). «ЯМР-спектроскопические исследования смешанных агрегатов, лежащих в основе высокоэнантиоселективных 1,2-присоединений циклопропилацетилида лития к хиназолинонам». Дж. Ам. хим. Соц . 123 (37): 9135–9143. дои : 10.1021/ja0105616 . ПМИД 11552822 .
- ^ Зоммер, ЛХ; Корте, WD (1970). «Реакции стереоспецифического сочетания между литийорганическими реагентами и вторичными галогенидами». Дж. Орг. Хим . 35 : 22–25. дои : 10.1021/jo00826a006 .
- ^ Jump up to: а б с д Литийорганические реагенты Райх, HJ 2002 https://organicchemistrydata.org/hansreich/resources/organolithium/organolithium_data/orgli-primer.pdf
- ^ Jump up to: а б Приготовление литийорганических реагентов и промежуточных продуктов Леру Ф., Шлоссер. М., Зоар. Э., Марек. I., Уайли, Нью-Йорк. 2004. ISBN 978-0-470-84339-0
- ^ Jump up to: а б Хоппе, Дитер; Кристоф, Гвидо (2009). «Асимметричное депротонирование алкиллитием – (-)-спартеином». Химия функциональных групп ПАТАИ . John Wiley & Sons, Ltd. doi : 10.1002/9780470682531.pat0313 . ISBN 9780470682531 .
- ^ Клейден, Джонатан (2009). «Направленная металлизация ароматических соединений». Химия функциональных групп ПАТАИ . John Wiley & Sons, Ltd. doi : 10.1002/9780470682531.pat0306 . ISBN 9780470682531 .
- ^ Шлоссер, М (1988). «Супероснования для органического синтеза» . Чистое приложение. Хим . 60 (11): 1627–1634. дои : 10.1351/pac198860111627 .
- ^ Руш, WR; и др. (1988). «Энантиоселективный синтез с использованием модифицированных диизопропилтартратом (E)- и (Z)-кротилборонатов: реакции с ахиральными альдегидами». Тетраэдр Летт . 29 (44): 5579–5582. дои : 10.1016/S0040-4039(00)80816-3 .
- ^ Парк, Ю.С.; и др. (1996). «(-)-Спартеин-опосредованное α-литиирование N-Boc-N-(п-метоксифенил)бензиламина: энантиоселективный синтез (S) и (R) моно- и дизамещенных N-Boc-бензиламинов». Дж. Ам. хим. Соц . 118 (15): 3757–3758. дои : 10.1021/ja9538804 .
- ^ Jump up to: а б с д Вально, Жан-Ив; Маддалуно, Жак (2009). «Аспекты синтеза, строения и реакционной способности енолятов лития». Химия функциональных групп ПАТАИ . John Wiley & Sons, Ltd. doi : 10.1002/9780470682531.pat0345 . ISBN 9780470682531 .
- ^ Ирландия. РЭ; и др. (1976). «Перегруппировка Кляйзена енолята сложного эфира. Стереохимический контроль посредством стереоселективного образования енолята». Дж. Ам. хим. Соц . 98 (10): 2868–2877. дои : 10.1021/ja00426a033 .
- ^ Пархэм, WP; Брэдшер, К.К. (1982). «Ароматические литийорганические реагенты, несущие электрофильные группы. Получение галоген-литиевым обменом». Акк. хим. Рез . 15 (10): 300–305. дои : 10.1021/ar00082a001 .
- ^ Кори, Э.Дж.; Волленберг, Р.Х. (1975). «Полезные новые металлоорганические реагенты для синтеза аллильных спиртов путем нуклеофильного винилирования». Дж. Орг. Хим . 40 (15): 2265–2266. дои : 10.1021/jo00903a037 .
- ^ Ридер, MR; и др. (2003). «Улучшенный метод реакции кросс-сочетания палладия производных оксазол-2-илцинка с арилбромидами». Орг. Процесс Рез. Дев . 7 (5): 696–699. дои : 10.1021/op034059c .
- ^ Накамура, Э.; и др. (1997). «Путь реакции сопряженного присоединения кластеров органокупрата лития к акролеину». Дж. Ам. хим. Соц . 119 (21): 4900–4910. дои : 10.1021/ja964209h .
- ^ «Металлоорганические соединения в органическом синтезе», Шлоссер, М., Эд, Уайли: Нью-Йорк, 1994. ISBN 0-471-93637-5
- ^ Си-Фодиль, М.; и др. (1998). «Получение 2,2-(диэтокси)виниллития и 2-метил-4-этоксибутадиениллития арен-катализируемым литированием соответствующих хлорпроизводных. Синтетические применения». Тетраэдр Летт . 39 (49): 8975–8978. дои : 10.1016/S0040-4039(98)02031-0 .
- ^ Коэн, Т; Бхупати. М (1989). «Щелочноорганические соединения путем восстановительного металлирования фенилтиоэфиров, индуцированного анион-радикалом». Акк. хим. Рез . 22 (4): 152–161. дои : 10.1021/ar00160a006 .
- ^ Jump up to: а б Снекус, В. (1990). «Направленное орто-металлирование. Руководители третичных амидов и О-карбаматов в стратегиях синтеза полизамещенных ароматических соединений». хим. Преподобный . 90 (6): 879–933. дои : 10.1021/cr00104a001 .
- ^ Jump up to: а б Швиндеман, Джеймс А.; Вольтерманн, Крис Дж.; Летчфорд, Роберт Дж. (2002). «Безопасное обращение с литийорганическими соединениями в лаборатории». Химическое здоровье и безопасность . 9 (3): 6–11. дои : 10.1016/S1074-9098(02)00295-2 . ISSN 1074-9098 .
- ^ Геллерт, Х; Зиглер, К. (1950). «Щелочноорганические соединения. XVI. Термическая устойчивость литийалкилов». Либигс Анн. Хим . 567 : 179–185. дои : 10.1002/jlac.19505670110 .
- ^ Хуаристи, Э.; Мартинес-Рича, А.; Гарсиа-Ривера, А.; Крус-Санчес, Дж.С. (1983). «Использование 4-бифенилметанола, 4-бифенилуксусной кислоты и 4-бифенилкарбоновой кислоты/трифенилметана в качестве индикаторов при титровании алкилов лития. Исследование дианиона 4-бифенилметанола». Журнал органической химии . 48 (15): 2603–2606. дои : 10.1021/jo00163a038 .
- ^ «Титрование растворимых реагентов RM, R2NM и ROM» (PDF) . Проверено 4 июня 2014 г.
- ^ «Методы стандартизации алкиллитиевых реагентов (литература до 2006 г.)» (PDF) . Проверено 4 июня 2014 г.
- ^ Станетти, П.; Коллер, Х.; Миховилович, М. (1992). «Направленное ортолитиирование 1,1-диметилэтилового эфира фенилкарбаминовой кислоты (N-Boc-анилин). Пересмотр и улучшения». Дж. Орг. хим. 57 (25): 6833–6837. дои : 10.1021/jo00051a030 .