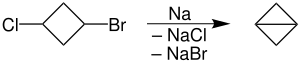Внутримолекулярная реакция
В химии внутримолекулярный или характеристику , описывает процесс ограниченную структурой одной молекулы , свойство или явление, ограниченное пределами одной молекулы.
Относительные ставки
[ редактировать ]Во внутримолекулярных органических реакциях в одной молекуле содержатся два реакционных центра. Эта конфигурация повышает эффективную концентрацию реагирующих партнеров, что приводит к высокой скорости реакции . Многие внутримолекулярные реакции наблюдаются там, где межмолекулярный вариант не протекает.
Внутримолекулярные реакции, особенно приводящие к образованию 5- и 6-членных колец, протекают быстро по сравнению с аналогичным межмолекулярным процессом. Во многом это является следствием снижения энтропийной стоимости достижения переходного состояния образования колец и отсутствия значительных напряжений, связанных с образованием колец таких размеров. Для образования колец разного размера путем циклизации субстратов различной длины связи порядок скоростей реакций (константы скорости k n для образования n -членного кольца) обычно следующий: k 5 > k 6 > k 3 > k 7 > k 4 , как показано ниже для ряда ω-бромалкиламинов. Этот несколько сложный тренд отражает взаимодействие этих энтропийных факторов и факторов деформации:

| н | к отн. | н | к отн. | н | к отн. |
|---|---|---|---|---|---|
| 3 | 0.1 | 6 | 1.7 | 12 | 0.00001 |
| 4 | 0.002 | 7 | 0.03 | 14 | 0.0003 |
| 5 | 100 | 10 | 0.00000001 | 15 | 0.0003 |
Для «маленьких колец» ( 3- и 4-членных ) низкие скорости являются следствием угловой деформации, возникающей в переходном состоянии. Хотя трехчленные кольца более напряжены, образование азиридина происходит быстрее, чем образование азетидина из-за близости уходящей группы и нуклеофила в первом, что увеличивает вероятность их встречи в реакционноспособной конформации. Те же рассуждения справедливы и для «недеформированных колец» ( 5-, 6- и 7-членных ). Образование «колец среднего размера» ( от 8 до 13 членов ) особенно неблагоприятно из-за сочетания все более неблагоприятных энтропийных затрат и дополнительного присутствия трансаннулярной деформации , возникающей в результате стерических взаимодействий поперек кольца. Наконец, для «больших колец» ( 14-членных или выше ) константы скорости выравниваются, поскольку расстояние между уходящей группой и нуклеофилом теперь настолько велико, что реакция теперь фактически является межмолекулярной. [1] [2]
Хотя детали могут несколько меняться, общие тенденции сохраняются для различных внутримолекулярных реакций, включая процессы, опосредованные радикалами и (в некоторых случаях) катализируемые переходными металлами.
Примеры
[ редактировать ]Многие реакции в органической химии могут протекать как внутримолекулярно, так и межмолекулярно. Некоторые реакции по определению являются внутримолекулярными или осуществляются только внутримолекулярно, например,
- Дикмановская конденсация диэфиров представляет собой внутримолекулярный вариант альдольной конденсации .
- синтез индолов Маделунг
- Перестановка улыбки
- Гидроацилирование почти всегда практикуется внутримолекулярно для получения кетонов. [3]
- RCHO + CH 2 =CHR' → RC(O)CH 2 CH 2 R'
- Реакция циклизации Назарова для синтеза циклопентенонов
- Реакция Вюрца , включающая восстановительное сочетание алкилгалогенидов, по существу полезна только тогда, когда проводится внутримолекулярно. Его полезность иллюстрируется синтезом напряженных колец: [4]
Некоторые преобразования, которые активируются или усиливаются внутримолекулярно. Например, ацилоиновая конденсация диэфиров почти всегда приводит к образованию 10-членных карбоциклов, которые иначе трудно построить. [5] Другим примером является циклоприсоединение норборнадиена 2+2 с образованием квадрициклана .
Инструменты и концепции
[ редактировать ]Для использования преимуществ внутримолекулярной циклизации было разработано множество инструментов и концепций. Например, установка крупных заместителей использует эффект Торпа-Ингольда . Реакции высоких разбавлений подавляют межмолекулярные процессы. Один набор инструментов включает в себя привязку, как описано ниже.
Связанные внутримолекулярные [2+2] реакции
[ редактировать ]Связанные внутримолекулярные [2+2] реакции влекут за собой образование циклобутана и циклобутанона посредством внутримолекулярных 2+2 фотоциклоприсоединения . Тетеринг обеспечивает формирование многоцикловой системы.
![Связанные внутримолекулярные [2+2] реакции](http://upload.wikimedia.org/wikipedia/commons/8/88/23_fig._1.png)
Длина привязки влияет на стереохимический результат реакции [2+2]. Более длинные привязки имеют тенденцию генерировать «прямой» продукт, в котором концевой углерод алкена связан с -углерод энона . [6] Когда привязь состоит только из двух атомов углерода, образуется «изогнутый» продукт, в котором -углерод енона соединен с концевым углеродом алкена. [7]
![Влияние длины привязки на реакцию фотоциклизации [2+2]](http://upload.wikimedia.org/wikipedia/commons/8/82/23_fig._2.png)
Связанные реакции [2+2] использовались для синтеза органических соединений с интересными кольцевыми системами и топологиями . Например, фотоциклизация [2+2] была использована для построения трициклической основной структуры гинкголида B. [8]
![Привязанная [2+2] реакция полного синтеза (+)-гинкголида Б.](http://upload.wikimedia.org/wikipedia/commons/1/14/23_fig._3.png)
Молекулярные привязи
[ редактировать ]В противном случае межмолекулярные реакции можно временно сделать внутримолекулярными, соединив оба реагента привязью со всеми вытекающими из этого преимуществами. Популярные привязи содержат эфир карбоната , эфир бороновой кислоты , силиловый эфир или силилацеталь ( силиконовые привязи ). [9] [10] которые довольно инертны во многих органических реакциях, но могут расщепляться специфическими реагентами. Основным препятствием на пути реализации этой стратегии является выбор правильной длины троса и обеспечение оптимальной ориентации реактивных групп относительно друг друга. Примером может служить реакция Паусона-Кханда, в которой алкен и алкин связаны вместе силиловым эфиром. [11]
В этой конкретной реакции угол привязки, соединяющий реакционноспособные группы вместе, эффективно уменьшается за счет размещения изопропильных групп на атоме кремния посредством эффекта Торпа-Ингольда . Когда эти объемистые группы заменяются более мелкими метильными группами, реакции не происходит. Другим примером является фотохимическое [2+2] циклоприсоединение с двумя алкеновыми группами, связанными через ацеталь кремния (рацемическая, другой энантиомер не показан), которая впоследствии расщепляется TBAF с образованием эндодиола.
Без привязки образуется экзо-изомер . [12]
Ссылки
[ редактировать ]- ^ Стрейтвизер, Эндрю; Хиткок, Клейтон Х.; Косауэр, Эдвард М. (2017). Введение в органическую химию . Нью-Дели: Medtech (Scientific International, перепечатка пересмотренного 4-го издания 1998 г., Macmillan). п. 198. ИСБН 9789385998898 .
- ^ Джонатан Клейден (2001). Органическая химия . Оксфорд: Издательство Оксфордского университета. стр. 454]. ISBN 0198503474 . OCLC 43338068 .
- ^ Майкл К. Уиллис (2009). «Гидроацилирование алкенов и алкинов, катализируемое переходными металлами». хим. Откр. 110 (2): 725–748. дои : 10.1021/cr900096x . ПМИД 19873977 .
- ^ Лэмпман, Гэри М.; Омиллер, Джеймс К. (1971). «Бицикло[1.1.0]бутан». Органические синтезы . 51 : 55. дои : 10.15227/orgsyn.051.0055 .
- ^ Смит, Майкл Б.; Марч, Джерри (2007), Продвинутая органическая химия: реакции, механизмы и структура (6-е изд.), Нью-Йорк: Wiley-Interscience, стр. 1461, ISBN 978-0-471-72091-1
- ^ Коутс, Р.М.; Сентер, ПД; Бейкер, WR (1982). «Аннелативное расширение кольца посредством внутримолекулярного [2 + 2] фотоциклоприсоединения α,β-ненасыщенных γ-лактонов и восстановительного расщепления: синтез гидроциклопентациклооктен-5-карбоксилатов». Дж. Орг. Хим . 47 (19): 3597. doi : 10.1021/jo00140a001 .
- ^ Тамура, Ю.; Кита, Ю.; Исибаши, Х.; Икеда, М. (1971). «Внутримолекулярное фотоциклоприсоединение 3-аллилокси- и 3-аллиламиноциклогекс-2-енонов: образование окса- и аза-бицикло[2,1,1]гексанов». Дж. Хим. Соц. Д. 19 (19): 1167. doi : 10.1039/C29710001167 .
- ^ Кори, Э.Дж.; Канг, MC; Десаи, MC; Гош, АК; Упис, Индиана (1988). «Полный синтез (.+-.)-гинкголида Б» . Дж. Ам. хим. Соц . 110 (2): 649–651. дои : 10.1021/ja00210a083 . ПМК 6746322 . ПМИД 31527923 .
- ^ Кокс, Лиам Р.; Лей, Стивен В. (2007). «Использование временной связи в органическом синтезе». В Дидерихе, Франсуа; Стэнг, Питер Дж. (ред.). Шаблонный органический синтез . стр. 274–395. дои : 10.1002/9783527613526 . ISBN 9783527296668 .
- ^ Брейсгедл, С.; Андерсон, Э.А. (2010). «Последние достижения в использовании временных кремниевых привязей в реакциях, опосредованных металлами». хим. Соц. Преподобный . 39 (11): 4114–4129. дои : 10.1039/C0CS00007H . ПМИД 20838677 .
- ^ Доббс, А.; Миллер, И.; Мартинович, С. (2007). «Использование привязей на основе кремния для реакции Паусона-Ханда» . Журнал органической химии Байльштейна . 2007 (3): 21. doi : 10.1186/1860-5397-3-21 . ЧВК 1949821 . ПМИД 17617903 .
- ^ Букер-Милберн, Кевин И.; Гюльтен, Сирин; Шарп, Эндрю (1997). «Диастереоселективные внутримолекулярные фотохимические [2 + 2] реакции циклоприсоединения связанных тетрагидрофталимидов, производных l-(+)- валинола ». хим. Коммун. 1997 (15): 1385–1386. дои : 10.1039/a702386c .