Теория Маркуса
В теоретической химии теория Маркуса — это теория, первоначально разработанная Рудольфом А. Маркусом , начиная с 1956 года, для объяснения скорости реакций переноса электрона — скорости, с которой электрон может двигаться или прыгать от одного химического вида (называемого донором электрона ). в другой (называемый акцептором электронов ). [1] Первоначально он был сформулирован для рассмотрения реакций переноса электрона во внешней сфере , в которых два химических соединения меняют свой заряд только в результате скачка электрона (например, окисление иона, такого как Fe 2+ /Фе 3+ ), но не претерпевают больших структурных изменений. Он был расширен за счет включения вкладов переноса электронов во внутреннюю сферу изменение расстояний или геометрии в сольватных или координационных оболочках , в которых учитывается двух химических соединений (расстояния Fe-O в Fe(H 2 O) 2+ и Fe(H 2 O) 3+ разные). [2] [3]
Для реакций переноса электрона без образования или разрыва связей теория Маркуса заменяет теорию переходного состояния Айринга. [4] [5] который был получен для реакций со структурными изменениями. Обе теории приводят к уравнениям скорости одной и той же экспоненциальной формы. Однако если в теории Эйринга партнеры реакции в ходе реакции становятся прочно связанными, образуя структурно определенный активированный комплекс, то в теории Маркуса они слабо связаны и сохраняют свою индивидуальность. Именно термоиндуцированная реорганизация окружения, растворителя (внешняя сфера) и оболочки растворителя или лигандов (внутренняя сфера) создает геометрически выгодную ситуацию до и независимо от электронного скачка.
Оригинальная классическая теория Маркуса для реакций переноса электрона во внешней сфере демонстрирует важность растворителя и ведет к расчету свободной энергии активации Гиббса с использованием поляризационных свойств растворителя, размера реагентов, расстояния переноса и свободная энергия Гиббса окислительно-восстановительной реакции. Самым поразительным результатом теории Маркуса была «перевернутая область»: в то время как скорость реакции обычно увеличивается с увеличением эксергоничности реакции, перенос электрона, согласно теории Маркуса, должен замедляться в очень отрицательной области. домен. Ученые искали в инвертированной области доказательства более медленной скорости переноса электронов в течение 30 лет, пока это не было однозначно подтверждено экспериментально в 1984 году. [6]
За эту теорию Р. А. Маркус получил Нобелевскую премию по химии в 1992 году. Теория Маркуса используется для описания ряда важных процессов в химии и биологии, включая фотосинтез , коррозию , некоторые виды хемилюминесценции , разделение зарядов в некоторых типах солнечных элементов и многое другое. Помимо приложений внутренней и внешней сферы, теория Маркуса была расширена для рассмотрения гетерогенного переноса электронов .
Внешний и внутренний ET [ править ]
В окислительно-восстановительной реакции донор электронов D должен диффундировать к акцептору A, образуя комплекс-предшественник, который лабилен, но допускает перенос электрона с образованием комплекса-преемника. Затем пара распадается. При переносе одного электрона реакция выглядит так:
(D и A могут уже нести заряды). Здесь k 12 , k 21 и k 30 - константы диффузии, k 23 и k 32 - константы скорости активированных реакций. Общая реакция может контролироваться диффузией (стадия переноса электрона происходит быстрее, чем диффузия, каждое столкновение приводит к реакции) или контролируемой активацией (достигается «равновесие ассоциации», стадия переноса электрона медленная, разделение комплекса-преемника происходит). быстрый). Лигандные оболочки вокруг A и D сохраняются. Этот процесс называется переносом электрона во внешнюю сферу . Внешняя сфера инопланетян находится в центре внимания традиционной теории Маркуса. Другой вид окислительно-восстановительных реакций представляет собой внутреннюю сферу, где A и D ковалентно связаны мостиковым лигандом . Скорость таких реакций ET зависит от скорости обмена лигандов.
Проблема [ править ]
В окислительно-восстановительных реакциях внешней сферы связи не образуются и не разрываются; имеет место только перенос электрона (ET). Достаточно простой пример — Fe 2+ /Фе 3+ окислительно-восстановительная реакция, реакция самообмена, которая, как известно, всегда происходит в водном растворе, содержащем аквакомплексы [ Fe(H 2 O) 6 ] 2+ и [Fe(H 2 O)6] 3+ . Окисление-восстановление происходит со свободной энергией реакции Гиббса. .
По температурной зависимости скорости реакции определяют энергию активации , которую интерпретируют как энергию переходного состояния на диаграмме реакции. Последняя изображается, по Аррениусу и Эйрингу, в виде энергетической диаграммы с координатой реакции по оси абсцисс. Координата реакции описывает минимальный энергетический путь от реагентов к продуктам, а точки этой координаты представляют собой комбинации расстояний и углов между реагентами и внутри них в процессе образования и/или разрыва связей. Максимум энергетической диаграммы — переходное состояние — характеризуется специфической конфигурацией атомов. Более того, в TST Айринга [4] [5] за пересечение точки максимума отвечает вполне специфическое изменение ядерных координат , следовательно, вибрация в этом направлении трактуется как трансляция.
Для внешнесферных окислительно-восстановительных реакций такого пути реакции быть не может, но тем не менее энергия активации наблюдается. Уравнение скорости реакций, контролируемых активацией, имеет ту же экспоненциальную форму, что и уравнение Эйринга:
- свободная энергия Гиббса образования переходного состояния, экспоненциальный член представляет вероятность его образования, A содержит вероятность перехода от комплекса-предшественника к комплексу-преемнику.
Модель Маркуса [ править ]
Следствием переноса электрона является перестановка зарядов, что сильно влияет на окружение растворителя. Ибо диполярные молекулы растворителя перестраиваются в направлении поля зарядов (это называется ориентационной поляризацией), а также слегка смещаются атомы и электроны в молекулах растворителя (атомная и электронная поляризация соответственно). Именно эта поляризация растворителя определяет свободную энергию активации и, следовательно, скорость реакции.
перемещения ядер и сдвиг зарядов ( перенос заряда Реакции замещения, отщепления и изомеризации отличаются от внешнесферной окислительно-восстановительной реакции не только изложенными выше структурными изменениями, но и тем, что на пути реакции происходят , CT). непрерывным и согласованным образом: ядерные конфигурации и распределение заряда всегда находятся «в равновесии». Это иллюстрируется замещением S N 2 при омылении алкилгалогенида, при котором атака с тыльной стороны OH − ион выталкивает ион галогенида и где необходимо визуализировать переходное состояние с пятикоординированным атомом углерода. В ходе реакции система реагентов настолько прочно связывается, что образует активированный комплекс как единое целое. Растворитель здесь оказывает незначительное влияние.
Напротив, во внешнесферных окислительно-восстановительных реакциях смещение ядер в реагентах невелико, здесь доминирующую роль играет растворитель. Донорно-акцепторная связь слабая, оба сохраняют свою идентичность во время реакции. Поэтому электрон, будучи элементарной частицей, может «перепрыгивать» только целиком ( перенос электрона , ЭТ). Если электрон прыгает, перенос происходит намного быстрее, чем движение больших молекул растворителя, в результате чего ядерные положения партнеров реакции и молекул растворителя одинаковы до и после скачка электрона ( принцип Франка-Кондона ). [7] Прыжок электрона регулируется квантовомеханическими правилами, он возможен только в том случае, если и энергия ЭТ-системы не изменится «во время» прыжка.
Расположение молекул растворителя зависит от распределения заряда на реагентах. Если конфигурация растворителя должна быть одинаковой до и после скачка и энергия может не меняться, то растворитель не может находиться ни в сольватном состоянии предшественника, ни в состоянии последующего комплекса, поскольку они различны, он должен находиться где-то в между. Для реакции самообмена по соображениям симметрии условием было бы расположение молекул растворителя точно посередине молекул предшественника и комплекса-преемника. Это означает, что расположение растворителя, в котором половина электрона находится как на доноре, так и на акцепторе, будет подходящей средой для прыжка. Кроме того, в этом состоянии энергия предшественника и преемника в их растворяющей среде будет одинаковой.
Однако электрон как элементарная частица не может быть разделен, он находится либо на доноре, либо на акцепторе и соответственно располагает молекулы растворителя в равновесии. С другой стороны, «переходное состояние» требует конфигурации растворителя, которая возникла бы в результате переноса половины электрона, что невозможно. Это означает, что реальное распределение заряда и необходимая поляризация растворителя не находятся в «равновесии». Однако возможно, что растворитель примет конфигурацию, соответствующую «переходному состоянию», даже если электрон окажется на доноре или акцепторе. Однако это требует энергии. Эта энергия может быть обеспечена тепловой энергией растворителя, а тепловые флуктуации могут создать правильное состояние поляризации. Как только это будет достигнуто, электрон сможет совершить прыжок. Создание правильного расположения растворителя и скачок электрона не связаны и не происходят в синхронном процессе. Таким образом, энергия переходного состояния в основном представляет собой энергию поляризации растворителя.
Теория Маркуса [ править ]
Макроскопическая система: две проводящие сферы [ править ]
На основе своих рассуждений Р. А. Маркус разработал классическую теорию с целью расчета энергии поляризации указанного неравновесного состояния. Из термодинамики хорошо известно, что энергию такого состояния можно определить, если найти обратимый путь к этому состоянию. Маркусу удалось найти такой путь с помощью двух обратимых этапов зарядки для подготовки «переходного состояния» из комплекса-предшественника.
Для модели, на которой основана теория, важны четыре элемента:
- Маркус использует классическую, чисто электростатическую модель. Заряд (многие элементарные заряды) может передаваться в любой части от одного тела к другому.
- Маркус разделяет поляризацию быстрых электронов P e и медленную атомную и ориентационную поляризацию P u растворителя на основании того, что их постоянные времени различаются на несколько порядков.
- Маркус разделяет внутреннюю сферу (реагент + прочносвязанные молекулы растворителя, в комплексах + лиганды) и внешнюю сферу (свободный растворитель).
- В этой модели Маркус ограничивается расчетом внешней сферной энергии неравновесной поляризации «переходного состояния». Энергия внешней сферы часто намного превышает вклад внутренней сферы из-за далеко идущих электростатических сил (сравните Дебая-Хюккеля ). теорию электрохимии
Инструмент Маркуса — теория диэлектрической поляризации в растворителях. Он решил в общем виде задачу о переносе заряда между двумя телами произвольной формы с произвольным поверхностным и объемным зарядом. Для реакции самообмена окислительно-восстановительная пара (например, Fe(H 2 O) 6 3+ / Fe(H 2 O) 6 2+ ) заменяется двумя макроскопическими проводящими сферами на определенном расстоянии, несущими определенные заряды. Между этими сферами обратимо обменивается определенное количество заряда.
На первом этапе вычисляется энергия W I переноса определенного количества заряда, например, для системы в состоянии, когда обе сферы несут половину количества заряда, которое должно быть передано. Такого состояния системы можно достичь, перенеся соответствующий заряд из донорной сферы в вакуум и затем обратно в акцепторную сферу. [8] Тогда сферы в этом заряженном состоянии создают в растворителе определенное электрическое поле, которое создает полную поляризацию растворителя P u + P e . Тем самым эта поляризация растворителя взаимодействует с зарядами.
На втором этапе рассчитывается энергия W II обратимого (обратного) переноса заряда в первую сферу, опять же через вакуум. Однако атомная и ориентационная поляризация P u остаются фиксированными , только электронная поляризация P e может подстраиваться под поле нового распределения заряда и фиксированного P u . После этого второго шага система находится в желаемом состоянии с электронной поляризацией, соответствующей начальной точке окислительно-восстановительной реакции, а атомная и ориентационная поляризация соответствуют «переходному состоянию». Энергия W I + W II этого состояния, термодинамически говоря, является свободной энергией Гиббса G.

Конечно, в этой классической модели возможна передача любого произвольного количества заряда Δe. Таким образом, энергию неравновесного состояния и, следовательно, энергию поляризации растворителя можно исследовать как функцию Δe. Таким образом, Маркус очень изящным образом объединил координаты всех молекул растворителя в одну координату поляризации растворителя Δp, которая определяется количеством переданного заряда Δe. Таким образом, он достиг упрощения представления энергии только до двух измерений: G = f(Δe). Результатом для двух проводящих сфер в растворителе является формула Маркуса.
Где r 1 и r 2 - радиусы сфер, а R - их расстояние между собой, ε s и ε opt - статическая и высокочастотная (оптическая) диэлектрическая проницаемость растворителя, Δe - количество перенесенного заряда. График зависимости G от Δe представляет собой параболу (рис. 1). В теории Маркуса энергия, принадлежащая переносу единичного заряда (Δe = 1), называется энергией реорганизации (внешней сферы) λ o , т.е. энергией состояния, в котором поляризация соответствовала бы передаче единичного количества заряда. , но реальное распределение заряда такое же, как и до передачи. [9] По направлению обмена система симметрична.
Микроскопическая система: донорно акцепторная - пара
Сжатие модели двух сфер до молекулярного уровня создает проблему, заключающуюся в том, что в реакции самообмена заряд больше не может передаваться в произвольных количествах, а только в виде одного электрона. Однако поляризация по-прежнему определяется полным ансамблем молекул растворителя и, следовательно, ее можно рассматривать классически, т. е. энергия поляризации не подлежит квантовым ограничениям. Следовательно, энергию реорганизации растворителя можно рассчитать как обусловленную гипотетическим переносом и обратным переносом частичного элементарного заряда по формуле Маркуса. Таким образом, энергия реорганизации для химических окислительно-восстановительных реакций, которая представляет собой свободную энергию Гиббса, также является параболической функцией Δe этого гипотетического переноса. Для реакции самообмена, где по соображениям симметрии Δe = 0,5, свободная энергия активации Гиббса равна ΔG. (0) ‡ = λ o /4 (см. рис. 1 и рис. 2 пересечения парабол I и f, f(0) соответственно).
До сих пор все было физикой, теперь входит немного химии. Реакция самообмена представляет собой очень специфическую окислительно-восстановительную реакцию, большинство окислительно-восстановительных реакций происходит между разными партнерами. [10] например
и они имеют положительную (эндергоническую) или отрицательную (экзергоническую) свободную энергию реакции Гиббса. .
Поскольку расчеты Маркуса относятся исключительно к электростатическим свойствам растворителя (внешняя сфера). и независимы друг от друга и поэтому их можно просто сложить. Это означает, что параболы Маркуса в системах с разными смещаются вверх или вниз в против. диаграмма (рис. 2). Вариант можно повлиять в экспериментах, предложив одному и тому же донору разные акцепторы.
Простой расчет точки пересечения парабол i и дать Гиббсу свободную энергию активации
- ,
где = и = с . Пересечение этих парабол представляет собой энергию активации, а не энергию переходного состояния фиксированной конфигурации всех ядер в системе, как это имеет место в случае реакции замещения и других упомянутых реакций. Переходное состояние последних реакций должно соответствовать структурным и энергетическим условиям, окислительно-восстановительные реакции должны соответствовать только энергетическим требованиям. Если в остальных реакциях геометрия переходного состояния одинакова для всех пар реагентов, то для окислительно-восстановительных пар энергетическим условиям могут соответствовать многие поляризационные среды.
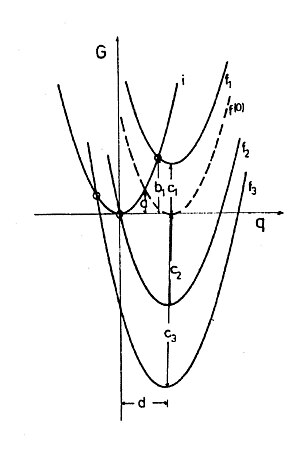
Формула Маркуса показывает квадратичную зависимость свободной энергии Гиббса активации от свободной энергии Гиббса реакции. Из огромного химического опыта известно, что реакции обычно протекают тем быстрее, чем более негативна реакция. . Во многих случаях обнаруживается даже линейное соотношение свободной энергии. Согласно формуле Маркуса, скорости возрастают и при большей экзергоничности реакций, однако лишь до тех пор, пока положительный или слегка отрицательный. Удивительно, но для окислительно-восстановительных реакций по формуле Маркуса энергия активации должна возрастать при очень экзергонической реакции, т.е. в тех случаях, когда является отрицательным, и его абсолютное значение больше, чем у . Эта область свободной энергии реакции Гиббса называется «инвертированной областью Маркуса». На рис. 2 становится очевидным, что пересечение парабол i и f движется вверх в левой части графика при продолжает становиться все более отрицательным, а это означает увеличение энергии активации. Таким образом, общий график против. должен иметь максимум.
Максимум курса ET ожидается на уровне Здесь и (рис. 2), что означает, что электрон может перепрыгнуть в комплексе-предшественнике при его равновесной поляризации. Никакой термической активации не требуется: реакция безбарьерная. В инвертированной области поляризация соответствует трудно вообразимому представлению о распределении заряда, при котором донор получил, а акцептор отдал заряд. Конечно, в реальном мире этого не происходит, не реальное распределение заряда создает эту критическую поляризацию, а термические колебания в растворителе. Эту поляризацию, необходимую для переноса в инвертированной области, можно создать – с некоторой вероятностью – так же, как и любую другую. [11] Электрон только и ждет, пока он прыгнет.
Перенос электронов во внутренней сфере [ править ]
В модели внешней сферы считалось, что донор или акцептор и прочно связанные сольватные оболочки или лиганды комплекса образуют жесткие структуры, не изменяющиеся в процессе переноса электрона. Однако расстояния во внутренней сфере зависят от заряда донора и акцептора, например, расстояния между центральными ионами и лигандами различны в комплексах, несущих разные заряды, и снова необходимо соблюдать принцип Франка-Кондона: чтобы произошел прыжок электрона ядра должны иметь одинаковую конфигурацию как с предшественником, так и с комплексами-преемниками, конечно, сильно искаженную. В этом случае потребность в энергии удовлетворяется автоматически.
В этом случае внутренней сферы справедлива концепция Аррениуса: переходное состояние определенной геометрической структуры достигается по геометрической координате реакции, определяемой движениями ядер. Для образования комплекса-преемника не требуется никакого дальнейшего движения ядра, достаточно просто прыжка электрона, что меняет теорию TST. Координата реакции для энергии внутренней сферы определяется вибрациями и они различаются по окисляемым и восстанавливающим видам. [12]
Для системы самообмена Fe 2+ /Фе 3+ рассматриваются только симметричные дыхательные колебания шести молекул воды вокруг ионов железа. [12] Предполагая гармонические условия, эта вибрация имеет частоты и , силовые константы f D и f A равны и энергии
где q 0 — равновесная нормальная координата и смещения по нормальной координате множитель 3 обусловлен 6 (H 2 O)· 1 ⁄ 2 . Как и при внешнесферной энергии перестройки, кривая потенциальной энергии имеет квадратичный характер, однако здесь вследствие вибраций.
Равновесные нормальные координаты различаются в Fe(H 2 O) 6 2+ и Fe(H 2 O) 6 3+ . Термическим возбуждением дыхательных колебаний можно достичь геометрии, общей как для донора, так и для акцептора, т. е. здесь пересекаются кривые потенциальной энергии дыхательных колебаний D и A. Это ситуация, когда электрон может перепрыгнуть. Энергия этого переходного состояния представляет собой энергию реорганизации внутренней сферы λ в .
Для реакции самообмена можно рассчитать расстояние металл-вода в переходном состоянии. [12]
Это дает энергию реорганизации внутренней сферы.
К счастью, выражения для энергий внешней и внутренней реорганизации имеют одинаковую квадратичную форму. Энергии реорганизации внутренней и внешней сфер независимы, поэтому их можно суммировать, чтобы получить и подставлено в уравнение Аррениуса
Здесь можно видеть, что A представляет вероятность скачка электрона, exp[-Δ G в ‡ / kT ] — достижение переходного состояния внутренней сферы и exp[-Δ G o ‡ / kT ] что касается регулировки внешней сферы.
Для несимметричных (перекрестных) реакций типа
выражение для тоже можно вывести, но это сложнее. [12] Эти реакции имеют энтальпию свободной реакции ΔG. 0 которая не зависит от энергии реорганизации и определяется разными окислительно-восстановительными потенциалами пары железа и кобальта. Следовательно, квадратное уравнение Маркуса справедливо и для энергии реорганизации внутренней сферы, включая предсказание инвертированной области. Это можно представить следующим образом: (а) в нормальной области как начальное, так и конечное состояние должны иметь растянутые связи, (б) в Δ G ‡ = 0, если равновесная конфигурация начального состояния представляет собой растянутую конфигурацию конечного состояния, и (c) в инвертированной области исходное состояние имеет сжатые связи, тогда как конечное состояние имеет в значительной степени растянутые связи.Аналогичные соображения справедливы для металлокомплексов, в которых лиганды крупнее молекул растворителя, а также для полиядерных комплексов с лигандными мостиками.
Вероятность скачка электрона [ править ]
Сила электронной связи донора и акцептора определяет, будет ли реакция переноса электрона адиабатической или неадиабатической. В неадиабатическом случае связь слабая, т.е. H AB на рис. 3 мала по сравнению с энергией реорганизации, а донор и акцептор сохраняют свою идентичность. Система имеет определенную вероятность перепрыгнуть от начальной к конечной кривой потенциальной энергии. В адиабатическом случае связь значительна, щель 2 H AB больше и система остается на нижней кривой потенциальной энергии. [13]
Теория Маркуса, изложенная выше, представляет собой неадиабатический случай. [14] Следовательно, можно применить полуклассическую теорию Ландау-Зинера , которая дает вероятность взаимного превращения донора и акцептора за однократное прохождение системы через область пересечения кривых потенциальной энергии
где H if — энергия взаимодействия в месте пересечения, v — скорость системы через область пересечения, s i и s f — уклоны там.
Рис. 3 Энергетическая диаграмма переноса электрона, включая реорганизацию внутренней и внешней сферы и электронную связь: вертикальная ось — это свободная энергия, а горизонтальная ось — «координата реакции» — упрощенная ось, представляющая движение всех атомных ядер (включительно). платежеспособная реорганизация)
Решая это, можно прийти к основному уравнению теории Маркуса.
где - константа скорости переноса электрона, - электронная связь между начальным и конечным состояниями, – энергия реорганизации (как внутренней, так и внешней сферы), а - полное изменение свободной энергии Гиббса для реакции переноса электрона ( – постоянная Больцмана и – абсолютная температура ).
Таким образом, теория Маркуса основывается на традиционном уравнении Аррениуса для скоростей химических реакций двумя способами:1. Он дает формулу для энергии активации, основанную на параметре, называемом энергией реорганизации, а также свободной энергии Гиббса. Энергия реорганизации определяется как энергия, необходимая для «перестройки» структуры системы от начальных до конечных координат без осуществления переноса заряда.2. Он дает формулу для предэкспоненциального множителя в уравнении Аррениуса, основанную на электронной связи между начальным и конечным состояниями реакции переноса электрона (т.е. перекрытие электронных волновых функций двух состояний).
экспериментов Результаты
Маркус опубликовал свою теорию в 1956 году. В течение многих лет шел интенсивный поиск инвертированной области, которая могла бы стать доказательством теории. Но все эксперименты с сериями реакций все более и более отрицательных ΔG 0 выявил только увеличение скорости реакции до диффузионного предела, т.е. до значения, показывающего, что каждое столкновение приводит к переносу электрона, и этот предел сохраняется также для очень отрицательных ΔG. 0 ценности (поведение Рема-Веллера). [15] Прошло около 30 лет, прежде чем Миллер, Калькатерра и Клосс однозначно обосновали инвертированную область внутримолекулярного переноса электрона в молекуле, где донор и акцептор удерживаются на постоянном расстоянии посредством жесткого спейсера (рис.4). [16]

Апостериорно можно предположить, что в системах, где партнеры реакции могут свободно диффундировать, можно искать оптимальное расстояние для скачка электрона, т.е. расстояние, на котором ΔG ‡ = 0 и ΔG 0 = - λ о . Поскольку λ o зависит от R, λ o увеличивается при большем R и меньшем раскрытии параболы. Формально всегда можно замкнуть параболу на рис. 2 до такой степени, чтобы f-парабола пересекала i-параболу в вершине. Тогда всегда ΔG ‡ = 0 и скорость k достигает максимального диффузионного значения для всех очень отрицательных ΔG 0 . Однако существуют и другие концепции этого явления. [1] например, участие возбужденных состояний или то, что уменьшение констант скорости будет настолько глубоким в инвертированной области, что оно не поддается измерению.
Р. А. Маркус и его сотрудники развили изложенную здесь теорию в нескольких аспектах. Они включали, среди прочего, статистические аспекты и квантовые эффекты, [18] они применили теорию к хемилюминесценции [19] и электродные реакции. [20] Р. А. Маркус получил Нобелевскую премию по химии в 1992 году, и его Нобелевская лекция дает обширный обзор его работы. [1]
См. также [ править ]
Ссылки [ править ]
- ↑ Перейти обратно: Перейти обратно: а б с «Реакции переноса электрона в химии: теория и эксперимент» . Нобелевский фонд . 8 декабря 1992 года . Проверено 2 апреля 2007 г.
- ^ В отличие от подхода Маркуса, теория переноса электронов во внутренней сфере Ноэля С. Хаша относится к непрерывному изменению электронной плотности во время переноса по геометрической координате ( адиабатический случай), а также учитывает влияние растворителя, как это сделал Маркус. Формулировка Хаша известна как теория Маркуса – Хаша.
- ^ Тише, NS Trans. Фарадей Соц. 1961 57,557 ,
- ↑ Перейти обратно: Перейти обратно: а б П. В. Аткинс: Физическая химия , 6. Изд., Oxford University Press, Оксфорд, 1998, стр. 830.
- ↑ Перейти обратно: Перейти обратно: а б Р. С. Берри, С. А. Райс, Дж. Росс: Физическая химия , Wiley, Нью-Йорк, 1980, S. 1147 и далее,
- ^ Миллер Дж.Р., Calcaterra LT, Клосс Г.Л.: «Внутримолекулярный перенос электронов на большие расстояния в анион-радикалах. Влияние свободной энергии и растворителя на скорость реакции», J.Am.Chem.Soc. 1984, 106 , 3047, два : 10.1021/ja00322a058
- ^ В. Ф. Либби, «Теория реакций электронного обмена в водном растворе» J.Phys.Chem. 1952, 56 , 863
- ^ Маркус принимает вакуумное состояние реагентов за точку нулевой энергии. Поэтому многие из его уравнений содержат также энергию сольватации изолированных частиц W iso и электростатическую энергию образования комплексов-предшественников и преемников.
- ^ Примечание: квадратичная зависимость энергии реорганизации внешней сферы не является следствием вибраций реагентов или растворителя!
- ^ их часто называют перекрестными реакциями Маркуса.
- ^ Обратная реакция может способствовать пониманию: для этой реакции поляризация из-за гипотетической передачи единичного заряда электрона недостаточна для достижения поляризации, при которой энергии поляризации A/D и A − /Д + равны. Это может произойти только при гипотетической передаче более чем одного заряда электрона.
- ↑ Перейти обратно: Перейти обратно: а б с д Н. Сутин, 'Теория реакций переноса электрона: взгляд и взгляд в прошлое', Progr. Неорг. хим. 1083, 30 , 441-448
- ^ В обычных химических реакциях, таких как замещения, которые протекают через переходное состояние, верхняя кривая потенциальной энергии находится настолько высоко, что ею пренебрегают.
- ^ Теория адиабатического переноса электрона с участием движения ядра (которую можно рассматривать как перенос заряда, а не скачок электрона) была разработана Хашем.
- ^ Рем, Д., Веллер, А. «Кинетика и механизм переноса электронов при тушении флуоресценции в ацетонитриле» Ber. Bunsenges.Physik.Chem. 1969, 73 , 834-839 охарактеризовали это поведение эмпирической формулой
- ^ Миллер Дж.Р., Calcaterra LT, Клосс Г.Л.: «Внутримолекулярный перенос электронов на большие расстояния в анион-радикалах. Влияние свободной энергии и растворителя на скорость реакции», J.Am.Chem.Soc. 1984, 106 , 3047, два : 10.1021/ja00322a058
- ^ Мы рекомендуем обращаться к оригинальной статье, JACS не лицензирует Википедию для графиков.
- ^ Сайдерс, П., Маркус, Р.А. «Квантовые эффекты в реакциях переноса электрона» J.Am.Chem.Soc. 1981 г., 103 741; Сайдерс П., Маркус Р.А. «Квантовые эффекты для реакций переноса электрона в «перевернутой области»» J.Am.Chem.Soc. 1981 103,748 ,
- ^ Маркус. РА «К теории хемилюминесцентных реакций переноса электрона» Ж.Хим.Физ. 1965, 43 , 2654
- ^ Маркус, Р.А. «К теории реакции переноса электрона VI. Единое рассмотрение гомогенных и электродных реакций» J.Chem.Phys. 1965 43,679 ,
Маркуса Ключевые документы
- Маркус, РА (1956). «К теории окислительно-восстановительных реакций с переносом электрона. I» (PDF) . Дж. Хим. Физ. 24 (5): 966–978. Бибкод : 1956ЖЧФ..24..966М . дои : 10.1063/1.1742723 . S2CID 16579694 .
- Маркус, РА (1956). «Электростатическая свободная энергия и другие свойства состояний, имеющих неравновесную поляризацию. I» (PDF) . Дж. Хим. Физ. 24 (5): 979–989. Бибкод : 1956ЖЧФ..24..979М . дои : 10.1063/1.1742724 .
- Маркус, РА (1957). «К теории окислительно-восстановительных реакций с переносом электрона. II. Приложения к данным о скоростях реакций изотопного обмена» (PDF) . Дж. Хим. Физ. 26 (4): 867–871. Бибкод : 1957ЖЧФ..26..867М . дои : 10.1063/1.1743423 .
- Маркус, РА (1957). «К теории окислительно-восстановительных реакций с переносом электрона. III. Приложения к данным о скоростях органических окислительно-восстановительных реакций» (PDF) . Дж. Хим. Физ. 26 (4): 872–877. Бибкод : 1957ЖЧФ..26..872М . дои : 10.1063/1.1743424 .
- Маркус, РА (1960). «Реакции обмена и реакции переноса электрона, включая изотопный обмен. Теория окислительно-восстановительных реакций, связанных с переносом электрона. Часть 4. Статистически-механическая основа для рассмотрения вкладов растворителя, лигандов и инертной соли» (PDF) . Обсуждать. Фарадей Соц. 29 : 21–31. дои : 10.1039/df9602900021 .
- Маркус, РА (1963). «К теории реакций окисления-восстановления с переносом электрона. V. Сравнение и свойства электрохимических и химических констант скорости». Дж. Физ. хим. 67 (4): 853–857. дои : 10.1021/j100798a033 . ОСТИ 4712863 .
- Маркус, РА (1964). «Химическая и электрохимическая теория переноса электрона». Анну. Преподобный физ. хим. 15 (1): 155–196. Бибкод : 1964ARPC...15..155M . дои : 10.1146/annurev.pc.15.100164.001103 .
- Маркус, РА (1965). «К теории реакций переноса электрона. VI. Единая трактовка гомогенных и электродных реакций» (PDF) . Дж. Хим. Физ. 43 (2): 679–701. Бибкод : 1965ЖЧФ..43..679М . дои : 10.1063/1.1696792 .
- Маркус, РА; Сутин Н (1985). «Переносы электронов в химии и биологии» . Биохим. Биофиз. Акта . 811 (3): 265. doi : 10.1016/0304-4173(85)90014-X .

![{\displaystyle {\ce {{D}+A<=>[k_{12}][k_{21}][D{\dotsm }A]<=>[k_{23}][k_{32}] [D+{\dotsm }A^{-}]->[k_{30}]{D+}+{A^{-}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9011d1fe6f8639a87bf5c31e70967d0fcdf4bcc1)




![{\displaystyle {\ce {{[Fe^{II}(CN)6]^{4-}}+{[Ir^{IV}Cl6]^{2-}}<=>{[Fe^{III }(CN)6]^{3-}}+{[Ir^{III}Cl6]^{3-}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/31656dcef696dc00f999db7bf1e70e8747989c22)



























![{\displaystyle {\ce {{[Fe(H2O)6]^{2}+}+{[Co(H2O)6]^{3}+}<=>{[Fe(H2O)6]^{3 }+}+{[Co(H2O)6]^{2}+}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6cc3b6ef06cdd44100c25f3909ffaf574da148c0)

![{\displaystyle P_{if}=1-\exp \left[-{\frac {4\pi ^{2}{H_{if}^{2}}}{hv\left|s_{i}-s_{ f}\right|}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/859b6031bec85625808c0da2d23506517c8fb52f)






