Координационная сфера

The Группы NH 3 и Cl образуют координационную сферу вокруг центрального иона кобальта .
В координационной химии первая координационная сфера относится к множеству молекул и ионов ( лигандов ), непосредственно связанных с центральным атомом металла . Вторая координационная сфера состоит из молекул и ионов, которые различными способами присоединены к первой координационной сфере.
Первая координационная сфера
[ редактировать ]Первая координационная сфера относится к молекулам, прикрепленным непосредственно к металлу. Взаимодействия между первой и второй координационными сферами обычно включают образование водородных связей. Для заряженных комплексов важное значение имеет ионное спаривание .
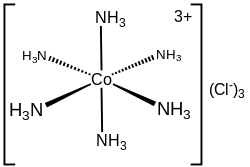
В хлориде гексамминкобальта(III) ([Co(NH 3 ) 6 ]Cl 3 ) катион кобальта плюс 6 аммиачных лигандов составляют первую координационную сферу. Таким образом, координационная сфера этого иона состоит из центрального ядра MN 6, «украшенного» 18 расходящимися наружу связями N-H.
Вторая координационная сфера
[ редактировать ]
Ионы металлов можно описать как состоящие из серии двух концентрических координационных сфер, первой и второй. Более удаленные от второй координационной сферы молекулы растворителя ведут себя скорее как « объемный растворитель ». Моделирование второй координационной сферы представляет интерес для вычислительной химии . Вторая координационная сфера может состоять из ионов (особенно в заряженных комплексах), молекул (особенно тех, которые образуют водородные связи с лигандами в первой координационной сфере) и частей основной цепи лиганда. По сравнению с первой координационной сферой вторая координационная сфера оказывает менее прямое влияние на реакционную способность и химические свойства металлокомплекса. Тем не менее вторая координационная сфера важна для понимания реакций металлокомплекса, включая механизмы лигандного обмена и катализа.
Роль в катализе
[ редактировать ]Механизмы металлопротеинов часто вызывают модуляцию белком второй координационной сферы. [1]

Роль в механистической неорганической химии
[ редактировать ]Скорость обмена лигандов между первой и второй координационной сферой является первой стадией реакций замещения лигандов. При ассоциативном замещении лиганда входящий нуклеофил располагается во второй координационной сфере. Эти эффекты имеют отношение к практическим применениям, таким как контрастные вещества, используемые в МРТ . [4]
Энергетика внутрисферных реакций переноса электрона обсуждается с точки зрения второй координационной сферы. Некоторые реакции переноса электрона с протонной связью включают перенос атома между вторыми координационными сферами реагентов:
- [Fe*(H 2 O) 6 ] 2+ + [Fe(H 2 O) 5 (OH)] 2+ → [Fe(H 2 O) 6 ] 3+ + [Fe*(H 2 O) 5 (OH)] 2+
Роль в спектроскопии
[ редактировать ]Влияние растворителя на цвет и стабильность часто объясняется изменениями во второй координационной сфере. Подобные эффекты могут быть ярко выражены в комплексах, где лиганды в первой координационной сфере являются сильными донорами и акцепторами водородных связей, например соответственно [Co(NH 3 ) 6 ] 3+ и [Fe(CN) 6 ] 3− . Краун-эфиры связываются с полиаминными комплексами через вторую координационную сферу. Катионы полиаммония связываются с азотными центрами цианометаллатов. [5]
Роль в супрамолекулярной химии
[ редактировать ]Макроциклические молекулы, такие как циклодекстрины, часто действуют как вторая координационная сфера для металлокомплексов. [6] [7]
См. также
[ редактировать ]Дальнейшее чтение
[ редактировать ]Ссылки
[ редактировать ]- ^ Чжао, Мэн; Ван, Хай-Бо; Цзи, Лян-Нянь; Мао, Цзун-Ван (2013). «Взгляд на металлоферментное микроокружение: биомиметические металлокомплексы с функциональной второй координационной сферой» . Обзоры химического общества . 42 (21): 8360–8375. дои : 10.1039/c3cs60162e . ISSN 0306-0012 . ПМИД 23881282 .
- ^ Ян, JY; Чен, С.; Догерти, В.Г.; Кассель, WS; Буллок, РМ; Дюбуа, DL; Раугей, С.; Руссо, Р.; Дюпюи, М.; Раковски Дюбуа, М. (2010). «Катализ окисления водорода комплексом дифосфина никеля с подвесными трет-бутиламинами». хим. Коммун . 46 (45): 8618–8620. дои : 10.1039/c0cc03246h . ПМИД 20938535 .
- ^ Буллок, РМ; Хелм, МЛ (2015). «Молекулярные электрокатализаторы окисления водорода с использованием земных металлов: перемещение протонов с помощью протонных реле» . Акк. хим. Рез . 48 (7): 2017–2026. doi : 10.1021/acs.accounts.5b00069 . ОСТИ 1582563 . ПМИД 26079983 .
- ^ RM Супковски, В. Дью. Хоррокс-младший. «Об определении количества молекул воды q, координированных с ионами европия (III) в растворе, по времени жизни затухания люминесценции» Inorganic Chimica Acta 2002, том 340, стр. 44–48. два : 10.1016/S0020-1693(02)01022-8
- ^ Лен, Дж. М. Супрамолекулярная химия: концепции и перспективы; ВЧ: Вайнхим, 1995.
- ^ З. Лю, С. Т. Шнеебели, Дж. Ф. Стоддарт «Возврат к координации второй сферы», Chimia 2014, 68, 315-320. два : 10.2533/chimia.2014.315
- ^ З. Лю, М. Фраскони, Дж. Лей, З. Дж. Браун, З. Чжу, Д. Цао, Дж. Ил, Г. Лю, А. К. Фаренбах, ОК Фарха, Дж. Т. Хапп, К. А. Миркин, Ю. Я. Ботрос, Дж. Ф. Стоддарт " Селективное выделение золота, облегченное координацией второй сферы с альфа-циклодекстрином» Nature Communications 2013, 4, 1855. дои : 10.1038/ncomms2891