Экзергоническая реакция
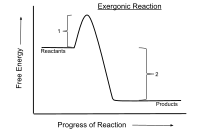
В химической термодинамике экзергоническая реакция — это химическая реакция , в которой изменение свободной энергии отрицательно (происходит чистое высвобождение свободной энергии). [1] Это указывает на самопроизвольную реакцию , если система закрыта и начальная и конечная температуры одинаковы. Для процессов, протекающих в закрытой системе при постоянном давлении и температуре, свободная энергия Гиббса используется , тогда как энергия Гельмгольца актуальна для процессов, протекающих при постоянном объеме и температуре. Согласно второму закону термодинамики, любая реакция, происходящая при постоянной температуре без подвода электрической или фотонной энергии, является экзергонической . Примером является клеточное дыхание .
Символически высвобождение свободной энергии, , в экзергонической реакции (при постоянных давлении и температуре) обозначается как
Хотя говорят, что экзергонические реакции происходят спонтанно , это не означает, что реакция будет происходить с наблюдаемой скоростью . Например, диспропорционирование перекиси водорода высвобождает свободную энергию, но происходит очень медленно в отсутствие подходящего катализатора. Было высказано предположение, что в этом контексте термин «жадный» будет более интуитивным. [2]
В более общем смысле термины экзергонический и эндергонический относятся к изменению свободной энергии в любом процессе, а не только в химических реакциях. Напротив, термины экзотермический и эндотермический относятся к изменению энтальпии в закрытой системе во время процесса, обычно связанного с теплообменом .
См. также [ править ]
Ссылки [ править ]
- ^ ИЮПАК Определение Золотой книги : экзергоническая реакция (экзоэргическая реакция)
- ^ Хамори, Юджин; Джеймс Э. Малдри (1984). «Использование слова «стремительный» вместо «спонтанный» для описания экзергонических реакций». Журнал химического образования . 61 (8): 710. Бибкод : 1984JChEd..61..710H . дои : 10.1021/ed061p710 .

