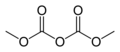
Карбонатный эфир

В органической химии ( карбонатный эфир органический карбонат или органокарбонат ) — эфир угольной кислоты . Эта функциональная группа состоит из карбонильной группы, окруженной двумя алкоксигруппами . Общая структура этих карбонатов такова. R-O-C(=O)-O-R' и относятся к сложным эфирам ( R-O-C(=O)-R' ), эфиры ( R-O-R' ), а также к неорганическим карбонатам .
Мономеры поликарбоната (например , Макролон или Лексан) связаны карбонатными группами. Эти поликарбонаты используются в линзах для очков, компакт-дисках и пуленепробиваемых стеклах. Небольшие сложные эфиры карбоната, такие как диметилкарбонат , этиленкарбонат , пропиленкарбонат , используются в качестве растворителей, диметилкарбонат также является мягким метилирующим агентом .
Структуры
[ редактировать ]
Сложные эфиры карбонатов имеют плоские ядра OC(OC) 2 , что придает жесткость. Уникальная связь O=C короткая (1,173 Å в изображенном примере), тогда как связи CO более похожи на эфир (расстояния между связями 1,326 Å для изображенного примера). [1]
Сложные эфиры карбонатов можно разделить на три структурных класса: ациклические, циклические и полимерные. Первый и общий случай — ациклическая карбонатная группа. Органические заместители могут быть идентичными или нет. Известны как алифатические, так и ароматические заместители, их называют диалкил- или диарилкарбонатами соответственно. Простейшими представителями этих классов являются диметилкарбонат и дифенилкарбонат .
Альтернативно, карбонатные группы могут быть связаны 2- или 3-углеродным мостиком, образуя циклические соединения, такие как этиленкарбонат и триметиленкарбонат . Мостиковое соединение также может иметь заместители, например CH 3 вместо пропиленкарбоната . Вместо концевых алкильных или арильных групп две карбонатные группы могут быть связаны алифатической или ароматической бифункциональной группой.
Третьим семейством карбонатов являются полимеры, такие как поли(пропиленкарбонат) и поли(бисфенол А карбонат) (например, Макролон или Лексан).
Подготовка
[ редактировать ]Органические карбонаты не получают из неорганических карбонатных солей. Практикуются два основных пути получения сложных эфиров карбонатов: реакция спирта (или фенола) с фосгеном (фосгенирование) и реакция спирта с окисью углерода и окислителем ( окислительное карбонилирование ). Другие сложные эфиры карбонатов впоследствии могут быть получены переэтерификацией . [2] [3]
можно получить прямой конденсацией метанола В принципе сложные эфиры карбонатов и диоксида углерода . Однако реакция термодинамически невыгодна. [4] Для отделения воды от реакционной смеси и увеличения выхода можно использовать селективную мембрану. [5] [6] [7] [8]
-
Дифенилкарбонат, типичный ациклический эфир карбоната.
-
Диметилдикарбонат , консервант.
-
Этиленкарбонат , циклический эфир карбоната
-
Триметиленкарбонат , еще один сложный эфир циклической карбоната.
-
Поли(бисфенол А карбонат) , коммерчески важный пластик (Лексан).
Фосгенирование
[ редактировать ]Спирты реагируют с фосгеном с образованием карбонатных эфиров по следующей реакции:
- 2 ROH + COCl 2 → ROC(O)OR + 2 HCl
Аналогично реагируют фенолы. поликарбонат, полученный из бисфенола А. Таким способом получают Этот процесс является высокопродуктивным. Однако используется токсичный фосген, а для нейтрализации образующегося хлористого водорода требуются стехиометрические количества основания (например, пиридина). [2] [3] Эфиры хлорформиата являются промежуточными продуктами в этом процессе. Вместо того, чтобы вступать в реакцию с дополнительным спиртом, они могут диспропорционироваться с образованием желаемых диэфиров карбоната и одного эквивалента фосгена: [3]
- PhOH + COCl 2 → PhOC(O)Cl + HCl
- 2 PhOC(O)Cl → PhOC(O)OPh + COCl 2
Общая реакция такая:
- 2 PhOH + COCl 2 → PhOC(O)OPh + 2 HCl
Окислительное карбонилирование
[ редактировать ]Альтернативой фосгенированию является окислительное карбонилирование. Преимущество заключается в отсутствии фосгена . С помощью медных катализаторов диметилкарбонат получают следующим образом: [3] [9]
- 2 MeOH + CO + 1/2 O 2 → MeOC(O)OMe + H 2 O
Дифенилкарбонат получают аналогично, но с использованием палладиевых катализаторов. Процесс, катализируемый Pd, требует сокатализатора для повторного превращения Pd (0) в Pd (II). Ацетилацетонат марганца (III) используется в коммерческих целях. [10]
Реакция углекислого газа с эпоксидами
[ редактировать ]Реакция углекислого газа с эпоксидами является основным путем получения циклических 5-членных карбонатов. Годовое производство циклических карбонатов в 2010 году оценивалось в 100 000 тонн в год. [11] В промышленности оксиды этилена и пропилена легко реагируют с диоксидом углерода с образованием карбонатов этилена и пропилена (с соответствующим катализатором). [2] [3] Например:
- C 2 H 4 O + CO 2 → C 2 H 4 O 2 CO
Переэтерификация карбонатов
[ редактировать ]Сложные эфиры карбонатов можно превратить в другие карбонаты путем переэтерификации. Более нуклеофильный спирт вытеснит менее нуклеофильный спирт. Другими словами, алифатические спирты вытесняют фенолы из арилкарбонатов. Если выходящий спирт более летуч, равновесие можно установить путем его отгонки. [2] [3]
Реакции
[ редактировать ]Эфиры карбонатов подвергаются многим реакциям, вступающим в реакции обычных эфиров карбоновых кислот. С реактивами Гриньяра сложные эфиры карбонатов реагируют с образованием третичных спиртов . Некоторые циклические карбонаты подвержены полимеризации.
Использование
[ редактировать ]Органические карбонаты используются в качестве растворителей в литиевых батареях . Благодаря высокой полярности они растворяют соли лития. Проблему высокой вязкости можно решить, используя смеси, например , диметилкарбоната , диэтилкарбоната и диметоксиэтана.
Они также используются в качестве растворителей в органическом синтезе. [12] Классифицируемые как полярные растворители , они имеют широкий диапазон температур жидкости. Одним из примеров является пропиленкарбонат с температурой плавления -55 °C и температурой кипения 240 °C. Другими преимуществами являются низкая экотоксичность и хорошая биоразлагаемость . Многие пути промышленного производства карбонатов не являются «зелеными», поскольку они основаны на использовании фосгена или оксида пропилена . [13]
Диметилдикарбонат обычно используется в качестве для напитков консерванта , технологической добавки или стерилизатора . [14]
Ссылки
[ редактировать ]- ^ Jump up to: а б Перес, Серж; Скариндж, Раймонд П. (1987). «Кристаллические особенности 4,4'-изопропилидендифенилбис(фенилкарбоната) и конформационный анализ поликарбоната 2,2-бис(4-гидроксифенил)пропана». Макромолекулы . 20 (1): 68–77. Бибкод : 1987МаМол..20...68П . дои : 10.1021/ma00167a014 .
- ^ Jump up to: а б с д Шейх Аббас-Алли Г.; Сваминатан Шиварам (1996). «Органические карбонаты». Химические обзоры . 96 (3): 951–976. дои : 10.1021/cr950067i . ПМИД 11848777 .
- ^ Jump up to: а б с д и ж Буйш, Ханс-Йозеф (2012). «Эфиры угольной кислоты». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a05_197 . ISBN 3527306730 .
- ^ Чжан, Чжи-Фан (2011). «Синтез диметилкарбоната из диоксида углерода и метанола на CexZr1-xO2 и [EMIM]Br/Ce0,5Zr0,5O2». Исследования в области промышленной и инженерной химии . 50 (4): 1981–1988. дои : 10.1021/ie102017j .
- ^ Ли, Чуан-Фэн (2003). «Исследование по применению мембранного реактора в прямом синтезе ДМК из CO2 и CH3OH на катализаторе Cu–KF/MgSiO». Катализ сегодня . 82 (1–4): 83–90. дои : 10.1016/S0920-5861(03)00205-0 .
- ^ Вермеррис, Рене. Мембранное преобразование метанола и диоксида углерода в диметилкарбонат (PDF) (Отчет). Архивировано (PDF) из оригинала 5 октября 2013 г.
- ^ Ауисси, Ахмед; Аль-Осман, Зейд Абдулла; Аль-Амро, Амро (2010). «Газофазный синтез диметилкарбоната из метанола и углекислого газа на гетерополианионе кеггинского типа Co1.5PW12O40» . Международный журнал молекулярных наук . 11 (4): 1343–1351. дои : 10.3390/ijms11041343 . ПМЦ 2871119 . ПМИД 20480023 .
- ^ Биан, июнь (2009). «Высокоэффективный синтез диметилкарбоната из метанола и диоксида углерода с использованием нового биметаллического нанокомпозитного катализатора медь-никель/графит». Химико-технологический журнал . 147 (2–3): 287–296. дои : 10.1016/j.cej.2008.11.006 .
- ^ Шейх Аббас-Алли Г.; Шиварам, Сваминатан (1 января 1996 г.). «Органические карбонаты». Химические обзоры . 96 (3): 951–976. дои : 10.1021/cr950067i . ISSN 0009-2665 . ПМИД 11848777 .
- ^ Григорий Леонидович Соловейчик1 (2016). «Окислительное карбонилирование: дифенилкарбонат». В Шеннон С. Шталь; Пол Л. Альстерс (ред.). Жидкофазный катализ аэробного окисления: промышленное применение и академические перспективы . Название Жидкофазный катализ аэробного окисления: промышленное применение и академические перспективы: Промышленное применение и академические перспективы . Вайли-ВЧ. стр. 189–208. дои : 10.1002/9783527690121.ch12 . ISBN 9783527337811 .
{{cite encyclopedia}}: CS1 maint: числовые имена: список авторов ( ссылка ) - ^ Норт, Майкл; Паскуале, Риккардо; Янг, Карл (2010). «Синтез циклических карбонатов из эпоксидов и CO2». Зеленая химия . 12 (9): 1514. doi : 10.1039/c0gc00065e .
- ^ Шеффнер, Б.; Шеффнер, Ф.; Верёвкин, ИП; Бёрнер, А. (2010). «Органические карбонаты как растворители в синтезе и катализе». Химические обзоры . 110 (8): 4554–4581. дои : 10.1021/cr900393d . ПМИД 20345182 .
- ^ Сибия, Майк Сбонело (19 мая 2008 г.). Каталитическое превращение пропиленкарбоната в диметилкарбонат и пропиленгликоль (магистерская диссертация по химии). Университет Йоханнесбурга. Архивировано из оригинала 18 августа 2020 г. Проверено 12 апреля 2022 г.
- ^ Часы, Герман; Мильке, Буркхард; Экснер, Отто; Пейн, Кен Р.; Хилл, Эдвард (2013). «Биоциды». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. стр. 1–26. дои : 10.1002/14356007.a16_563.pub2 . ISBN 9783527306732 .